程远渡 1,易有金 1,*,易传祝 2,夏 菠 1,夏延斌 1
(1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.湖南省疾病预防控制中心,湖南 长沙 410000)
摘 要:目的:探讨植物甾醇酯和葛根素联合使用对肥胖小鼠的减肥作用。方法:饲喂高脂饲料建立小鼠肥胖模型,将肥胖小鼠按体质量分为5 组(肥胖模型组、植物甾醇酯组、葛根素组、植物甾醇酯和葛根素联合组、奥利司他组),每组10 只,连续灌胃6 周。观察药物干预后小鼠体质量、摄食量、肥胖指数(Lee's指数)、脂肪系数,血清总胆固醇(total cholestetol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平,脂肪细胞数量和大小、肝脏病变的情况。结果:与肥胖模型组相比,植物甾醇酯组、葛根素组、植物甾醇酯和葛根素联合组小鼠体质量分别降低5.41%、6.98%、12.50%;Lee's指数分别降低3.41%、3.26%、6.25%;脂肪系数分别降低19.88%、27.41%、30.42%。3 组血清TC、TG、LDL-C水平均低于肥胖模型组,其中植物甾醇酯和葛根素联合组降幅最大,分别为21.40%、37.50%、30.43%。植物甾醇酯和葛根素联合组小鼠的脂肪细胞直径变小、数量增多、肝脏脂肪性病变得到缓解。结论:植物甾醇酯和葛根素都能抑制小鼠肥胖,其中两者联合使用时减肥效果最好。
关键词:植物甾醇酯;葛根素;肥胖小鼠;减肥
肥胖主要是由遗传因素和环境因素共同作用所导致的一种慢性疾病,是与糖尿病、高血压、冠心病、中风、睡眠时呼吸综合征等多种疾病密切相关的诱发因素,已成为当今全世界广泛关注的重大公共卫生问题之一 [1-2]。据世界卫生组织预测,到2015年全世界有约23 亿成人为超重,7亿多成人为肥胖。中国是人口大国,从肥胖净人口来看,2009年,我国已超过美国(美国肥胖净人口为1.1 亿人),成为全球肥胖者最多的国家,而且近几年肥胖者数量持续快速增长 [3]。针对肥胖问题,国内外学者对肥胖原因进行了深入分析,并进行了多种药物的筛选,以期能够解除这一困扰全球健康的问题 [4]。目前治疗肥胖的药物数量少、疗效有限、副作用大,如西布曲明因增加心脏病的风险而在全球退市 [5],使得减肥的安全性引起人们的重视,因此,研究开发安全有效的减肥保健食品及药物非常有必要。
葛根(Pueraria lobata)是祖国传统中药,被广泛应用。葛根素(puerarin)是从葛根中提取的一种异黄酮苷类化合物,安全性强,具有扩张冠状动脉、降血脂、降血压、降血糖、治疗非酒精性脂肪肝、减肥等功效 [6-10],可治疗和预防胰岛素抵抗、血脂异常等代谢综合征。植物甾醇酯(phytosterol ester)是植物油脂中普遍存在的一种微量成分,可通过植物甾醇与脂肪酸酯化反应制得,具有与植物甾醇相同甚至更优的生理活性功能 [11]。美国食品药品监督管理局(U.S. Food and Drug Administration,FDA)已认定其为“一般认为安全(generally recognized as safe,GRAS)”产品,大量研究表明植物甾醇酯具有降低胆固醇水平、抗炎、抗癌、抗衰老、调节免疫、防治前列腺疾病的作用 [12-16]。葛根素和植物甾醇酯不仅在降脂、抗炎等方面具有疗效,而且其长期使用副作用不明显、安全性高,符合人们药物选择的观点。目前很少见有关这两种药物减肥作用的研究报道,且未见两种药物联合使用能否增强减肥效果的报道。本实验采用高脂饲料建立与人类肥胖最相似的小鼠单纯性饮食肥胖模型,通过单独和同时给予两种物质,研究在二者联合使用时的减肥效果是否比单一使用时更好,为中药葛根和植物甾醇酯的有效开发提供理论依据和实验支持。
1.1 动物、材料与试剂
S P F级雄性昆明种小鼠,4 周龄,体质量(20±2) g,共140 只,购自湖南斯莱克景达实验动物有限公司,生产许可证编号:SCXK(湘)2013-0004;动物使用许可证编号:SYXK(湘)2010-0011。
基础饲料、营养肥胖造模饲料(以下均为质量分数:基础饲料79.5%,猪油10%,蛋黄粉10%,胆固醇0.5%) [17]均购自湖南斯莱克景达实验动物有限公司,生产许可证编号:SCXK(湘)2009-0009。
植物甾醇酯(纯度95%) 湖北兴银河化工有限公司;葛根素(纯度99%) 西安天本生物工程有限公司。
奥利司他片(批号12122401) 浙江海正药业股份有限公司;10%中性福尔马林溶液、苏木精-伊红(hematoxylin-eosin,HE)染液 国药集团化学试剂有限公司。
1.2 仪器与设备
3-18k型高速离心机 德国Sigma公司;AU680全自动生化分析仪 美国贝克曼库尔特公司;RM2235石蜡切片机 德国徕卡公司;Motic BA400光学显微镜 日本奥林巴斯显微镜公司;JH1102型电子天平 上海精科实业有限公司。
1.3 方法
1.3.1 小鼠肥胖模型的建立
将所有昆明种小鼠饲养于SPF级动物实验室,室温20~26 ℃,相对湿度45%~65%,明暗周期各12 h,通风良好。140 只小鼠自由采食和饮水,适应性喂养基础饲料7 d后,按体质量随机分为2 组:正常组(10 只)和造模组(130 只)。正常组饲喂基础饲料,造模组饲喂营养肥胖造模饲料,每周称量两次体质量。造模组用于建立肥胖模型,根据公式(1)计算小鼠肥胖度,当肥胖度大于20%时即为肥胖,表明肥胖模型建立成功 [18]。
1.3.2 动物分组及给药
从造模成功的小鼠中,按体质量抽取50 只小鼠分为5 组,每组10 只:肥胖模型组、植物甾醇酯组、葛根素组、植物甾醇酯和葛根素联合组(简称联合组)、奥利司他组(阳性组)。各组继续饲喂营养肥胖造模饲料,正常组饲喂基础饲料,实验期间自由采食和饮水。以FDA推荐量为基础,按人体10 倍剂量对各组小鼠灌胃:植物甾醇酯组灌胃200 mg/(kg·d)(以体质量计,下同)植物甾醇酯,葛根素组灌胃300 mg/(kg·d)葛根素,联合组以200 mg/(kg·d)和300 mg/(kg·d)剂量分别灌胃植物甾醇酯和葛根素,阳性组按54 mg/(kg·d)剂量灌胃奥利司他片,肥胖模型组和正常组灌胃溶媒,灌胃量为0.1 mL/10 g。每天上午9:00灌胃,连续6 周。
1.3.3 检测指标
1.3.3.1 小鼠体质量和摄食量的测定
每组小鼠自由采食和饮水,灌胃期间每天记录小鼠的摄食量,每周称量体质量,连续6 周。
摄食量/g=给食量/g-剩食量/g-撒食量/g (2)
1.3.3.2 肥胖指数(Lee's)指数测定
Lee's指数测定参照文献[19]方法进行。
1.3.3.3 血清生化指标的测定
实验结束时,禁食12 h,对小鼠摘眼球采血,37 ℃水浴30 min后,3 000 r/min离心15 min,吸取上清液(血清) [20],送湖南省疾病预防控制中心进行血清总胆固醇(total cholestetol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoproteincholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平测定。
1.3.3.4 脂肪系数的测定
将小鼠处死,打开小鼠腹腔取出睾丸、双肾周围的脂肪,用电子天平称量其湿质量,按照公式(3)计算小鼠脂肪系数 [21]。
1.3.3.5 脂肪和肝脏组织切片制备及HE染色
将小鼠处死后,取其睾丸周围同一部位的脂肪组织,立即浸泡在10%的中性福尔马林溶液中固定,将固定好的组织进行流水冲洗、梯度酒精脱水,按组织病理切片制备的标准步骤进行浸泡→包埋→6 μm厚切片→烤干→脱水→复水→染色→脱水→封片。随后用高倍光学显微镜在40、100、400 倍下观察拍照,观察全视野的细胞数目,用测微尺测量脂肪细胞的直径。取肝脏同一部位的组织,同样按上述步骤制作肝脏切片,在高倍光学显微镜下观察肝脏组织的病变情况 [22]。
1.4 数据统计分析
采用SPSS 18.0软件进行统计处理,实验数据以
 表示。采用单因素方差分析(one-way analysis of variance,one-way ANOVA)法比较各实验组之间差异的显著性,P<0.05表示有统计学意义。
表示。采用单因素方差分析(one-way analysis of variance,one-way ANOVA)法比较各实验组之间差异的显著性,P<0.05表示有统计学意义。
2.1 小鼠肥胖模型建立结果
实验前正常组和造模组小鼠体质量无显著差异(P>0.05),造模饲喂7 周后,62 只小鼠肥胖度大于20%,肥胖模型建立成功,造模成功率为47.7%。按体质量抽取50 只小鼠分为5 组进行后续实验,由表1可知,各药物组小鼠的体质量均显著高于正常组(P<0.05)。
表1 灌胃期间各组小鼠体质量比较

T diaffbelreen t 1g asBtoridc yp erwfeusiigonh tpesrioodsf
 mice from eachroup in
mice from eachroup in
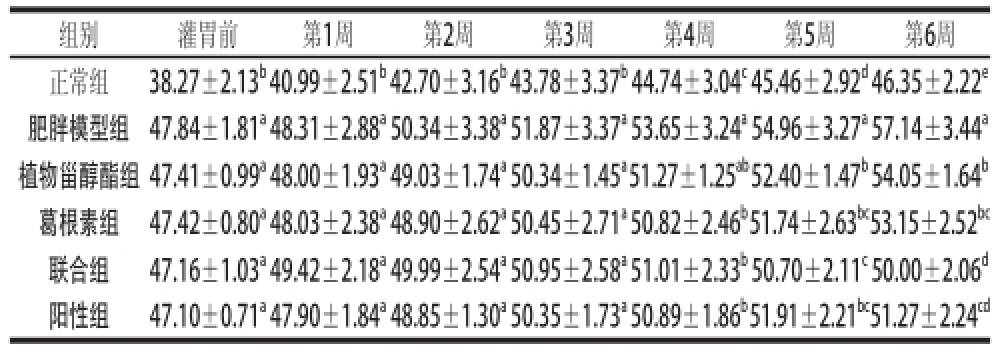
注:同列小写字母不同表示差异显著(P<0.05)。下同。
组别灌胃前第1周第2周第3周第4周第5周第6周正常组38.27±2.13 b40.99±2.51 b42.70±3.16 b43.78±3.37 b44.74±3.04 c45.46±2.92 d46.35±2.22 e肥胖模型组47.84±1.81 a48.31±2.88 a50.34±3.38 a51.87±3.37 a53.65±3.24 a54.96±3.27 a57.14±3.44 a植物甾醇酯组47.41±0.99 a48.00±1.93 a49.03±1.74 a50.34±1.45 a51.27±1.25 ab52.40±1.47 b54.05±1.64 b葛根素组47.42±0.80 a48.03±2.38 a48.90±2.62 a50.45±2.71 a50.82±2.46 b51.74±2.63 bc53.15±2.52 bc联合组47.16±1.03 a49.42±2.18 a49.99±2.54 a50.95±2.58 a51.01±2.33 b50.70±2.11 c50.00±2.06 d阳性组47.10±0.71 a47.90±1.84 a48.85±1.30 a50.35±1.73 a50.89±1.86 b51.91±2.21 bc51.27±2.24 cd
2.2 植物甾醇酯和葛根素对小鼠体质量的影响
如表1所示,灌胃前,肥胖模型组和各药物组小鼠的体质量无显著差异(P>0.05),肥胖模型组、各药物组小鼠的体质量与正常组比较,差异显著(P<0.05),表明建模成功。灌胃期间的前3 周内,各组小鼠体质量逐渐增加,各药物组与肥胖模型组比较无显著差异(P>0.05)。第4周时,与肥胖模型组相比,葛根素组、联合组、阳性组小鼠的体质量分别降低了5.27%、4.92%、5.14%(P<0.05)。第6周时,植物甾醇酯组、葛根素组、联合组、阳性组小鼠体质量与肥胖模型组相比,分别降低了5.41%、6.98%、12.50%、10.27%(P<0.05);联合组小鼠的体质量与植物甾醇酯组、葛根素组比较,分别降低了7.49%、5.93%(P<0.05),与阳性组比较,降低2.45%(P>0.05),说明植物甾醇酯和葛根素都可以对肥胖小鼠的体质量起到减轻作用,二者联合使用时对肥胖小鼠体质量的控制效果比单独使用时效果要好,与阳性组无明显差别。
2.3 植物甾醇酯和葛根素对小鼠摄食量的影响
表2 植物甾醇酯和葛根素对小鼠摄食量的影响(x±s,n==1100)
Table2 Effects of phytosterol ester and puerarin on feed intake in obese mice
 g
g

组别第1周第2周第3周第4周第5周第6周正常组64.98±2.74 b68.83±3.83 a68.10±2.67 ac71.10±2.71 b65.41±5.17 b60.36±5.83 b肥胖模型组74.87±4.45 a70.04±9.04 a65.58±4.16 c76.79±7.75 ab76.94±5.56 a74.96±4.34 a植物甾醇酯组70.25±7.98 ab76.66±8.37 a71.72±2.50 ab78.45±7.10 a72.35±3.22 a74.63±4.75 a葛根素组75.65±7.24 a72.10±7.90 a66.76±3.28 c74.19±3.35 ab71.95±6.36 a73.90±4.57 a联合组76.48±11.47 a77.03±8.34 a72.13±7.19 a77.51±4.65 a74.91±3.15 a71.05±6.83 a阳性组72.63±5.40 a70.04±4.34 a67.15±4.17 bc77.08±6.10 ab72.32±4.46 a72.05±4.99 a
如表2所示,灌胃第1周,正常组小鼠的摄食量小于肥胖模型组和各药物组,与肥胖模型组、联合组、葛根素组、阳性组相比差异显著(P<0.05),可能是因为肥胖模型组和各药物组小鼠所摄食的营养肥胖造模饲料中含有蛋黄粉,刺激了小鼠的食欲,从而造成了小鼠摄食量增加;各药物组和肥胖模型组之间差异不显著。随着灌胃实验的进行,各组小鼠的摄食量有所波动,肥胖模型组和各药物组小鼠摄食量普遍大于正常组,到第5、6周时,正常组小鼠的摄食量显著低于肥胖模型组和各药物组(P<0.05),各药物组、肥胖模型组之间摄食量虽然不同,但无显著差异(P>0.05)。根据各组小鼠体质量和摄食量变化可知,植物甾醇酯、葛根素以及二者联合使用起到的减肥效果并不是减少小鼠食物的摄入而引起体质量的增长受到抑制所致。
2.4 植物甾醇酯和葛根素对小鼠Lee's指数的影响
表3 植物甾醇酯和葛根素对小鼠Lee s指数的影响(

Table3 Effects of phytos
 terol ester and puerarin on Lee s index inobese mice
terol ester and puerarin on Lee s index inobese mice

组别体长/cmLee's指数正常组10.67±0.26 ab336.79±6.67 c肥胖模型组10.49±0.30 b367.30±8.57 a植物甾醇酯组10.66±0.28 ab354.76±8.76 b葛根素组10.59±0.36 ab355.31±10.22 b联合组10.70±0.26 ab344.34±5.61 c阳性组10.90±0.48 a341.17±11.08 c
Lee's指数与人的身体质量指数(body mass index,BMI)一样,主要反映动物机体的肥胖程度。如表3所示,肥胖模型组小鼠体长低于阳性组,差异显著(P<0.05),其余各组小鼠体长无显著差异(P>0.05)。与肥胖模型组相比,植物甾醇酯组、葛根素组、联合组、阳性组小鼠的Lee's指数分别降低了3.41%、3.26%、6.25%、7.66%(P<0.05);联合组与植物甾醇酯组、葛根素组相比,Lee's指数分别降低了2.94%、3.09%(P<0.05),与阳性组和正常组比较无显著差异(P>0.05)。2.5 植物甾醇酯和葛根素对小鼠体脂含量的影响
表4 植物甾醇酯和葛根素对小鼠体脂含量的影响(x
 Table4 Effects of phytosterol ester and puerarin on fat content in obese mic
Table4 Effects of phytosterol ester and puerarin on fat content in obese mic
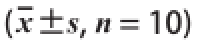
组别总脂含量/g脂肪系数/%正常组1.16±0.24 b2.51±0.53 ab肥胖模型组1.92±0.81 a3.32±1.29 a植物甾醇酯组1.43±0.45 ab2.66±0.87 ab葛根素组1.29±0.46 b2.41±0.81 b联合组1.15±0.38 b2.31±0.81 b阳性组1.13±0.39 b2.20±0.76 b
如表4所示,与肥胖模型组相比,植物甾醇酯组、葛根素组、联合组、阳性组小鼠体内的总脂含量分别降低了25.52%(P>0.05),32.81%、40.10%、41.45%(P<0.05);联合组与植物甾醇酯、葛根素相比分别降低了19.58%、10.85%(P>0.05),与阳性组、正常组比较也无显著差异(P>0.05)。脂肪系数反映了小鼠内脏脂肪性肥胖的程度,与肥胖模型组相比,植物甾醇酯组、葛根素组、联合组、阳性组脂肪系数分别降低了19.88%(P>0.05),27.41%、30.42%、33.73%(P<0.05);联合组与植物甾醇酯组和葛根素组比较,脂肪系数分别降低13.16%、4.15%(P>0.05),与阳性组、正常组比较也无显著差异(P>0.05)。药物干预后,各药物组小鼠的总脂含量普遍低于肥胖模型组,部分存在显著差异;葛根素组、联合组、阳性组小鼠的脂肪系数与肥胖模型组存在显著差异;联合组小鼠的脂肪系数低于正常组、植物甾醇酯组和葛根素组,与阳性组也无显著差异。以上结果表明,植物甾醇酯和葛根素都能减轻小鼠内脏脂肪性肥胖程度,二者联合使用时效果更加明显。
2.6 植物甾醇酯和葛根素对小鼠血脂水平的影响
表5 植物甾醇酯和葛根素对小鼠血脂水平的影响( x ±s, n = 10)

Table5 Effects of phytosterol ester and puerarin on blood lipids in obese mice ( x ±s, n = 10)
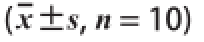

LDL-C含量/(mmol/L)正常组2.88±0.36 c0.95±0.13 c2.14±0.18 a0.64±0.22 c肥胖模型组4.30±0.55 a1.60±0.35 a1.32±0.25 e1.84±0.41 a植物甾醇酯组3.66±0.74 b1.17±0.21 bc1.76±0.50 bc1.41±0.28 b葛根素组3.75±0.49 ab1.30±0.40 ab1.69±0.18 c1.35±0.37 b联合组3.38±0.35 bc1.00±0.38 c1.98±0.17 ab1.28±0.51 b阳性组3.06±0.82 c0.99±0.29 c2.05±0.28 a1.17±0.30 b组别TC含量/(mmol/L)TG含量/(mmol/L)HDL-C含量/(mmol/L)

图1 小鼠睾丸脂肪组织切片(HE,×40000)
Fig.1 Tissue sections of testis fat from mice (HE, × 400)
a. 正常组;b. 肥胖模型组;c. 植物甾醇酯组;d. 葛根素组;e. 联合组;f. 阳性组。图2同。
肥胖与体内的血脂水平密切相关,血脂水平升高可能是肥胖的前兆。肥胖小鼠给药6 周后,采血分析血清血脂水平变化。如表5所示,与正常组相比,肥胖模型组小鼠的TC、TG、LDL-C含量普遍偏高,HDL-C含量下降,差异均达到显著水平(P<0.05),说明长期食用营养肥胖造模饲料能升高小鼠血脂水平,增加其患动脉粥样硬化的风险。与肥胖模型组比较,植物甾醇酯组、葛根素组、联合组、阳性组小鼠的TC含量分别降低14.88%(P<0.05),12.79%(P>0.05),21.40%、28.84%(P<0.05),联合组与植物甾醇酯组、葛根素组比较,TC含量分别降低7.65%、9.87%(P>0.05)。植物甾醇酯组、葛根素组、联合组、阳性组与肥胖模型组比较,TG含量分别降低26.88%(P<0.05),18.75%(P>0.05)、37.50%、38.13%(P<0.05),联合组与植物甾醇酯组、葛根素组比较,TG含量分别降低14.53%(P>0.05)、23.08%(P<0.05)。用药后各实验组小鼠的HDL-C含量与肥胖模型组相比均提高,葛根素组、植物甾醇酯组、联合组、阳性组分别提高28.03%、33.33%、50%、55.30%(P<0.05),联合组与植物甾醇酯组、葛根素组比较分别提高12.5%(P>0.05)、17.16(P<0.05)。而用药后LDL-C含量也发生变化,与肥胖模型组比较,各药物组LDL-C含量都普遍降低,植物甾醇酯组、葛根素组、联合组、阳性组分别降低23.37%、26.63%、30.43%、36.41%(P<0.05),联合组与植物甾醇酯组和葛根素组比较分别降低9.22%、5.19%(P>0.05)。综上所述,植物甾醇酯和葛根素能够降低肥胖小鼠血清TC、TG、LDL-C含量,升高HDL-C含量,二者联合使用时对小鼠血脂水平的改善效果更加显著。
2.7 植物甾醇酯和葛根素对小鼠脂肪细胞和肝脏的影响
如图1所示,肥胖模型组小鼠睾丸脂肪细胞变大,内部充满脂滴,显微镜相同视野范围内,脂肪细胞数量明显减少。与肥胖模型组相比,正常组和各药物组小鼠脂肪细胞直径显著减小,显微镜相同视野内脂肪细胞数量明显增加,可能是由于各药物可以减少脂肪细胞内脂滴的积累,抑制脂肪细胞变大所致。药物组中,阳性组对脂肪细胞抑制作用最好,其次是联合组,两者的细胞直径都小于植物甾醇酯组和葛根素组,相同视野中细胞数量也明显更多,提示联合组对脂肪细胞变大的抑制作用要好于植物甾醇酯和葛根素单独使用时的效果。

图2 小鼠肝脏组织切片(HE,×40000)
Fig.2 Tissue sections of mouse liver (HE, ×400)
如图2所示,与正常组比较,肥胖模型组小鼠的肝脏呈中度脂肪肝样改变,部分肝小叶结构不清晰、肝细胞索及肝血窦结构难以辨认,肝血窦扩张充血,汇管区有少量炎性细胞浸润,肝细胞胞浆中可见大小不等的脂肪空泡,部分细胞脂肪空泡融合,挤压细胞核呈印戒状。与肥胖模型组比较,植物甾醇酯组小鼠的肝脏肝小叶结构少部分恢复,肝细胞胞浆中仍可见少量大小不等的脂肪空泡,少部分脂肪空泡融合,挤压细胞核呈印戒状,汇管区少量炎性细胞浸润;葛根素组小鼠的肝脏肝小叶结构部分恢复,肝细胞水肿,部分胞浆中可见少量小的脂肪空泡,汇管区有极少量炎性细胞浸润;联合组小鼠的肝脏肝小叶结构大部分恢复,肝细胞索及肝窦结构较清晰,肝细胞内脂肪空泡显著减少,汇管区无炎性细胞浸润;阳性组小鼠的肝脏脂肪变性程度及细胞肿胀程度也稍有减轻。综上所述,植物甾醇酯、葛根素单独使用对肝细胞脂肪变性有改善作用,而二者联合使用时对肝细胞脂肪变性有显著改善作用。
饮食诱导的肥胖小鼠模型在一定程度上与人类单纯性肥胖的形成具有相似发病机制,按照一定的标准通常只有部分小鼠可诱导成功,约一半小鼠存在肥胖抵抗 [23]。通过7 周的营养肥胖造模饲料喂养,62 只小鼠肥胖造模成功,造模成功率为47.7%,造模成功率与以往文献报道基本一致 [23]。
体质量、脂肪系数与Lee's指数是反映小鼠肥胖程度的重要指标。各药物组都能使肥胖小鼠的体质量减轻、Lee's指数降低、脂肪系数减小并使脂肪细胞体积变小,其中联合组的小鼠与葛根素组、植物甾醇酯组相比,体质量、体内脂肪含量相对降低,部分存在显著差异性。结果反映这二者对肥胖小鼠具有一定的减肥作用,且联合组减肥效果更好。
肥胖患者一般伴随着高血脂症,血液黏度增加,易发生心血管疾病 [20]。一般认为血浆TC、TG和LDL-C水平与动脉粥样硬化发生率成正相关,而血浆HDL-C水平则与之成负相关 [24]。HDL-C是拮抗动脉粥样硬化的脂蛋白,其水平升高可增强机体逆向转运胆固醇的能力,使外周组织胆固醇蓄积的可能性变小。实验结果表明各药物组均可降低血液中TC、TG与LDL-C的水平,升高HDL-C水平,对肝脏脂肪性病变具有缓解作用,推测植物甾醇酯和葛根素可能是通过沉淀、置换胆固醇,相互竞争来阻碍胆固醇的吸收或者通过上调7α-羟化酶(7α-hydroxylase,CYP7A1)的表达 [25],从而促进胆固醇向胆酸转化,排出体外,起到减肥降脂作用。
综上所述,本实验通过对营养性肥胖小鼠进行干预,观察到植物甾醇酯和葛根素联合使用可以使肥胖小鼠体质量减轻、血清血脂水平降低、脂肪细胞内的脂滴减少、脂肪细胞的膨大得到抑制,肝脏病变也得以缓解,其减肥作用比单一使用时要好,而且两者本身具有很好的安全性,可作为减肥的新药物,实验结果也为药物新的使用方向提供一定思路,但其减肥机理有待进一步深入探讨。
参考文献:
[1] LOW S, CHIN M C, DEURENBERG-YAP M. Review on epidemic of obesity[J]. Annals Academy of Medicine Singapore, 2009, 38(1): 57-59.
[2] LABIB M. The investigation and management of obesity[J]. Journal of Clinical Pathology, 2003, 56(1): 17-25.
[3] 倪国华, 张璟, 郑风田. 中国肥胖流行的现状与趋势[J]. 中国食物与营养, 2013, 19(10): 70-74.
[4] GERMAN A J, RYAN V H, GERMAN A C, et al. Obesity, its associated disorders and the role of inflammatory adipokines in companion animals[J]. The Veterinary Journal, 2010, 185(1): 4-9.
[5] U.S. Food and Drug Administration. FDA drug safety communication: FDA recommends against the continued use of Meridia (sibutramine)[EB/OL].(2010-08-10)[2014-05-26]. http://www.fda.gov/Drugs/DrugSafety/ ucm228746.htm.
[6] 倪秀芹, 李星, 赵玲辉, 等. 葛根素对大鼠心肌梗死后梗死部位胆碱能神经支配的影响[J]. 中国新药与临床杂志, 2005, 24(12): 968-970.
[7] 张利夫, 陈少伟. 葛根素对高脂血症患者ET、NO及血脂的影响[J].医学临床研究, 2008, 25(8): 1417-1419.
[8] CHEN Wangchuan, HAYAKAWA S, YAMAMOTO T, et al. Mediation of beta-endorphin by the isoflavone puerarin to lower plasma glucose in streptozotocin-induced diabetic rats[J]. Planta Medica, 2004, 70(2): 113-116.
[9] 霍欣. 葛根素对抗家兔实验性高脂血症引起的非酒精性脂肪肝及动脉粥样硬化的研究[D]. 贵阳: 贵州大学, 2008: 7.
[10] 张玉武, 李新平, 申付文, 等. 葛根素对营养性肥胖大鼠的减肥作用及机制[J]. 中国药学杂志, 2008, 43(2): 110-114.
[11] VILLENEUVE P, TURON F, CARO Y, et al. Lipase-catalyzed synthesis of canola phytosterols oleate esters as cholesterol lowering agents[J]. Enzyme and Microbial Technology, 2005, 37(1): 150-155.
[12] 王国栋, 王竹, 韩军花, 等. 植物甾醇酯对实验大鼠血脂水平的影响[J].卫生研究, 2006, 35(5): 581-583.
[13] BLAIR S N, CAPUZZI D M, GOTTLIEB S O, et al. Incremental reduction of serum total cholesterol and low-density lipoprotein cholesterol with the addition of plant stanol ester-containing spread to statin therapy[J]. The American Journal of Cardiology, 2000, 86(1):46-52.
[14] GABAY O, SANCHEZ C, SALVAT C, et al. Stigmasterol:a phytosterol with potential anti-osteoarthritic properties[J]. Osteoarthritis and Cartilage, 2010, 18(1): 106-116.
[15] de STEFANI E, BOFFETTA P, RONCO A L, et al. Plant sterols and risk of stomach cancer: a case-control study in Uruguay[J]. Nutrition and Cancer, 2000, 37(2): 140-144.
[16] 刘虹蕾, 廖铭, 江波, 等. 植物甾醇酯的研究与分析[J]. 食品工业科技, 2012, 33(4): 434-437.
[17] 王会宁, 李淑颖, 吴亚妮, 等. 复方芳香植物提取物对营养型肥胖大鼠的减肥作用[J]. 中国实验方剂学杂志, 2012, 18(1): 168-172.
[18] 黄高霞, 张莉, 汪东风, 等. 大豆胰蛋白酶抑制剂对饮食肥胖小鼠的减肥作用[J]. 大豆科学, 2012, 31(2): 284-287.
[19] ADENEYE A A, ADEYEMI O O, AGBAJE E O. Anti-obesity and antihyperlipidaemic effect of Hunteria umbellata seed extract in experimental hyperlipidaemia[J]. Journal of Ethnopharmacology,2010, 130(2): 307-314.
[20] 赵鹏, 姚思宇, 刘荣珍, 等. γ-亚麻酸降血脂的动物实验研究[J]. 中国热带医学, 2004, 4(5): 722-723.
[21] 禹海文, 李妍妍, 苏秀榕. 浒苔对营养性肥胖小鼠减肥功能的研究[J].食品科学, 2012, 33(7): 247-250.
[22] CLARK J M. The epidemiology of nonalcoholic fatty liver disease in adults[J]. Journal of Clinical Gastroenterology, 2006, 40(Suppl 1):5-10.
[23] 申瑞玲, 马婧. 四种肥胖动物造模方法的比较[J]. 动物医学进展,2007, 28(3): 105-108.
[24] 陈茂彬, 黄琴. 三种植物甾醇酯预防小鼠高脂血症作用的比较[J].中国粮油学报, 2005, 20(2): 80-82.
[25] 闫莉萍, 陈瞬宏, 陈伟民, 等. 葛根素对膳食诱导的高胆固醇血症大鼠的血脂调节作用[J]. 中国临床药理学与治疗学, 2006, 11(5): 574-577.
Effects of Phytosterol Ester and Puerarin on Weight Loss in Nutritionally Obese Mice
CHENG Yuandu
1, YI Youjin
1,*, YI Chuanzhu
2, XIA Bo
1, XIA Yanbin
1
(1. College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China;2. Hunan Provincial Center for Disease Control and Prevention, Changsha 410000, China)
Abstract:Purpose: To study the weight loss effect of phytosterol ester and puerarin in obese mice. Methods: An obese mouse model was established by feeding high fat diet, and then the obese mice were divided into five groups, including model group, phytosterol ester group, puerarin group, phytosterol ester plus puerarin group, orlistat tablet group (10 mice per group). The treatments by gavage lasted for six weeks. Then, body weight, food intake, obese index, fat index, serum total cholestetol (TC), serum triglyceride (TG), low density lipoprotein cholesterol (LDL-C), high density lipoprotein cholesterol(HDL-C), the number and diameter of fat cells and liver lesions were measured. Results: Compared with the model group,body weight in the mice from phytosterol ester group, puerarin group and combined treatment group were respectively decreased by 5.41%, 6.98% and 12.50%. Obese indexes were respectively decreased by 3.41%, 3.26% and 6.25%. Fa t indexes were respectively decreased by 19.88%, 27.41% and 30.42%. The serum levels of TC, TG and LDL-C of the groups treated with phytosterol ester and/or puerarin decreased compared to the model group, and the combined treatment group showed the largest decline in the three serum lipid parameters by 21.40%, 37.50% and 30.43%, respectively. The number of fat cells in the combined treatment group was increased, and liver fatty lesion was also alleviated. Conclusion: Phytosterol ester and puerarin have weight-reducing effects on obese mice, especially when used in combination.
Key words:phytosterol ester; puerarin; obese mouse; weight loss
中图分类号:R915
文献标志码:A
文章编号:1002-6630(2015)13-0223-06
doi:10.7506/spkx1002-6630-201513041
收稿日期:2014-08-07
基金项目:“十二五”国家科技支撑计划项目(2015BAD16B00-2015BAD16B01);国家自然科学基金面上项目(31071738;31000827)
作者简介:程远渡(1989—),男,硕士研究生,研究方向为功能性食品。E-mail:chengyuandu@126.com
*通信作者:易有金(1968—),女,教授,博士,研究方向为食品营养与卫生。E-mail:yiyoujin@163.com