
金莉莉,马 俊,李 婷,娄 虹,张海波,王秋雨*
(辽宁大学生命科学院,辽宁 沈阳 110036)
摘 要:目的:探讨不同来源北冬虫夏草主要活性成分的差异,并评价其调节小鼠免疫功能的能力。方法:使用高效液相色谱法测定不同来源北冬虫夏草虫草素和腺苷的含量;通过测定小鼠免疫器官指数以及碳廓清实验和脾淋巴细胞增殖实验研究其对小鼠免疫功能的影响。结果:虫草素含量由高到低依次为蚕蛹虫草3.68 mg/g、小麦虫草2.86 mg/g、大米虫草2.63 mg/g、头状虫草0.95 mg/g;腺苷含量由高到低依次为蚕蛹虫草1.11 mg/g、小麦虫草0.79 mg/g 、头状虫草0.64 mg/g、大米虫草0.094 mg/g。碳廓清指数和脾淋巴细胞增殖能力研究结果表明4 种虫草均有提高小鼠免疫活性的功效,与空白组相比差异极显著,蚕蛹虫草和小麦虫草功效最佳;饲喂4 种虫草的小鼠免疫器官指数与空白组相比差异显著。结论:不同来源北冬虫夏草的虫草素和腺苷含量有所差异,蚕蛹虫草和小麦虫含量最高,其提高小鼠免疫功能的能力也最强。
关键词:北冬虫夏草;不同来源;虫草素;腺苷;免疫功能
北冬虫夏草(Cordyceps militaris)简称北虫草,又名蛹虫草,是我国珍贵的食药真菌资源,与冬虫夏草同属,含有多种有效成分,目前公认的主要活性成分为虫草素和腺苷 [1]。蛹虫草具有极高的药用价值,具有抗肿瘤、抗病毒、抗疲劳、调节人体内分泌和增强免疫力等多种功效 [1]。由于野生的天然冬虫夏草生长条件苛刻,其产量受到了生长环境的限制,并且近年来被过度开采,导致其产量远远不能满足人们的需求,因此人工培育的冬虫夏草逐渐得到了广大消费者的青睐 [2]。虫草素和腺苷是北虫草中的主要活性成分,对其质量控制具有重要的意义 [3]。蚕蛹虫草为以柞蚕蛹为培养基培育得到的北虫草,即生长在柞蚕蛹上的北虫草,大米虫草和小麦虫草分别为以大米和小麦为培养基培育得到的北虫草,头状虫草也是以小麦为培养基培育得到的北虫草,但其子实体头部近球形,故取名为头状虫草。不同来源的北虫草其培养基成分和培养成本差异显著,有关其活性成分含量的差异及药物功效尚无研究报道。本研究采用高效液相色谱法测定这4 种不同来源北虫草的主要活性成分,并研究它们对小鼠免疫功能的影响,以期为选择优质北虫草培养基和优质品系提供理论参考。
1.1 动物与材料
健康清洁级雄性昆明种小鼠,体质量约30 g,购于辽宁长生生物技术有限公司。
蚕蛹虫草 辽宁凤城蚕业研究所;小麦虫草、大米虫草 沈阳瑞欣养殖公司;头状虫草 沈阳市于洪区栽培户。
1.2 试剂与仪器
虫草素、腺苷标准品 中国药品生物制品检定所;印度墨水 北京市西中化工厂;乙腈(色谱纯)北京鼎国昌盛生物技术有限责任公司;其他试剂均为分析纯。
Waters e2695高效液相色谱仪(检测器为Waters 2489,工作站为Empower) 沃特世科技(上海)有限公司。
1.3 方法
1.3.1 虫草素及腺苷含量测定
1.3.1.1 标准品溶液的制备
分别精确称取虫草素和腺苷各10 mg于100 mL容量瓶中,加入甲醇使其溶解并定容至刻度,摇匀,配制成100 μg/mL的溶液。
1.3.1.2 色谱条件
色谱柱为Agilent Zorbax SB-C 18(4.6 mm×250 mm,5 μm),虫草素的检测条件参照石俊英 [3]和李娟 [4]等的方法;腺苷的检测条件参照吴燕等 [5]的方法。
1.3.1.3 标准曲线绘制
将虫草素和腺苷标准品均分别稀释为1、5、10、50 μg/mL,按照1.3.1.2节色谱条件进行测定,进样量10 μL,以虫草素和腺苷质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线,得出回归方程及决定系数。
1.3.1.4 测试样品溶液的制备
将4 种不同来源的虫草烘干至恒质量,精密称取0.5 g经烘干研磨的粉末溶于双蒸水中,超声波辅助提取2 h后,离心弃去上清液,用双蒸水定容至50 mL,得到虫草素测试样品 [6];取上述经烘干研磨的样品0.5 g置于具塞锥形瓶中,精密加入90%甲醇10 mL,摇匀,加热回流30 min,冷却后称质量,用90%甲醇补足减失的质量,过滤得到腺苷测试样品 [7]。
1.3.1.5 4 种样品虫草素和腺苷含量的测定
分别取虫草素和腺苷测试样品溶液10 μL,按照
1.3.1.2 节色谱条件进行测定,根据同一保留时间下的出峰面积,外标法计算4 种样品中虫草素和腺苷的含量。
1.3.2 小鼠免疫功能测定
雄性昆明小鼠100 只随机均分为碳廓清实验组和脾淋巴细胞增殖实验组,每组再分为空白组、蚕蛹虫草组、大米虫草组、头状虫草组和小麦虫草组(每组10 只)。实验组小鼠按10 mg/(kg·d)(以体质量计,下同)的剂量灌胃0.2 mL虫草测试样品(1.3.1.4节虫草素测试样品和腺苷测试样品的混合物),共计28 d;空白组小鼠灌胃同体积的生理盐水 [8]。
1.3.2.1 碳廓清实验及免疫器官指数测定
末次灌胃30 min 后,于小鼠尾静脉注射印度墨汁0.1 mL/10 g,分别于注射后2 min(t 1)和10 min(t 2)从眼眶静脉丛取血20 μL,立即置于含有2 mL 0.1% Na 2CO 3溶液的试管中,在600 nm波长处测定二者的光密度(OD)值得到OD 1和OD 2,按照公式(1)、(2)计算碳廓清指数K和吞噬指数a [9]。

分别处死并解剖各组小鼠,取其胸腺及脾脏,称质量并分别计算其与体质量的比值,得到相应的免疫器官指数。
1.3.2.2 脾淋巴细胞增殖实验
利用噻唑蓝(methyl thiazolyl tetrazolium,MTT)法检测4 种虫草对小鼠淋巴细胞增殖的影响,参照梁坚等 [10]的方法进行。
2.1 4 种虫草的虫草素和腺苷含量
按照相应的高效液相色谱测定条件,虫草素和腺苷标准品溶液在1~100 μg/mL范围内均具有良好的线性关系,回归方程分别为y=336 940x+37 096( R 2= 0.999 5)和y=31 647x-18 575(R 2=0.999 5)。虫草素和腺苷的出峰时间分别为4.1 min和7.4 min(图1)。
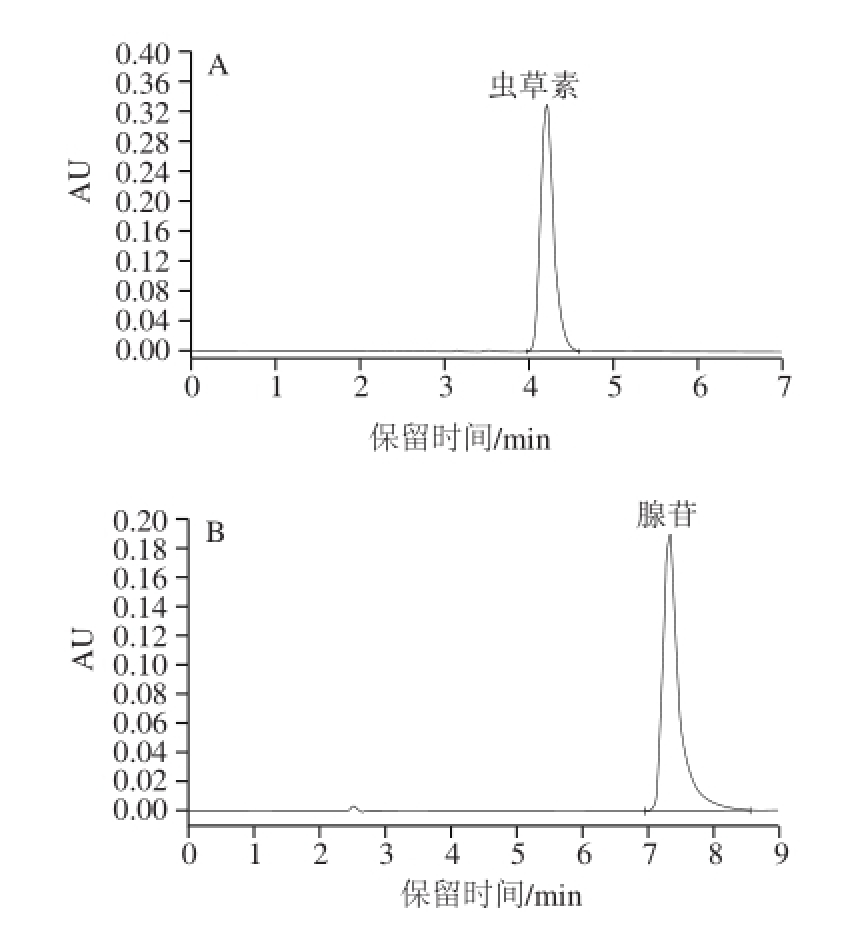
图1 虫草素(A)和腺苷(B)对照品的高效液相色谱图
Fig.1 HPLC chromatograms of standard samples of cordycepin (A)and adenosine (B)
按照上述虫草素测定色谱条件进样,测定蚕蛹虫草、大米虫草、头状虫草和小麦虫草供试样品溶液中虫草素含量分别为3.68、2.63、0.95、2.86 mg/g,测定结果显示不同来源虫草的虫草素含量差异较大,蚕蛹虫草的虫草素含量最高。
按照上述虫草素测定色谱条件进样,蚕蛹虫草、大米虫草、头状虫草、小麦虫草供试样品溶液中腺苷含量分别为1.11、0.094、0.64、0.79 mg/g。测定结果表明不同来源虫草的腺苷含量差异也较大,蚕蛹虫草的虫草素含量最高。
2.2 4 种虫草对小鼠免疫功能的影响
表1 小鼠的碳廓清指数和免疫器官指数

Table1 Carbon clearance index and immune organ indexes of mice

注:*. 与空白组相比,差异显著(P<0.05);**. 与空白组相比,差异极显著(P<0.01);下同。同列大写字母不同表示不同虫草处理组之间差异显著(P<0.05)。
组别碳廓清指数K吞噬指数a脾脏指数胸腺指数空白组0.038 6±0.004 75.907 1±0.785 50.036 4±0.011 20.001 9±0.001 0蚕蛹虫草组0.073 1±0.015 4 B**7.428 5±0.614 5 A**0.054 3±0.017 3*0.002 1±0.001 0*大米虫草组0.050 7±0.018 9 A**6.540 3±0.307 3 A**0.052 6±0.009 6*0.002 0±0.000 9*头状虫草组0.051 8±0.012 9 A**6.764 1±0.674 1 A**0.044 7±0.004 3*0.002 2±0.000 8*小麦虫草组0.062 0±0.029 8 C**7.189 0±0.591 6 A**0.043 2±0.019 7*0.002 1±0.001 0*
如表1所示,饲喂4 种虫草实验组的小鼠与空白组的小鼠相比,碳廓清指数K和吞噬指数a差异极显著(P<0.01)。4 种虫草实验组间相比,小鼠碳廓清指数K为蚕蛹虫草>小麦虫草>头状虫草和大米虫草,具有显著差异(P<0.05),头状虫草组和大米虫草组相比,碳廓清指数无显著差异(P>0.05)。4 个虫草实验组小鼠免疫器官指数与空白组相比差异显著(P<0.05),各虫草实验组间差异无统计学意义。
表2 小鼠的脾淋巴细胞增殖能力(x
Table2 The proliferation capacity of spleen lymphocytes in mice
组别空白组蚕蛹虫草组大米虫草组头状虫草组小麦虫草组OD 570 nm0.142 8±0.014 10.235 6±0.018 0 B**0.200 8±0.014 2 A**0.201 9±0.012 9 A**0.229 8±0.019 0 C**
如表2所示,各虫草实验组与空白组相比,可明显增强小鼠淋巴细胞的增殖率,差异极显著(P<0.01)。各虫草实验组间相比,小鼠脾淋巴细胞增殖能力为蚕蛹虫草>小麦虫草>头状虫草和大米虫草,具有显著差异(P<0.05),大米虫草组和头状虫草组间相比差异不显著(P>0.05)。
在文献报道的基础上 [11-14],本实验分别选择水和甲醇作为溶剂,提取样品中的虫草素和腺苷,经过分析比较,发现测定虫草素含量用水作为溶剂提取效果最好,而测定腺苷含量则选择《中华人民共和国药典》(2010年版) [7]中的方法进行提取,虽然提取过程较为复杂,但是更能精确地测定虫草中腺苷的含量,峰型和分离效果良好。4 种虫草中的虫草素和腺苷含量差异显著,虫草素含量比较结果为:蚕蛹虫草3.68 mg/g>小麦虫草2.86 mg/g>大米虫草2.63 mg/g>头状虫草0.95 mg/g;腺苷含量比较结果为:蚕蛹虫草1.11 mg/g>小麦虫草0.79 mg/g>头状虫草0.64 mg/g>大米虫草0.094 mg/g。
胸腺和脾脏是哺乳动物最重要的中枢和外周免疫器官之一,胸腺指数和脾脏指数能间接反映机体的免疫水平 [15]。巨噬细胞具有吞噬、杀伤及消化病原体的功能,并在特异性免疫应答中参与抗原提呈及免疫调节作用 [16],巨噬细胞的激活可使机体抗感染能力提高,从而增强机体的非特异性免疫功能 [17]。淋巴细胞是体内免疫活性细胞,淋巴细胞增殖能力的强弱在某种程度上代表了免疫功能的高低 [18]。本研究通过对小鼠灌胃不同来源虫草,4 个虫草实验组的小鼠免疫器官指数与空白组相比均有显著差异(P<0.05),对小鼠碳廓清指数和脾淋巴细胞增殖能力均有提高作用,3 种指标的比较结果均为蚕蛹虫草>小麦虫草>大米虫草和头状虫草。结果说明摄入一定量的虫草可增强小鼠机体吞噬细胞的吞噬功能以及脾淋巴细胞的增殖能力,从而增强其免疫功能,其中蚕蛹虫草提高小鼠免疫功能的效果最佳。
本研究结果表明,虽然4 种不同来源虫草均可以提高小鼠的免疫功能,但活性成分含量较高的蚕蛹虫草和小麦虫草对小鼠免疫功能的影响最强,即虫草中活性成分含量的多少与其增强小鼠免疫功能的能力成正相关。蚕蛹和小麦中的蛋白质含量较高,充足的氮源可能对提高北虫草中的活性成分含量具有一定的作用。本研究的结果为培养高质量北虫草提供了一定理论参考依据。
参考文献:
[1] 宋江峰, 刘春泉, 李大婧, 等. HPLC-DAD测定人工北冬虫夏草中虫草素含量[J]. 食品科学, 2008, 29(4): 352-354.
[2] 张绪璋. 北冬虫夏草的人工培植及其营养成分分析[J]. 中国食用菌,2003, 22(2): 19-21.
[3] 石俊英, 徐君, 刘献宏, 等. RP-HPLC法测定北虫草中腺苷、虫草素含量[J]. 山东中医杂志, 2008, 27(10): 706-708.
[4] 李娟, 王颜红, 王世成, 等. HPLC测定人工蛹虫草培养基中的虫草素[J]. 光谱实验, 2012, 29(6): 3300-3303.
[5] 吴燕, 杨滨. HPLC法同时测定保健品中腺苷和虫草素含量的研究[J].中国卫生检验杂志, 2007, 17(6): 983-985.
[6] 钟欣, 招淑艳, 刘昕. 冬虫夏草与香棒虫草的分子及化学指纹图谱鉴别[J]. 中国食品学报, 2009, 9(1): 175-182.
[7] 国家药典委员会. 中华人民共和国药典(一部)[M]. 北京: 中国医药科技出版社, 2010: 121-165.
[8] 吴艳明, 黄文芳, 林湘. 蛹虫草菌丝对高血脂调节作用的研究[J]. 华南师范大学学报: 自然科学版, 2008, 5(2): 111-117.
[9] 赵林伊, 王宝贵, 张桂英. 柞蚕蛹虫草对小鼠免疫功能的影响[J]. 中国公共卫生, 2004, 20(2): 230.
[10] 梁坚, 何励, 傅伟忠, 等. 虫草多肽对小鼠免疫功能的影响[J]. 中国热带医学, 2007, 7(7): 1104-1106.
[11] 孙军德, 白立红, 房琳琳, 等. 蛹虫草中虫草素测定方法的比较[J].沈阳农业大学学报, 2011, 42(2): 212-215.
[12] 颜玉文, 许登泉, 赵宇蕾, 等. 腺苷和虫草素在北虫草子实体各部位中的分布及含量[J]. 实验研究, 2014, 12(2): 42-44.
[13] 贺军芳, 刘晓兰, 郑喜群, 等. HPLC测定不同产地蛹虫草液体深层培养液中虫草素含量[J]. 农产品加工: 学刊, 2013(5): 12-14.
[14] HUANG Lei, LI Qizhang, CHEN Yiyuna, et al. Determination and analysis of cordycepin and adenosine in the products of Cordyceps spp.[J]. African Journal Microbiology Research, 2009, 3(12): 957-961.
[15] 吴新正, 何迎春, 刘红萍, 等. 红景天复方对小鼠免疫、耐缺氧和抗疲劳能力的影响[J]. 湖南中医药大学学报, 2008, 28(1): 29-31.
[16] 龚非力. 医学免疫学[M]. 2版. 北京: 科学出版社, 2004: 75-93.
[17] 黄凯, 杨新波, 黄正明, 等. 金丝桃苷对正常小鼠免疫功能的影响[J].解放军药学学报, 2009, 25(2): 133-135.
[18] 帅学宏, 胡庭俊, 陈炅然, 等. 鬼臼多糖对小鼠免疫功能和抗氧化能力的影响[J]. 畜牧兽医学报, 2008, 38(7): 1000-1004.
Determination of Active Components in Cordyceps militaris from Different Sources and Their Impacts on Immune Function of Mice
JIN Lili, MA Jun, LI Ting, LOU Hong, ZHANG Haibo, WANG Qiuyu*
(School of Life Science, Liaoning University, Shenyang 110036, China)
Abstract:Purpose: To comparatively analyze active components in Cordyceps militaris from different sources and investigate the effects of Cordyceps militaris from different sources on the immune function of mice. Methods: High performance liquid chromatography (HPLC) was used to determine the contents of cordycepin and adenosine in four kinds of Cordyceps militaris, and their immune-regulatory effects on mice were evaluated by carbon clearance rate, immune organ indexes and proliferation capacity of spleen lymphocytes. Results: Silkworm chrysalis Cordyceps militaris, wheat Cordyceps militaris, rice Cordyceps militaris and Cordyceps capitata contained 3.68, 2.86, 2.63 and 0.95 mg/g cordycepin, and 1.11,0.79, 0.64 and 0.094 mg/g adenosine, respectively. Based on the results of carbon clearance rate, proliferation capacity of spleen lymphocytes and immune organ indexes, all the four kinds of Cordyceps militaris could increase the immune function of mice when c ompared with the control group. Meanwhile, silkworm chrysalis Cordyceps militaris and wheat Cordyceps militaris were much better in improving the immune function than those from two other sources. Conclusions: The contents of cordycepin and adenosine were significantly different among Cordyceps militaris from different sources, and Cordyceps militaris from silkworm chrysalis and wheat had higher contents of cordycepin and adenosine, and exerted more potent immune-regulatory effects on mice.
Key words:Cordyceps militaris; different sources; cordycepin; adenosine; immune function
中图分类号:R915
文献标志码:A
文章编号:1002-6630(2015)13-0243-04
doi:10.7506/spkx1002-6630-201513045
收稿日期:2014-07-07
基金项目:沈阳市科技计划项目(F12-277-1-40);辽宁省教育厅科学研究一般项目(L2013007)
作者简介:金莉莉(1971—),女,教授,博士,研究方向为食品营养和安全。E-mail:lilijin@lnu.edu.cn
*通信作者:王秋雨(1961—),男,教授,博士,研究方向为食品营养和安全。E-mail:qiuyuwang@lnu.edu.cn