夏 娜,陈义磊,陶海燕,木合塔尔·吐尔洪*
(喀什大学化学与环境科学学院,叶尔羌绿洲生态与生物资源研究高校重点实验室,新疆 喀什 844000)
摘 要:目的:研究药桑多糖对四氯化碳(CCl 4)所致大鼠肝损伤的保护作用。方法:取健康Sprague-Dawley(SD)大鼠40 只,根据体质量随机分为5 组:对照组、CCl 4损伤组、药桑多糖低(50 mg/(kg·d))、中(100 mg/(kg·d))、高(200 mg/(kg·d))剂量组,每组8 只,连续灌胃7 d后,除对照组外,其余各组大鼠腹腔注射CCl 4橄榄油溶液制造肝损伤模型。24 h后,取血清测定谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)活力以及胆红素含量,取各器官计算脏器指数并测定肝脏超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-Px)活力,以及丙二醛(malondialdehyde,MDA)、干扰素-γ(interferon-γ,IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-10(interleukin-10,IL-10)含量,并对肝脏进行组织切片观察。结果:100、200 mg/(kg·d)剂量的药桑多糖能显著增加大鼠体质量(P<0.05),降低肝脏指数(P<0.05)、肾脏指数(P<0.05)和脾脏指数(P<0.01),能显著抑制CCl 4所致肝损伤大鼠血清ALT、AST活力和胆红素含量的升高(P<0.05);肝脏MDA、IFN-γ、TNF-α含量显著降低(P<0.05),SOD、CAT、GSH-Px活力以及IL-10含量显著升高(P<0.05)。50 mg/(kg·d)剂量的药桑多糖能显著降低肝损伤大鼠的肝脏指数、肾脏指数和脾脏指数(P<0.05),显著增加肝脏GSH-Px活力和IL-10含量(P<0.05),降低肝脏TNF-α含量(P<0.05)。结论:药桑多糖对CCl 4诱导的大鼠肝损伤具有明显的保护作用,其肝脏保护作用与提高肝脏抗氧化能力及抑制肝脏炎症有关。
关键词:药桑多糖;肝保护作用;抗氧化活性;四氯化碳
药桑属半栽培半野生资源,在植物分类学上属桑科桑属黑桑种(Morus nigra Linn.),原产于伊朗,16世纪在我国新疆等地开始栽培,是我国唯一的黑桑品种,也是自然界极为罕见的珍稀药用果桑资源。在我国,药桑一直被维吾尔族作为民间药材,用以治疗急慢性扁桃体炎、风湿关节痛、咽喉肿痛等疾病 [1]。在藏药中被称为“桑孜那保”,收载于《四部医典》、《晶珠本草》等藏医药经典著作中 [2]。目前对药桑的研究主要集中在对其有效成分的分离与提取及体外自由基清除方面,关于其有效成分生理功能的研究报道较为少见 [3-7]。路国兵等 [8]研究发现药桑果实多糖具有降血糖作用,裴凌鹏等 [9]研究认为药桑总黄酮对糖尿病大鼠骨质具有影响。据《维吾尔药志》 [10]记载,药桑果实具有润肝、明目等功能,暗示药桑可能对肝脏具有保护作用,然而目前关于药桑对肝脏的保护作用却知之甚少。
肝脏是机体重要的代谢器官,是化学毒物或药物在体内代谢或转化的重要场所,因此肝脏极易受到各外源性物质的攻击,从而引发急性或慢性损伤 [11]。肝脏疾病已成为人类最常见的疾病之一,严重威胁着人类健康,据国内外多家医院统计数据 [12]显示,每年因肝损伤住院的患者占急性肝炎患者的10%,且呈逐年上升的趋势。因而研究抗肝脏疾病的有效功能性食物成分或药物显得尤为重要,以无或少毒副作用角度出发,从植物中提取天然性成分成为肝脏保护作用研究的热点。众多研究 [13-15]表明,多糖类化合物对化学性、药物性、酒精性等不同类型的肝损伤具有不同程度的保护作用。前人研究结果显示,药桑果实多糖能提高糖尿病小鼠肝脏的抗氧化能力 [8],据此提出药桑果实多糖是否具有肝脏保护作用的疑问。因此,本实验拟以CCl 4诱导大鼠肝损伤模型为对象,研究和探讨药桑果实多糖对大鼠肝损伤的保护作用,以期为药桑功能性食品的开发以及应用提供实验依据。
1.1 材料、动物与试剂
药桑采摘于新疆喀什市,其果实多糖由本实验室制备,于冰箱中4 ℃条件下保存备用。
SPF级雌性Sprague-Dawley(SD)大鼠,体质量(200±20) g,由新疆医科大学实验动物中心提供,室温条件下常规饲养。
芦丁 国药集团化学试剂有限公司;谷丙转氨酶(alanine aminotransferase,ALT)试剂盒、谷草转氨酶(aspartate aminotransferase,AST)试剂盒、总胆红素试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-Px)试剂盒、过氧化氢酶(catalase,CAT)试剂盒 南京建成生物科技有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒、干扰素-γ(interferon-γ,IFN-γ)试剂盒、白细胞介素-10(interleukin-10,IL-10)试剂盒 武汉博士德生物工程有限公司;硝酸铝、CCl 4、二甲苯、无水乙醇等均为分析纯。
1.2 仪器与设备
5418冷冻离心机 德国艾本德股份公司;722型可见分光光度计 上海光谱仪器有限公司;旋转蒸发仪 上海亚荣生化仪器厂;SHZ-D(Ⅲ)循环水式多用真空泵 巩义市予华仪器有限责任公司;真空冷冻干燥系统 北京亚泰隆科技仪器有限公司。
1.3 药桑多糖的提取与多糖含量测定
1.3.1 药桑多糖的提取
药桑采摘后,将原料洗净、晾干,80 ℃烘干3 h,粉碎后过35 目筛,制成药桑干粉。药桑多糖提取工艺流程:药桑干粉→80%乙醇浸泡12 h→滤渣中加入蒸馏水→95 ℃水浴搅拌提取5 h→取上清液,旋转蒸发浓缩→脱色→除蛋白质→乙醇沉淀→脱水→冷冻干燥→药桑多糖粉。
1.3.2 粗多糖含量的测定
采用苯酚-硫酸法 [16]对提取的多糖定量,以葡萄糖当量表示。准确称取葡萄糖10.0 mg,蒸馏水溶解并定容至100 mL,配制成0.1 mg/mL的葡萄糖标准溶液。吸取0~1.2 mL葡萄糖标准液分别置于10 mL比色管中,用蒸馏水补至2.0 mL,加入1.0 mL体积分数6%的苯酚试剂,混匀,迅速加入浓硫酸5.0 mL,混匀后放置10 min,于沸水浴中加热15 min,取出冷却至室温,以试剂为空白参比液,490 nm波长处测定吸光度,以葡萄糖质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,求得回归方程。取一定量的药桑多糖溶液,按上述方法测定其吸光度并按照回归方程计算其粗多糖含量。
1.4 动物分组与饲养
大鼠适应性喂养3 d后,根据体质量随机分为5 组,每组8 只:对照组(灌胃等量蒸馏水),CCl 4损伤组(灌胃等量蒸馏水),药桑多糖低(50 mg/(kg·d))、中(100 mg/(kg·d))、高(200 mg/(kg·d))剂量组。受试样品用蒸馏水溶解配制,每天上午9:00—10:00灌胃1 次,连续灌胃7 d。末次灌胃2 h后,对照组大鼠腹腔注射2 mL橄榄油,其余各组大鼠一次性腹腔注射1 g/100 mL的CCl 4橄榄油溶液2 mL,建立大鼠肝损伤模型。实验期间,所有动物供给全价颗粒饲料,自由饮水。24 h后,对大鼠摘眼球取血,分离血清,同时分离肝脏、肾脏及脾脏并称质量。
1.5 指标检测与方法
1.5.1 脏器指数的测定
将大鼠处死后,剖腹采集肝脏、肾脏及脾脏,分别称质量,并按照下式计算各器官的脏器指数。
1.5.2 肝脏组织形态学观察
取大鼠肝右叶组织置于体积分数10%的中性甲醛溶液中固定,石蜡包埋、切片,苏木精-伊红染色,在光学显微镜下观察肝组织的形态学变化。
1.5.3 血清ALT和AST活力以及胆红素含量的测定
血清ALT和AST活力,以及胆红素含量均采用分光光度法测定,严格按照试剂盒说明书进行检测。
1.5.4 肝脏组织SOD、CAT、GSH-Px活力及MDA含量的测定
取大鼠肝脏组织准确称质量,生理盐水匀浆,制成质量分数10%的肝脏组织匀浆液,于4 ℃、3 000 r/min离心10 min,取上清液于-20 ℃条件下保存备用。肝脏组织SOD、CAT、GSH-Px活力及MDA含量的测定严格按照试剂盒说明书方法进行。
1.5.5 肝脏组织中TNF-α、IFN-γ及IL-10含量的测定
采用酶联免疫吸附法检测质量分数10%的肝脏组织匀浆液中TNF-α、IFN-γ和IL-10的含量,严格按照试剂盒说明书方法操作,于450 nm波长处测定样品吸光度。
1.6 数据统计分析
上述所有数据均以
 表示,SPSS 11.5软件进行数据分析与处理,组内采用Duncan's多重比较法进行方差分析。
表示,SPSS 11.5软件进行数据分析与处理,组内采用Duncan's多重比较法进行方差分析。
2.1 药桑多糖中的粗多糖含量
由标准曲线得到回归方程y=0.008 9x-0.057 3(R 2= 0.999 2),其中x为样品中药桑粗多糖含量,y为吸光度。经实验测得药桑多糖样品中粗多糖含量为60.13%。
2.2 药桑多糖对CCl 4所致肝损伤大鼠体质量、组织质量的影响
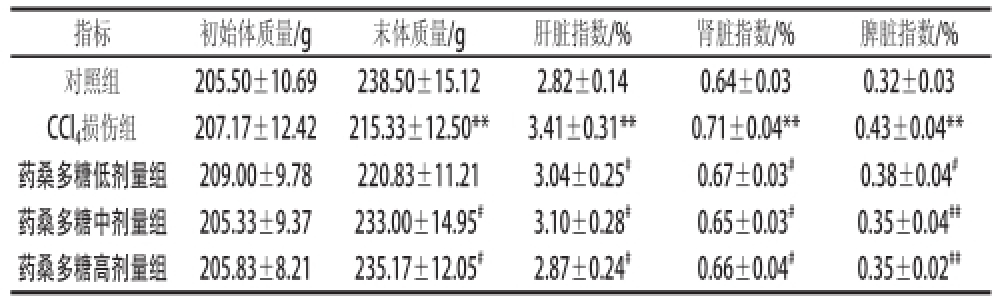
表1 药桑多糖对CCll4所致肝损伤大鼠的体质量和组织质量的影响
Table1 Effect off Morus
 niiggrraa Linn. fruit polysaccharides on body weights and tissue weights in rats with CCl4-induced liver injury y
niiggrraa Linn. fruit polysaccharides on body weights and tissue weights in rats with CCl4-induced liver injury y
 (x ±s,n=8)
(x ±s,n=8)
注:**. 与对照组相比,差异极显著(P<0.01);#. 与CCl 4损伤组相比,差异显著(P<0.05);##. 与CCl 4损伤组相比,差异极显著(P<0.01)。下同。
指标初始体质量/g末体质量/g肝脏指数/%肾脏指数/%脾脏指数/%对照组205.50±10.69238.50±15.122.82±0.140.64±0.030.32±0.03 CCl 4损伤组207.17±12.42215.33±12.50**3.41±0.31**0.71±0.04**0.43±0.04**药桑多糖低剂量组209.00±9.78220.83±11.213.04±0.25 #0.67±0.03 #0.38±0.04 #药桑多糖中剂量组205.33±9.37233.00±14.95 #3.10±0.28 #0.65±0.03 #0.35±0.04 ##药桑多糖高剂量组205.83±8.21235.17±12.05 #2.87±0.24 #0.66±0.04 #0.35±0.02 ##
由表1可知,与对照组相比,CCl 4损伤组大鼠末体质量极显著降低(P<0.01),肝脏指数、肾脏指数及脾脏指数极显著升高(P<0.01)。不同剂量的药桑多糖对CCl 4所致肝损伤大鼠的体质量降低,肝脏指数、肾脏指数及脾脏指数的增加均有不同程度的缓解作用。相对于CCl 4损伤组,药桑多糖低剂量组大鼠的肝脏指数、肾脏指数和脾脏指数显著降低(P<0.05),给予中、高剂量的药桑多糖干预后,大鼠末体质量显著增加(P<0.05),肝脏指数、肾脏指数和脾脏指数均显著或极显著降低(P<0.05或P<0.01)。
2.3 药桑多糖对CCl 4所致肝脏损伤大鼠血清AST、ALT活力以及胆红素含量的影响
表2 药桑多糖对大鼠血清AST、ALT活性和胆红素含量的影响
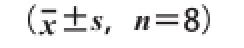
Table2 Effect of Morus nigra Linn. fruit polysaccharides on serum AST and ALT activities and bilirubin contents in rats with CCl -induced liver injury


注:*. 与对照组相比,差异显著(P<0.05)。下同。
胆红素含量/(mg/dL)对照组173.30±21.2959.67±9.290.51±0.09 CCl 4损伤组208.17±23.03*83.94±10.60**0.72±0.08*药桑多糖低剂量组198.50±21.0776.00±12.200.68±0.09药桑多糖中剂量组180.17±22.05 #70.87±6.50 #0.61±0.10 #药桑多糖高剂量组169.17±18.95 #59.83±9.58 #0.57±0.09 #指标AST活力/(U/L)ALT活力/(U/L)
由表2可知,CCl 4损伤组大鼠的血清AST、ALT活力和胆红素含量明显高于对照组,具有统计学意义(P<0.05或P<0.01),说明CCl 4对大鼠的肝脏造成了损伤,大鼠肝损伤模型建立成功。与CCl 4损伤组相比,药桑多糖中、高剂量组大鼠的AST、ALT活力及胆红素含量均显著降低(P<0.05),药桑多糖低剂量组大鼠的血清各项指标与CCl 4损伤组相比无显著差异(P>0.05),以上结果表明药桑多糖对CCl 4所致的大鼠肝损伤具有一定保护作用,且与其剂量有一定关系。
2.4 药桑多糖对CCl 4所致肝损伤大鼠肝脏组织形态的影响


图1 药桑多糖对大鼠肝脏组织形态的影响(×20000)
Fig.1 Effect of Morus nigra Linn. fruit polysaccharides on histological change of liver in rats (× 200)
A. 对照组;B. CCl 4损伤组;C. 药桑多糖低剂量组;D. 药桑多糖中剂量组;E. 药桑多糖高剂量组。
如图1所示,对照组大鼠肝组织结构正常,肝小叶结构清晰,肝细胞索明显,无变性坏死、炎性细胞浸润、纤维组织增生(图1A)。CCl 4损伤组大鼠肝索排列紊乱,中央静脉周围出现炎性细胞浸润以及肝细胞坏死、肝细胞肿胀、肝窦变窄,出现脂肪样病变(图1B)。药桑多糖低剂量组大鼠肝索排列整齐,淋巴细胞浸润和脂肪样病变程度降低(图1C),药桑多糖中、高剂量组大鼠肝组织结构明显好转,趋向正常形态(图1D、1E)。
2.5 药桑多糖对CCl 4所致肝损伤大鼠肝脏抗氧化能力的影响
表3 药桑多糖对大鼠肝脏抗氧化能力的影响(x

Table3 Effect off Morus niiggrraa Linn. fruit polysaccharides on liver antioxidant ability in rats with CCl4-induced liver injuryy
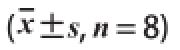
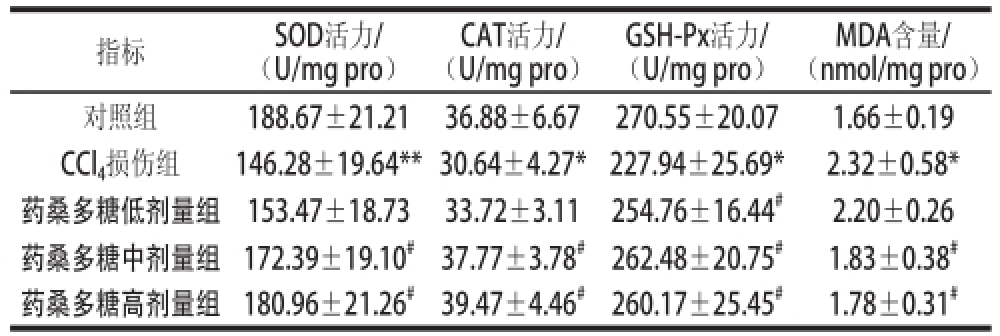
MDA含量/(nmol/mg pro)对照组188.67±21.2136.88±6.67270.55±20.071.66±0.19 CCl 4损伤组146.28±19.64**30.64±4.27*227.94±25.69*2.32±0.58*药桑多糖低剂量组153.47±18.7333.72±3.11254.76±16.44 #2.20±0.26药桑多糖中剂量组172.39±19.10 #37.77±3.78 #262.48±20.75 #1.83±0.38 #药桑多糖高剂量组180.96±21.26 #39.47±4.46 #260.17±25.45 #1.78±0.31 #指标SOD活力/(U/mg pro)CAT活力/(U/mg pro)GSH-Px活力/(U/mg pro)
氧化应激是CCl 4造成肝脏损伤的重要因素,由表3可知,相对于对照组,CCl 4损伤组大鼠SOD、CAT和GSH-Px活力极显著或显著降低(P<0.01或P<0.05),MDA的含量显著升高(P<0.05)。与CCl 4损伤组相比,药桑多糖低剂量组大鼠的GSH-Px活力显著升高(P<0.05);与CCl 4损伤组相比,药桑中、高剂量组大鼠的SOD、CAT和GSH-Px活力显著升高(P<0.05),MDA含量显著降低(P<0.05)。由此可见,药桑多糖能提高CCl 4所致肝损伤大鼠肝脏的抗氧化能力。
2.6 药桑多糖对CCl 4所致肝损伤大鼠肝脏细胞因子含量的影响
由表4可知,与对照组相比,CCl 4损伤组大鼠肝脏TNF-α和IFN-γ含量显著或极显著升高(P<0.05或P<0.01),IL-10含量显著降低(P<0.05)。与CCl 4损伤组相比,药桑多糖低剂量组大鼠肝脏TNF-α含量显著降低(P<0.05),IL-10含量显著升高(P<0.05);药桑多糖中、高剂量组大鼠肝脏TNF-α和IFN-γ含量显著降低(P<0.05),IL-10含量显著升高(P<0.05)。
表4 药桑多糖对大鼠肝脏细胞因子的影响(x

Table4 Effect off Morus niiggrraa Linn. fruit polysaccharides on liver cytokines in rats with CCll 4-induced liver injury
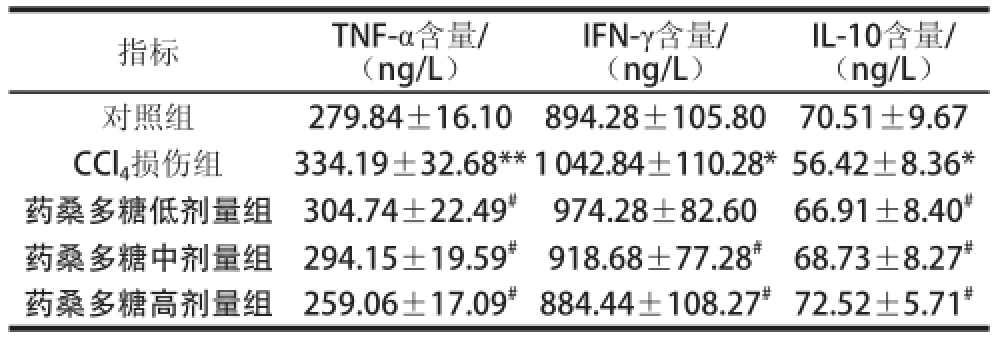
IL-10含量/(ng/L)对照组279.84±16.10894.28±105.8070.51±9.67 CCl 4损伤组334.19±32.68**1 042.84±110.28*56.42±8.36*药桑多糖低剂量组304.74±22.49 #974.28±82.6066.91±8.40 #药桑多糖中剂量组294.15±19.59 #918.68±77.28 #68.73±8.27 #药桑多糖高剂量组259.06±17.09 #884.44±108.27 #72.52±5.71 #指标TNF-α含量/(ng/L)IFN-γ含量/(ng/L)
肝脏是机体重要的代谢器官,它在糖类、脂类及蛋白质代谢过程中起着重要作用,同时肝脏还具有分泌、排泄和生物转化等功能。当肝脏出现损伤时,机体的物质代谢将发生紊乱,并影响其他器官的功能,严重时甚至会危及生命。
CCl 4被认为是一种典型的化学性肝损伤诱导剂,研究表明其诱导的肝损伤所表现的症状和肝脏病理改变特征等与病毒性肝炎具有相似性 [17-18]。CCl 4在肝细胞色素P450氧化酶作用下,生成CCl 3·和Cl·,造成细胞膜系统的氯烷化和脂质过氧化,继而引起细胞膜结构和功能的改变,导致肝细胞损害 [19]。本实验采用腹腔注射CCl 4建立大鼠肝损伤模型,肝脏病理学检测表现为肝细胞肿胀,伴有炎性细胞浸润,肝小叶中央区坏死和脂肪变性,同时血清学检测到AST和ALT活性升高以及胆红素含量升高,说明成功地制造了大鼠肝损伤模型。
肝脏损伤常常伴随血清ALT和AST活性升高以及胆红素含量的升高。ALT和AST是存在于肝细胞胞浆和线粒体中的转氨酶,当肝细胞受损时,ALT和AST即从肝细胞内渗漏入血液,血清中AST和ALT活性即升高 [20]。本实验及前人研究结果均显示CCl 4引起血清AST和ALT活性升高,以及胆红素水平的升高 [21]。然而在给予药桑多糖(低剂量除外)后,大鼠血清AST和ALT的活性以及胆红素的含量均明显降低,这一结果说明药桑多糖能缓解CCl 4所致的肝脏损伤。这一结果同时被肝脏组织的病理学观察所佐证。给予药桑多糖后,大鼠肝细胞无大量坏死,肝小叶内仅偶尔可见坏死小灶,淋巴细胞浸润减少,肝细胞肿胀及脂肪变性程度降低,其中药桑多糖中、高剂量组比低剂量组效果好。
药桑多糖提高了CCl 4所致肝损伤大鼠肝脏的抗氧化能力,且效果随着其剂量的增加而增强。SOD、CAT和GSH-Px是组成生物体体内酶促防御体系重要的抗氧化酶,它们能有效地清除活性氧自由基并终止自由基链式反应,当抗氧化酶的活力降低时,会引起机体自由基清除障碍,导致自由基过度累积,引起细胞膜完整性和功能的丧失 [22-23]。MDA是脂质过氧化产物,其含量的变化可反映肝细胞的损伤程度 [24]。在本实验中,与CCl 4损伤组相比,药桑多糖中、高剂量组大鼠肝脏SOD、CAT和GSH-Px活力显著升高,MDA含量显著降低,低剂量的药桑多糖仅显著提高了大鼠肝脏GSH-Px活力。该结果说明药桑多糖能提高大鼠肝脏抗氧化能力,并呈量效关系。
药桑多糖缓解了CCl 4损伤造成的大鼠肝脏炎症。TNF-α是一种多功能的促炎性细胞因子,它能刺激一系列促炎性物质,如IL-1、IL-6、NO、巨噬细胞趋化蛋白1等的产生,因此TNF-α在诱导肝脏炎症和引起肝脏损伤过程中发挥重要作用 [25-26]。IFN-γ是一类Th1型细胞因子,CCl 4介导的肝损伤将引起其表达量的上升 [27]。IL-10是常见的抗炎因子,IL-10含量的增加将会引起TNF-α和IFN-γ等促炎性细胞因子分泌的减少,研究认为IL-10可以保护CCl 4所致的急性及慢性肝损伤 [27-28]。因此,降低促炎性细胞因子(如TNF-α和IFN-γ)表达,提高抗炎性细胞因子(如IL-10)表达能缓解CCl 4造成的肝脏炎症。本实验结果显示,中、高剂量的药桑多糖显著降低了大鼠肝脏TNF-α和IFN-γ含量,增加了IL-10含量,药桑多糖低剂量组大鼠肝脏TNF-α含量显著降低(P<0.05),IL-10含量显著升高(P<0.05)。该结果显示药桑多糖具有降低肝脏炎症的作用,且抗炎效果与其剂量有一定相关性。
综合以上研究结果,无论肝脏的生化指标检测还是病理学观察均表明药桑多糖对CCl 4所致的大鼠肝损伤具有保护作用,其中中、高剂量的药桑多糖对大鼠肝脏的保护作用较低剂量组更好,说明药桑多糖对大鼠肝脏的保护作用与其剂量有一定相关性。药桑多糖对大鼠肝损伤的保护作用与其提高肝脏抗氧化能力以及抑制肝脏炎症相关。
参考文献:
[1] 新疆吾尔自治区农业厅, 新疆吾尔自治区蚕学会, 新疆吾尔自治区和田蚕桑科学研究所. 新疆桑树品种资源志[M]. 乌鲁木齐: 新疆维吾尔自治区农业厅, 1980: 3-7.
[2] 敖其尔, 乌力吉特古斯. 浅析草乌在藏医中的应用[J]. 中国民族医药杂志, 2009, 15(1): 21-22.
[3] 伍春, 徐立, 刘峻池, 等. 响应曲面法优化新疆药桑桑皮总多酚提取工艺[J]. 食品科学, 2011, 32(2): 104-107.
[4] 江岩, 郑力. 药桑椹花青素的体外抗氧化作用[J]. 食品科学, 2011,32(13): 45-48.
[5] 吴石磊, 徐立, 王茜龄, 等. 桑树中抗氧化物质的研究进展[J]. 蚕学通讯, 2009, 28(2): 22-26.
[6] 蒋昊, 徐立, 刘峻池, 等. 药桑的生物活性成分及药理作用研究进展[J].蚕业科学, 2011, 37(1): 98-104.
[7] 杨玲, 苏亚丽, 陈敏. 新疆药桑椹中花色苷的分离与鉴定[J]. 食品科学, 2012, 33(21): 145-148.
[8] 路国兵, 任春久, 崔为正, 等. 桑叶多糖MLPⅡ的基本结构及对糖尿病模型大鼠的降血糖作用[J]. 蚕业科学, 2012, 37(6): 1053-1060.
[9] 裴凌鹏, 庞宗然. 维药黑药桑黄酮对糖尿病大鼠骨质影响研究[J].新疆中医药, 2009(4): 37-40.
[10] 刘永民, 刘伟新, 邹晔. 维吾尔药志(下)[M]. 乌鲁木齐: 新疆科技卫生出版社, 1999: 478-485.
[11] BLEIBEL W, KIM S, D'SILVA K, et al. Drug-induced liver injury:review article[J]. Digestive Diseases and Sciences, 2007, 52(10):2463-2471.
[12] 许建明. 急性药物性肝损伤[J]. 解放军保健医学杂志, 2007, 9(3):135-139.
[13] 周斌, 陶明煊, 程光宇, 等. 姬菇多糖对酒精所致小鼠急性肝损伤的保护作用[J]. 食品科学, 2012, 33(23): 323-326.
[14] 汤超, 汤文凡, 黄玉琴, 等. 木瓜发酵液对小鼠四氯化碳诱发肝损伤的防护作用[J]. 食品科学, 2013, 34(13): 271-274. doi: 10.7506/ spkx1002-6630-201313057.
[15] JOSEPHINE A, NITHYA K, AMUDHA G, et al. Role of sulphated polysaccharides from Sargassum wightii in cyclosporine A-induced oxidative liver injury in rats[J]. BMC Pharmacology, 2008, 8(1): 4. doi: 10.1186/1471-2210-8-4.
[16] 陈平, 陈新, 王珲, 等. 硫酸-蒽酮法测定鄂产竹节参多糖含量[J]. 中国医院药学杂志, 2008, 27(12): 1654-1656.
[17] WEBER L W D, BOLL M, STAMPFL A. Hepatotoxicity and mechanism of action of haloalkanes: carbon tetrachloride as a toxicological model[J]. CRC Critical Reviews in Toxicology, 2003,33(2): 105-136.
[18] LUCKEY S W, PETERSEN D R. Activation of Kupffer cells during the course of carbon tetrachloride-induced liver injury and fibrosis in rats[J]. Experimental and Molecular Pathology, 2001, 71(3): 226-240.
[19] BISHAYEE A, SARKAR A, CHATTERJEE M. Hepatoprotective activity of carrot (Daucus carota L.) against carbon tetrachloride intoxication in mouse liver[J]. Journal of Ethnopharmacology, 1995,47(2): 69-74.
[20] JAYAKUMAR T, RAMESH E, GERALDINE P. Antioxidant activity of the oyster mushroom, Pleurotus ostreatus, on CCl 4-induced liver injury in rats[J]. Food and Chemical Toxicology, 2006, 44(12): 1989-1996.
[21] OZERCAN I H, DAGLI A F, USTUNDAG B, et al. Does instant coffee prevent acute liver injury induced by carbon tetrachloride(CCl 4)?[J]. Hepatology Research, 2006, 35(3): 163-168.
[22] LIEBER C S. Role of oxidative stress and antioxidant therapy in alcoholic and nonalcoholic liver diseases[J]. Advances in Pharmacology, 1996, 38: 601-628.
[23] JAESCHKE H. Reactive oxygen and mechanisms of inflammatory liver injury[J]. Journal of Gastroenterology and Hepatology, 2000,15(7): 718-724.
[24] JANERO D R. Malondialdehyde and thiobarbituric acid-reactivity as diagnostic indices of lipid peroxidation and peroxidative tissue injury[J]. Free Radical Biology and Medicine, 1990, 9(6): 515-540.
[25] MUTO Y, MEAGER A, NOURI-ARIA K T, et al. Enhanced tumour necrosis factor and interleukin-1 in fulminant hepatic failure[J]. The Lancet, 1988, 332: 72-74.
[26] NAKAZATO H, OKU H, YAMANE S, et al. A novel antifibrotic agent pirfenidone suppresses tumor necrosis factor-α at the translational level[J]. European Journal of Pharmacology, 2002,446(1): 177-185.
[27] SHIM J Y, KIM M H, KIM H D, et al. Protective action of the immunomodulator ginsan against carbon tetrachloride-induced liver injury via control of oxidative stress and the inflammatory response[J]. Toxicology and Applied Pharmacology, 2010, 242(3): 318-325.
[28] CHOU W, LU C, LEE T, et al. Electroporative interleukin-10 gene transfer ameliorates carbon tetrachloride-induced murine liver fibrosis by MMP and TIMP modulation[J]. Acta Pharmacologica Sinica, 2006,27(4): 469-476.
Protective Effect of Polysaccharides from Morus nigra Linn. Fruits on CCl 4-Induced Liver Damage in Rats
XIA Na, CHEN Yilei, TAO Haiyan, Muhetaer·TUERHONG*
(Key Laboratory of Ecology and Biological Resources in Yarkand Oasis at Colleges and Universities under the Department of Education of Xinjiang Uygur Autonomous Region, College of Chemistry and Environmental Science, Kashgar University, Kashgar 844000, China)
Abstract:Objective: To study the hepatoprotective effect of polysaccharides from Morus nigra Linn. fruits (MNP) on CCl 4-induced liver damage in rats. Methods: Totally 40 healthy SD rats were randomized into 5 groups with 8 animals in each group: normal group, CCl 4-injury group, and three different treatment groups with different doses of MNP (50, 100,200 mg/(kg·d)). After 7 days of intragastric administration, all rats except for the normal group were subjected to intraperitoneal injection of CCl 4. After 24 hours, rat serum was collected for analyzing the activity of alanine aminotransferase (ALT) and aspartate aminotransferase (AST), and the content of bilirubin. Liver tissues were harvested for measuring the activities of superoxide dismutase (SOD), catalase (CAT) and glutathion peroxidase (GSH-Px), and the contents of malondialdehyde (MDA), interferon-γ (IFN-γ), tumor necrosis factor-α (TNF-α) and interleukin-10 (IL-10). Results: Compared with the CCl 4-injury group, the treatment groups with 100 and 200 mg/(kg·d) of MNP revealed a significant decrease in body weight (P < 0.05), liver index (P < 0.05), kidney index (P < 0.05) and spleen index (P < 0.01);serum ALT and AST activities (P < 0.05) and bilirubin content (P < 0.05); and the contents of MDA, IFN-γ and TNF-α(P < 0.05) in liver, while the activities of liver SOD, CAT, and GSH-Px and IL-10 contentwere significantly increased (P < 0.05). The administration with 50 mg/(kg·d) of MNP could result in a significant decrease in liver, kidney and spleen indexes (P < 0.05),GSH-Px activity (P < 0.05), IL-10 content (P < 0.05) in liver, and TNF-α content (P < 0.05) in liver. Conclusion: Polysaccharides from Morus nigra Linn. fruits can attenuate CCl 4-injduced liver injury in rats, and the underlying mechanism may be due to its antioxidant and anti-inflammatory effects.
Key words:Morus nigra Linn. polysaccharide; hepatoprotective effect; antioxidant activity; carbon tetrachloride
中图分类号:TS218
文献标志码:A
文章编号:1002-6630(2015)13-0247-05
doi:10.7506/spkx1002-6630-201513046
收稿日期:2014-08-11
基金项目:新疆维吾尔自治区高校科研计划青年教师科研培育基金项目(XJEDU2014S054)
作者简介:夏娜(1985—),女,讲师,硕士,主要从事食品加工原理与技术研究。E-mail:conniexn@126.com
*通信作者:木合塔尔·吐尔洪(1961—),男,教授,本科,主要从事分析化学、仪器分析研究。E-mail:2673134206@qq.com