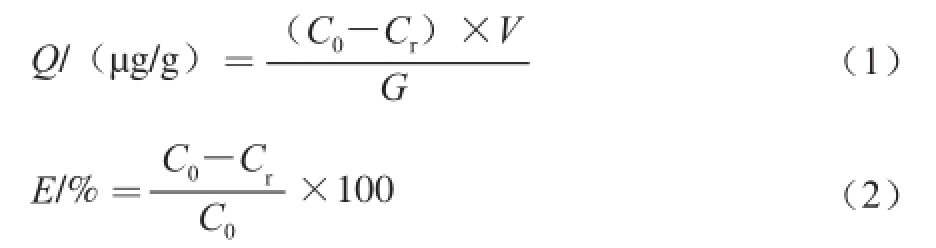
庞 立,邓子牛,刘吉凯,王仁才 *
(湖南农业大学园艺园林学院,湖南 长沙 410128)
摘 要:以柑橘柠檬苦素为考察指标,研究大孔树脂分离纯化柠檬苦素的工艺条件。结果表明,D101大孔树脂对柑橘柠檬苦素有较好的吸附分离性能,是分离纯化柑橘柠檬苦素的适宜大孔树脂;D101大孔树脂分离纯化柑橘柠檬苦素的最佳工艺条件为:上样流速1 mL/min、上样质量浓度0.5 mg/mL、用 pH 6、80%的乙醇溶液作洗脱剂、洗脱流速2 mL/min。通过树脂回收重复使用,发现D101树脂通过再生处理后,其吸附性能未有明显降低,可以重复使用。采用上述方法得到D101大孔树脂对柠檬苦素的吸附率为88.53%,解吸率为93.47%,得率为82.75%。高效液相色谱检测可知,柠檬苦素的含量达到了92.79%。
关键词:柑橘;柠檬苦素;大孔树脂;分离;纯化
中国是世界柑橘的主起源地之一,也是世界柑橘生产大国。我国柑橘种植面积及总产量均居世界首位,栽培面积占全球的30%左右,产量占全球的26%左右。然而,我国柑橘产量虽然巨大,但柑橘加工利用程度却远远不够,许多柑橘资源还未能得到充分地开发利用,其中就包括柑橘柠檬苦素。经研究表明,柠檬苦素在抗病毒、抗炎、镇痛、改善睡眠、抗菌、抗焦虑,调节体内胆固醇含量、防止动脉粥样硬化等方面都具有显著效果 [1-5]。另外,柑橘中的三萜类物质在抗肿瘤方面有很好的成效,柠檬苦素及其类似物就是其中一类重要组分 [6-8]。目前许多柑橘落果已经作为国内很多药厂的制药原材料 [9],而梓檬苦素作为柑橘主要活性功能成分之一 [10],研究柑橘柠檬苦素的提取、分离纯化及其检测,对以柑橘为原料的梓檬苦素产品开发利用具有积极作用。
大孔吸附树脂是近代发展起来的一类有机高聚物吸附剂,具有多孔性与较大的比表面积,主要是通过其物理作用从溶液当中有选择性地吸附有机物,从而达到分离纯化的目的 [11-12]。而用吸附树脂提取三萜类化合物,制所得产品纯度高、质量稳定、成本低 [13-14]。另外,大孔树脂法具有吸附容量大、吸附速度快、选择性好、再生简便等优点,因而被广泛用于天然产物的分离纯化 [15-16]。本研究旨在根据柑橘柠檬苦素的结构特性,通过优化大孔树脂分离纯化柑橘柠檬苦素的工艺,探讨高含量柠檬苦素的制备方法,为柑橘柠檬苦素的规模生产及综合利用提供理论依据。
1.1 材料与试剂
柑橘果实(湖南)烘干至恒质量,打粉。
HPD450、HPD600、AB-8、D101、DM130、聚酰胺30-60、聚酰胺60-100大孔吸附树脂 河北沧州宝恩吸附材料科技有限公司;梓檬苦素标准品(色谱纯,≥8%)成都曼斯特生物科技有限公司;无水乙醇、二氯甲烷(均为分析纯)、乙腈(色谱纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
LC-20AT高效液相色谱仪 日本Shimadzu公司;DR-1001旋转蒸发仪 郑州长城科工贸有限公司;DHG-9246A电热恒温干燥箱 上海精宏实验设备有限公司。
1.3 方法
1.3.1 柠檬苦素粗提液的制备
准确称取已烘干的柑橘果实粉末10 g,用85%的乙醇溶液300 mL于55 ℃条件下超声提取25 min [17-18]。提取后抽滤,滤液在45 ℃旋转蒸发至无醇味,以足量的二氯甲烷分3 次萃取,保留并合并二氯甲烷相,旋转蒸发(45 ℃)至干,用过量的75%乙醇溶解,经浓缩至无醇味后用蒸馏水定容到100 mL。
1.3.2 柠檬苦素高效液相色谱(high performance liquid chromatography,HPLC)测定
以柠檬苦素标准品为标准样,色谱条件为:液相用色谱柱为WeLchrom C 18(4.6 mm×250 mm,5 μm);流动相釆用V 乙腈∶V 水=45∶55等度洗脱;流速1.0 mL/min;柱温30 ℃;检测波长210 nm;进样量10 μL。
1.3.3 大孔树脂筛选
1.3.3.1 吸附量和吸附率测定
将树脂用95%乙醇溶液洗至无色后,用蒸馏水洗至无醇味。然后用5% HCl溶液洗至无色,用水洗至中性,再用5% NaOH溶液洗至无色,用水洗至中性。称取HPD450、HPD600、AB-8、D101、DM130、聚酰胺30-60、聚酰胺60-100大孔吸附树脂各1 g,分别置于7 个100 mL的锥形瓶中;取柠檬苦素粗提液50 mL,定容至250 mL,摇匀后各取50 mL加入7个锥形瓶中,于恒温振荡器内在30 ℃,40 r/min条件下振荡2 h,取出后冷却至室温,分别过滤10 mL,采用HPLC法测过滤后流出液中柠檬苦素质量浓度,得到静态吸附柠檬苦素的吸附量(μg/g)和吸附率(E/%) [19]。
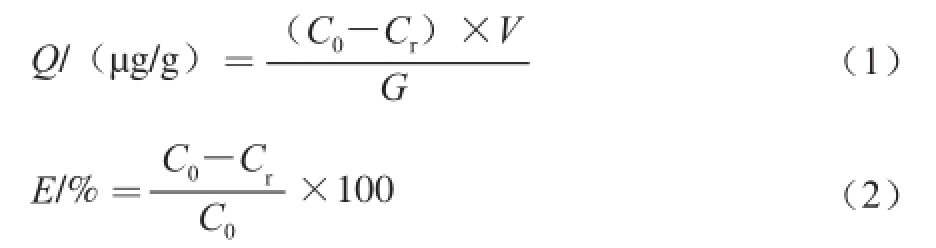
式(1)、(2)中:Q为树脂对柠檬苦素的饱和吸附量/(μg/g);C 0为吸附前柠檬苦素溶液的起始质量浓度/(μg/mL);C r为吸附后过滤液的剩余质量浓度/(μg/mL);V为柠檬苦素溶液体积/mL;G为树脂质量/g。
1.3.3.2 解吸率测定
对上述处理后的树脂用蒸馏水洗至流出液无色,滤纸吸干后将其置于锥形瓶中,各加入80%乙醇溶液200 mL,在30 ℃、40 r/min条件下振荡3 h,取出后冷却至室温,分别过滤各洗脱液10 mL,HPLC法测剩余液体中柠檬苦素质量浓度,得到静态吸附柠檬苦素解吸率 [19]。
式中:C为解吸后洗脱液中柠檬苦素质量浓度/(μg/mL);W为树脂对柠檬苦素的饱和吸附量/(μg/g);V为洗脱液的体积/mL。
1.3.4 大孔树脂柱分离纯化柑橘柠檬苦素方法的确定
1.3.4.1 最佳吸附和解吸pH值的确定
按照1.3.3节静态吸附与解吸实验方法,用pH值分别为4.0、5.0、6.0、7.0、8.0的柑橘柠檬苦素粗提液进行静态吸附实验,洗脱液为80%乙醇溶液;柑橘柠檬苦素粗提液进行吸附后,分别用pH 3.0、4.0、5.0、6.0、7.0的80%乙醇溶液进行解吸。HPLC法测剩余液体中柠檬苦素质量浓度,确定最佳柑橘柠檬苦素粗提液的pH值及解吸液pH值。
1.3.4.2 上样质量浓度的确定
将已经预处理好的树脂10 g用湿法装柱,将柑橘柠檬苦素提取液配成质量浓度为0.6、0.5、0.4、0.3、0.2 mg/mL,并全部调至中性,以10 mL上柱,用蒸馏水以1 mL/min流速冲洗。然后用80%的乙醇溶液(pH 6)进行以2 mL/min的流速洗脱,收集乙醇洗脱液,并浓缩定容至100 mL。通过考察洗脱液中柠檬苦素含量,确定其最佳上样质量浓度。
1.3.4.3 上样流速的确定
将已经预处理好的树脂10 g用湿法装柱,将柑橘柠檬苦素提取液配成质量浓度0.5 mg/mL,pH值为 7,上样10 mL,用蒸馏水以2 mL/min流速冲洗。然后用80%的乙醇溶液(pH 6)以0.5、0.75、1、2、3 mL/min的流速洗脱,分别收集乙醇洗脱液,并浓缩定容至100 mL。通过考察洗脱液中柠檬苦素含量,确定其最佳上样液流速。
1.3.4.4 解吸醇体积分数的确定
将已经预处理好的树脂10 g用湿法装柱,将柑橘柠檬苦素提取液配成质量浓度为0.5 mg/mL,pH值为7,上样10 mL,用蒸馏水以1 mL/min流速冲洗。然后分别用pH 6.0的50%、60%、70%、80%、95%的乙醇溶液以2 mL/min的流速洗脱,收集乙醇洗脱液,并浓缩定容至100 mL。通过考察洗脱液中柠檬苦素含量,确定其最佳洗脱液pH值。
1.3.4.5 解吸流速的确定
将已经预处理好的树脂10 g用湿法装柱,将柑橘柠檬苦素提取液配成质量浓度为0.5 mg/mL,pH值为7,上样10 mL,用蒸馏水以1 mL/min流速冲洗。然后分别用80%的乙醇溶液(pH 6)以1、2、3、4 mL/min速率洗脱,收集乙醇洗脱液,并浓缩定容至100 mL。通过考察洗脱液中柠檬苦素含量,确定其最佳解吸流速。
1.4 统计学方法
所有数据都是3 次独立重复实验的结果,采用SPSS 18.0软件进行方差分析。
2.1 柠檬苦素HPLC测定
柠檬苦素的检测方法有多种,包括分光光度法 [20]、薄层色谱法 [21]、HPLC法 [22-23]等。在前期研究中,本课题组通过实验探索与考察,确定了本实验柠檬苦素含量的HPLC分析检测方法,并以此对湖南省多个不同柑橘品种果实中柠檬苦素的含量进行了定量分析 [24]。此方法加标回收率为92.84%~99.71%,相对标准偏差为0.55%~1.19%,精密度、重现性良好,其最低检测质量浓度为0.25 ng/mL。此方法方便快捷,分离效果较好,适用于柑橘柠檬苦素的检测分析。
2.2 树脂筛选
表1 不同树脂对类柠檬苦素吸附和解吸效果
Table1 Comparison of adsorption and desorption efficiencies of different macroporous resins for citrus limonin
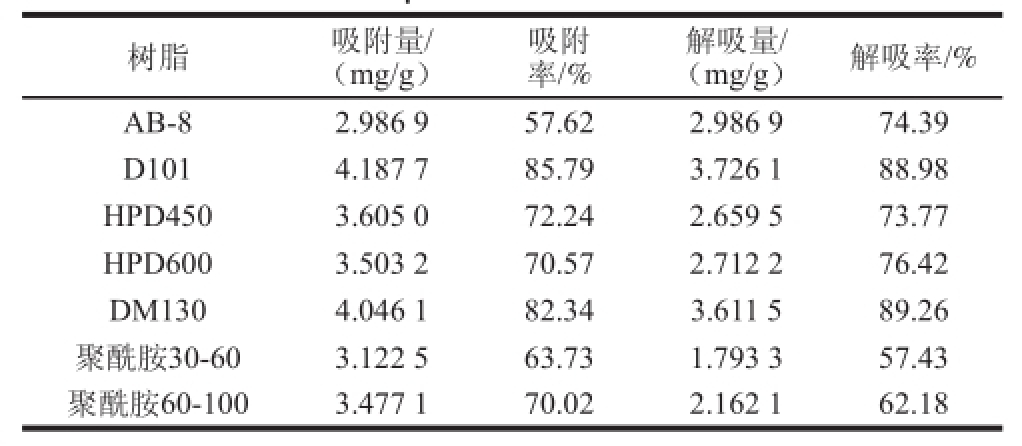
率/%解吸量/(mg/g)解吸率/% AB-82.986 957.622.986 974.39 D1014.187 785.793.726 188.98 HPD4503.605 072.242.659 573.77 HPD6003.503 270.572.712 276.42 DM1304.046 182.343.611 589.26聚酰胺30-603.122 563.731.793 357.43聚酰胺60-1003.477 170.022.162 162.18树脂吸附量/(mg/g)吸附
大孔树脂由于其理化性质不同对吸附分离的影响很大,而不同物质在树脂中的吸附和解吸效果也会有较大差别 [25]。综合评价所选的7 种大孔树脂(表1)可知,D101树脂对样品提取液中类柠檬苦素的吸附效果较好,解吸率为88.98%,而吸附率有85.79%。而DM130树脂虽然解吸率最高,但是其吸附效果并不理想。由于D101树脂对柠檬苦素粗提液中的柠檬苦素的吸附率和解吸率较高,故确定D101树脂为分离纯化柚皮黄酮的最佳树脂。
2.3 分离纯化柑橘柠檬苦素方法的确定
2.3.1 pH值对柑橘柠檬苦素吸附和解吸的影响
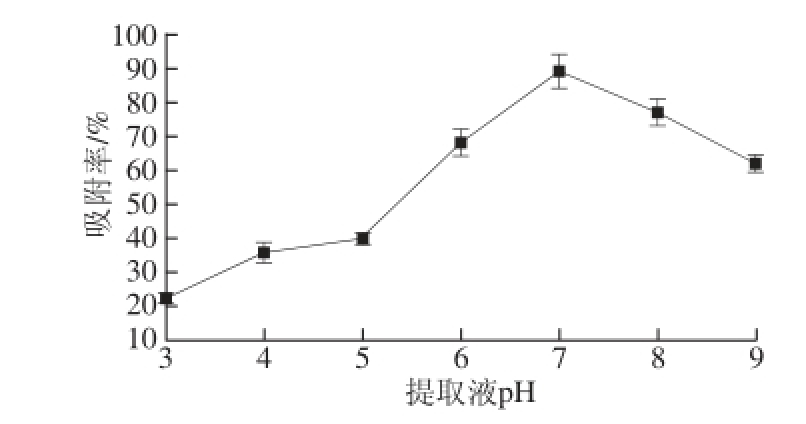
图1 提取液pH值对D101树脂吸附率的影响
Fig.1 Influence of sample pH on the adsorption capacity of D101
提取液pH值对D101树脂吸附率有较大影响,且较酸性或较碱性条件下柠檬苦素的吸附率都不高,而接近中性时,树脂吸附率达到最大(图1)。随着pH值的升高,D101树脂的吸附率呈先增后减的趋势,当pH 7时,吸附率则达到了80%以上,说明提取液处于pH值中性条件下,吸附效果最佳。因此确定其最佳的上样提取液pH 7。
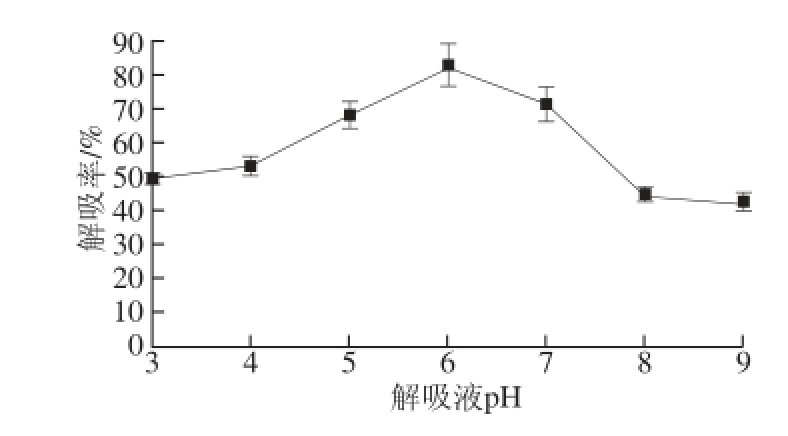
图2 解吸液pH值对D101树脂解吸率的影响
Fig.2 Influence of desorbent pH on the desorption capacity of D101
提取液pH值对树脂吸附率存在影响,解吸液pH值对已吸附树脂的洗脱同样存在较大影响(图2)。随着pH值的升高,虽然整体趋势也是先增后减,但当洗脱液pH 6时,其树脂解吸率最大。因此选择解吸液pH 6作为最佳解吸pH值。
2.3.2 上样质量浓度对D101大孔树脂吸附的影响
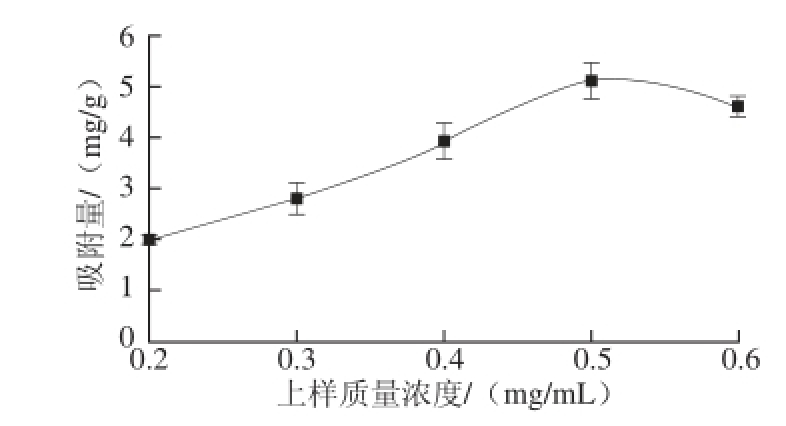
图3 上样质量浓度对树脂吸附量的影响
Fig.3 Influence of sample concentration on the adsorption capacity of D101
如图3所示,随着上样质量浓度的增加,其D101树脂吸附量随之增加,说明D101大孔树脂吸附承载能力较高。当上样质量浓度达到0.5 mg/mL时,其吸附量达到最大值,而之后质量浓度增加其吸附量反而减小,说明其上样质量浓度已经超过了树脂承载范围,上样液处理量减少。因此,当上样质量浓度为0.5 mg/mL时,其树脂吸附能力发挥最大作用,此时为最佳上样质量浓度。
2.3.3 上样流速对D101大孔树脂吸附影响
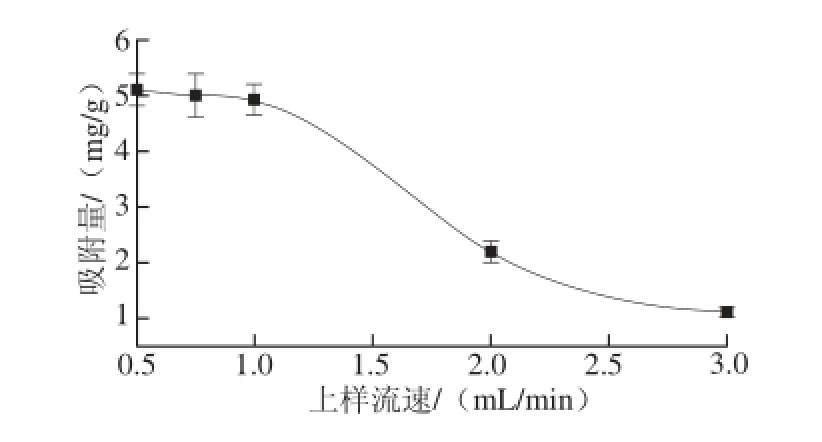
图4 上样流速对树脂吸附量的影响
Fig.4 Influence of sample loading flow rate on the adsorption capacity of D101
如图4所示,随着上样流速的增加,其D101树脂吸附量越来越小。上样流速在0.5~1 mL/min期间,其树脂吸附量下降并不明显,之后其吸附量下降幅度较大。为了缩短实验周期,故选择上样流速为1 mL/min为最佳上样流速。
2.3.4 洗脱醇体积分数对洗脱效果影响

图5 洗脱醇体积分数对解吸率的影响
Fig.5 Influence of alcohol concentration on the desorption rate of D101
如图5所示,随着洗脱醇体积分数的增加,其解吸率随之增高。在洗脱醇体积分数为80%的时候,解吸率达到了86.3%,随后其解吸率下降。说明较低和过高体积分数的乙醇溶液洗脱效果不佳。因此,选用80%乙醇溶液作为最佳洗脱液。
2.3.5 洗脱流速对洗脱效果的影响

图6 洗脱流速对解吸率的影响
Fig.6 Influence of elution flow rate on the desorption rate of D101
如图6所示,随着洗脱流速的增加,其解吸效果下降,这说明在洗脱流速低的情况下,吸附树脂作用越好,并且洗脱更完全。当洗脱流速为1 mL/min时,其解吸率为84.1%,而在洗脱流速等于2 mL/min时,其解吸率仍然有75.6%,而随着洗脱流速的增加,其解吸率都低于50%。同时,考虑实验周期、时间等因素,综合提高柠檬苦素大孔树脂纯化效率,因此选用2 mL/min的流速作为最佳洗脱流速。
2.4 柠檬苦素纯化结果
根据以上因素的考察结果,在本实验中,将已经预处理好的D101树脂10 g,采用湿法装柱,pH 7上样质量浓度为0.5 mg/mL,以1 mL/min的流速上样10 mL,再用pH 6的80%乙醇溶液在2 mL/min的解吸流速条件下洗脱,进行实验,收集80%乙醇洗脱液,并在55 ℃条件下旋转蒸发至干,用色谱纯乙腈定容至10 mL。其粗提取液通过大孔树脂采用上述方法得到D101树脂的吸附率为88.53%,解吸率为93.47%,经过纯化后柠檬苦素含量达到了92.79%,其纯度为2.56%。
本研究通过对7 种树脂进行柠檬苦素大孔树脂静态吸附与解吸实验,发现D101和DM130大孔树脂有较好的静态吸附和解吸效率,通过综合考察吸附与解吸率,实验选择了D101大孔树脂进行柠檬苦素的分离纯化。确定D101大孔吸附树脂的最佳纯化条件为:吸附时提取液pH 7、解吸时解吸液pH 6、上样流速1 mL/min、上样质量浓度0.5 mg/mL、洗脱流速2 mL/min、洗脱液为体积分数为80%乙醇溶液、用量240 mL。通过树脂回收重复使用,发现D101树脂通过再生处理后,其吸附性能未有明显降低,可以重复使用。采用上述方法得到D101树脂对柠檬苦素的吸附率为88.53%,解吸率为93.47%,得率为82.75%,HPLC检测可知,柠檬苦素的含量达到了92.79%。
参考文献:
[1] PARK E S, BAE I K, JEON H J, et al. Limonoid derivatives and its pesticidal activities[J]. Entomological Research, 2014, 44(4): 158-162.
[2] 孟鹏, 郑宝东. 超高效液相色谱法快速并同时检测金柑中柠檬苦素和诺米林[J]. 中国食品学报, 2013, 13(2): 177-181.
[3] KARIM M, HASHINAGA F. Preparation and properties of immobilized pummelo limonoid glucosyltransferase[J]. Process Biochemistry, 2002, 38(5): 809-814.
[4] 陈静, 高彦祥, 吴伟莉, 等. 高效液相色谱法测定柑橘汁中的柠檬苦素和柚皮苷[J]. 色谱, 2006, 24(2): 157-160.
[5] BIAO L, RUI S, ZHI X, et al. Extraction and insecticidal activities of limonin in peel of citrus maxima[J]. Chinese Agricultural Science Bulletin, 2012, 28(1): 284-288.
[6] CHIDAMBARA-MURTHY K N, JAYPRAKASHA G, KUMAR V, et al. Citrus limonin and its glucoside inhibit colon adenocarcinoma cellproliferation through apoptosis[J]. Journal of Agricultural and Food Chemistry, 2011, 59(6): 2314-2323.
[7] 方修贵, 戚行江, 胡安生. 柑橘果实中抗癌活性物质的研究现状和前景[J]. 食品与发酵工业, 2004, 29(10): 79-82.
[8] PATIL J R, JAYAPRAKASHA G, MURTHY K, et al. Characterization of Citrus aurantifolia bioactive compounds and their inhibition of human pancreatic cancer cells through apoptosis[J]. Microchemical Journal, 2010, 94(2): 108-117.
[9] 吴桂苹, 苏学素, 焦必宁, 等. 柑橘活性成分检测技术研究进展[J].食品与发酵工业, 2006, 32(9): 116-121.
[10] 王贱荣, 董美玲, 郭跃伟. 芸香科柠檬苦素类化合物及其生物活性研究进展[J]. 国际药学研究杂志, 2009, 36(5): 321-331.
[11] 李善吉, 伍胜君. 大孔树脂的应用研究概况[J]. 广东轻工职业技术学院学报, 2006, 4(2): 11-13.
[12] LIN Lianzhu, ZHAO Haifeng, DONG Yi, et al. Macroporous resin purifi cation behavior of phenolics and r osmarinic acid from Rabdosia serra HARA leaf[J]. Food Chemistry, 2012, 130(2): 417-424.
[13] 张旭, 王锦玉, 仝燕, 等. 大孔树脂技术在中药提取纯化中的应用及展望[J]. 中国实验方剂学 杂志, 2012, 18(6): 286-290.
[14] KRANZ P, ADLER P, KUNZ B. Investigation of citrus flavor adsorption during debit tering of grapefruit juice using kinetic modeling and response surface methodology[J]. Food Science and Biotechnology, 2011, 20(3): 715-724.
[15] 李春美, 钟朝 辉, 窦宏亮, 等. 大孔树脂分离纯化柚皮黄酮的研究[J].农业工程学报, 2006, 22(3): 153-157.
[16] 周林, 蔡妙颜, 郭祀远, 等. 大孔吸附树脂应用的研究进展[J]. 昆明理工大学 学报: 理工版, 2003, 28(6): 99-102.
[17] 施英, 徐玉娟, 陈卫东, 等. 桔核中柠檬苦素类物质最佳提取条件的探讨及清除DPPH活性的研究[J]. 食品与机械, 2007, 22(6): 74-76.
[18] 张朝晖, 朱中品, 李辉. 柑橘中柠檬苦素超声提取工艺及含量分析[J].食品科学, 2009, 30( 8): 56-59.
[19] HUANG Zhuanhua, LIU Shouxin, ZHANG Bin, et al. Equilibrium and kinetics studies on the absorption of Cu(Ⅱ) from the aqueous pHase using a β-cyclodextrin-based adsorbent[J]. Carbohydrate Polymers,2012, 88(2): 609- 617.
[20] 潘碧妍. 高速逆流色谱法分离制备吴茱萸中的柠檬苦素、吴茱萸碱和吴茱萸次碱[J]. 世界科学技术: 中医药现代化, 2011, 13(2):310-314.
[21] 汤冬梅. 香抽中类柠檬 苦素和柚皮苷提取纯化及二氢查尔酮合成[D].长沙: 中南大学, 2011.
[22] 赵雪梅, 叶兴乾, 席屿芳, 等. 胡柚皮有效成分的分离鉴定及其药理活性[J]. 果树学报, 2006, 23(3): 458-461.
[23] 汤冬梅, 朱春风, 周明达. 柚核中柠檬苦素纯化工艺的研究[J]. 农产品加工: 学刊, 2010(10): 47-50.
[24] 刘吉凯, 王仁才, 邓子牛. 湖南不同柑橘品种果实柠檬苦素含量分析[J]. 湖 南农业科学, 2013(5): 111-113.
[25] KERKEZ Ö, BAYAZIT S, USLU H. A comparative study foradsorption of methyle ne blue from aqueous solutions by twokinds of amberlite resin materials[J]. Desalin Water Treat, 2012, 45: 206-214.
Separation and Purification of Citrus Limonin by Macroporous Resin
PANG Li, DENG Ziniu, LIU Jikai, WANG Rencai*
(College of Gardening and Horticulture, Hunan Agricultural University, Changsha 410128, China)
Abstract:A method for the purifi cation of limonin from citrus by macroporous resin was proposed. The results showed that D101 resin was the best adsorbent for the purifi cation of citrus limonin. The optimal purifi cation conditions were achieved by loading the sample containing 0.5 mg/mL limonin onto the column at a fl ow rate of 1 mL/min and subsequently eluting the adsorbed limonin with 80% alcohol at pH 6 at a fl ow rate of 2 mL/min. The adsorption capacity of D101 resin remained almost unchanged after several cycles of repeated use and regeneration. Under the optimized conditions, the adsorption rate,desorption rate and yield of limonin were 88.53%, 93.47% and 82.75%, respectively. The result of HPLC showed that the limonin content (i.e., purity) of the purifi ed product was 92.79%.
Key words:citrus; limonin; D101 macroporous resin; separation; purifi cation
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2015)14-0024-05
doi:10.7506/spkx1002-6630-201514005
收稿日期:2014-12-01
基金项目:教育部创新团队项目(IRT0963);湖南农业大学校青年基金项目(13QN18)
作者简介:庞立(1980—),女,实验师,博士研究生,研究方向为果树学。E-mail:julinomber2@sina.com
*通信作者:王仁才(1962—),男,教授,博士,研究方向为果树学。E-mail:wangrenc@163.com