表1 梯度洗脱程序
Table1 Gradient elution program

时间/min流动相A体积分数/%流动相B体积分数/% 0 5 95 3224.275.8 3724.275.8 42595
贡雯玉 1,2,卞 欢 1,吴海虹 1,王道营 1,耿志明 1,刘 芳 1,张牧焓 1,徐为民 1,诸永志 1,*
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.南京农业大学 教育部肉品加工与质量控制重点实验室,江苏 南京 210095)
摘 要:为提高水产品胶原蛋白的利用率,采用柱前衍生-高效液相色谱法对鲫鱼鱼皮、鱼肉、鱼鳞、鱼鳔组织中的羟脯氨酸含量进行检测,再将羟脯氨酸含量换算成相应胶原蛋白的含量。鲫鱼样品经盐酸110 ℃水解18 h,丹磺酰氯衍生,采用高效液相色谱-紫外法进行检测。色谱柱:反相C 18柱(250 mm×4.6 mm,5 μm);流动相:A为甲醇,B为四氢呋喃-甲醇-0.05 mol/L乙酸钠(1∶15∶84,V/V)溶液,采用梯度洗脱;流速1 mL/min;柱温40 ℃;检测波长 254 nm。结果表明:羟脯氨酸在20~400 μg/mL范围内呈现良好的关系(R 2=0.999 8),最低检测限为0.18 μg/g,不同水平的平均回收率为80.22%~83.33%,相对标准偏差范围为0.31%~1.84%。实际样品分析显示,鱼皮、鱼肉、鱼鳞、鱼鳔组织中胶原蛋白含量分别为106.62、24.75、166.94、115.05 mg/g。本实验建立的分析方法简便快捷、具有较好的灵敏度和可靠性,可用于水产品不同组织中胶原蛋白的定量分析。
关键词:鲫鱼;羟脯氨酸;胶原蛋白;高效液相色谱法
随着生活节奏的加快,用传统方法熬制汤煲过于耗时,因此健康快捷的汤煲类产品将会有很大的市场空间。目前,汤煲类产品主要为冲调型汤煲和真空包装型汤煲 [1];冲调型汤煲营养欠缺,真空包装型汤煲食材易烂且有蒸煮味,因此当务之急是开发新型汤煲类产品。鲫鱼(Carassius auratus)是我国国民消费的大众品种,在淡水鱼中营养最为丰富;其肉质细嫩,比畜、禽肉更容易消化和吸收,产妇食用鲫鱼汤能有效催乳,对母体恢复也有很好的补益作用,鲫鱼浓汤也是家庭中最为普遍的食用方法。鲫鱼含有全面且优质的蛋白质,其 中胶原蛋白占鲫鱼总蛋白质含量的25%~30% [2],相当于体质量的6%,是含量最丰富、分布最广泛的蛋白质。胶原蛋白主要存在于鲫鱼的皮、骨、软骨、鳞中,是结缔组织重要的结构蛋白质,起着支撑器官、保护机体的作用 [3]。胶原蛋白的浓度越大,其分子间的交联度就越大,形成的凝胶结构就越致密,凝胶强度也越大,所以本实验研究鲫鱼不同组织胶原蛋白含量,以胶原蛋白含量多的组织作为原料处理后(如鱼鳞胶)加入鲫鱼汤,制作天然营养的固体凝胶型鲫鱼汤,以此填补产品空白。目前,国内外关于水产中胶原的报道集中在深海鱼(黄鳍金枪鱼、小须鲸、河豚、尖吻鲈、鳕鱼等) [4-6]、淡水鱼皮、鱼鳞(鲤鱼、罗非鱼、草鱼等) [7-10]的胶原提取工艺,以及水产品如海参的羟脯氨酸含量研究上,而对淡水鱼中各部分组织胶原的定量分析报道很少。
胶原蛋白中含有2 种特有的氨基酸——脯氨酸和羟脯氨酸,它们的含量很高,约占25% [11-12]。羟脯氨酸是胶原蛋白的特异性氨基酸,在胶原蛋白的生物合成过程中,没有游离的羟脯氨酸参与合成,所有的羟脯氨酸均由已合成的肽链中的脯氨酸经羟化酶作用转化而来。胶原蛋白中的羟脯氨酸含量稳定,通过测定羟脯氨酸的含量即可获得胶原蛋白含量 [13-14]。传统测定羟脯氨酸的方法是比色法 [15-16],样品需要量大,操作步骤繁琐,影响因素多,且特异性、灵敏性差;氨基酸自动分析法是一种快速、准确灵敏度高的测定方法 [17-21],适用于多种氨基酸同时分析,对于单一氨基酸的分析而言其费用高,普通实验室难以实现;高效液相色谱仪具有优良的灵敏度和精密度,近年来广泛用于氨基酸、尤其是单一氨基酸的分析测定。本实验以丹磺酰氯(dansyl chloride,Dns-Cl)作为液相色谱柱前衍生试剂,通过样品水解、衍生条件的确立、以及高效液相色谱分离、检测条件的优化,建立鲫鱼鱼皮、鱼肉、鱼鳞、鱼鳔组织中羟脯氨酸的定量检测方法。
1.1 材料与试剂
鲫鱼 市购;新鲜鲫鱼经宰杀之后,去内脏,清洗鱼腹内的黑膜。分别取不同部位样品组织,切碎待用。
L-羟基脯氨酸标准品(L-Hyp,纯度99%) 美国Aladdin公司;甲醇、四氢呋喃(均为色谱纯) 美国Tedia公司;衍生试剂:Dns-Cl(纯度>98%) 日本TCI公司;称取0.04 g Dns-Cl,用丙酮溶解,并定容至10 mL,4 ℃避光保存,有效期3 d;其余试剂均为分析纯。
1.2 仪器与设备
e2695高效液相色谱(配有二极管阵列检测器、XBridge C 18色谱柱) 美国Milford公司;HS2060A超声波振荡器 常州国华电器有限公司;烘箱 上海索谱仪器有限公司;纯水仪 美国Millipore公司。
1.3 方法
1.3.1 标准溶液配制
称取适量羟脯氨酸标准品,用超纯水溶解,配制1.00 g/L标准贮备液,于4 ℃保存,临用时用超纯水稀释配制质量浓度为20~400 μg/mL系列标准工作溶液。
1.3.2 样品处理
称取2 g(准确至0.001 g)绞碎后的样品于10 mL水解管中,加入6 mol/L盐酸溶液6 mL,充氮气1 min,抽真空至管内盐酸起泡,用火焰封口,于110 ℃烘箱中水解18 h。冷却后,将水解液全部转移到50 mL容量瓶中,加水至刻度。混匀后,取5 mL水解液于10 mL容量瓶中,用2 mol/L氢氧化钠溶液调节pH值至中性,加水稀释至刻度。稀释液经0.22 μm微孔滤膜过滤,待高效液相色谱分析。
1.3.3 衍生
取过滤后的稀释液1 mL于10 mL具塞离心管中,加饱和碳酸氢钠溶液400 μL,衍生试剂800 μL,旋涡混匀30 s,80 ℃水浴中避光反应45 min,取出迅速冷却,加入1 mol/L盐酸溶液800 μL终止反应,经0.22 μm微孔滤膜过滤,待高效液相色谱分析。
1.3.4 色谱条件
梯度洗脱程序见表1,色谱柱:C 18柱(250 mm×4.6 mm,5 μm);流动相:A为甲醇,B为四氢呋喃-甲醇-0.05 mol/L乙酸钠(1∶15∶84,V/V)溶液;梯度洗脱,流速1 mL/min;柱温40 ℃;检测波长254 nm;进样量20 μL。
表1 梯度洗脱程序
Table1 Gradient elution program

时间/min流动相A体积分数/%流动相B体积分数/% 0 5 95 3224.275.8 3724.275.8 42595
1.3.5 精密度实验
配制不同质量浓度的羟脯氨酸标准溶液,按照1.3.2节和1.3.3节方法处理,并进行高效液相色谱测定,以测定的结果计算相对标准偏差(relative standard deviation,RSD)。
1.3.6 回收率实验
分别称取2 g不同组织样品,根据其羟脯氨酸含量添加不同水平(50%、100%、150%)的羟脯氨酸标准品,按1.3.2节和1.3.3节方法进行实验,测定羟脯氨酸含量,计算回收率,每一样品做3 次平行实验。
1.3.7 计算公式
回收率和胶原蛋白含量按公式(1)、(2)计算:
式中:X为加入羟脯氨酸后样品中羟脯氨酸的测定总量/mg;Y为样品中羟脯氨酸测定量/mg;Z为加入标准羟脯氨酸量/mg。
2.1 水解条件的确定
测定蛋白质中的氨基酸首先要通过水解破坏蛋白质的肽键,一定浓度的酸液可以使胶原蛋白水解为肽及游离的L-氨基酸,并释放到溶剂中。酸水解的优点是水解彻底,水解的最终产物是L-氨基酸,没有旋光异构体产生。酸浓度和温度对动物组织胶原蛋白的水解过程有较大影响,增加酸浓度和提高温度可使反应进程加快,使胶原蛋白水解为多肽的过程更彻底 [22]。本实验观察了水解温度、时间以及盐酸浓度对鲫鱼不同组织中胶原蛋白水解产生羟脯氨酸的影响,最终确定的水解条件为:水解温度110 ℃,6 mol/L盐酸溶液中水解18 h。
2.2 衍生试剂选择
动物组织中的胶原蛋白经酸水解后生成包括羟脯氨酸在内的氨基酸混合物,羟脯氨酸本身不具有紫外、荧光吸收,需要衍生后才能进行分析。Dns-Cl在氨基酸的液相色谱分析中有着广泛的应用 [23],常作为液相色谱的柱前衍生试剂 [24]。Dns-Cl可以同伯胺或仲胺基上的活泼氢反应,脱掉一分子的HCl生成具有荧光和紫外吸收的衍生物,其衍生操作简单、衍生物稳定性较好、可定量完成磺酰化反应、有较强的荧光和紫外吸收。本实验同样选择Dns-Cl作为鲫鱼不同组织胶原蛋白水解液中羟脯氨酸的柱前衍生试剂,衍生产物在C 18柱上的分离效果好,干扰峰极少,谱图干净,如图1所示。
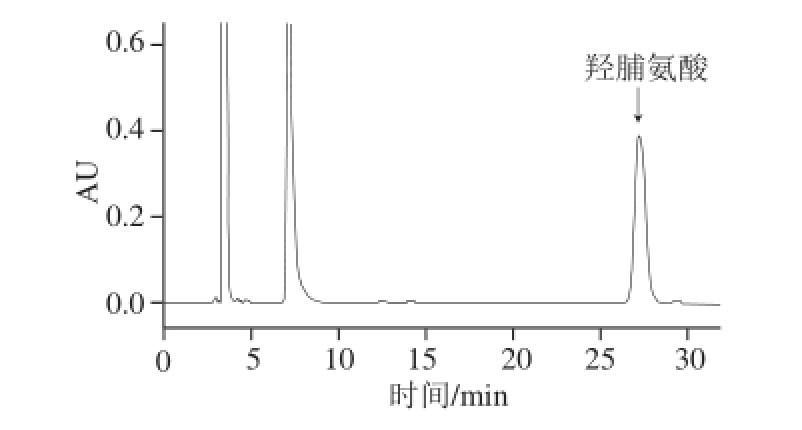
图1 40000 μg/mL羟脯氨酸标准样品的高效液相色谱图
Fig.1 HPLC chromatogram of Hyp standard solution at 400 μg/mL
2.3 色谱条件优化
实验中流动相A为甲醇,B为四氢呋喃、甲醇和0.05 mol/L乙酸钠组成的混合溶液。其中对乙酸钠缓冲液分别配制了3 种不同pH值分别为4.8、4.0、3.4,观察了三者对羟脯氨酸在C 18柱上保留行为的影响。结果发现,pH值越低越有利于分离,有些文献报道使用pH值为3.1的缓冲液,但考虑到色谱柱的使用寿命,选择pH值为3.4的乙酸钠缓冲液,在pH值为3.4时羟脯氨酸的峰形最好,并且保留时间明显提前;四氢呋喃的加入能有效地改善峰形和分离度。甲醇、四氢呋喃和乙酸钠溶液体积比为1∶15∶84时,经过梯度洗脱可以有效的调节保留时间且拥有良好的检测限。
实验中为选择最佳洗脱梯度,分别设置了不同的洗脱程序进行测定。结果发现流动相A的比例越小物质分离越完全,并且可以将杂质很好的分离,在不断增加甲醇比例时0.6 mL/min的增加速率为最佳,最终选择梯度洗脱程序如表1所示。
为选择最佳检测波长,本实验采用三波长模式(240、254 nm和260 nm)同时检测羟脯氨酸含量,如图2所示。结果表明,羟脯氨酸在波长254 nm处有最大吸收峰,且在波长254 nm处基线稳定,因此将检测波长设为254 nm。
本实验还考察温度、流速对羟脯氨酸在C 18柱上的保留行为的影响,二者对羟脯氨酸的保留时间有一定影响,但对检测灵敏度影响不大,最终将温度设为40 ℃,流速1.0 mL/min。在设定的色谱条件下,羟脯氨酸保留时间约27.1 min,如图2所示。

图2 样品在不同波长条件下的高效液相色谱图
Fig.2 HPLC chromatograms of sample at different wavelengths
2.4 线性范围及最低检测限
按照3 倍信噪比计算最低检测限,得出方法的最低检测限为0.18 μg/g。
取标准贮备液,分别用水配制质量浓度为20、50、100、200、400 μg/mL的羟脯氨酸系列标准工作溶液。取1 mL上述系列标准溶液于10 mL具塞离心管中,分别按1.3.3节方法衍生,其中衍生后羟脯氨酸的质量浓度依次为6.67、16.67、33.34、66.67、133.33 μg/mL。在波长254 nm处进行高效液相色谱测定分析,以羟脯氨酸衍生后质量浓度(μg/mL)为横坐标X,以对应峰面积为纵坐标Y,绘制标准曲线。回归方程Y=1.35×10 5X-8.56×10 3,相关系数R²为0.999 8。由此可见在质量浓度20~400 μg/mL范围内,羟脯氨酸质量浓度与峰面积有良好的线性关系。
2.5 精密度
配制100、200、300 μg/mL羟脯氨酸标准溶液,取1 mL上述标准溶液于10 mL具塞离心管中,分别按1.3.3节方法衍生,其中衍生后质量浓度分别为33.34、66.67、100 μg/mL,按照1.3.4节 色谱条件进行分析,每个质量浓度重复操作3 次,记录峰面积,得100、200、300 μg/mL的羟脯氨酸标准溶液峰面积的RSD分别为1.34%、0.31%、1.84%,结果表明本实验建立的方法具有良好的精密度。
2.6 回收率
分别取鲫鱼不同部位鱼皮、鱼肉、鱼鳔、鱼鳞的组织样品测定羟脯氨酸,计算回收率,结果见表2。
表2 鲫鱼不同组织样品羟脯氨酸添加水平回收率测定结果( n=3)
Table2 Recoveries of Hyp spiked at different levels (n = 3)

样品添加量/mg检测量/mg样品含量/mg回收率/%平均回收率/%鱼皮10.1000.2820.19191.00 80.22鱼皮20.2000.3450.19177.00鱼皮30.3000.4090.19172.67鱼肉10.0200.0540.03880.00鱼肉20.0500.0790.03882.00鱼肉30.1000.1260.03888.00鱼鳔10.1000.2890.20584.00 83.33鱼鳔20.2000.3560.20575.50鱼鳔30.3000.4530.20582.67鱼鳞10.1000.3750.29481.00 80.72鱼鳞20.2000.4540.29480.00鱼鳞30.3000.5370.29481.00 80.67
由表2可以看出,样品回收率在72.67%~91.00%之间,鱼皮、鱼肉、鱼鳔、鱼鳞样品中平均回收率分别为80.22%、83.33%、80.72%、80.67%,可满足鲫鱼不同组织中胶原蛋白分析研究的需要。
2.7 实际样品分析
表3 实际样品分析结果(n=3)
Table3 Contents of Hyp in real samples (n=3)

样品羟脯氨酸质量浓度/(μg/mL)羟脯氨酸含量/(mg/g)胶原蛋白含量/(mg/g)RSD/%鱼皮64.049.61106.620.52鱼肉14.842.2324.752.40鱼鳔69.1210.37115.051.43鱼鳞100.3015.04166.943.00
分别分析了鲫鱼不同部位鱼皮、鱼肉、鱼鳔、鱼鳞的组织样品中羟脯氨酸的含量,结果见表3。鲫鱼4 个部分中鱼鳞胶原蛋白含量最多为166.94 mg/g,鱼肉胶原蛋白含量最少为24.75 mg/g,各组织样品的RSD在0.52%~3.00%之间。曾名勇等 [25]用氨基酸自动分析仪测得鲫鱼鱼皮中羟脯氨酸含量为8.12 mg/g,鲈鱼鱼皮胶原含量为8.75 mg/g,鳙鱼鱼皮胶原含量为8.34 mg/g;詹永献 [26]用分光光度法测得的草鱼鱼鳔中羟脯氨酸含量为49.7 mg/g;潘杨 [27]根据Woessner J法计算鲢鱼鱼鳞中羟脯氨酸的含量为41.6 mg/g。含量有所差异可能和测量方法、组织来源、部位不同有关,但羟脯氨酸在胶原蛋白中含量稳定,约占9%,胶原蛋白含量高,其羟脯氨酸含量也高,将测得的羟脯氨酸含量乘以相关系数11.1即为胶原蛋白的含量。
本实验通过样品水解条件确定、衍生试剂选择和色谱条件的优化,建立了鲫鱼鱼皮、鱼肉、鱼鳞、鱼鳔组织中羟脯氨酸的高效液相色谱检测方法,从而计算出相应的胶原蛋白含量。鲫鱼组织经盐酸110 ℃水解18 h,Dns-Cl衍生,然后以甲醇和四氢呋喃-甲醇-0.05 mol/L乙酸钠(1∶15∶84,V/V)溶液为流动相、在反相C 18柱上进行分离。在20~400 μg/mL范围内关系良好(R 2为0.999 8),最低检测限为0.18 μg/g,平均回收率为80.22%~83.33%,RSD范围为0.31%~1.84%,同时检测出鲫鱼鱼皮、鱼肉、鱼鳞、鱼鳔组织中胶原蛋白含量分别为106.62、24.75、166.94、115.05 mg/g。
本实验建立的鲫鱼不同组织中羟脯氨酸的高效液相色谱检测方法,操作简便、具有良好的灵敏度和准确性。鉴于鲫鱼汤是家庭中最为普遍的食用方法、以及家庭鲫鱼汤制作耗时较长,后续研究将围绕以胶原蛋白含量多的组织为原料,进行处理后(如鱼鳞胶)加入鲫鱼汤中,制作天然营养的固体凝胶型鱼汤。
参考文献:
[1] 于美娟, 马美湖, 李高阳. 畜禽汤类产品加工技术研究进展[J]. 肉类研究, 2012, 26(12): 61-66.
[2] 王丽娜, 黄素珍. 胶原蛋白的研究进展[J]. 肉类研究, 2010, 24(1):16-22.
[3] 夏启泉, 许慧卿. 鲫鱼浓汤的制作工艺及营养分析[J]. 扬州大学烹饪学报, 2005, 22(3): 24-26.
[4] 万春燕, 王英华, 邬元娟, 等. 胶原蛋白在食品中的应用现状及其发展前景[J]. 中国食物与营养, 2008, 14(9): 24-26.
[5] 周倩, 罗志刚, 何小维. 胶原蛋白的应用研究[J]. 现代食品科技,2008, 24(3): 285-289.
[6] 连喜军, 鲁晓翔, 刘勤生. 鱼类胶原蛋白研究进展[J]. 肉类研究,2007, 21(1): 46-49.
[7] 杨树奇, 曾少葵, 周春霞, 等. 3 种鱼皮的基本成分及氨基酸组成分析[J]. 广东海洋大学学报, 2010, 30(1): 97-100.
[8] NAGAI T, SUZUKI N, NAGASHIMA T. Collagen from common minke whale (Balaenoptera acutorostrata) unesu[J]. Food Chemistry,2008, 111(2): 296-301.
[9] 申锋, 杨莉莉, 熊善柏, 等. 胃蛋白酶水解草鱼鱼鳞制备胶原肽的工艺优化[J]. 华中农业大学学报, 2010, 29(3): 387-391.
[10] 张俊杰, 段蕊, 曾庆孝. 鲤鱼鳞中羟脯氨酸测定的影响因素[J]. 食品科学, 2005, 26(1): 191-195.
[11] NAGAI T, ARAKI Y, SUZUKI N. Collagen of the skin of ocellate puffer fish (Takifugu rubripes)[J]. Food Chemistry, 2002, 78(2): 173-177.
[12] BLACHIER F, WU Guoyao, YIN Yulong, et al. Nutritional and physiological functions of amino acids in pigs[M]. Springer, 2013:217-229.
[13] QIU Bing, WEI Fengxiang, SUN Xiuzhi, et al. Measurement of hydroxyproline in collagen with three different methods[J]. Molecular Medicine Reports, 2014, 10(2): 1157-1163.
[14] GB/T 9695.23—2008 肉与肉制品: 羟脯氨酸含量测定[S]. 北京: 中国标准出版社, 2008
[15] SANKAR S, SEKAR S, MOHAN R, et al. Preparation and partial characterization of collagen sheet from fish (Lates calcarifer) scales[J]. International Journal of Biological Macromolecules, 2008, 42(1): 6-9.
[16] 吕婷, 王红英, 孙佳佳, 等. 酶法制取鱼皮胶原蛋白短肽[J]. 大连工业大学学报, 2009, 28(1): 9-12.
[17] 白洋. 罗非鱼下脚料制取胶原肽研究[D]. 南宁: 广西大学, 2009: 15-25.
[18] 赵天珍, 袁秀金, 谭贵良, 等. 比色法快速测定奶粉和含乳饮料中游离L-羟脯氨酸[J]. 食品研究与开发, 2009, 29(12): 111-113.
[19] 张笑, 刘杰, 陈翠岚. 比色法测定明胶中的L-羟脯氨酸[J]. 食品安全质量检测学报, 2010, 27(3): 124-127.
[20] 邹晓莉, 黎源倩, 曾红燕, 等. 反相高效液相色谱法测定人肌腱中的胶原蛋白[J]. 色谱, 2006, 24(3): 263-266.
[21] 崔勇, 刘智, 张博, 等. 反相高效液相色谱柱前衍生法测定保健食品中羟脯氨酸的含量[J]. 中国卫生检验杂志, 2008, 18(11): 2247-2248.
[22] SILVA C, SPINELLI E, RODRIGUES S. Fast and sensitive collagen quantification by alkaline hydrolysis/hydroxyproline assay[J]. Food Chemistry, 2014, 173: 619-623.
[23] AKSAMIJA A, MATHE C, VIEILLESCAZES C. Liquid chromatography of triterpenic resins after derivatization with dansyl chloride[J]. Journal of Liquid Chromatography & Related Technologies, 2012, 35(9): 1222-1237.
[24] QI Baoling, LIU Ping, WANG Qiuyi, et al. Derivatization for liquid chromatography-mass spectrometry[J]. Trends in Analytical Chemistry, 2014, 59: 121-132.
[25] 曾名勇, 张联英, 刘尊英, 等. 几种鱼皮胶原蛋白的理化特性及其影响因素[J]. 中国海洋大学学报: 自然科学版, 2005, 35(4): 608-612.
[26] 詹永献. 草鱼鱼鳔胶原蛋白理化性质及结构特点的研究[D]. 洛阳:河南科技大学, 2012: 15-17.
[27] 潘杨. 鲢鱼鱼鳞明胶的制备及其性质研究[D]. 无锡: 江南大学,2008: 14-17.
Determination of Collagen in Different Tissues of Crucian Carp (Carassius auratus) by High Performance Liquid Chromatography
GONG Wenyu
1,2, BIAN Huan
1, WU Haihong
1, WANG Daoying
1, GENG Zhiming
1, LIU Fang
1, ZHANG Muhan
1, XU Weimin
1, ZHU Yongzhi
1,*
(1. Institute of Agricultural Products Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;2. Key Laboratory of Meat Processing and Quality Control, Ministry of Education, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:In order to improve the utilization of collagen in fishery products, a high performance liquid chromatographic(HPLC) method with pre-column derivatization was established to determine hydroxyproline in the skin, meat, scale, and blubber of the crucian carp Carassius auratus and the content of collagen was calculated based on hydroxyproline levels in samples. Samples were hydrolyzed by hydrochloric acid at 110 ℃ for 18 h, followed by pre-column derivatizations with dansyl chloride. Hydroxyproline was determined by HPLC connected to an ultraviolet detector (HPLC-UV). The chromatographic co nditions were set as follows: column, C 18(250 mm × 4.6 mm, 5 μm); mobile phase, A: methanol, B:tetrahydrofuran-methanol-0.05 mol/L sodium acetate (1:15:84, V/V); flow rate, 1.0 mL/min; co lumn temperature, 40 ℃; and detect ion wavelength, 254 nm. Results showed a good linear relationship existed when hydroxyproline was in the range of 20-400 μg/mL (R 2= 0.999 8). The limit of detection (LOD) was 0.18 μg/g and the average recoveries were 80.22%-83.33% with relative standard deviations (RSDs) of 0.31%-1.84%. The contents of collagen in skin, meat, scale, blubber of crucian carp were 106.62, 24.75, 166.94, 115.05 mg/g, respectively. The present method proved to be of high maneuverability,excellent sensitivity and accuracy, and could be employed to analyze collagen contents in fishery products.
Key words:crucian carp (Carassius auratus); hydroxyproline; collagen; high performance liquid chromatography (HPLC)
中图分类号:TS254.7
文献标志码:A
文章编号:1002-6630(2015)14-0065-05
doi:10.7506/spkx1002-6630-201514013
收稿日期:2014-11-19
基金项目:“十二五”国家科技支撑计划项目(2014BAD04B00);江苏省农业科技自主创新资金项目(CX(14)2117)
作者简介:贡雯玉(1991—),女,硕士研究生,研究方向为肉品加工与质量控制。E-mail:gwy3428@163.com
*通信作者:诸永志(1975—),男,副研究员,硕士,研究方向为肉品加工与质量控制。E-mail:yongzhizhu@163.com