表1 不同类型表面活性剂对黄酮类物质保留因子的影响
Table1 Effect of surfactants on the retention factors of five flavonoids

黄酮标品保留因子SDSBrij-35儿茶素0.4352.569芦丁0.5564.897槲皮素2.09812.768山柰酚3.11214.248杨梅酮4.01416.243
赵 丹 1,苏 宁 2,郑洪艳 2,杨 丽 2,霍 彤 1,王昌涛 1,*
(1.北京工商大学理学院,北京 100048;2.中国检验检疫科学研究院,北京 100123)
摘 要:目的:利用微乳液相色谱分离并测定蓝莓叶中儿茶素、芦丁、山柰酚、槲皮素和杨梅酮5 种黄酮成分。方法:从表面活性剂、助表面活性剂、pH值、有机相4 个方面对微乳液相色谱分离蓝莓叶黄酮的条件进 行优化。结果:分离蓝莓叶黄酮的最优条件为:使用2.5%聚氧乙烯(23)月桂醚作为表面活性剂,8%正丁醇为助表面活性剂,0.8%乙酸乙酯为有机相,0.5%乙酸调节体系pH值为3.2,在以上条件下蓝莓叶黄酮在20 min内能够得到有效分离。结论:蓝莓叶中提取的黄酮类化合物含有儿茶素9.76 mg/g、芦丁13.12 mg/g、山柰酚31.04 mg/g、槲皮素26.42 mg/g、杨梅酮20.30 mg/g。
关键词:蓝莓叶;黄酮类化合物;微乳液相色谱;分离;测定
蓝莓原产于美洲,不仅果实营养丰富,蓝莓叶有利尿、解毒的功效,可入药。蓝莓叶汁中的花青素类黄酮能够降血糖,有助于提高毛细血管的完整性,稳定毛细血管的通透性,从而抑制糖尿病人血管和神经后遗症的产生 [1-3]。如何对蓝莓叶黄酮进行提取分离,得到高纯度的黄酮类物质已成为当今的研究热点。传统的分离纯化黄酮类化合物的方法有液-液萃取法、柱色谱法等,还有气相色谱-质谱(gas chromatography with mass spectrometry,GC-MS)联用法、高效液相色谱(high-performance liquid chromatography, HPLC)法和HPLC-质谱(HPLC combined with mass spectrometry,HPLC-MS)联用法等 [4-6]。在上述的方法中,多数以大量的有机溶剂作为流动相,对环境造成了不利的影响 [7-8]。微乳液相色谱(microemulsion liquid chromatography,MELC)是一种将表面活性剂、助表面活性剂、油和水等物质以一定的比例混合后形成的油水混合分散体系为流动相的液相色谱,溶质的保留由其在固定相、微乳分散相和水相之间的分配平衡决定。通过调节优化参数,可改善溶质的保留行为,提高分离度 [9-10]。微乳流动相含有水约90%,利用MELC对物质进行分离具有低污染、分离效果好、分离速度快的优点 [11]。
目前与蓝莓叶黄酮相关的研究多集中在蓝莓叶总黄酮的提取以及抗氧化活性的检测,而在其成分的分离测定方面研究甚少。本实验利用MELC对蓝莓叶黄酮进行分离与测定,从表面活性剂、助表面活性剂、有机相和pH值4 个方面对色谱条件进行优化,使蓝莓叶黄酮的主要成分在短时间内得到有效分离。以此建立准确可靠、稳定快速检测蓝莓叶黄酮成分的方法,为蓝莓叶黄酮的进一步开发和应用提供了理论依据。
1.1 材料与试剂
十二烷基硫酸钠(sodium dodecyl sulphate,SDS)、聚氧乙烯(23)月桂醚(polyethylene glycol monoisotridecyl ether,Brij-35)均为分析纯;儿茶素、芦丁、槲皮素、山柰酚和杨梅酮标准品(纯度>97%)上海阿拉丁试剂公司。乙酸乙酯、乙酸、乙醇、盐酸、正丁醇(均为分析纯) 北京化工厂;甲醇(色谱纯)美国Fisher Chemical公司。
超纯水通过Mili-Q水微乳净化系统(Milford,USA)制得,所配制溶液需通过0.45 μm的滤膜(美国Millipore公司)进行过滤,以此来保证流动相中无杂质。
1.2 仪器与设备
T6型新世纪紫外-可见分光光度计 北京普析通用仪器有限公司;RE-301旋转蒸发仪 上海互佳仪器有限公司;SHZ-CD型循环水真空泵 上海贝伦仪器设备有限公司;MELC系统:1525二进制HPLC泵、2707自动进样系统、2489 UV/VIS检测器、反相C 18色谱柱(250 mm×4.6 mm,5 μm) 美国Waters公司。
1.3 方法
1.3.1 蓝莓叶黄酮样品的制备
取500 mL质量浓度为300 mg/mL的粗提蓝莓叶黄酮溶液,准确称取经50 g预处理过的DM130树脂,在25 ℃条件下恒温振荡吸附4 h。以60%乙醇为洗脱剂,进行静态洗脱4 h,得到纯化的蓝莓叶黄酮提取物,将其冷冻干燥至恒质量。准确称3 份10.0 g冷冻干燥后,分别加20 mL 70%乙醇(0.2%乙酸)溶液,超声15 min,室温条件下静置,过滤,用70%乙醇溶液定容至100 mL。精密取1 mL,用甲醇定容至10 mL,在检测前通过0.45 μm滤膜,待用 [12]。
1.3.2 标准溶液的制备
精密称取真空干燥至恒质量的5 种标准品各0.020 0 g,分别加甲醇超声溶解后,转移至10 mL容量瓶中,定容,摇匀,配制成2.00 mg/mL储备液。分别取5 种标准储备液2 mL,混合后超声混匀制成混合标准液质量浓度为0.40 mg/mL。对混合标准溶液梯度稀释至0.04、0.08、0.10、0.20、0.40 mg/mL。标准溶液在检测前经0.45 μm滤膜进行过滤。
1.3.3 色谱条件
检测波长368 nm和279 nm;流速1.0 mL/min ;进样量10 μL。流动相1.0%乙酸乙酯,2.5%Brij-35,8.0%正丁醇,0.5%乙酸,pH 4.5。流动相配制好后超声30 min,待微乳液呈透明溶液后用0.45 μm膜过滤。
2.1 表面活性剂及质量分数的选择
表面活性剂的类型和质量分数对微乳的形成和性质有重要影响 [13]。色谱分离的选择性会受到表面活性剂类型的影响,表面活性剂改变了黄酮类物质在微乳液滴间的分配性质,并使黄酮类物质与固定相间的作用发生改变 [14-16]。微乳液体系中常用作为检测黄酮类化合物的表面活性剂有SDS、Brij-35和吐温20等。本实验采用SDS-乙酸乙酯-正丁醇和Brij-35-乙酸乙酯-正丁醇微乳体系为流动相,在微乳稳定质量分数范围内,选择2.5% SDS和1.0% Brij-35进行考察 [17]。2 种表面活性剂对5 种黄酮类物质的保留因子(k)的影响不同,如表1所示。结果表明,由于SDS对微乳流动相的洗脱能力 较强,混合样品与溶剂几乎同时出峰,而Brij-35的洗脱能力相对较弱,能够使5 种标准样品混合液达到基线分离。因此,选择Brij-35作为表面活性剂进行后续实验。
表1 不同类型表面活性剂对黄酮类物质保留因子的影响
Table1 Effect of surfactants on the retention factors of five flavonoids

黄酮标品保留因子SDSBrij-35儿茶素0.4352.569芦丁0.5564.897槲皮素2.09812.768山柰酚3.11214.248杨梅酮4.01416.243
表面活性剂可以被固定相吸附,并能填充柱填料间存在的空隙 [18],待测样品的保留时间会随着表面活性剂质量分数的增加而缩短 [19-20]。
由图1可以看出,随着表面活性剂Brij-35 质量分数从0.5%增加到2.5%,混合标品(儿茶素、芦丁、槲皮素、山柰酚和杨梅酮)的出峰时间不断缩短。当Brij-35质量分数低于2.0%时,5 种黄酮标品达不到基线分离;增加Brij-35至2.5%,5 种物质分离效果较好。如果Brij-35质量分数继续增加,则混标的保留时间过短。因此,2.5% Brij-35作为最适表面活性剂添加量,保证了适当的洗脱时间的同时,也保证了5 种黄酮标准品可以达到基线分离。

图1 Brij-35添加量对5 种黄酮标准品色谱保留力的影响
Fig.1 Effect of Brij-35 concentration on the retention times of five flavonoids
2.2 助表面活性剂的影响
微乳液是通过表面活性剂将油相和水相进行结合的,但是仅仅依靠表面活性剂、水相和油相3者组成的体系是极不稳定的 [21]。在助表面活性剂的作用下可以使体系更加的稳定 [22]。

图2 正丁醇添加量对5 种黄酮标准品色谱保留力的影响
Fig.2 Effect of n-butyl alcohol concentration on the retention times of five flavonoids
通过考察异丙醇、四氢呋喃和正丁醇3 种不同类型助表面活性剂对分离选择性的影响发现,以异丙醇和四氢呋喃作为助表面活性剂,标准品出峰位置重叠,而正丁醇作为助表面活性剂可以使混合标准品中的5 个峰得到基线分离。考察正丁醇添加量得到的结果表明(图2),添加5.0%正丁醇溶液使儿茶素和芦丁出峰时间非常接近,保留时间过长。当添加量增加至8.0%时,由于正丁醇提高了微乳液的增溶作用,标准品的保留时间明显缩短,且儿茶素和芦丁可以达到最佳的基线分离效果。但正丁醇的添加量继续增加对其分离影响不大。综合考虑,选取8.0%作为正丁醇的添加量。
2.3 pH值的影响
考察流动相在pH 3.2~5.2条件下蓝莓叶黄酮的分离效果。如图3所示,乙酸添加量为0.1%时,儿茶素和芦丁出峰时间重叠。随着乙酸添加量的增加,儿茶素和芦丁的分离效果越来越好,在添加量0.5%、流动相pH 3.2的条件下,5 种黄酮类物质基本可以达到基线分离。当流动相中乙酸的添加量大于0.5%时,标准品的保留时间过长,且流动相pH值过低易发生键合相水解,对色谱柱会有损害,缩短使用寿命。因此选择在流动相中添加0.5%乙酸。

图3 乙酸添加量(pH值)对5 种黄酮标准品色谱保留力的影响
Fig.3 Effect of acetic acid concentration on the retention times of five flavonoids
2.4 有机相的影响
有机相的类型和浓度都会因为其极性的差异而对黄酮类物质的出峰时间有着显著的影响 [23]。常作为有机相的溶剂有乙酸乙酯、正庚烷、正辛烷。这几种有机溶剂对5 种黄酮类化合物的洗脱能力各不相同,正辛烷最大,乙酸乙酯最小,并且只有乙酸乙酯可以使被测5 种黄酮成分达到基线分离 [24-25]。故选择乙酸乙酯作为有机相进行后续的工艺优化。图4显示了0.1%~0.8%添加量的乙酸乙酯对标准品保留时间的影响。

图4 乙酸乙酯添加量对5 种黄酮标准品色谱保留力的影响
Fig.4 Effect of ethyl acetate concentration on the retention times of five flavonoids
由图4可知,乙酸乙酯添加量对黄酮标准品的影响不如其他条件明显。乙酸乙酯的添加量从0.1%提高到0.2%时,槲皮素、山柰酚和杨梅酮的保留时间有所延长,但乙酸乙酯的添加量继续增加,对5 种黄酮标准品的保留时间没有太大影响。当乙酸乙酯的添加量达到0.8%时,儿茶素和芦丁的分离较好,因此选择0.8%为乙酸乙酯的添加量。
2.5 检测波长的选择
在以上实验中获得的最优条件下,测量混合标准品在279 nm和368 nm的出峰情况。如图5所示,在279 nm条件下,5 种黄酮标准品峰形良好,出峰时间适当,并无拖尾现象。在368 nm条件下杨梅酮没有出峰,不能达到分离的目的。因此选择279 nm作为分离蓝莓叶黄酮的最佳检测波长。综合以上最优条件,绘制5 种混合标品的标准曲线,结果见表2。
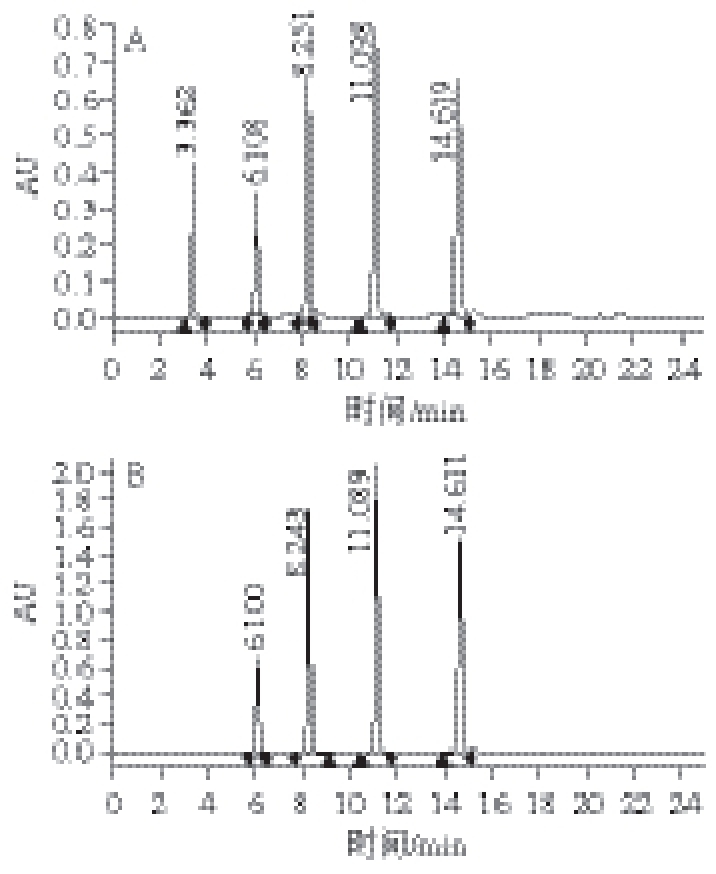
图5 279nm(A)和368 nm(B)检测波长下混标MELC色谱图
Fig.5 Microemulsion liquid chromatogram (MELC) of mixed standard solution of five flavonoids at different wavelengths
表2 MELC法测定5 种黄酮标准品的标准曲线
Table2 Standard curve equations for the MELC determination of five flavonoids
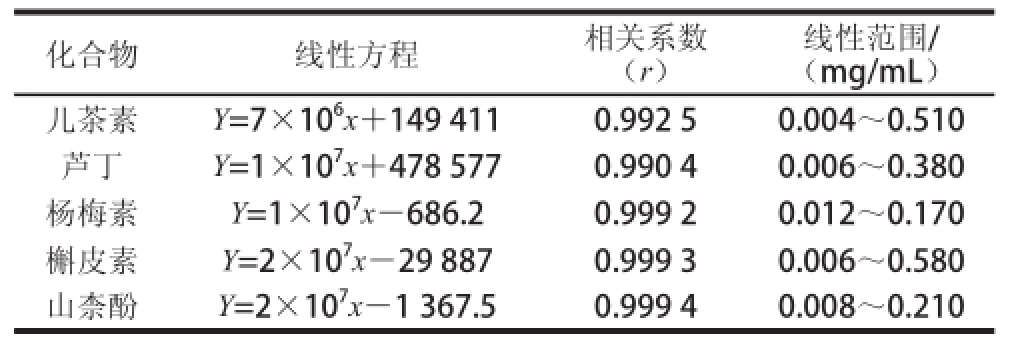
化合物线性方程相关系数(r)线性范围/(mg/mL)儿茶素Y=7×10 6x+149 4110.992 50.004~0.510芦丁Y=1×10 7x+478 5770.990 40.006~0.380杨梅素Y=1×10 7x-686.20.999 20.012~0.170槲皮素Y=2×10 7x-29 8870.999 30.006~0.580山柰酚Y=2×10 7x-1 367.50.999 40.008~0.210
2.6 蓝莓叶提取物中的黄酮成分含量

图6 MELC法对蓝莓叶提取物黄酮成分的含量测定
Fig.6 Microemulsion liquid chromatogram (MELC) of flavonoids extracted from blueberry leaves
按照优化得到的色谱条件,对3 个不同批次的蓝莓叶提取物中的黄酮成分进行测定,结果如图6所示。由于蓝莓叶黄酮中除了本研究的5 种物质外,还含有多种其他成分,在进行MELC分离时会出现多个物质出峰接近的情况。根据预实验摸索的条件,在5 种物质的相应出峰时间计算出峰面积,结合标准曲线,得出蓝莓叶黄酮中5 种组分含量。见表3。
表3 MELC法对蓝莓叶提取物中5 种黄酮成分的含量测定(n=3)
Table3 Contents of three flavonoids in the extract of blueberry leaves (n=3)
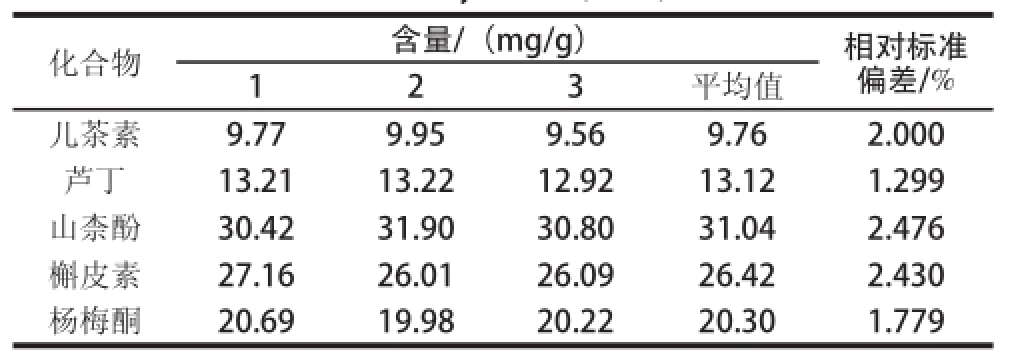
化合物含量/(mg/g)相对标准偏差/% 123平均值儿茶素9.779.959.569.762.000芦丁13.2113.2212.9213.121.299山柰酚30.4231.9030.8031.042.476槲皮素27.1626.0126.0926.422.430杨梅酮20.6919.9820.2220.301.779
在综合考虑保留时间和分离效果的前提下,本实验从表面活性剂等4 个方面对MELC分离检测蓝莓叶黄酮的条件进行了摸索和优化。得到最优检测参数:279 nm检测波长下,使用2.5% Brij-35作为表面活性剂,8%正丁醇为助表面活性剂,0.8%乙酸乙酯为有机相,利用0.5%乙酸调节体系pH值为3.2,在以上条件下蓝莓叶黄酮在20 min内能够得到有效分离。最终测得蓝莓叶黄酮中含有儿茶素9.76 mg/g、芦丁13.12 mg/g、山柰酚31.04 mg/g、槲皮素26.42 mg/g、杨梅酮20.30 mg/g。
本方法可在短时间内同时检测蓝莓叶黄酮中5 种物质的含量,并得到有效的分离,结果准确可靠,重复性好,灵敏度高。为今后在生产实践中开发利用蓝莓叶提供了一定的理论基础和方法指导。
参考文献:
[1] NAGAO K, HIGA K, SHIROUCHI B, et a1. Effects of Vaccinium ashei Reade leaves on lipid metabolism in Otsuka Long. Evans Tokushima Fatty rats[J]. Bioscience Biotechnology and Biochemistry,2008, 72: 1619-1622.
[2] 张玉香, 曲慧鸽, 杨润亚, 等. 响应面法优化蓝莓叶黄酮的微波提取艺[J]. 食品科学, 2010, 31(16): 33-37.
[3] 刘小莉, 周剑忠, 单成俊. 蓝莓叶总黄酮的微波提取及抗氧化活性研究[J]. 食品研究与开发, 2011, 32(3): 44-46.
[4] 袁帅, 姚胜军, 耿昱. HPLC-ESI-MS/MS 识别蓝莓提取物中的花青素和黄酮醇[J]. 化学学报, 2009(4): 318-322.
[5] ZUO Yuegang, WANG Chengxia, ZHAN Jian. Separation,characterization, and quantitation of benzoic and phenolic antioxidants in American cranberry fruit by GC-MS[J]. Journal of Agricultural and Food Chemistry, 2002, 50(13): 3789-3794.
[6] 冯进, 李敏, 曾晓雄, 等. 大孔树脂纯化蓝莓叶多酚及其组成分析[J].食品科学, 2013, 34(10): 86-91. doi: 10.7506/spkx1002-6630-201310019.
[7] LEO M, ABREU M, PAWLOWSKA A, et al. Profiling the chemical content of Opuntia fi cus-indica flowers by HPLC-PDA-ESI-MS and GC/EIMS analyses[J]. Phytochemistry Letters, 2010, 3(1): 48-52.
[8] 朱冬雪, 顾采琴, 周伯春. 不同大孔树脂吸附-解吸附喜树黄酮性能的研究[J]. 广东化工, 2011, 12(38): 180-181.
[9] 朱兰寸, 刘志华, 李高, 等. 微乳液相色谱法测定广东紫珠中5 种黄酮成分[J]. 中国现代应用药学, 2013, 30(6): 651-654.
[10] SELLAPAN S, AKOH C, KREWER G. Phenolic compounds and antioxidant capacity of Georgia-grown blueberries and blackberries[J]. Journal of Agricultural and Food Chemistry, 2002, 50(8): 2432-2438.
[11] 张守尧, 周苏泰, 王秉钧, 等. 微乳液相色谱法测定虎杖中2 种成分的含量[J]. 今日药学, 2009, 19(2): 41-43.
[12] SKUPIEN K, OSZMIANSKI J, KOSTRZEWA N D, et al. In vitro antileukaemic activity of extracts from berry leaves against sensitive and multi-drug resistant HL60 cells[J]. Cancer letters, 2006, 236: 281-291.
[13] 刘建芳, 孙进, 何仲贵. 微乳液相色谱法及其应用进展[J]. 分析化学,2007, 35(10): 1529-1534.
[14] WALASH M, BELAI F, El-ENANYl N, et al. Microemulsion liquid chromato-graphic determination of nicardipine hydrochloride in pharmaceutical preparations and biological fluids. Application to stability studies[J]. Journal of Liquid Chromatography and Related Technologies, 2007, 30(8): 1015-1034.
[15] 陈红兰, 刘成梅, 刘玮琳, 等. 微乳技术的应用[J]. 江西食品工业,2008(2): 36-37; 41.
[16] ALTHANYAN M, ASSI K, CLARK B, et al. Microemulsion high performance liquid chromatography (MELC) method for the determination of terbutaline in pharmaceutical preparation[J]. Journal of Pharmaceutical and Biomedical Analysis, 2011, 55(3): 397-402.
[17] 李宁, 黄光亮, 李玉兰. 微乳液型色谱法同时测定山楂叶提取物中4种黄酮成分[J]. 分析化学研究简报, 2009(12): 1791-1794.
[18] RUIZ A M, CARDA B S, TORRES L, et al. Retention mechanisms in micellar liquid chromatography[J]. Journal of Chromatography A,2009, 1216(10): 1798-1814.
[19] 何素珍. 微乳液相色谱法在中药成分分析中的应用[D]. 广州: 南方医科大学, 2012.
[20] MALENOVIC A, IVANOVIC D, MEDENNICA M, et al. Influence of structural and interfacial properties of microemulsion eluent on chromatographic separation of simvastatin and its impurities[J]. Jou rnal of chromatography A, 2006, 1131(1/2): 67-73.
[21] WAMON M, SHEILA D, JOE P, et al. Optimisation and validation of a rapid and efficient microemulsion liquid chromatographic (MELC)method for the determination of paracetamol (a cetaminophen) content in a suppository formulation[J]. Journal of Pharmaceutical and Biomedical Analysis, 2007, 44(1): 137-143
[22] 孙斌, 章平, 瞿伟菁, 等. 沙棘籽渣黄酮类化合物诱导人肝癌细胞凋亡研究[J]. 中药材, 2003, 26(12): 875-877.
[23] LI Yuan, SONG Jiaqi, TIAN Ning, et al. Improving oral bioavailability of metformin hydrochloride using water-in-oil microemulsions and analysis of phase behavior after dilution[J]. International Journal of Pharmaceutics, 2014, 473(1/2): 316-325.
[24] 韩明, 曾庆孝, 肖更生, 等. 微乳层析分离鉴定青梅提取物中的黄酮类成分[J]. 华南理工大学学报: 自然科学版, 2005, 33(6): 85-88.
[25] 李宁, 侯璇珠, 杨雯, 等. 水包油型微乳液相色谱分离激素类药物的影响因素[J]. 色谱, 2009, 27(3): 323-327.
Isolation and Quantification of Flavonoids in Blueberry Leaves by Microemulsion Liquid Chromatography
ZHAO Dan
1, SU Ning
2, ZHENG Hongyan
2, YANG Li
2, HUO Tong
1, WANG Changtao
1,*
(1. School of Science, Beijing Technology and Business University, Beijing 100048, China;2. Chinese Academy of Inspection and Quarantine, Beijing 100123, China)
Abstract:Purpose: To optimize the procedure for isolating flavonoids from blueberry leaves by microemulsion liquid chromatography (MELC) and to quantify the flavonoids obtained under the optimum conditions. Methods: Four MELC conditions including surfactant, cosurfactant, pH of the mobile phase and organic phase were optimized. Results: The optimum chromatographic conditions were determined as follows: 2.5% Brij-35 act as the surfactant, 8% 1-butanol as the cosurfactant, the mobile phase adjusted to pH 3.2 with 0.5% acetic acid, and 0.8% ethyl acetate as the organic solvent. The flavonoids in blueberry leaves could be separated efficiently and quantified precisely in 20 minutes under the above conditions. Conclusions: The flavonoids in blueberry leaves included catechinic acid (9.76 mg/g), rutin (13.12 mg/g),kaempferol (31.04 mg/g), quercetin (26.42 mg/g), and myricetin (20.30 mg/g).
Key words:blueberry leaves; flavonoids; microemulsion liquid chromatography; isolation; quantification
中图分类号:R151.3
文献标志码:A
文章编号:1002-6630(2015)14-0091-05
doi:10.7506/spkx1002-6630-201514018
收稿日期:2014-11-03
基金项目:质检公益性行业科研专项(201310132;201410019)
作者简介:赵丹(1988—),女,助理实验师,硕士,研究方向为生物技术。E-mail:zhaodanustb@126.com
*通信作者:王昌涛(1975—),男,教授,博士,研究方向为植物功效成分开发应用。E-mail:wangct@th.btbu.edu.cn