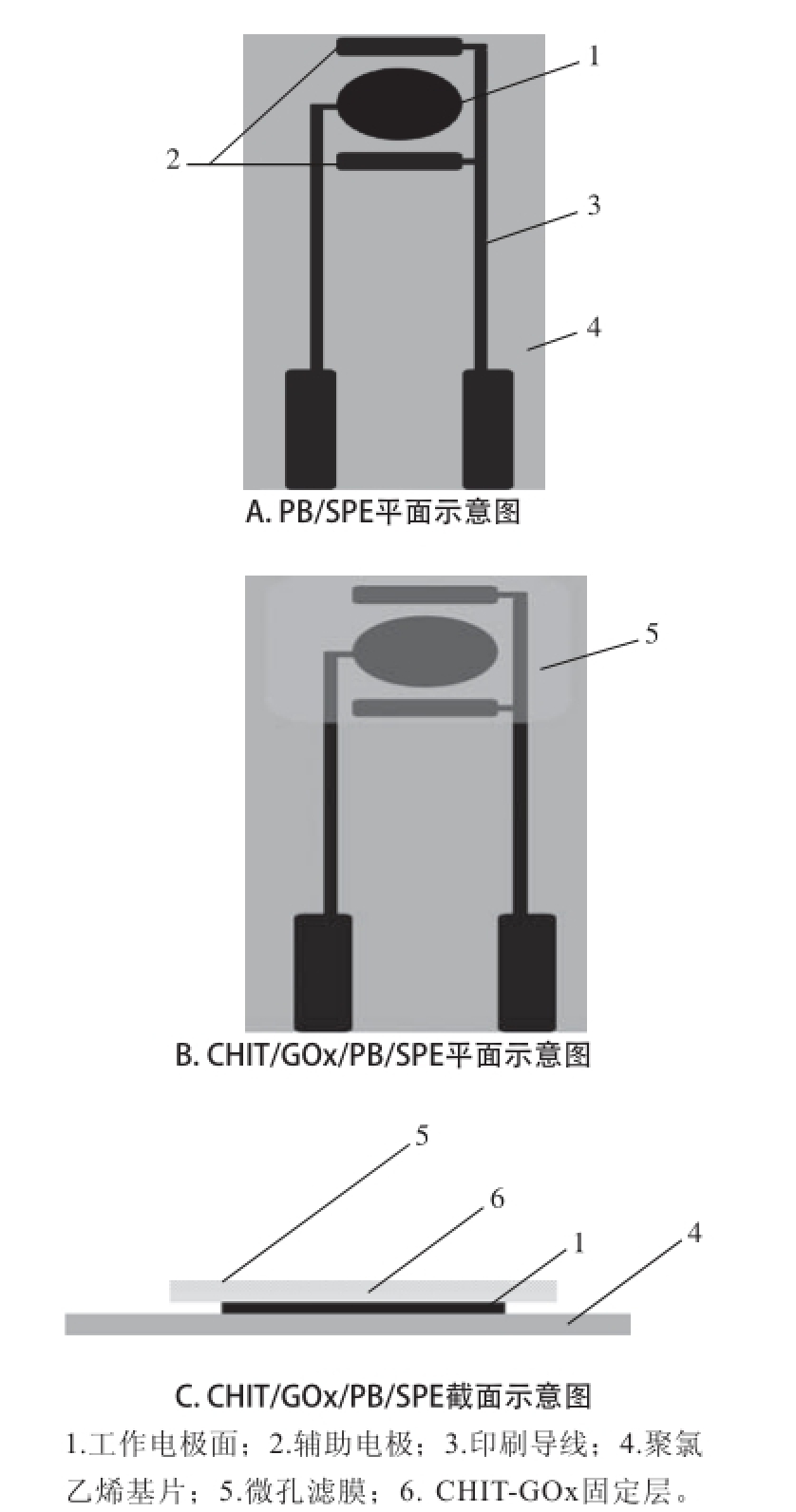
图1 CHIT/PB/SPE结构示意图
Fig.1 Schematics of the structure of CHIT/PB/SPE
綦翠华 1,李一苇 2,3,张晓伟 1
(1.济南大学酒店管理学院,山东 济南 250022;2.山东省科学院生物研究所,山东省 生物传感器重点实验室,山东 济南 250014;3.济南大学化学化工学院,山东 济南 250022)
摘 要:利用易于制备的水不溶性普鲁士蓝制备了介体掺入式丝网印刷电极,并以该电极作为电化学换能器制备葡萄糖氧化酶电极。电化学表征结果显示,酶电极对葡萄糖的电流响应特征良好,其线性范围为8.0 μmol/L~2.2 mmol/L,检测限达0.082 7 μmol/L(R SN=3),灵敏度为1.016 μA·L/mmol,响应时间5 s,其抗干扰性能、稳定性及重复性良好。实验还确定了该酶电极的最佳制备配方及工作条件。该电极制作简单、廉价,适用于成分复杂的果汁原浆的快速分析测试。
关键词:果汁原浆;葡萄糖;丝网印刷电极;工业应用
果汁原浆是指用新鲜的水果榨成果浆的果汁,其与新鲜水果本身的营养价值接近,是果汁工业的重要原料或半成品,可作为各种不同浓度果汁的基料。果汁原浆中的糖类含量是监控其品质及浓度的重要指标之一。其中,单一组分糖类物质的检测,对于果汁原浆类产品的营养分析及改善、加工过程及产品质量控制等具有重要意义。果汁原浆成分复杂,浓度高、黏度大,其单一成分的定量分析难度较大。目前,尚缺乏对果汁原浆单一糖分分析的相关国家标准。葡萄糖与其他重要糖类如果糖、蔗糖、乳糖及海藻糖等一同作为水果及果汁原浆中的主要糖类组分,在果汁类产品的分析、评价中具有特殊意义 [1]。迄今已发展出多种葡萄糖的检测方法,如光学法 [2-3]、色谱法 [4]、酶法 [5]等。这些方法虽然具备分析精度足够高、测试重复性良好和目标组分分辨能力强等优势,但这些方法往往需要昂贵的分析仪器或分析成本、仪器往往体积较大,且要求检测环境苛刻、需要专业人员的操作及较长的测定时间而较难大规模进入食品工业应用。此外,对于果汁原浆的检测,通常还存在需要样本前处理的问题。
葡萄糖氧化酶(glucose oxidase,GOx)电极具有灵敏度高、稳定性好的特点,且市场上已出现了用途多样的商品化GOx电极 [6]。GOx电极多是通过测定有氧条件下GOx对其底物葡萄糖进行生物催化氧化时所产生的H 2O 2实现的。目前,能够实现H 2O 2的低电位还原的技术方案有2 种,即过氧化物酶及铁氰化物修饰电极。相比过氧化物酶法,普鲁士蓝(Prussian blue,PB)灵敏度高 [7]、成本低廉、稳定性良好、检测电位低且能够有效避免双酶传感器电子传质速率低 [8]的缺陷。学界已有大量基于PB构建的酶传感器的研究报道,可应用于葡萄糖 [9-10]、氨基酸 [11]、有机酸 [12]、乙醇 [13]等食品组分的分析测定。PB可在极低的电位条件下 [11,14](0 mV附近)完成对H 2O 2的电催化,相比传统电极 [14]可以有效避免实际样品中多种物质的干扰。当前研究中,PB的合成主要有电化学沉积法及化学沉积法2 类 [15-16]。电化学沉积法需要沉积液现用现配、设备要求较高、操作复杂。此外,化学沉积法制得的PB在碱性环境中具备较高的稳定性 [7]。在化学沉积法的应用中,多数研究者使用水溶性PB [17-18]。该方法虽然易获得粒径更小、更为均质的PB粒子,但沉积周期长,合成后仍需要丙酮的诱导以加速沉降 [19]。以化学沉积法获得水不溶性PB,制备简易、廉价、便于批量制取,更适合在食品工业中应用。
壳聚糖(chitosan,CHIT)具有无毒、成膜性良好、分子易于进行修饰、在多数酶的工作环境中不溶等优点,已成为酶固定化的一种优良载体。CHIT具有良好的成膜特性 [20],在其成膜过程中,具有线性结构的CHIT分子可形成网状的空间结构。同时,CHIT可与碳纳米管、石墨烯、石墨等碳系材料良好融合。利用这些特性,可以将CHIT作为GOx的载体将之固定于电极表面制成酶电极。张彦等 [21]利用鸡蛋壳膜为载体固载GOx后,滴加CHIT固定后制成了葡萄糖生物传感器。其研究表明,CHIT固定化的GOx较戊二醛固定化的效果更为理想。避免使用具有一定毒性的戊二醛,将使固定化修饰后的GOx电极在食品行业中具有更大的推广价值。
本实验旨在介绍一种适合食品工业中果汁原浆葡萄糖含量的高效分析检测方法。该方法采用比合成方法更为简便的水不溶性PB构建对H 2O 2具有线性电化学响应的换能元件,并以CHIT制成GOx膜将其固定于电化学换能元件上构成酶电极,从而实现对待测样本中的葡萄糖含量的测定。结合特别适于大规模生产的丝网印刷技术 [22]用以PB修饰的电化学换能器的制备,为该方法的实用化提供技术方案。以消费量大、成分复杂且较具代表性的苹果汁原浆 [23]作为分析样本,对其性能进行了综合评价。实验证明,此电极的检测限低、灵敏度高、线性范围宽。同时,其所需响应时间极短,能够有效抵抗分析样本中其他单糖或双糖、有机酸、抗坏血酸、酚类等组分的干扰,且生产成本极低,完全能够满足食品工业中果汁原浆的分析测试要求,可作为开发食品工业质量检验仪器、便携式测试仪器等的核心部件。
1.1 材料与试剂
苹果汁原浆 莱州姜之源饮料食品有限公司。
GOx(E.C1.1.3.4,177 U/mg) 美国Sigma公司;葡萄糖 国药集团化学试剂有限公司;质量分数50%戊二醛溶液、CHIT(脱乙酰度≥95%,黏度>400 mPa·s)、铁氰化钾、六水合氯化铁 美国Aladdin试剂公司;JUJO CH-8型碳基导电油墨 日本十条公司;透析袋(截留分子质量8 000~14 000 D) 美国Spectrum公司;水系微孔滤膜(35 mm×0.15 μm)上海市新亚净化器件厂;其他试剂皆为分析纯。
1.2 仪器与设备
CHI760d型电化学工作站、Ag/AgCl(饱和KCl溶液)电极 上海辰华仪器有限公司;JB-2型磁力搅拌器、PHSJ-3F型酸度计 上海雷磁公司。
1.3 方法
1.3.1 化学沉积法制备PB
配制含有K 3Fe(CN) 6、盐酸及KCl各0.03 mol/L溶液50 mL,在快速搅拌条件下向其中逐滴加入含0.04 mol/L FeCl 3溶液50 mL,溶液随即变为深蓝色。以此比例制备的PB粒子不易在近中性溶液环境中溶解 [24],从而降低其作为介体材料在修饰电极上流失的可能。持续搅拌过夜后,将溶液转入透析袋内以蒸馏水不断透析至透析液透明无色、无法检出Cl -,且袋内PB完全沉降于袋底部为止(约2 d)。经此处理后,粒径过小的PB粒子得以去除,使制备的PB更加适于稳定性更佳的丝网印刷电极(screen-printed electrode,SPE)片的制作。倾去上层水液后置于烘箱内,95 ℃条件下将多余水分挥发干净,再于100 ℃条件下烘烤1 h,使PB粒子得到活化。将活化后的PB置于玛瑙研钵内研细,置于干燥器内待用。
1.3.2 PB修饰的SPE(PB/SPE)的制备
准确称取一定质量的PB粉末置于玛瑙研钵内,与一定质量的导电油墨及0.3 mL N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)充分混合并研磨成质地均一、无颗粒感的PB修饰印浆。
取厚度为0.5 mm聚氯乙烯基片,以1 mol/L NaOH溶液浸泡处理4 h后洗净晾干备用。手工制作网版,在聚氯乙烯基片上以未添加PB的导电油墨手工印制如图1A所示的双电极体系。溶剂挥发后以PB修饰的导电油墨印制工作电极部分,其工作电极部分为直径3 mm的圆形面。印刷完成后,置于90 ℃的烘箱内鼓风干燥2 h使有机溶剂充分挥发并使基底电极活化。除工作电极、对电极和电极接口外,在充分挥发溶剂后以硅酮胶印刷覆盖其余部分形成绝缘层,构成完整的PB/SPE。

图1 CHIT/PB/SPE结构示意图
Fig.1 Schematics of the structure of CHIT/PB/SPE
电极在使用前以蒸馏水清洗其工作面积后于室温条件下晾干待用,进行电化学表征时,电极片接口与专门制作的转接口连接后同电化学工作站连接。
1.3.3 GOx电极的制备
将1 g CHIT片状固体加入100 mL含0.1 mol/L冰乙酸溶液的蒸馏水中,加热至90 ℃至完全溶解,冷却至室温后以针头式过滤器过滤,得到质量分数1%稀溶液,贮存于4 ℃冰箱内待用。将150 μL质量分数1% CHIT溶液与200 μL 0.1 mol/L磷酸缓冲盐(pH 5.5)缓冲液均匀混合;准确称取2 mg GOx冻干粉末(约300~340 U),将其充分溶 解于CHIT混合液内,使其在室温条件下静置1 h。以移液器吸取15 μL GOx-CHIT混合溶胶,小心滴涂于切割至合适尺寸的微孔滤膜一侧表面,于室温条件下静置2 h使水分充分挥发制成酶膜。将酶膜固定有GOx的一侧小心贴附于PB/SPE片的工作电极面上,以新调配的环氧树脂作为黏合剂使酶膜边缘与电极片紧密黏合。室温条件下静置,待树脂固化后形成如图1B、1C中所示的GOx修饰的酶电极(CHIT/GOx/PB/SPE)。同时,以完全相同的方法制备不含GOx的修饰电极(CHIT/PB/ SPE)作为对照,以阐明酶电极的工作原理。进行电化学表征前,以蒸馏水充分冲洗电极表面,使未同酶膜紧密结合的成分被彻底清除。不使用时,将此电极于4 ℃条件下进行保存。
1.3.4 酶电极的电化学表征及实际样品测试
以手工印制的CHIT/GOx/PB/SPE双电极电极片作为工作电极和辅助电极,参比电极为Ag/AgCl电极,连接至电化学工作站的对应电极夹上。反应池为10 mL小烧杯。进行安培法表征时,以磁力搅拌器不断进行搅拌,反应温度为室温。
实验选用工厂生产的新鲜苹果汁原浆作为模式分析样本,以检验此电极测试实际样品的能力。苹果汁原浆样品在获得后迅速以CHIT/GOx/PB/SPE进行安培法检测,检测前样品不经过任何预处理步骤,直接稀释至所需浓度后完成检测。
2.1 检测条件优化
2.1.1 PB修饰量
按照本实验方法合成 的虽为水不溶性PB粒子,但PB本身仍为亲水性组分,在长期处于水溶液环境中依然可以从修饰电极上发生部分泄漏。此外,在较低电位条件下,PB存在式(1)反应:
其中,真正对H 2O 2起到电还原作用的物质为普鲁士白(Prussian white,PW) [25],PW为水溶性组分,在施加检测电位时易发生流失。PB修饰量过高,虽然电极的灵敏度有所提高,但所修饰的PB容易发生泄漏而导致检测信号不断减小,且易造成PB/SPE均一性降低。修饰量过低,电极的灵敏度及信号强度则明显降低。因此,合适的PB修饰量是PB/SPE性能的首要影响因素。
固定DMF的用量0.3 mL,分别将新制的0、10、20、30、40、50、60 mg PB粉末与相应质量的导电油墨混合成总质量为3 g,PB含量不同的PB/SPE,并按1.3.2节及1.3.3节所述方法制得相应的CHIT/PB/SPEs,在0.1 mol/L pH 6.0的PBS中通过循环伏安(cyclic voltammetry,CV)法进行表征,结果如图2所示。CV扫描结果显示,PB的掺入使得PB/SPE在约100 mV及约200 mV处出现一对对称性良好的氧化还原峰,该氧化还原峰的存在可以由式(1)的反应进行解释。随着PB在PB/SPE中含量的增加,电极的基底电流信号总体表现出增大趋势。但同时,峰电位差(ΔE)也有所增大,说明电极的可逆性随之略有降低;当PB含量大于50 mg时,电极可逆性锐减。因此,选择50 mg(即PB与导电油墨质量比为1∶59)为最佳PB添加量。
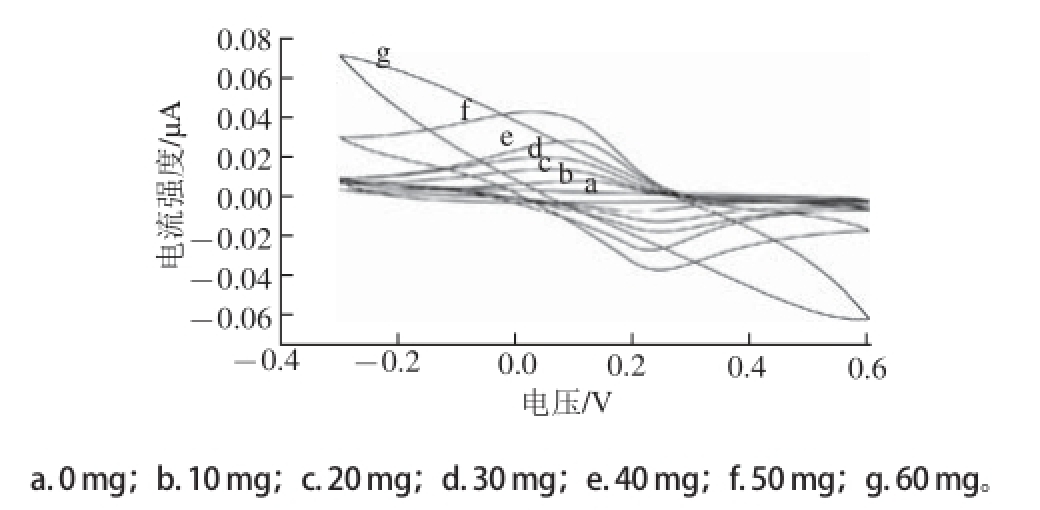
图2 不同PB含量CHIT/GOx/PB/SPEs在PBS中的循环伏安图
Fig.2 Cyclic voltammograms of CHIT/GOx/PB/SPEs with varying PB to paste ratios in 0.1 mol/L PBS at pH 6.0
取以此比例新制的CHIT/PB/SPE一支,以蒸馏水清洗其工作面后进行CV表征,结果如图3所示。由图3a可以看出,CHIT/PB/SPE在PBS中的CV响应中得到一对对称性良好的氧化还原峰,此为PB的特征氧化还原峰,可由式(1)的反应加以解释 [19]。当向反应液中加入葡萄糖后,响应曲线未出现变化;而当加入H 2O 2后,可以明显观察到还原峰电位处的响应电流值增大并伴随氧化峰电位处响应电流值的减小。该现象说明PB修饰的电极片对葡萄糖并无电化学响应,而H 2O 2则可在电极上被高效氧化,产生灵敏响应。
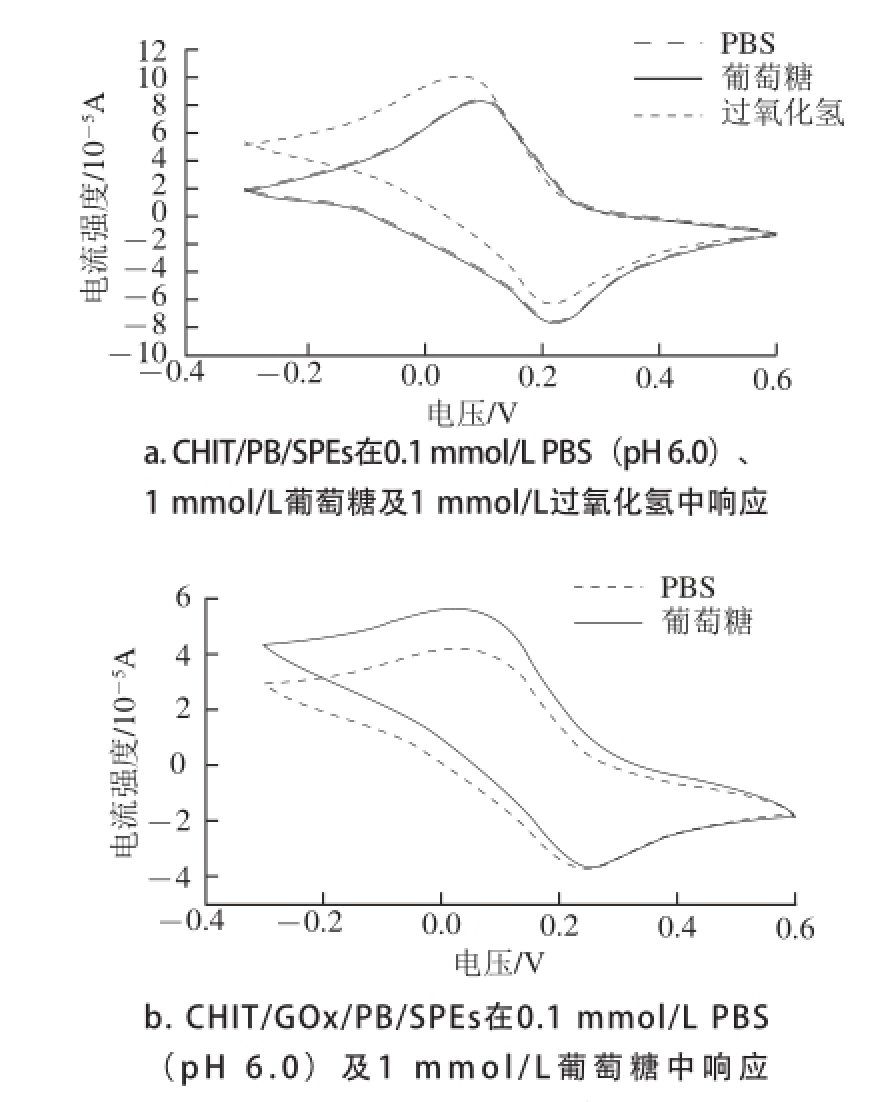
图3 循环伏安响应
Fig.3 Cyclic voltammograms
以相同方法制备CHIT/GOx/PB/SPE,CV表征结果见图3b。当缓冲体系内有葡萄糖存在时,其还原峰电流显著增大,而氧化峰电流略有减小。说明在酶的催化条件下,葡萄糖被氧化并产生一定浓度的H 2O 2,所产生的H 2O 2在PB的电催化条件下发生氧化反应。可利用此反应完成酶电极对其底物的定量检测。相比于CHIT/PB/SPE的响应结果,CHIT/GOx/PB/SPE的响应电流信号强度减小,这主要是由于在电极表面增加了酶膜部分,从而导致电极表面的电导率有所下降产生的。
2.1.2 检测电位
对于安培型电化学传感器而言,检测电位对分析结果是一个极其重要的影响因素。传感器的灵敏度和抗干扰性能等皆可因检测电位的不同而不同。根据上述实验结果,以PB对导电油墨的质量比为1∶59配制的修饰碳浆制作PB/SPE的电极片为基底电极制作CHIT/GOx/PB/ SPE,在含有葡萄糖及抗坏血酸各0.5 mmol/L的pH 6.0的PBS中,分别于-150、-100、-50、0、50、100 mV与150 mV电位(饱和Ag/AgCl电极)条件下进行安培检测,检测温度25 ℃。测量结果如图4所示,以相应的电流响应值作为衡量CHIT/GOx/PB/SPE对葡萄糖响应灵敏度及受氧化型干扰组分影响程度的依据。

图4 不同检测电位条件下的响应信号
Fig.4 Response signal intensity and interference of ascorbic acid recorded at varying detection potentials
在负电位区段,随检测电位的负向移动,酶电极对葡萄糖的电流响应信号强度增大,且由抗坏血酸产生的干扰信号强度明显减小;在-100 mV时,酶电极对待测底物的电流响应信号达到增高水平,而受到抗坏血酸的影响水平最低(约为相应葡萄糖响应值的0.6%)。当检测电位大于0 V时,酶电极对葡萄糖的电流响应强度降低而受到抗坏血酸干扰的程度明显增高。因此,综合考虑各指标性能,确定酶电极的最佳检测电位为-100 mV。
2.1.3 pH值
GOx是目前所应用的酶制剂中稳定性较理想的一种,其纯酶制剂在pH值3.5~6.5的范围内稳定性较好,最适pH值为5.0 [26]。在经历固定化操作后,酶的化学动力学参数及其最适催化条件会有所改变,寻找固定化后酶电极的最适pH值对增强其测试性能、延长其稳定期限等有重要意义。
通过向0.1 mol/L PBS中滴加不等量的0.5 mol/L NaOH溶液配制得pH值5.0~8.0的梯度溶液,用于实验操作。分别测定CHIT/GOx/PB/SPE于不同pH值条件下的电流-时间响应,如图5所示。pH值小于6.5时,响应电流强度随pH值的增加而增大,至pH 6.5时达到最大值。当pH值水平高于中性条件后,电流响应强度下降。同时,考虑到在偏碱性pH值条件下,GOx及PB的稳定性均有所下降等因素,确定pH 6.0作为CHIT/GOx/PB/ SPE的最佳工作pH值。

图5 pH值对CHIT/GOx/PB/SPE电流响应强度的影响
Fig.5 Effect of pH on the current response intensity of CHIT/GOx/PB/SPE
2.2 葡萄糖在CHIT/GOx/PB/SPE上的安培型响应及其校正曲线的建立
为阐明CHIT/GOx/PB/SPE对葡萄糖的电流响应信号强度与所测定的葡萄糖浓度之间的关系,该实验通过安培法研究CHIT/GOx/PB/SPE在最佳工作条件下对葡萄糖的电流响应特征,结果见图6。

图6 CHIT/GOx/PB/SPE在0.1 mol/L PBS(pH 6.0)中连续加入0.04 mmol/L 葡萄糖的安培响应图
Fig.6 Chronoamperometric responses of CHIT/GOx/PB/SPE in 0.1 mol/L PBS (pH 6.0) with successive addition of 0.04 mmol/L glucose
葡萄糖的加入使电流信号快速增大,经历约8 s后电流响应达到其稳定响应值的95%。随着底物葡萄糖浓度的增加,电流强度也随之有规律地增大。通过对更大浓度范围葡萄糖的测定分析,计算得校正曲线为:i/μA = 1.016 C/(mmol/L)+0.0911(R=0.999 4)。该酶电极对在8.0 μmol/L~2.2 mmol/L范围内的葡萄糖具有线性响应,其灵敏度为1.016 μA·L/mmol。根据信噪比等于3的原则,该酶电极的检测限为0.082 7 μmol/L(R SN=3)。
2.3 抗干扰性测试
果汁原浆中的成分比较复杂,除单糖、双糖外,氨基酸、抗坏血酸、有机酸、酚类等成分的存在,都可能对酶电极的葡萄糖定量测试结果产生干扰 [27]。本实验选择了果糖、麦芽糖、蔗糖、柠檬酸、苹果酸、草酸、抗坏血酸、甘氨酸、天冬氨酸、丁香酸10 种物质作为酶电极抗干扰性能评价的模式干扰物质。在最佳工作条件下,记CHIT/GOx/PB/SPE于含1 mmol/L葡萄糖的缓冲体系中的响应值为100%,分别测定向缓冲体系内添加与葡萄糖等浓度的10 种物质,记录其各自响应信号的变化。测试结果见表1。
表1 干扰组分测试结果
Table1 Results obtained in the presence of different interfering components
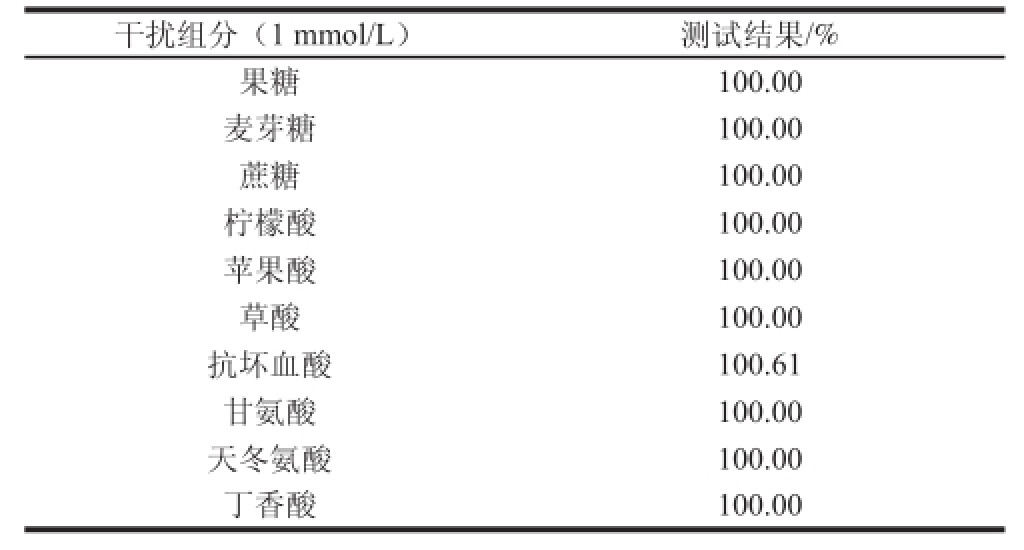
干扰组分(1 mmol/L)测试结果/%果糖 100.00麦芽糖 100.00蔗糖 100.00柠檬酸 100.00苹果酸 100.00草酸 100.00抗坏血酸 100.61甘氨酸 100.00天冬氨酸 100.00丁香酸 100.00
测定结果显示,酶电极对多种苹果汁原浆内所含的干扰组分皆表现出理想的抗干扰性能。其中,抗坏血酸所造成的干扰最明显,但依然处于不足正常响应信号强度1%的水平,说明此酶电极具备良好的抗干扰性能,适合于在不经历样本预处理条件下的果汁原浆实际样本检测。
2.4 实际样品测试及回收率实验
由于果汁原浆单糖含量较高且黏度大,分析前需进行适当稀释。准确量取5 mL果汁原浆,以0.1 mol/L的PBS(pH 6.0)稀释定容至50 mL,再以同样方法继续稀释定容一次,得到1/100的梯度稀释溶液。准确量取50 μL该稀释液,注入含4.95 mL 0.1 mol/L的PBS(pH 6.0)的反应池内完成安培检测,检测时以磁力搅拌器匀速搅拌。共完成5次平行测定,测得稀释样品中的葡萄糖含量的平均值为0.181 5 mmol/L。并进行5 次加标回收率实验,结果记录于表2。
表2 实际样品及回收率测试
Table2 Spiked recoveries in real sample
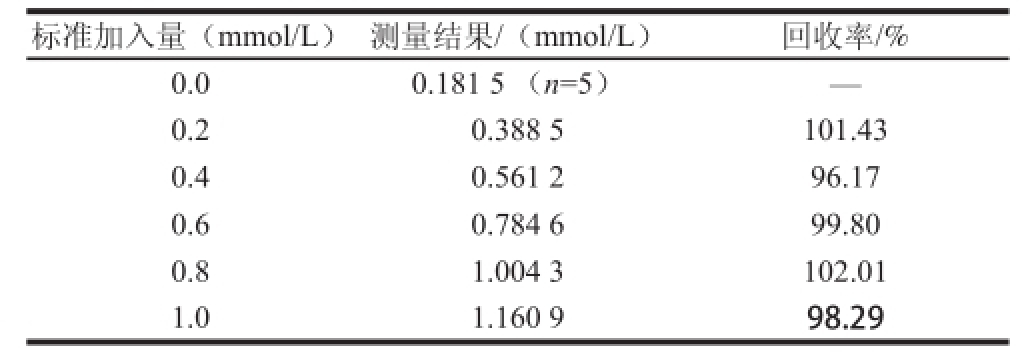
注:—.参数于此处无意义,即此处未记录该参数。
标准加入量(mmol/L)测量结果/(mmol/L)回收率/% 0.00.181 5 (n=5)—0.20.388 5101.43 0.40.561 296.17 0.60.784 699.80 0.81.004 3102.01 1.01.160 998.29
实验测得回收率在96.17%~102.01%,表明酶电极对于果汁原浆实际样品的检测性能与被分析组分的标准物质具有相同的响应特征。该酶电极适用于果汁原浆的实际检测。
2.5 电极重复性及稳定性测试

图7 酶电极重复性测试结果
Fig.7 Repeatability of the enzymatic electrode
表3 酶电极稳定性测试结果
Table3 Stability of the enzymacti electrode
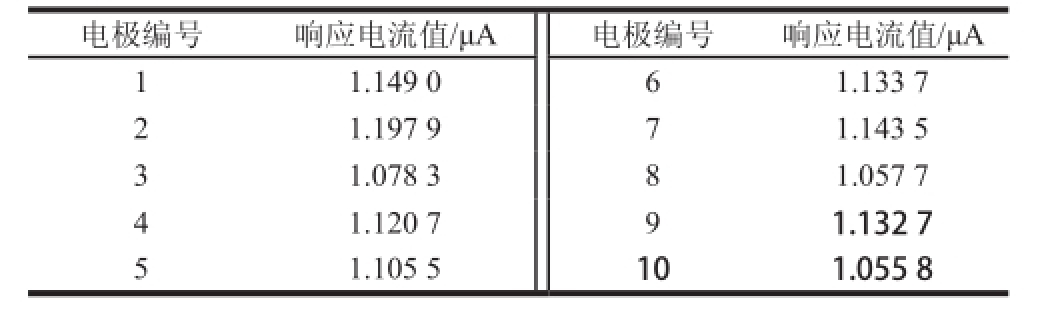
电极编号响应电流值/μA电极编号响应电流值/μA 1 1.149 061.133 7 2 1.197 971.143 5 3 1.078 381.057 7 4 1.120 791.132 7 5 1.105 5101.055 8
表4 酶电极重复性测试结果
Table4 Reproducibility of the enzymatic electrode

测定次数响应电流值/μA测定次数响应电流值/μA 1 1.102 9 61.056 7 2 1.120 471.087 5 3 1.114 881.004 1 4 1.071 291.030 7 5 1.062 9101.014 3
在最优检测条件下,以安培法对含有1 mmol/L葡萄糖标准试样的PBS缓冲体系独立进行30次电化学检测。每次测定时令酶电极在无底物的PBS中首先进行100 s扫描,以使电极充分极化、稳定。随后立刻向缓冲体系中注入固定浓度与体积的底物,读取注入底物5 s后的电流响应值作为底物定量结果。30 次重复测试的结果,平均响应电流强度为1.137 μA,相对标准偏差为1.57%,结果见图7。酶电极在不使用时,贮存于4 ℃冰箱中。每隔3 d对同一支电极进行一次检测,30 d后,响应电流强度下降为初始值的91.6%,说明酶电极的稳定性良好(结果见表3)。另外,为测试电极的重复性,以相同方法制作10 支酶电极,分别记录其对含有1 mmol/L葡萄糖标准试样的PBS缓冲体系的电流响应值。计算得10 次独立测定结果的平均响应电流强度为1.087 μA,相对标准偏差为4.43%,表明CHIT/GOx/PB/S PE具有较理想的重复性,结果见表4。
本研究通过实验确定CHIT/GOx/PB/SPE的最佳制作方法及工作条件为:按照PB与导电油墨的质量比为1∶59调制PB修饰的丝网印刷导电油墨用于酶电极制作;在0.1 mol/L的PBS(pH 6.0)中,以-100 mV(Ag/AgCl)作为检测电位。通过电化学表征,证明CHIT/GOx/PB/ SPE对葡萄糖具有良好的电流响应特征。该酶电极对8.0 μmol/L~2.2 mmol/L范围内的葡萄糖的电流响应呈线性关系,检测限达0.082 7 μmol/L(R SN=3),灵敏度为1.016 μA·L/mmol。同时,该电极对果汁原浆实际样品表现出理想的响应特征,且几乎不受分析样本中复杂成分的干扰,分析测定前无需对样本进行预处理,适合作为适用于食品工业分析检测的一次性或重复使用的葡萄糖电化学分析仪器核心部件。
参考文献:
[1] 胡明方. 食品分析[M]. 重庆: 西南师范大学出版社, 1993: 56-62.
[2] 鲁争. 折光法测定葡萄糖注射液的含量[J]. 中国医疗前沿, 2007,2(8): 76-77.
[3] 席永清, 邱海鸥, 杨明, 等. 血红蛋白模拟酶催化荧光法测定葡萄糖[J].分析化学, 2008, 36(10): 1343-1348.
[4] 葛姗姗, 施思, 郭鑫艳, 等. HPLC-ELSD法测定红腺忍冬叶抗氧化有效部位中果糖和葡萄糖的含量[J]. 中华中医药学刊, 2014, 32(4):882-885.
[5] 费维伦, 梁春阳. 3 种血清葡萄糖测定方法的比较[J]. 检验医学与临床, 2012, 9(20): 2573-2574.
[6] 高学金, 刘广生, 程丽, 等. 发酵过程葡萄糖在线检测系统的研制[J].分析化学, 2012, 40(12): 1945-1949.
[7] 卢惠婷, 陈昌国, 董海峰. 普鲁士蓝修饰生物传感器的研究进展[J].理化检验: 化学分册, 2010, 46(4): 460-464.
[8] BANERJEE S, SARKAR P, TURNER A P F. Amperometric biosensor based on Prussian Blue nanoparticle-modifi ed screen-printed electrode for estimation of glucose-6-phosphate[J]. Analytical Biochemistry,2013, 4392: 194-200.
[9] FU Guanglei, YUE Xiuli, DAI Zhifei. Glucose biosensor based on covalent immobilization of enzyme in sol-gel composite film combined with Prussian blue/carbon nanotubes hybrid[J]. Biosensors and Bioelectronics, 2011, 26(9): 3973-3976.
[10] 王贝贝, 籍雪平, 李献锐, 等. 基于纳米复合材料/壳聚糖膜的葡萄糖生物传感器研究[J]. 分析试验室, 2013, 32(6): 20-23.
[11] LIU Lifang, SHI Lei, CHU Zhenyu, et al. Prussian blue nanocubes modified graphite electrodes for the electrochemical detection of various analytes with high performance[J]. Sensors and Actuators B:Chemical, 2014, 202: 820-826.
[12] HIRST N A, HAZELWOOD L D, JAYNE D G, et al. An amperometric lactate biosensor using H 2O 2reduction via a Prussian Blue impregnated poly (ethyleneimine) surface on screen printed carbon electrodes to detect anastomotic leak and sepsis[J]. Sensors and Actuat ors B:Chemical, 2013, 186: 674-680.
[13] RAMA E C, BISCAY J, GONZALEZ G M B, et al. Comparative study of different alcohol sensors based on screen-printed carbon elec trodes[J]. Analytica Chimica Acta, 2012, 728: 69-76.
[14] RICCI F, PALLESCHI G. Sensor and biosensor preparation,optimisation and applications of Prussian Blue modifi ed electrodes[J]. Biosensors and Bioelectronics, 2005, 21(3): 389-407.
[15] WANG Zonghua, SHI Guoyu, XIA Jianfei, et al. Facile preparation of a Pt/Prussian blue/graphene composite and its application as an enhanced catalyst for methanol oxidation[J]. Electrochimica Acta,2014, 121: 245-252.
[16] HUSMANN S, NOSSOL E, ZARBIN A J G, et al. Carbon nanotube/ Prussian blue paste electrodes: characterizationand study of key parameters for application as sensors fordetermination of low concentration of hydrogen peroxide[J]. Sensors and Actuators B:Chemical, 2014, 192: 782-790.
[17] ZHU Xiang, NIU Xiangheng, ZHA O Hongli, et al. Doping ionic liquid into Prussian blue-multiwalled carbon nanotubesmodifi ed screen-printed electrode to enhance the nonenzymatic H 2O 2sensing performance[J]. Sensors and Actuators B: Chemical, 2014, 195: 274-280.
[18] PIERMARINI S, VOLPE G, ESTI M, et al. Real time monitoring of alcoholic fermentation with low-cost amperometric biosensors[J]. Food Chemistry, 2011, 127(2): 749-754.
[19] PRAVDA M, O' HALLORAN M P, KREUZER M P, et al. Composite glucose biosensor electrode bulk modified with Prussian Blue and glucose oxidase[J]. Analytical Letters, 2002, 35(6): 959-970.
[20] WANG Beibei, JI Xueping, ZHAO Haiyan, et al. An amperometric be ta-glucan biosensor based on the immobilization of bi-enzyme on Prussian b lue-chitosan and gold nanoparticles-chitosan nanocomposite fi lms[J]. Biosensors & Bioelectronics, 2014, 55: 113-119.
[21] 张彦, 南彩凤, 冯丽, 等. 壳聚糖固定化葡萄糖氧化酶生物传感器测定葡萄糖的含量[J]. 分析化学, 2009, 37(7): 1049-1052.
[22] 周建红, 令玉林, 司士辉. 丝网印刷电极在食品检测中的应用研究进展[J]. 食品工业科技, 2012, 33(1): 388-390.
[23] 贺蕾. 中国苹果汁市场需求研究: 基于国际与国内市场需求比较视角分析[D]. 杨凌: 西北农林科技大学, 2011: 1.
[24] 温建辉, 董光华, 寇海啸. 普鲁士蓝(Ⅱ)水溶液的稳定性研究[J]. 晋中学院学报, 2005, 22(6): 4-6.
[25] SALAZAR P, MARTINA M, ROCHE R. Microbiosensors for glucose based on Prussian Blue modifi ed carbon fi ber electrodes for in vivo monitoring in the central nervous system[J]. Biosensors and Bioelectronics, 2010, 26: 748-753.
[26] 刘超, 袁建国, 王元秀, 等. 葡萄糖氧化酶的研究进展[J]. 食品与药品, 2010, 12(7): 285-289.
[27] 付兴隆. HPLC在浓缩果汁及加工用助剂相关成分测定中的研究[D].西安: 西安理工大学, 2010: 2.
Development of Enzymatic Electrode for the Detection of Glucose in Not-From-Concentrate (NFC) Fruit Juices
QI Cuihua
1, LI Yiwei
2,3, ZHANG Xiaowei
1
(1. School of Hotel Management, University of Jinan, Jinan 250022, China; 2. Key Biosensor Laboratory of Shandong Province,Biology Institute of Shandong Academy of Sciences, Jinan 250014, China;3. School of Chemistry and Chemical Engineering, University of Jinan, Jinan 250022, China)
Abstract:A glucose oxidase (GOx) electrode fabricated on the basis of an electron mediator b ulk-modifi ed screen-printed electrode as an electrochemical transducer made from water-insoluble prussian blue (PB), which was easy to prepare, was reported in this study. Electrochemical characterizations revealed that the enzyme electrode exhibited robust current response properties. It possessed a linearity toward glucose within the range of 8.0 μmol/L-2.2 mmol/L. Its limit of detection (LOD)was 0.082 7 μmol/L (R SN= 3), sensitivity was 1.016 μA·L/mmol, response time was 5 s and it showed satisfactory antiinterference capability, stability and reproducibility. The formulation and working conditions of the electrode were also optimized. This electrode is easy to prepare, economic and applicable for the rapid assay of glucose in not-from-concentrate(NFC) fruit juices.
Key words:not-from-concentrate (NFC) fruit juices; glucose; screen-printed electrode; industrial application
中图分类号:TS3
文献标志码:A
文章编号:1002-6630(2015)14-0111-07
doi:10.7506/spkx1002-6630-201514022
收稿日期:2014-09-09
基金项目:山东省自然科学基金项目(ZR2014BP015);国家自然科学基金面上项目(21375047)
作者简介:綦翠华(1965—),女,副教授,硕士,研究方向为食品营养与检测。E-mail:st_qich@ujn.edu.cn