原江锋 1,邱智军 1,呼丽君 2,刘 贺 1,高耀辉 1
(1.河南科技大学食品与生物工程学院,河南 洛阳 471003;2.山西文水县重点项目发展管理办公室,山西 吕梁 032100)
摘 要:采用高效液相色谱方法对河南连翘花提取物中芦丁、金丝桃苷、连翘酯苷A、连翘苷、齐墩果酸、熊果酸含量进行分析,并对连翘花提取物稳定性进行研究。结果表明:连翘花提取物中含有较高含量的芦丁、金丝桃苷、连翘苷、齐墩果酸和熊果酸;在中性和弱酸性环境中连翘花提取物具有较强的稳定性;在25~75 ℃范围内,温度对连翘花提取物影响较小;室光和避光对连翘花提取物的影响小于自然光;金属离子K +、Na +、Ca 2+对连翘花提取物的吸光度影响较小,Mg 2+、Fe 3+有增强连翘花提取物吸光度作用;氧化剂、还原剂、蔗糖、食盐和淀粉对连翘花提取物稳定性影响较小。本实验为综合利用连翘花提取物资源提供有用信息。
关键词:连翘花提取物;活性成分;稳定性
连翘(Forsythia suspensa (Thunb.) Vahl)为木犀科(Oleacaae)落叶灌木 [1],主产于山西、河南、陕西、山东等地 [2-4]。近年来,有关连翘果实和连翘叶有效成分和药理作用研究较多,研究结果表明,连翘果实和连翘叶具有十分相似的化合物,含有苯乙醇苷类、木脂素类、黄酮类、三萜类等化学成分,连翘果实和连翘叶具有降血糖、保肝、抗氧化、抗疲劳、抗肿瘤等作用 [5-12]。连翘花于每年3—4月份开花,花期长、花量大,花色鲜黄且长久不褪,是一种来源丰富的资源,但对连翘花的研究很少。根据王金亭 [13]、盛锋 [14]和王玲丽 [15]等报道,对连翘花提取物进行微波提取和超声提取工艺进行了优化,并对其进行抗氧化、对光和热的稳定性进行研究。本实验为进一步了解连翘花提取物,分析了提取物中主要活性成分,并对连翘花提取物的稳定性进行研究,为其开拓应用市场提供理论依据。
1.1 材料与试剂
连翘花,2013年4月采自河南豫西伏牛山地区连翘种植基地,经河南科技大学农学院候小改教授鉴定为木犀科植物连翘的花。
甲醇、乙腈(均为色谱纯) 美国Fisher公司;芦丁(批号:100080-200707,纯度>92.5%)、金丝桃苷(批号:111521-201205,纯度>93.3%)、连翘酯苷A(批号:111810-201405,纯度>91.4%)、连翘苷(批号:110821-201213,纯度>95.3%)、齐墩果酸(批号:110709-201206,纯度>94.9%)、熊果酸(批号:110742-201220,纯度>99.3%) 中国食品药品检定研究院;其他试剂均为分析纯。
1.2 仪器与设备
1260高效液相色谱仪 美国安捷伦公司;BS 124S型万分之一天平 赛多利斯科学仪器有限公司;KQ-500DE型数控超声波清洗器 昆山市超声仪器有限公司;721可见分光光度计 上海精密科学仪器有限公司;UV2400紫外-可见分光光度计 上海舜宇恒平科学仪器有限公司。
1.3 方法
1.3.1 色谱条件及检测方法
色谱柱:Agilent Zorbax SB-C 18(4.6mm×250 mm,5 μm);芦丁、金丝桃苷、连翘酯苷A、连翘苷以乙腈-0.2%磷酸为流动相进行等度洗脱,洗脱程序:体积分数5%乙腈溶液;流速1.0 mL/min;检测波长275 nm;柱温30 ℃。
齐墩果酸、熊果酸以甲醇-1%磷酸溶液为流动相进行等度洗脱,洗脱程序:体积分数85%甲醇溶液;流速0.8 mL/min;检测波长210 nm。
1.3.2 混合对照品溶液的制备
精密称取50 ℃减压干燥至恒质量的芦丁、金丝桃苷、连翘酯苷A和连翘苷对照品分别为2.1、2.0、1.2、3.4 mg,用甲醇溶解后定容于5 mL容量瓶中,用0.45 μm微孔滤膜过滤,即得芦丁、金丝桃苷、连翘酯苷A和连翘苷质量浓度分别为0.42、0.40、0.24、0.68 mg/mL的混合对照品溶液Ⅰ;精密称取50 ℃定容至减压干燥至恒质量的齐墩果酸和熊果酸对照品分别为4.7、5.2 mg,用甲醇溶解后定容于5 mL容量瓶中,用0.45 μm微孔滤膜过滤,即得齐墩果酸和熊果酸质量浓度分别为0.94、1.04 mg/mL的混合对照品溶液Ⅱ。
1.3.3 连翘花提取物溶液的制备
分别取自然晾干后的连翘花,粉碎,精密称取1.2 g置于锥形瓶中,精密加入体积分数95%乙醇溶液10 mL,超声处理(250 W、40 kHz)30 min,用体积分数95%乙醇溶液补足失质量,滤过;残渣再加入10 mL体积分数95%乙醇溶液,再次超声30 min,用体积分数95%乙醇溶液补足失质量,滤过,合并滤液,经0.45 μm滤膜滤过,滤液作为测定活性化合物供试品溶液,避光保存。
1.3.4 连翘花提取物稳定性
1.3.4.1 样品溶液的制备
分别取自然晾干后的连翘花,粉碎,精密称取60 g置于锥形瓶中,精密加入体积分数95%乙醇溶液500 mL,超声处理(250 W、40 kHz)30 min,滤过;残渣再加入500 mL体积分数95%乙醇溶液,再次超声30 min,滤过,合并滤液,浓缩后冷冻干燥,得连翘花提取物。
1.3.4.2 连翘花提取物的紫外-可见光谱测定
参照文献[16],将连翘花提取物配成质量分数0.05%溶液,在紫外-可见分光光度计上进行波长300~700 nm扫描,以确定吸收波长。
1.3.4.3 温度对提取物稳定性的影响
取0.005 g/mL提取物溶液各10.0 mL于试管中,于25、50、75、100 ℃的水浴中加热1 h,取出,冷却至室温,测定吸光度。提取物保存率按下式计算。
式中:A 末为溶液处理后的吸光度;A 初为溶液处理前的吸光度。
1.3.4.4 pH值对提取物稳定性的影响
分别取0.005 g/mL色素溶液,用0.1 mol/L盐酸溶液和0.1 mol/L NaOH溶液调节pH值,使其在10 mL容量瓶定容到刻度后的pH值分别为2、4、6、8、10、12。放置1 h后,测定吸光度。
1.3.4.5 光对提取物稳定性的影响
取0.005 g/mL色素溶液分别在阳光、室内自然光、避光条件下,照射一定时间,定时取样,定期测定吸光度。
1.3.4.6 金属离子对提取物稳定性的影响
配制浓度为1 mol/L的K +、Na +、Ca 2+、Mg 2+、Fe 3+溶液,取0.005 g/mL提取物溶液2.0 mL,分别于2.0 mL上述金属离子溶液中,摇匀,放置1 h,测定吸光度。
1.3.4.7 氧化剂对色素稳定的影响
将H 2O 2配制成质量分数0%、0.6%、1.2%、1.8%、2.4%溶液,取0.01 g/mL提取物溶液2.0 mL分别于上述不同质量分数的2.0 mL H 2O 2溶液中摇匀,放置1 h,测定吸光度。
1.3.4.8 还原剂对色素稳定的影响
配制成质量分数0%、0.02%、0.04%、0.06%、0.08%、0.1%的VC溶液,取0.01 g/mL提取物溶液2.5 mL分别于2.5 mL上述不同质量分数的VC溶液中摇匀,在不同时间测定吸光度。
1.3.4.9 常见食品添加物对提取物稳定性的影响
在2.0 mL 0.01 g/mL连翘花提取物溶液中分别添加质量分数1.0%蔗糖溶液、质量分数1.0%食盐溶液、质量分数1.0%淀粉溶液2.0 mL,每隔1 d测定其吸光度。
2.1 连翘花提取物活性成分分析
分别将配好的混合对照品溶液Ⅰ和Ⅱ按照一定比例分别稀释成6 个系列质量浓度,分别采用高效液相色谱(high performance liquid chromatography,HPLC)法测定峰面积。以对照品溶液的质量浓度为横坐标,峰面积为纵坐标进行回归,绘制标准曲线,计算各自的回归方程和线性范围,结果见表1,对照品与样品的色谱图见图1、2。
表1 6个化合物的线性回归方程及线性范围( n=3)
Table1 Linear regression equations with linear ranges for 6 compounds (n= 3)

化合物线性回归方程相关系数线性范围/μg芦丁Y=1 301.2X-3.4880.999 90.084~4.200金丝桃苷Y=1 364.8X+13.5250.999 80.080~4.000连翘酯苷AY=1 027.7X+29.2410.999 90.048~2.400连翘苷Y=645.82X+16.4510.999 70.136~6.860齐墩果酸Y=727.52X+30.8470.999 70.094~4.700熊果酸Y=511.57X+24.8620.999 50.104~5.200
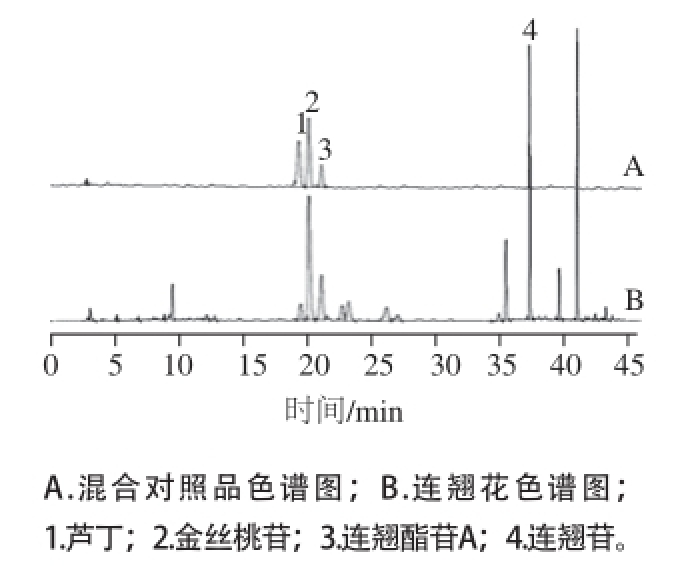
图1 HPLC色谱图
Fig.1 HPLC Chromatogram
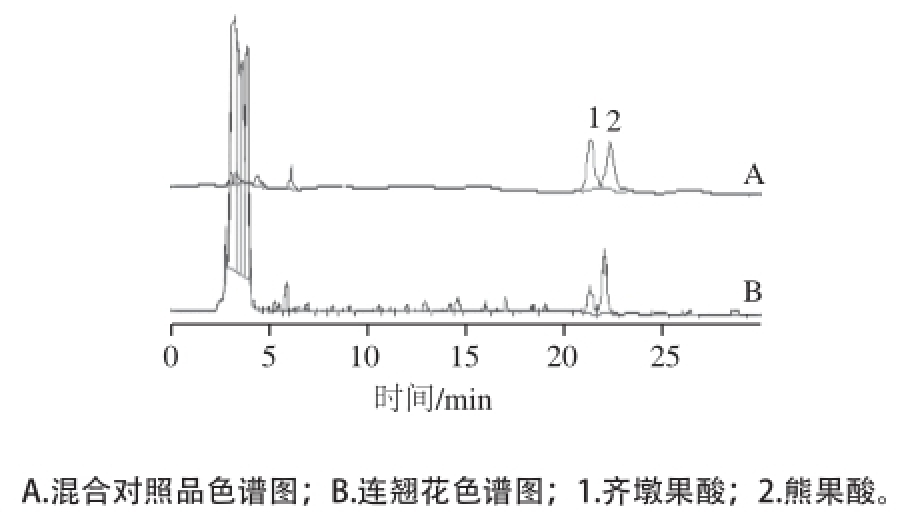
图2 HPLC色谱图
Fig.2 HPLC Chromatogram
按照1.3.1节方法,分别用外标法测得河南连翘花中芦丁、金丝桃苷、连翘酯苷A、连翘苷、齐墩果酸和熊果酸的含量,从表2可以看出,连翘花提取物含有较高含量的芦丁、金丝桃苷、连翘苷、齐墩果酸和熊果酸。根据已有文献报道,河南连翘花要高于连翘果实中的芦丁、金丝桃苷、连翘苷含量 [17];连翘花要高于金银花 [18]和辛塔花 [19]中芦丁和金丝桃苷的含量;连翘花中齐墩果酸和熊果酸含量与连翘 [20]中接近,连翘花中熊果酸含量要高于连翘果实 [21]中含量。根据结果说明,连翘花含有高含量的活性成分,连翘花提取物极具开发价值。
表2 连翘花中芦丁、金丝桃苷、连翘酯苷A、连翘苷、齐墩果酸和熊果酸的含量( n=3)
Table2 Contents of rutin, hyperin, forsythiaside A, phillyrin, oleanolic acid, and ursolic acid in Forsythia suspensa flowers ( n= 3)
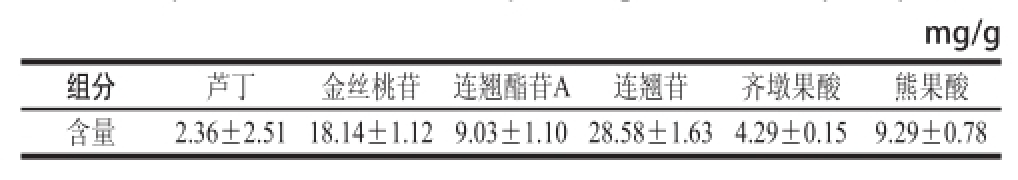
mg/g组分芦丁金丝桃苷连翘酯苷A连翘苷齐墩果酸熊果酸含量2.36±2.5118.14±1.129.03±1.1028.58±1.634.29±0.159.29±0.78
2.2 连翘花提取物吸收峰对应波长的确定

图3 连翘花提取物的吸收光谱
Fig.3 Absorption spectrum of Forsythia suspensa flower extract
由图3可知,连翘花提取物溶液扫描后,在波长300~700 nm范围内有明显吸收,其最佳检测波长为442 nm,因此,实验时选用此最大吸收波长来测定吸光度。此波长也与文献[14]报道的连翘花黄色素最大吸收波长相一致,说明该连翘花提取物含有浓度较高的连翘花黄色素化合物,因此本实验对连翘花提取物的稳定性研究也为对连翘花黄色素的研究和开发提供一定的理论基础和依据。
2.3 温度对连翘花提取物稳定性的影响
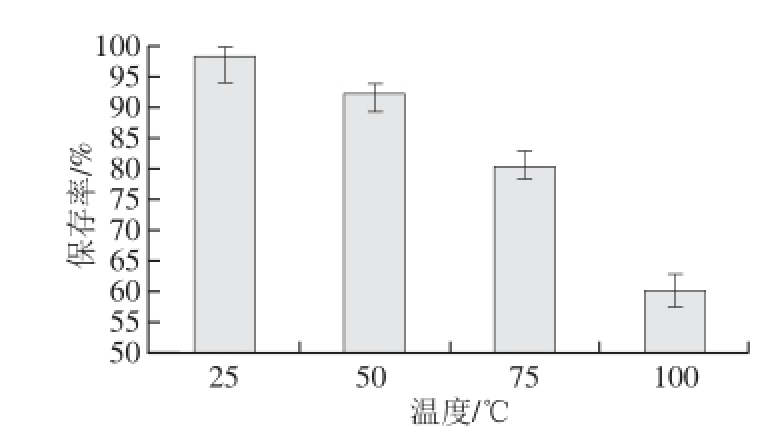
图4 温度对连翘花提取物稳定性影响(n==33)
Fig.4 Impact of temperature on the stability of Forsythia suspensa flower extract (n=3)
由图4可知,随温度升高,连翘花提取物吸光度呈下降趋势,说明温度对连翘花提取物有一定的影响。但总体来说,连翘花提取物在25~75 ℃范围内处理1 h提取物的稳定性变化较小,表明连翘花提取物相对比较稳定,色泽与对照相比无明显差别,连翘花提取物不易产生热变性,具备在食品中的使用要求;但是高温长时间处理会影响提取物的稳定性,这可能与化合物在高温处理的条件下提取物中所含化合物结构发生变化有关。这一热稳定性的特点提示:连翘花提取物即使添加于需进行短时间加热处理的食品中,也可稳定保持其提取物性能,可作为热加工食品中的添加剂。
2.4 pH值对提取物稳定性的影响
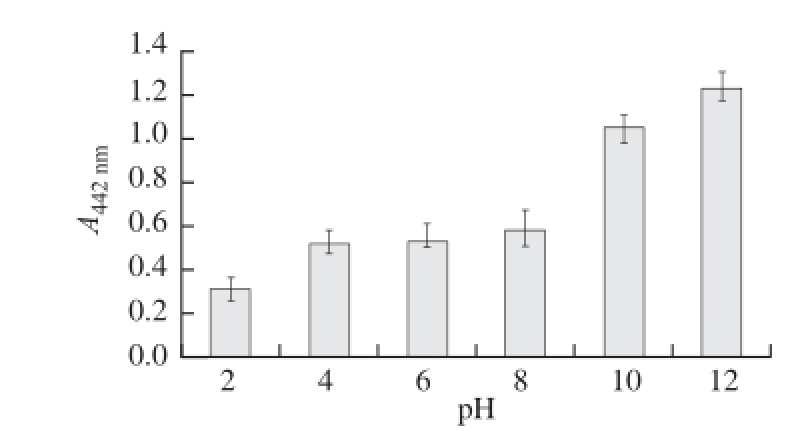
图5 pH值对连翘花提取物稳定性的影响(n==33)
Fig.5 Effect of pH value on the stability of Forsythia suspensa flower extract (n=3)
由图5可见,随着溶液酸度的增加,提取物在可见光内的吸收峰逐渐减弱。外观上,其黄色也逐渐消退,说明在酸性介质中该色素的稳定性较差。稀碱介质对色素稳定性影响很小,但随着碱性的增强,色素在可见光区内的吸光度明显增大,这一结果表明,碱性介质对色素有一定的增色作用。可能原因是,pH值升高或降低,改变了连翘花提取物中活性成分的结构,而在中性和弱酸的环境中连翘花提取物中活性成分的结构较稳定。这一特点提示,连翘花提取物在中性和弱酸性环境中活性较强。
2.5 光照条件对连翘花提取物稳定性的影响

图6 不同光照条件对连翘花提取物稳定性的影响(n==33)
Fig.6 Comparative stability of Forsythia suspensa flower extract under different illumination conditions (n=3)
由图6可见,室温条件下1 d内连翘花提取物在自然光、室光和避光条件均较稳定;2 d后随着时间的延长连翘花提取物的吸光度下降,但避光条件下基本稳定,而室外自然光对连翘花提取物吸光度影响较大,说明日光照射对连翘花提取物降解有很强的促进作用,光线会诱使带有生物活性的天然色素分解或氧化而褪色。
2.6 金属离子对提取物稳定性的影响
由图7可以看出,经K +、Na +、Ca 2+处理后,连翘花提取物吸光度基本没变,但与未处理组相比,吸光度略有下降。而经Mg 2+、Fe 3+离子处理后,对连翘花提取物吸光度的影响略有增加,说明这几种离子对连翘花提取物有保护作用。这一特点提示:连翘花提取物作为食品添加剂可以应用在含有钠、钾、钙、镁和铁等金属离子较丰富的食品中。
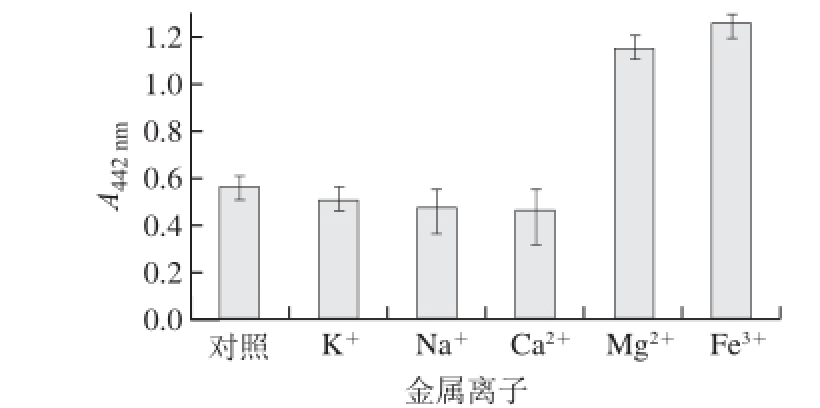
图7 金属离子对连翘花提取物稳定性的影响(n==33)
Fig.7 Effect of metal ions on the stability of Forsythia suspensa flower extract (n=3)
2.7 氧化剂对提取物稳定性的影响
表3 氧化剂H 对连翘花提取物稳定性的影响( n=3)
Table3 Effect of H on the stability of Forsythia suspensa flower extract (n = 3)
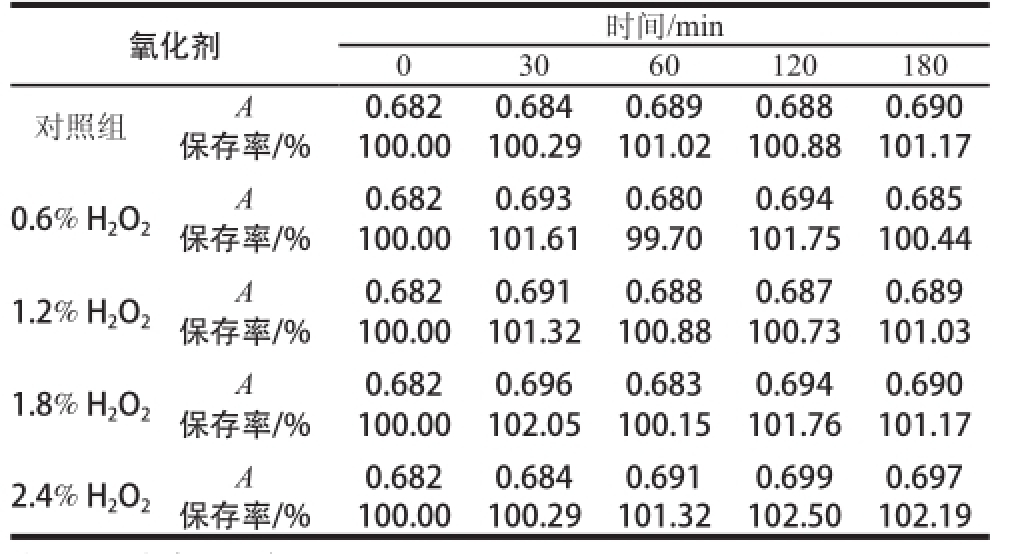
注:A.吸光度。下表同。
氧化剂时间/min 0 30 60 120 180对照组A0.6820.6840.6890.6880.690保存率/%100.00100.29101.02100.88101.17 A0.6820.6930.6800.6940.685保存率/%100.00101.6199.70101.75100.44 1.2% H 2O 20.6% H 2O 2A0.6820.6910.6880.6870.689保存率/%100.00101.32100.88100.73101.03 1.8% H 2O 2A0.6820.6960.6830.6940.690保存率/%100.00102.05100.15101.76101.17 2.4% H 2O 2A0.6820.6840.6910.6990.697保存率/%100.00100.29101.32102.50102.19
如表3所示,连翘花提取物的抗氧化性较优良,这也与连翘花所含有抗氧化化合物芦丁、金丝桃苷、连翘酯苷A、连翘苷、熊果酸等活性成分含量较高相关,因此连翘花提取物是一种具有保健价值较高的天然提取物。
2.8 还原剂对连翘花提取物稳定性的影响
表4 还原剂VC对连翘花提取物稳定性的影响(n=3)
Table4 Effect of ascorbic acid concentration on the stability of Forsythia suspensa flower extract ( n= 3)

氧化剂时间/min 03060120180对照组A0.6680.6690.6600.6580.650保存率/%100.00100.1598.8098.5097.31 0.02% VCA0.6680.6660.6550.6560.653保存率/%100.0099.7098.0598.2097.75 0.04% VCA0.6680.6550.6520.6430.640保存率/%100.0098.0597.6096.2595.81 0.06% VCA0.6680.6560.6520.6430.627保存率/%100.0098.2097.6096.2693.86 0.08% VCA0.6680.6520.6440.6400.621保存率/%100.0097.6096.4195.8092.96 0.10% VCA0.6680.6610.6400.6330.620保存率/%100.0098.9595.8094.7692.81
幅度不是很大,其颜色没有明显变化。总体来讲,连翘花提取物在还原剂抗坏血酸溶液中是 较稳定的。
2.9 食品添加物对连翘花提取物稳定性的影响
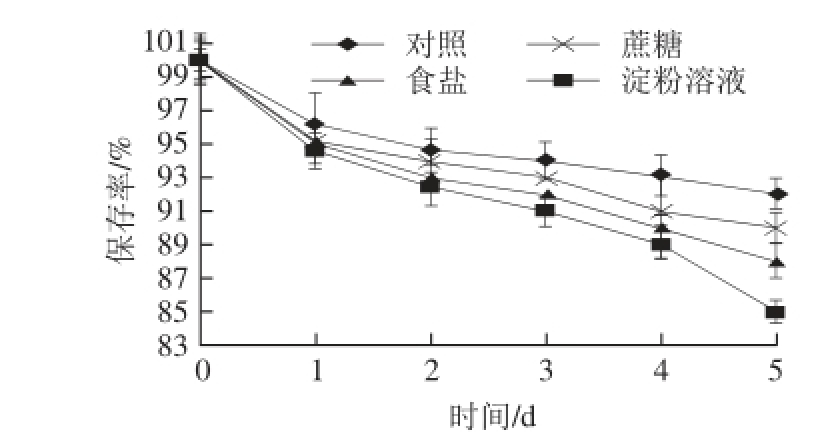
图8 常用食品添加物对连翘花提取物稳定性的影响(n==33)
Fig.8 Effect of common food additives on the stability of Forsythia suspensa flower extract (n = 3)
如图8所示,在添加蔗糖、食盐和淀粉的连翘花提取物溶液中,随着时间的延长,连翘花提取物溶液的吸光度有不同程度的下降,但吸光度下降的幅度很小,连翘花提取物溶液的颜色基本上没有发生改变。这说明,蔗糖、食盐和淀粉对连翘花提取物吸光度的影响不是很大,即连翘花提取物在富含蔗糖、食盐和淀粉的食品中有较好的稳定性。
本实验中,对连翘花提取物中主要活性成分进行检测,结果发现连翘花提取物含有较高含量的活性成分,从而明确连翘花提取物的物质基础,本课题组下一步将进行连翘花提取物主要活性物质的分离纯化与结构分析研究。连翘花提取物具有良好的热稳定性;在中性和弱酸性环境中连翘花提取物稳定性较强;在室光和避光条件下照射对连翘花提取物影响较小,应尽量减少连翘花提取物日光照射的时间;不同的金属离子对连翘花提取物稳定性能影响不同;氧化剂、还原剂和常见食品添加物对连翘花提取物影响很小;这些都是在实际应用中需要切实考虑的问题。
关于连翘花提取物中芦丁、金丝桃苷、连翘酯苷A、连翘苷、熊果酸和齐墩果酸等主要活性成分在温度、pH值、光、各金属离子、氧化剂、还原剂和各食品添加物等条件处理下各活性化合物的含量如何发生变化,也就是活性成分在不同处理条件下的变化规律和机制是接下来进一步需要探讨的问题。该连翘花提取物的最大吸收波长与连翘花黄色素溶液最大吸收波长一致,说明连翘花提取物含有较高含量的连翘花黄色素化合物。为了进一步开发连翘花中的黄色素,接下来连翘花提取物中的黄色素的物质基础也是需要探讨的问题。
参考文献:
[1] 国家药典委员会. 中华人民共和国药典[M]. 北京: 化学工业出版社,2005: 117-118.
[2] 李卫建, 李先恩, 祁建军. 连翘质量变异研究[J]. 中国中药杂志,2007, 32(5): 381-384.
[3] 裴红宾, 高凤琴. 连翘在山西的立地范围及其开发利用价值[J]. 北方园艺, 2006(2): 98-99.
[4] 胡静, 马琳, 张坚. 连翘的研究进展[J]. 中南药学, 2012, 10(10):760-764.
[5] 肖培根. 新编中药志[M]. 北京: 化学工业出版社, 2002: 280.
[6] 崔洋, 王巧, 张兰桐, 等. 河北道地药材连翘的高效液相色谱指纹图谱研究[J]. 中草药, 2010, 41(2): 297-301.
[7] 张海燕. 连翘化学成分及药理活性的研究进展[J]. 中药材, 2000,23(10): 657-658.
[8] JIAO Jiao, GAI Qingyan, LUO Meng, et al. Comparison of main bioactive compounds in tea infusions with different seasonal Forsythia suspensa leaves by liquid chromatography-tandem mass spectrometry and evaluation of antioxidant activity[J]. Food Research International,2013, 53(2): 857-863.
[9] 杨建雄, 刘静, 李发荣, 等. 连翘叶茶抗氧化抗衰老作用的实验研究[J].营养学报, 2004, 26(1): 65-67.
[10] 刘静, 杨建雄, 李小丹. 连翘叶提取物抗油脂氧化作用的实验研究[J].陕西教育学院学报, 2006, 22(2): 93-95.
[11] 黄亚亚, 杨建雄, 赵咏梅. 连翘叶黄铜对力竭游泳恢复小鼠的抗疲劳作用研究[J]. 天然产物研究与开发, 2009, 21(6): 1019-1022.
[12] 雷秋香, 赵连梅, 颜晰, 等. 连翘叶乙醇提取物对人食管癌细胞增殖抑制作用的研究[J]. 肿瘤防治研究, 2012, 39(4): 394-399.
[13] 王金亭, 李秋凤. 微波辅助提取连翘花黄色素及其抗氧化活性的研究[J]. 中国酿造, 2010, 29(11): 100-103.
[14] 盛锋, 付蕾, 李长城, 等. 连翘花黄色素的提取及其对光热稳定性的研究[J]. 食品与发酵工业, 2002, 28(2): 66-70.
[15] 王玲丽, 滕红梅, 弓苗苗. 响应面分析法优化超声提取连翘花黄色素工艺研究[J]. 浙江农业学报, 2014, 26(4): 961-965.
[16] 陈忻, 陈纯馨, 张俊敏, 等. 从板栗壳中提取棕色素及棕色素理化性质的研究[J]. 食品科学, 2003, 24(11): 52-53.
[17] 付云飞, 李清, 毕开顺. RP-HPLC 法同时测定不同产地连翘中的7种成分[J]. 中草药, 2013, 44(8): 1043-1046.
[18] 陈芳, 邓雁如, 郭利平. HPLC法同时测定金银花及金芪降糖片中9种成分的含量[J]. 天津中医药, 2014, 31(3): 168-172.
[19] 孟庆艳, 丁玲, 刘圆. 维药小新塔花和芳香新塔花的HPLC指纹图谱研究[J]. 中草药, 2014, 43(12): 1673-1678.
[20] 赵韶华, 刘敏彦, 王玉峰, 等. HPLC-ELSD法同时测定连翘叶中齐墩果酸和熊果酸[J]. 食品科学, 2012, 33(2): 224-226.
[21] 张博, 秦蓓, 李金娟, 等. RP-HPLC-ELSD法测定连翘中齐墩果酸及熊果酸的含量[J]. 光谱实验室, 2010, 27(6): 2541-2544.
Active Compounds and Stability of Forsythia suspensa Flower Extract
YUAN Jiangfeng
1, QIU Zhijun
1, HU Lijun
2, LIU He
1, GAO Yaohui
1
(1. College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471003, China;2. Key Project Management and Development Office of the People's Government of Wenshui, Lüliang 032100, China)
Abstract:This study aimed to determine the contents of rutin, quercetin, forsythiaside A, phillyrin, oleanolic acid, and ursolic acid in Forsythia suspensa fl ower extract (FFE) from Henan province by high performance liquid chromatography(HPLC) and to evaluate the stability of FFE. The results showed that the contents of rutin, quercetin, phillyrin, oleanolic acid, and ursolic acid in FFE were all higher. FFE was obviously stable between weakly acidic and neutral pH values, and displayed a higher thermostability at temperatures ranging from 25 to 75 ℃. Natural light and dark treatments had less effects on the extract than sunlight treatment. K +, Na +, and Ca 2+exerted less effect on the absorbance value whereas Mg 2+and Fe 3+enhanced the absorbance value of FFE. Oxidants, reducing agents, sugar, NaCl, and starch had only slight effects on the stability of FFE. This study can provide important information for comprehensive utilization of FFE.
Key words:Forsythia suspensa flower extract; active compounds; stability
中图分类号:TS202.3
文献标志码:A
文章编号:1002-6630(2015)14-0130-05
doi:10.7506/spkx1002-6630-201514025
收稿日期:2014-11-22
基金项目:洛阳市科技攻关项目(1401076A);河南人才培养联合基金项目(U1404307);大学生研究训练计划项目(SRTP2014113)
作者简介:原江锋(1978—),女,副教授,博士,主要从事生物活性成分分析和应用研究。E-mail:jiangfengyuan@163.com