
图1 浸泡过程微生物生长曲线
Fig.1 Growth curves of spoilage bacteria during soybean soaking
刘丽莎 1,彭义交 1,鲍鲁生 1,田 旭 1,吕晓莲 2,白 洁 1,李玉美 1,郭 宏 1,*
(1.北京食品科学研究院北京市食品研究所,北京 100162;2.北京二商集团有限责任公司,北京 100053)
摘 要:通过对大豆浸泡过程中腐败微生物种类及数量开展研究,经致腐细菌回接实验进一步探明豆浆腐败现象与致腐细菌的关系,为豆浆稳定性控制及豆制品加工自动化提供依据。从大豆浸泡水中分离3 株优势菌DF-1、DF-2和DF-3,结合形态学及16S rDNA序列分析,分别鉴定为短稳杆菌、产气肠杆菌和乳酸乳球菌。将优势菌分别回接至灭菌豆浆,于25 ℃保藏12 h,理化指标结果表明3 种微生物对豆浆品质影响有较大差异:短稳杆菌产黄色素,在豆浆表面形成黄色菌膜并产生腐臭味;产气肠杆菌产酸产气,使豆浆形成蜂窝状凝乳,腐败变馊;乳酸乳球菌产酸使豆浆凝固。本研究为豆制品自动化生产过程中控制豆浆品质及加工稳定性提供参考。
关键词:豆浆;浸泡工艺;腐败微生物
北豆腐作为植物蛋白的主要来源,富含蛋白质、微量元素和不饱和脂肪酸,深受消费者喜爱,是我国消费量较大的日常食品 [1-2]。同时由于大豆营养丰富,生产过程中容易被微生物污染 [3],尤其是在煮浆之前,微生物污染极其严重 [4]。目前国内北豆腐生产企业大都采用半自动化设备沿用传统加工工艺,大豆磨浆之前需浸泡8~12 h,微生物增殖迅速,企业在加工过程中需换水避免微生物过量繁殖,不仅耗费大量水资源,还给环境造成严重污染。此外,由于泡豆工序耗时长,企业一般在上午磨浆制备全天所用豆浆,生豆浆放置到下午时易出现发黏、发臭、pH值下降、表面黄膜等腐败现象,严重影响豆浆稳定性及豆腐品质,给消费者带来潜在的安全问题;严重腐败时,只能作为废液排放,给企业带来经济损失,也会对环境造成一定的影响。
目前已有较多针对豆腐腐败微生物的研究,关于豆浆制备及放置过程中的微生物腐败作用还没有人报道。本研究针对豆制品加工过程中腐败微生物种类及增殖趋势开展研究,分析腐败菌对豆浆的腐败作用,为开发新型大豆浸泡工艺,控制豆浆品质及稳定性提供基础。
1.1 材料与试剂
大豆:无虫蚀、无霉变大豆,取自北京二商希杰食品有限责任公司。
溶菌酶、蛋白酶K、细菌总DNA提取试剂盒、DNA胶回收试剂盒 宝生物技术有限公司;引物合成及序列测定由北京博迈德生物技术有限公司完成;其余试剂均为分析纯。
1.2 仪器与设备
TC-512聚合酶链式反应(polymerase chain reaction,PCR)仪 英国TechNet公司;PB-10 pH计 德国Sartorius公司;NDJ-1旋转黏度计 上海尼润设备有限公司。
1.3 方法
1.3.1 致腐细菌分离及检测
大豆采用传统浸泡工艺,即用3 倍体积自来水漂洗1 次,用3 倍自来水浸泡大豆,室温条件下(约25 ℃)浸泡12 h,每隔3 h取样检测菌落总数 [5]。将长出的菌落按菌落形态和镜检结果进行分离纯化。
1.3.2 菌株初步鉴定
采用细菌总DNA试剂盒提取腐败菌DNA,16S rRNA鉴定引物:LPW57(5’-AGTTTGATCCTGGCTCAG-3’)、LPW205(5’-CTTGTTACGACTTCACCC-3’) [6];PCR反应体系(25 μL):2×Taq PCR Master Mix 11.50 μL,上、下游引物各1.5 μL,模板DNA 1.0 μL,ddH 2O 10 μL;反应程序:94 ℃初始变性5 min,94 ℃变性1 min,42 ℃退火30 s,72 ℃延伸90 s,30 个循环,72 ℃终延伸10 min [7]。PCR反应产物纯化后,连接T载体后测序(北京博迈德生物技术有限公司),将结果与GenBank中收录的其他菌株序列进行分析比对,初步确定大豆浸泡过程的腐败微生物种类。
1.3.3 腐败菌对豆浆的微生物效应研究
新鲜豆浆经115 ℃、20 min杀菌后,按2%接种DF-1、DF-2、DF-3,于25 ℃培养,每3 h取样检测,研究腐败菌对豆浆的微生物效应。
1.3.3.1 感官评价
挑选豆制品加工经验丰富的人员对豆浆色泽、气味及质地进行评价,衡量豆浆的品质及腐坏程度。
1.3.3.2 活菌数测定
无菌吸取豆浆样品按10 倍梯度稀释至合适梯度,用稀释平板法测定各组细菌数。
1.3.3.3 pH值测定
采用pH计在25 ℃条件下测定豆浆样品的pH值。
1.3.3.4 黏度测定
采用NDF-1旋转式黏度计,在25 ℃测定酸乳样品的黏度。测定条件:27 #转子,80 r/min,30 s取值。
2.1 腐败菌在大豆浸泡过程中的生长规律研究

图1 浸泡过程微生物生长曲线
Fig.1 Growth curves of spoilage bacteria during soybean soaking
图1显示,在大豆浸泡过程中,微生物呈直线上升趋势,经25 ℃浸泡12 h,活菌数从10 5CFU/mL增长到10 8CFU/mL,其中DF-3(乳酸乳球菌)的初始菌落数及增殖速度最快,浸泡结束可达10 8CFU/mL,DF-1和DF-2活菌数分别增至10 7CFU/mL和10 6CFU/mL,泡豆水变浑浊,产生大量气泡。在工业化制浆过程中,为降低微生物污染采用流水浸泡方式,浪费大量水资源,且给企业带来巨大的治污负担,流水浸泡过程还会带走部分大豆的营养成分,对豆腐出品率造成影响。
2.2 腐败菌的分离纯化
挑取单菌落划线分离纯化,并观察菌落形态,革兰氏染色后于显微镜下观察菌体形态。
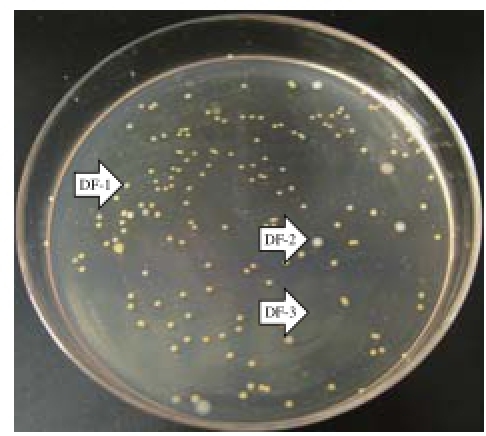
图2 腐败菌菌落形态图
Fig.2 Colonial morphology of three spoilage bacteria from soaked soybeans
如图2所示,大豆在浸泡过程中主要有3 种不同形态的菌落存在,其菌体形态如图3所示。DF-1在营养琼脂上为典型的黄色菌落,边缘整齐,光滑有光泽,显微镜下为革兰氏阴性球杆菌。DF-2为较大乳白色圆形菌落,边缘不规则,革兰氏染色呈阴性。DF-3为白色针尖状小菌落,显微镜下为革兰氏阳性链球菌。DF-1、DF-2的菌落形态与韩磊等并所述豆浆中菌落形态相似 [8-9],但对于腐败菌的种类及对豆浆的腐败作用并未涉及。
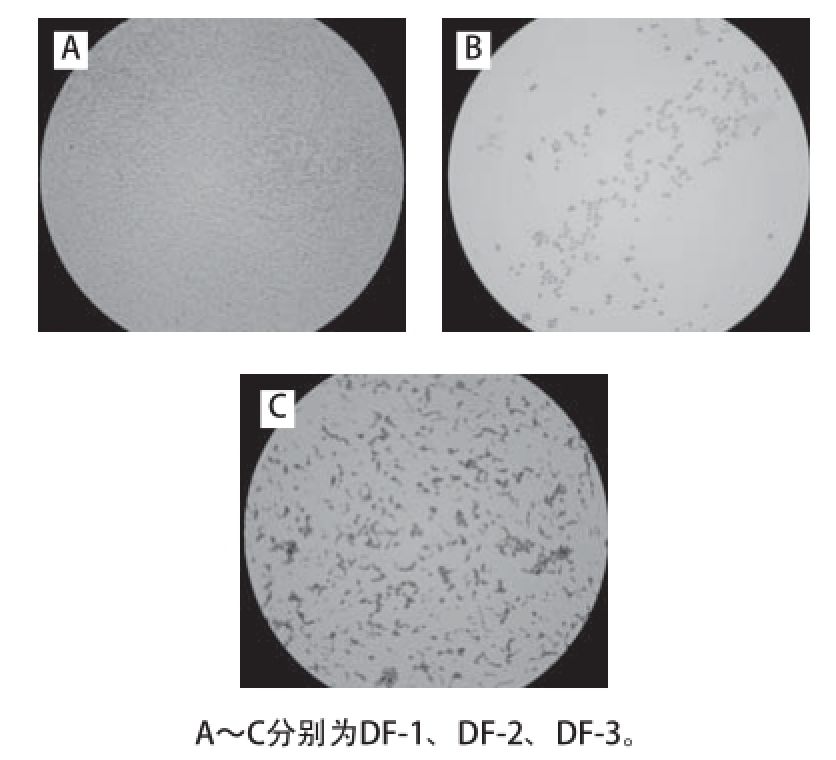
图3 腐败菌细胞形态图
Fig.3 Morphology of three spoilage bacteria from soaked soybeans
2.3 16S rDNA序列同源性分析
提取菌株的总DNA为模板,以引物LPW57、LPW205进行PCR扩增,得到约1 500 bp的目的片段,测序结果显示DF-1、DF-2、DF-3的16S rDNA片段长度分别为1 384、1 420、1 420 bp(结果未列出),经NCBI中BLAST进行序列同源性比对,菌株DF-1与Empedobacter brevis LMG 4011(Genbank序列号:NR_042471.2)同源性为100%,菌株DF-2与Enterobacter aerogenes EA1509E(Genbank序列号:FO203355.1)同源性为99%,DF-3与Lactococcus lactis PON10072(GenBank序列号:KC417004.1)同源性为99%。结合菌株形态学,将3 株腐败菌初步鉴定为短稳杆菌(旧称短黄杆菌Empedobacter brevis)、产气肠杆菌(Enterobacter aerogenes)及乳酸乳球菌(Lactococcus lactis)。本实验中豆浆腐败微生物豆腐等豆制品中微生物种类有较大差别,主要与豆制品加工过程需高温煮浆有关。非发酵类豆制品主要为耐热芽孢杆菌 [10-11]及后期污染的肠道菌 [12-13],此外还存在假单胞菌 [14-15]、乳酸菌 [16]和吉氏库特氏菌 [17]等腐败微生物,研究人员已开展豆腐腐败微生物控制研究 [18-19],但影响豆制品加工过程中豆浆品质及稳定性的微生物种类还未有报道,其微生物种类及数量主要与大豆原料中携带的微生物有关。
2.4 腐败菌对豆浆品质的影响研究
2.4.1 感官评价
接种后的豆浆感官变化如表1所示,25 ℃放置12 h后样品如图4所示。
表1 感官评价结果
Table1 Sensory evaluation of inoculated soymilk during storage at 25 ℃
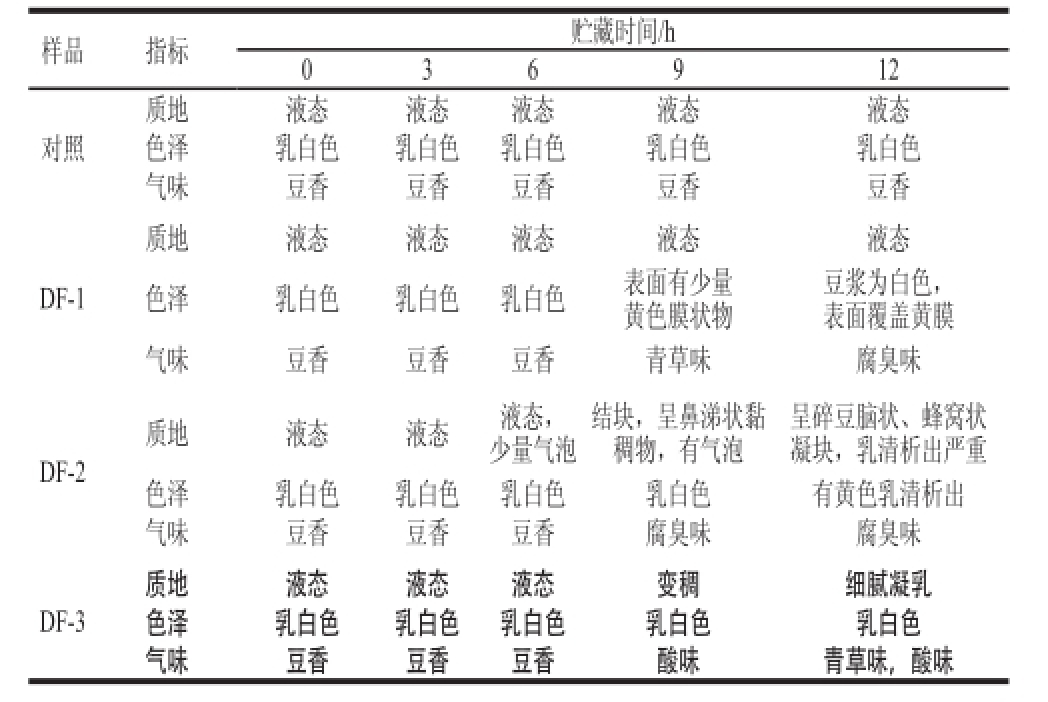
样品指标贮藏时间/h 036912对照质地液态液态液态液态液态色泽乳白色乳白色乳白色乳白色乳白色气味豆香豆香豆香豆香豆香DF-1质地液态液态液态液态液态色泽乳白色乳白色乳白色表面有少量黄色膜状物豆浆为白色,表面覆盖黄膜气味豆香豆香豆香青草味腐臭味DF-2质地液态液态液态,少量气泡呈碎豆脑状、蜂窝状凝块,乳清析出严重色泽乳白色乳白色乳白色乳白色有黄色乳清析出气味豆香豆香豆香腐臭味腐臭味结块,呈鼻涕状黏稠物,有气泡DF-3质地液态液态液态变稠细腻凝乳色泽乳白色乳白色乳白色乳白色乳白色气味豆香豆香豆香酸味青草味,酸味
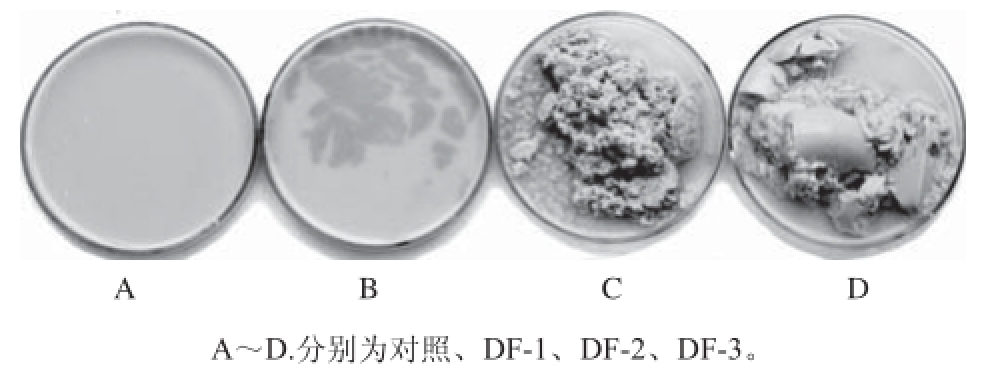
图4 微生物对豆浆感官品质的影响
Fig.4 Effects of three spoilage bacteria on appearance of soymilk
豆浆灭菌后为乳白色,流体状,豆香味浓郁,放置12 h内无明显感官变化,pH值、色泽、黏度、气味及微生物均无明显变化。DF-1放置9 h,表面开始长黄膜,并有轻微的臭味,由于短稳杆菌为严格好氧菌 [20],且能产生黄色素,表面黄膜可能是DF-1形成的菌膜。DF-2为产气菌,从6 h后开始产生大量气泡,呈鼻涕状半流体,放置12 h呈蜂窝状凝乳,有浓郁的腐臭味,可能与其产生大量生物胺有关。接种乳酸乳球菌的样品放置12 h产生类似酸乳的凝乳块,无明显的腐臭味,有较浓郁的发酵酸味。
2.4.2 活菌数变化
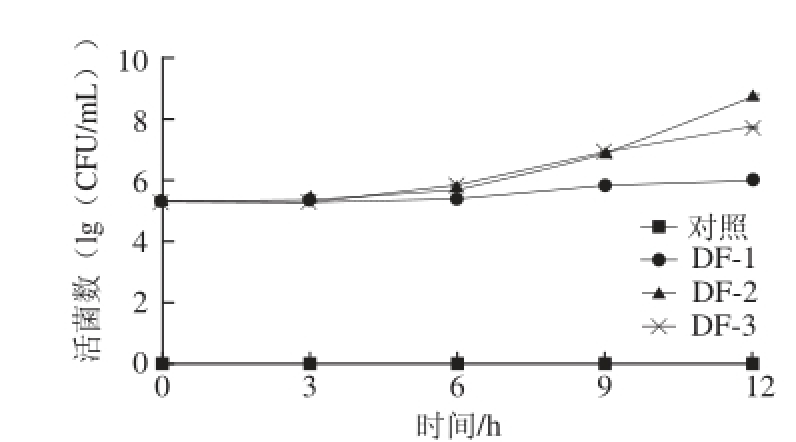
图5 腐败菌在豆浆中的生长曲线
Fig.5 Growth curve of three spoilage bacteria in soymilk
豆浆中微生物活菌数变化趋势如图5所示,3 株腐败菌在豆浆中的生长速度及对豆浆的微生物效应均有差异。3株腐败菌以2%(10 5CFU/mL)接种后,在前3 h处于迟缓期,活菌数均保持稳定,3 h后开始进入对数生长期,由于样品温度为25 ℃,比适宜生长温度下增长速率缓慢。培养9 h,DF-2和DF-3活菌数分别为7.5×10 6CFU/mL和8.9×10 6CFU/mL,对样品的pH值、感官有较明显的影响。DF-1活菌数增长速度较慢,放置12 h后活菌数为9.8×10 5CFU/mL。由于DF-1为严格好氧菌,DF-2及DF-3为兼性厌氧菌,故DF-1在静置豆浆中生长速度较慢。
2.4.3 腐败菌对豆浆理化性质的影响
接种3 株腐败菌后,定期测定豆浆的pH值及黏度变化,结果如图6和7所示。
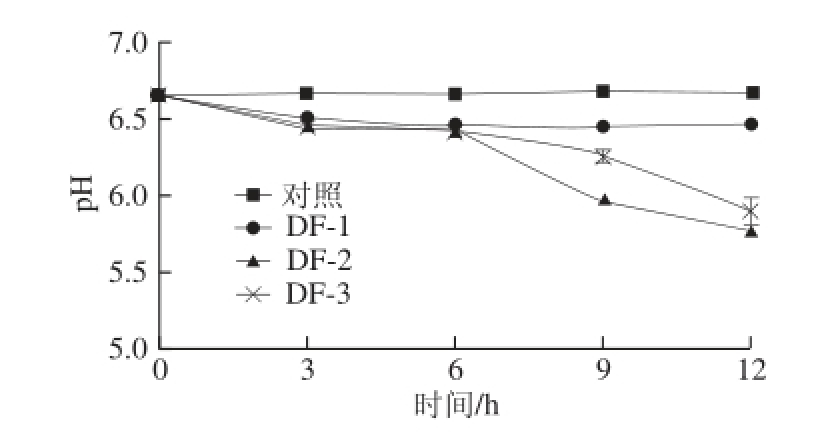
图6 腐败菌对豆浆pH值的影响
Fig.6 Effects of three spoilage bacteria on pH value of soymilk
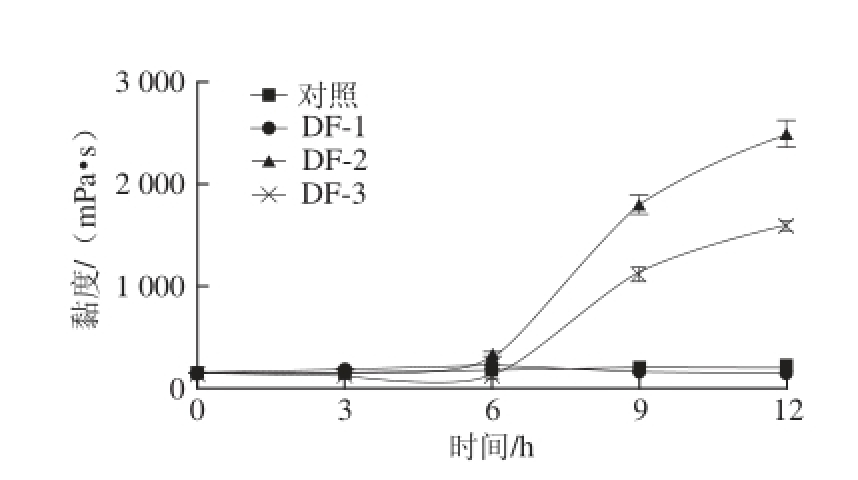
图7 腐败菌对豆浆黏度的影响
Fig.7 Effects of three spoilage bacteria on viscosity of soymilk
从图6、7可看出,DF-2、DF-3对豆浆的pH值及黏度影响较大,均在9 h出现显著的变化,pH值下降,黏度上升。微生物生长使脂肪分解成脂肪酸或碳水化合物分解成有机酸,使豆浆pH值下降,引起豆浆蛋白凝聚,形成凝乳或变稠。研究表明产气肠杆菌及乳酸乳球菌均可发酵碳水化合物产生乳酸 [21],DF-2、DF-3黏度升高可能由酸凝乳所致。DF-1(稳杆菌属)属于非发酵型微生物,豆浆的pH值及黏度并无明显变化。这3 类菌对高温耐受性普遍较低,基本可在煮浆过程中杀灭(95 ℃、5~10 min) [22],在成品豆腐中检出率较低,但由于生豆浆加热前无其余杀菌措施,在温度适宜条件下,腐败菌大量繁殖,导致豆浆腐败变质,从而使豆腐等豆制品的出品率下降或品质劣变。
豆浆品质不稳定是目前国内豆制品企业实现全自动化生产的行业瓶颈。由于泡豆及制浆设备为敞开式,原料及环境中微生物污染严重,加工过程微生物生长繁殖迅速,导致豆浆的理化性质不稳定,难以在点脑过程实现自动化控制,影响豆腐等豆制品生产效率及品质。本实验针对大豆浸泡过程中主要腐败微生物开展研究,确定引起豆浆腐败的主要微生物为短稳杆菌、产气肠杆菌及乳酸乳球菌,并分析了豆浆品质劣变的主要原因,短稳杆菌产生色素引起豆浆表面发黄,产生腐臭味;产气肠杆菌产酸产气,导致豆浆黏度增大,形成蜂窝状凝乳,有腐臭味;乳酸乳球菌产酸导致豆浆凝乳,对豆浆的气味无太大影响。短稳杆菌是一类条件致病菌可引发败血症 [23-24],目前研究主要应用于植物病虫害生物防治;产气肠杆菌是食品中常见的腐败菌,代谢形成尸胺、腐胺等生物胺产生严重腐臭味 [25],带来潜在的质量及安全问题。由于这两类菌较少出现在成品豆腐中,未引起研究人员的重视,在豆制品相关研究中的报道较少,对于其安全性、致病性研究较少。后续需针对豆制品加工中腐败微生物的安全性及控制开展研究,提高豆浆稳定性,实现豆制品加工自动化生产,确保豆制品质量与安全。
参考文献:
[1] 刘昱彤. 全豆豆腐加工工艺及质构特性的研究[D]. 无锡: 江南大学,2013: 33-37.
[2] SHIN I S, HAN J S, CHOI K D, et al. Effect of isothiocyanates from horseradish (Armoracia rusticana) on the quality and shelf life of tofu[J]. Food Control, 2010, 21: 1081-1086.
[3] 石彦国, 李博, 于志鹏. 传统豆腐微生物污染途径[J]. 食品工业科技,2011, 32(5): 186-189.
[4] 管立军, 程永强, 李里特. 豆腐保质期研究进展[J]. 食品工业科技,2008, 29(11): 269-271.
[5] GB/T 4789.2—2010 食品微生物学检验: 菌落总数测定[S]. 北京: 中国标准出版社, 2010.
[6] PATRICK C Y, AMI M, FUNG Y, et al. Identification by 16S rRNA gene sequencing of Lactobacillus salivarius bacteremic cholecystitis[J]. Journal of Clinical Microbiology, 2002, 40(1): 265-267.
[7] 刘丽莎. 双歧杆菌EPS生物合成、理化特性及在酸乳中的应用研究[D].北京: 中国农业大学, 2013: 11-12.
[8] 韩磊, 史艳东, 秦盼盼, 等. 鲜豆浆中菌落总数的测定[J]. 乳业科学与技术, 2010, 33(5): 228-230.
[9] 汪立平, 陈有容, 齐凤兰. 变质豆浆中腐败微生物的分离及其杀灭条件研究[J]. 大豆科学, 2006, 25(3): 254-258.
[10] 李除夕. 豆腐特定腐败菌研究及货架期预测模型建立[D]. 南京: 南京农业大学, 2005: 16-26.
[11] 黄宝莹. 绿豆黄豆浆腐败微生物的分离与控制研究[D]. 广州: 华南理工大学, 2011: 26-41.
[12] 王敏. 非发酵性豆制品(豆腐丝)主要腐败细菌的分离鉴定及其防腐研究[D]. 保定: 河北农业大学, 2004: 12-15.
[13] 李博, 李里特, 辰巳英三, 等. 豆腐(豆浆)中屎肠球菌生长的温度预测模型[J]. 中国农业大学学报, 2003, 8(2): 49-54.
[14] FOUAD K E, HEGEMAN G D. Microbial spoilage of tofu (soybean curd)[J]. Journal of Food Protect, 1993, 56(2): 157-164.
[15] 胡耀辉, 徐云, 于寒松, 等. 北豆腐中主要腐败微生物的分离与鉴定[J].粮油加工, 2010(9): 108-110.
[16] DOSTON C R, FRANK H A, CAVALETTO C C. Indirect methods as criteria of spoilage in tofu (soybean curd)[J]. Journal of Food Science,1977, 42: 273-274.
[17] TUITEM W K, FUNG D Y C. Microbiological study of tofu[J]. Journal of Food Protect, 1991, 54(13): 212-216.
[18] 李蕾. 乳酸乳球菌素LLC518和清酒乳杆菌素LSJ618在豆腐保鲜中的研究[D]. 合肥: 安徽农业大学, 2013: 18-23.
[19] 杨明, 陈信宇, 张辉, 等. 豆腐致腐细菌的分离鉴定及控制研究[J].食品工业科技, 2014, 35(12): 218-222.
[20] 王国戗, 邢善霞, 傅政. 短稳杆菌的分离情况和耐药性分析[J]. 实用医学杂志, 2011, 27(21): 3960-3962.
[21] 徐忠义, 王新磊, 闫巧娟, 等. 产气肠杆菌发酵蔗糖产乳酸条件的优化[J]. 中国酿造, 2011, 33(1): 78-81.
[22] 李辉尚. 不同大豆品种的北豆腐加工适应性研究[D]. 北京: 中国农业大学, 2005: 7-16.
[23] 李波, 周立勤, 王春香. 短稳杆菌致婴儿败血症1 例[J]. 中华医院感染学杂志, 2004, 14(3): 257.
[24] 杜迅, 王亚南, 何蔚荭, 等. 软腐白菜根系土壤中短稳杆菌的分离和鉴定[J]. 河南科学, 2012, 30(4): 444-447.
[25] 李彬. 产气肠杆菌(E. aerogenes)和阴沟肠杆菌(E. cloacae)产生物胺作用的研究[D]. 南京: 南京农业大学, 2011: 37-53.
Growth of Spoilage Microorganisms during Soaking of Soybean and Their Effects on Soymilk Quality
LIU Lisha
1, PENG Yijiao
1, BAO Lusheng
1, TIAN Xu
1, L☒ Xiaolian
2, BAI Jie
1, LI Yumei
1, GUO Hong
1,*
(1. Beijing Food Research Institute, Beijing Academy of Food Sciences, Beijing 100162, China;2. Beijing Er Shang Group Co. Ltd., Beijing 100053, China)
Abstract:In this research, three spoilage microorganisms named DF-1, DF-2 and DF-3, respectively were separated from soaked soybeans. Based on their morphological and physiological characteristics, and 16S rDNA analysis, these three strains were identifi ed as Empedobacter brevis, Enterobacter aerogenes and Lactococcus lactis, respectively. To investigate their effects on soymilk quality, sterile soymilk was inoculated with each of these spoilage strains and stored at 25 ℃ and changes in physicochemical indicators were measured during 12 h of storage. Physicochemical properties of soymilk were affected signifi cantly differently by the three spoilage bacteria. When being cultivated in soymilk, DF-1 produced yellow fi lms with putrefactive odor on the surface of soymilk while DF-2 produced gas and acid and formed a honeycomb-like gel indicating spoilage of soymilk. DF-3 also produced acid and caused coagulation of soymilk like yogurt. This research can lay a foundation for quality and processing stability control of soymilk during automatic production of soybean products.
Key words:soymilk; soaking process; spoilage microorganisms
中图分类号:TS214.2
文献标志码:A
文章编号:1002-6630(2015)14-0161-04
doi:10.7506/spkx1002-6630-201514031
收稿日期:2014-10-28
基金项目:国家高技术研究发展计划(863计划)项目(2013AA102105);“十二五”国家科技支撑计划项目(2012BAD34B03-2)
作者简介:刘丽莎(1989—),女,工程师,硕士,研究方向为食品微生物及代谢产物。E-mail:liulisha0616@sina.com
*通信作者:郭宏(1961—),男,高级工程师,硕士,研究方向为豆制品加工及综合利用。E-mail:guohong1961@sina.com