气调包装酱卤鸭翅贮藏过程中菌群结构分析
叶可萍
1,刘 佳
1,刘 梅
1,李春保
1,郭成祥
2
(1.南京农业大学食品科技学院,食品安全与营养协同创新中心,国家肉品质量安全控制工程技术研究中心,江苏 南京 210095;2.南京工业大学食品与轻工学院,江苏 南京 211800)
摘 要:运用传统细菌平板培养和聚合酶链式反应-变性梯度凝胶电脉方法研究气调包装酱卤鸭翅15 ℃贮藏过程中微生物菌群结构变化。细菌总数计数结果表明,产品生产的卫生条件较好,细菌初始污染菌数较低(小于2(lg(CFU/g))),至贮藏第9天左右产品细菌总数超过4(lg(CFU/g))。变性梯度凝胶电脉指纹图谱结果表明,贮藏初期产品的初始污染菌主要为不动杆菌属,至贮藏末期,产品中的主要菌群有嗜冷杆菌、莫拉氏菌、链球菌等,其中嗜冷杆菌属成为产品贮藏末期的优势菌。
关键词:酱卤鸭翅;气调包装;贮藏;菌群结构;聚合酶链式反应-变性梯度凝胶电脉法
酱卤肉类制品是我国传统的一类肉制品,是指肉在水中加食盐或酱油等调味料和香辛料一起煮制而成的一类熟肉类制品
[1],其主要特点是产品酥软、色香味俱全,深受广大消费者喜爱
[2]。近年来一些地方特色的酱卤产品已成规模化生产,如北京烤鸭、湖北周黑鸭、南京盐水鸭、北京天福号的酱肘子、德州扒鸡等。其中湖北传统酱卤鸭类产品以其入口微甜爽辣、吃后回味悠长的独特口味深受大众的喜爱,在国内有着广泛的市场。而酱卤鸭翅产品就是一种销量较大的酱卤鸭类产品,在许多工业化生产的企业中作为主要销售产品。该产品通过先对原料肉焯水,加香辛料和调味料及水煮制,后再经过摊凉、切割、气调包装等环节,完成产品的制作过程。但是,此类产品为带有卤液的熟肉制品,煮制后的包装处理环节较多,生产出来的产品货架期较短
[3-4],难以实现长途运输和销售,一定程度限制了酱卤肉制品在与西式肉制品共存市场中的发展。近年来,国内外许多即食肉制品采用气调包装、超高压等保鲜技术来延长产品货架期,解决产品不易包装和贮存运输的问题。由于酱卤鸭翅属于中国传统特色产品,无国外可借鉴的相关研究,而国内对于酱卤鸭类制品研究较少,主要集中在对酱卤鸭肉制品的工艺改进、贮藏特性变化(如硫代巴比妥酸(thiobarbituric acid-reactive substances,TBARS)值、pH值、颜色、细菌总数等)、风味物质分析等
[4-10],如殷雪
[5]通过传统细菌计数方法对卤鸭脖中不同属细菌的消长规律进行了分析;海丹等
[6]分析了气调包装酱牛肉贮藏过程中细菌总数、TBARS值、挥发性盐基氮、pH值等品质变化;谢彬
[7]研究了真空包装卤鸭脖低温微波杀菌和复合防腐剂最佳配比等综合保鲜技术;段昌圣
[3]研究了普通和真空包装条件下酱卤鸭脖的贮藏特性(包括细菌总数、品质特性等)。
湖北传统酱卤鸭翅是禽肉制品中中式酱卤制品的典型代表,主打开袋即食的理念,使用阻隔性材料的气调包装方式已成为发展趋势。气调包装(modified atmosphere packaging,MAP)就是近年来发展的一种新型包装技术,即用阻气性材料将肉类食品密封于一个改变了的气体环境中,抑制腐败微生物的生长及生化活性,达到延长货架期的目的,由于该技术在保持食品原有的口感、色泽、形状及营养的同时,还能起到延长保质期的作用,已越来越受到食品生产者的青昧
[11-14]。国内对于传统酱卤肉制品气调包装的研究处于初级阶段,对气调包装酱卤产品中微生物的菌群结构分析甚少,但此类研究是提高产品货架期的依据。因此,本实验将酱卤鸭翅气调包装,放置15 ℃条件下贮藏,在不同贮藏时期监测气调包装产品中的气体成分变化,并直接提取产品中细菌DNA,应用聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)技术,研究贮藏过程中微生物的生长和菌群结构变化规律,揭示贮藏末期产品的主要优势菌,为进一步研究气调包装酱卤鸭翅的保鲜措施提供科学依据。
1 材料与方法
1.1 材料与试剂
酱卤鸭翅产品取自某酱卤鸭类制品公司,该产品经原料鸭翅、焯水、卤制、摊凉、切割、气调包装等环节完成产品的制作过程,其中一个气调包装盒放置约300 g鸭翅,包装盒内充N
2。
平板计数琼脂 北京陆桥有限公司;琼脂糖凝胶 西班牙Biowest公司;DNA提取试剂盒(离心柱型TIANamp Bacteria DNA Kit) 北京天根生物科技有限公司;PCR预混液、2倍GoTaq
☒Green Master Mix预混液 美国Promega公司;DNA Marker(DL2000 bp)、溶菌酶(100×)、Gelred(10 000×)、TAE电泳缓冲液(50×) 北京Solarbio科技有限公司;过硫酸铵国药集团;四甲基乙二胺 南京生兴生物技术有限公司;引物均由上海生工生物技术有限公司合成。
1.2 仪器与设备
气体比例测定仪 德国Witt公司;ICP500培养箱德国Memmert公司;均质器 法国Interscience公司;J-E立式冷冻高速离心机 美国Beckman Coulter公司;9902型基因扩增仪 美国Applied Biosystems公司;DY602S型稳流稳压电泳仪 南京生兴生物技术有限公司;Ⅱ型凝胶成像仪 美国Bio-Rad公司;NANODROP-2000核酸蛋白分析仪 美国Thermo Scientific公司;MB-102金属浴 杭州博日科技有限公司;HVE-50型高温高压灭菌锅 日本株式会社平山制作所。
1.3 方法
1.3.1 生产过程微生物监控
对工厂中酱卤鸭翅生产过程的摊凉车、装框人员手掌、装产品框的内袋、装盒人员手掌等的细菌总数和大肠菌群进行监控,了解产品生产中的卫生条件。菌落总数测定按照GB 4789.2—2010《食品微生物学检验:菌落总数测定》方法进行;大肠菌群计数按照GB 4789.3—2010《食品微生物学检验:大肠菌群计数》方法进行。
1.3.2 贮藏实验
取工厂生产的酱卤鸭翅产品,由冷藏车运至实验室,放置于15 ℃条件下贮藏,间隔不同时间取样,测定样品中细菌总数,每次实验作3 个重复。
1.3.3 气体比例测定
将气体比例测定仪的探头插入不同贮藏时间的产品气调包装盒中,测定其O
2和CO
2的气体比例,每次实验作3 个重复。
1.3.4 直接提取样品中细菌DNA
取1.3.2节细菌总数测定中样品前处理1∶10稀释液30 mL于50 mL离心管中,800 r/min离心2 min后,吸取上清液,12 000 r/min离心10 min,取菌体沉淀,用2 mL生理盐水淋洗取上清液,加入180 μL溶菌酶(20 mg/mL)缓冲液37 ℃处理1 h,后按照细菌DNA提取试剂盒的操作说明进行,提取的细菌DNA经Nano Drop蛋白核酸浓度定量仪和1.2%琼脂糖电泳验证后,置于-20 ℃冰箱冻存。
1.3.5 细菌16S rRNA基因V3区PCR扩增
采用巢氏PCR对提取的细菌16S rRNA基因V3可变区进行扩增,引物见表1。首先第一轮PCR利用8f/798r引物扩增约800 bp的细菌16S rRNA基因序列,再以上述PCR产物为模板利用引物GC338f/518r对细菌16S rRNA基因的V3区片段进行第二轮的“touchdown”PCR扩增。PCR反应体系(50 ☒L):GoTaq
☒Green Master Mix(2×)25 ☒L,引物各1 ☒L(0.2 ☒mol/L),DNA模板1 ☒L,ddH
2O 9.5 ☒L。PCR扩增程序:94 ℃预变性5 min,然后采用touchdown PCR程序,即20 个循环(94℃变性1 min,退火温度从65 ℃到55 ℃,退火30 s,72 ℃延伸3 min),之后于恒定退火温度条件下进行10 个循环(94 ℃变性1 min,55 ℃退火30 s,72 ℃延伸3 min),最后72 ℃延伸10 min。PCR产物经1.2%琼脂糖凝胶电泳检测后,置于-20 ℃冰箱冻存。
表1 实验中所用引物
[1155]
Table1 Primers used in this study
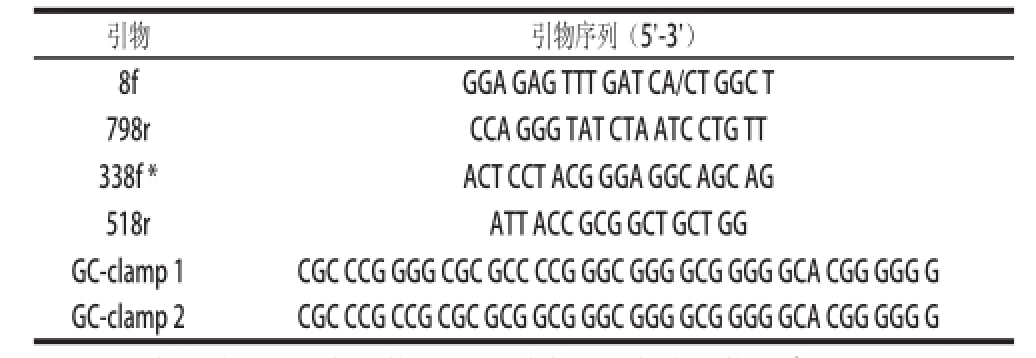
注:f.正向引物;r.反向引物;*. GC夹板2加在该引物5'端。
引物引物序列(5’-3’)8fGGA GAG TTT GAT CA/CT GGC T 798rCCA GGG TAT CTA ATC CTG TT 338f *ACT CCT ACG GGA GGC AGC AG 518rATT ACC GCG GCT GCT GG GC-clamp 1CGC CCG GGG CGC GCC CCG GGC GGG GCG GGG GCA CGG GGG G GC-clamp 2CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG G
1.3.6 DGGE分析
对细菌16S rRNA基因V3区的扩增产物分别进行DGGE分析。采用Biorad Dcode apparatus电泳仪,聚丙烯酰胺凝胶质量分数为10%(丙烯酰胺-甲叉双丙烯酰胺质量比为37.5∶1),经实验摸索确定变性梯度为32%~47%(100%变性剂含有7 mol/L尿素和40%甲酰胺),在0.5×TAE缓冲液中,60 ℃恒温条件下,先200 V电压下预电泳10 min,后在85 V电压下电泳16 h。
电泳结束后,将DGGE胶片用Gelred染料(15 mL超纯水+1 mol/L NaCl 5 mL+60 ☒L Gelred染料)染色15 min。弃去染色液,再用ddH
2O漂洗。染色后用凝胶成像系统拍照。
1.3.7 特殊条带的序列测定和结果分析
将Gelred染料染色后的DGGE胶片置于紫外灯下,利用无菌刀片切下不同位置的条带,分别放入灭过菌的1.5 mL离心管,加入20 ☒L DEPC水置于4 ℃条件下过夜。取2 ☒L作为模板以GC338f/518r为引物进行16S rRNA基因V3区扩增(条件同1.3.5节),PCR产物经DGGE后证明与所割条带位于相同的迁移位置,割胶回收,用不含GC夹板的338f/518r引物再次扩增16S rRNA基因V3区序列,纯化后测序(Invitrogen,上海)。登录NCBI(www.ncbi.nlm.nih,gov/blast/),将所得序列与数据库中已知序列进行相似性比对。
1.4 数据处理分析
应用Quantity One软件对DGGE图谱进行分析,其中采用非加权配对算术平均法(unweighted pair-group method with arithmetic means,UPGMA)进行相似性分析。
2 结果与分析
2.1 加工过程微生物监控
通过对酱卤鸭翅生产过程中摊凉车、装框人员手掌、装产品框的内袋、装盒人员手掌等产品二次污染的工艺点进行细菌总数和大肠菌群检测,了解产品生产的卫生环境情况,结果如表2所示。由表2可看出,产品生产过程中卫生环境良好,4 个产品工艺点中的菌落总数和大肠菌群数量均较低,对产品不会产品较大污染。
表2 产品加工过程中各工艺点的细菌总数和大肠菌群数量
Table2 Total numbers of bacteria and coliforms at each process point during the production of products
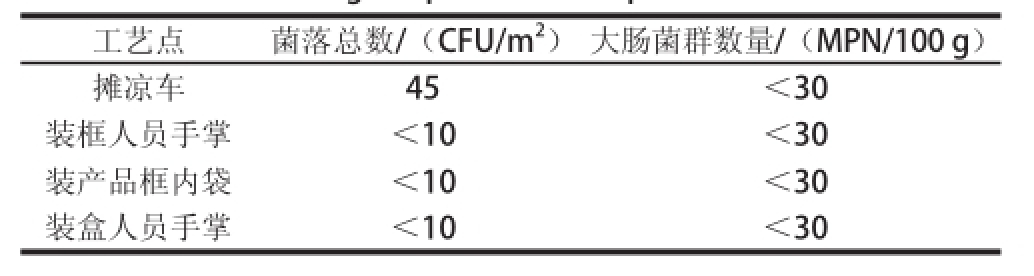
工艺点菌落总数/(CFU/m
2)大肠菌群数量/(MPN/100 g)摊凉车45<30装框人员手掌<10<30装产品框内袋<10<30装盒人员手掌<10<30
2.2 贮藏过程细菌总数变化
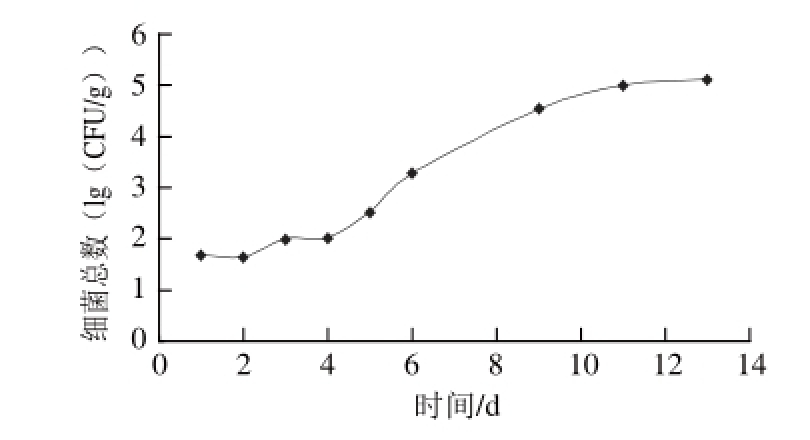
图1 气调包装酱卤鸭翅贮藏过程中细菌总数变化
Fig.1 Changes in total number of bacteria of pot-stewed duck wings during storage
由图1可知,酱卤鸭翅的初始污染细菌数小于2(lg(CFU/g)),表明酱卤鸭翅产品初始污染菌数较低,产品质量控制较好。随着贮藏时间的延长,样品从第5天开始细菌呈增长趋势,至贮藏第9天左右产品细菌总数超过4(lg(CFU/g))。至产品贮藏第12天,细菌生长减缓,数量为5(lg(CFU/g))以上。
2.3 贮藏过程气体比例变化
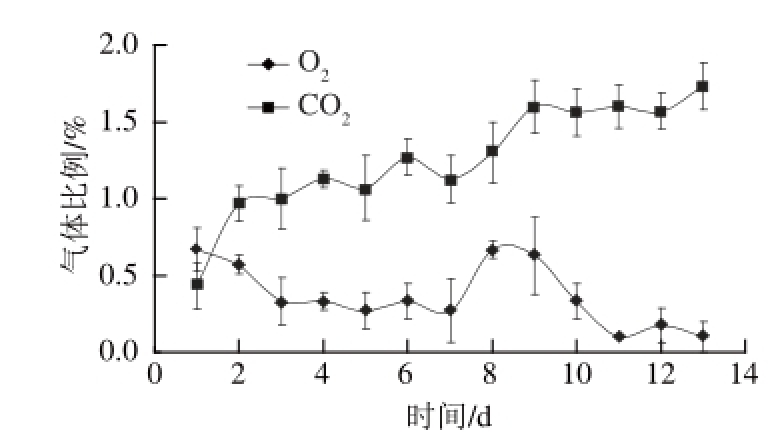
图2 贮藏过程中酱卤鸭翅包装袋中气体比例的变化
Fig.2 Changes in gas proportion in the package of pot-stewed duck wings during storage
由图2可知,产品中的气体成分主要为N
2,残留少量的O
2和CO
2。产品贮藏初期,盒子内O
2产生消耗,CO
2气体急剧上升,这可能是由于需氧细菌的呼吸作用导致O
2的消耗,释放CO
2;随着贮藏时间的延长,O
2体积分数未发生较大变化,而CO
2气体比例逐渐升高,至第12天时达到1.5%以上,这可能是贮藏过程中厌氧细菌适应环境开始生长,无氧呼吸产生CO
2,而随着O
2含量的减少,需氧细菌受到抑制;贮藏期间O
2气体比例在0.5%之间浮动。
2.4 菌群多样性
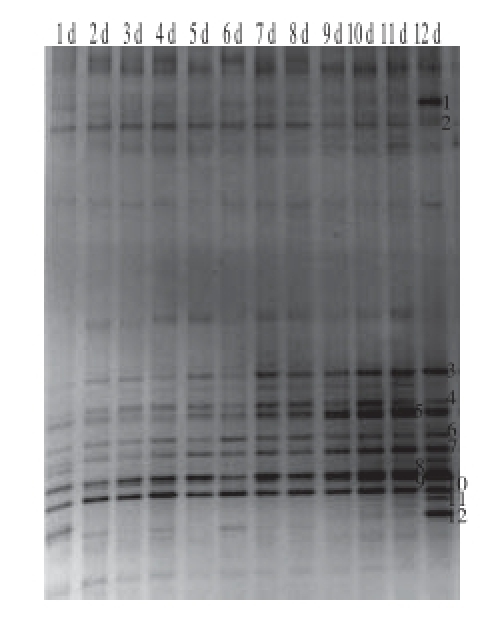
图3 不同贮藏时间酱卤鸭翅中细菌16S rRNA基因V3区DGGE图谱
Fig.3 DGGE profile of V3 regions of bacterial 16S rRNA genes from pot-stewed duck wings during different storage periods
表3 DGGE条带分离的细菌16S rRNA基因序列鉴定
Table3 DGGE bands identified by means of 16S rRNA gene sequencing
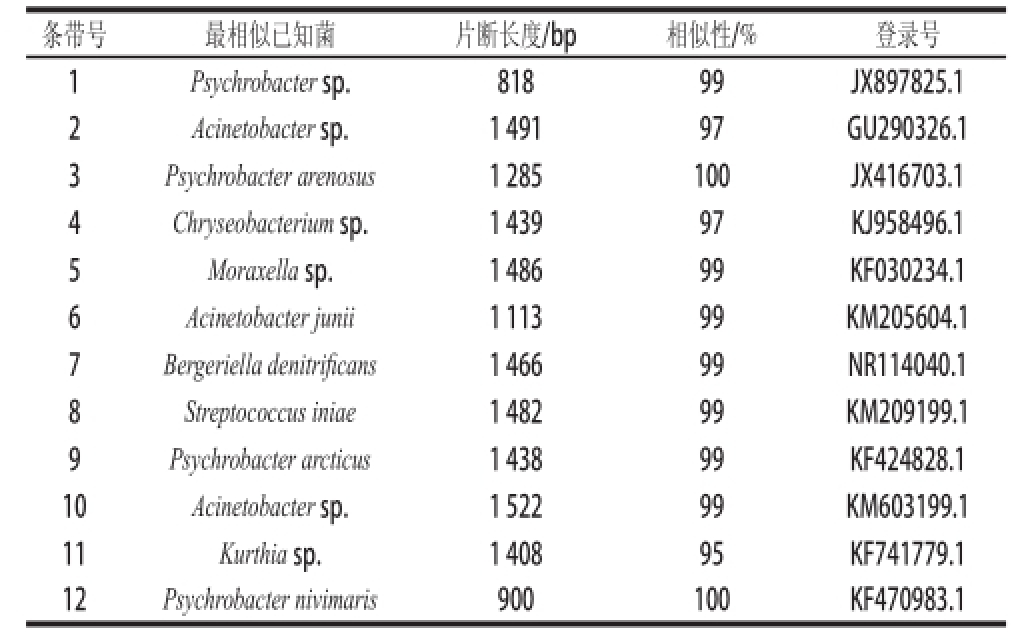
条带号最相似已知菌片断长度/bp相似性/%登录号1Psychrobacter sp.81899JX897825.1 2Acinetobacter sp.1 49197GU290326.1 3Psychrobacter arenosus1 285100JX416703.1 4Chryseobacterium sp.1 43997KJ958496.1 5 Moraxella sp.1 48699KF030234.1 6Acinetobacter junii1 11399KM205604.1 7Bergeriella denitrifi cans1 46699NR114040.1 8Streptococcus iniae1 48299KM209199.1 9Psychrobacter arcticus1 43899KF424828.1 10Acinetobacter sp.1 52299KM603199.1 11Kurthia sp.1 40895KF741779.1 12Psychrobacter nivimaris900100KF470983.1
直接提取贮藏第1~12天的酱卤鸭翅中细菌DNA,对细菌16S rRNA基因V3区进行PCR扩增,扩增产物进行DGGE分析。由图3和表3可知,酱卤鸭翅贮藏从第1~12天,条带数量和颜色发生了明显变化,贮藏初期条带相对复杂,条带不明显且亮度相对均一,主要条带为条带2(Acinetobacter sp.)、条带5(Moraxella sp.)、条带6(Acinetobacter junii)、条带8(Streptococcus iniae)和条带10(Acinetobacter sp.);随着贮藏时间的延长,由于细菌适应环境(包括气体环境、温度、盐浓度、食品成分等)的能力不同,条带5(Moraxella sp.)、条带8(Streptococcus iniae)及条带10(Acinetobacter sp.)逐渐加深,说明这3 种菌在贮藏过程中逐渐增多,而条带2(Acinetobacter sp.)在贮藏过程中逐渐变淡,说明贮藏环境对部分Acinetobacter菌株有一定抑制作用;从第2天开始检测到条带3(Psychrobacter arenosus)、条带4(Chryseobacterium sp.)、条带7(Bergeriella denitrificans)及条带9(Psychrobacter arcticus);第7天之后泳道中条带明显加深,至贮藏末期条带3(Psychrobacter arenosus)、条带5(Moraxella sp.)、条带7(Bergeriella denitrifi cans)、条带8(Streptococcus iniae)、条带9(Psychrobacter arcticus)及条带10(Acinetobacter sp.)成为主要优势条带,其中条带8(Streptococcus iniae)和条带10(Acinetobacter sp.)在样品贮藏过程中均存在,且条带清晰明显;贮藏第12天样品还检测到条带1(Psychrobacter sp.)、条带11(Kurthia sp.)和条带12(Psychrobacter nivimaris)。
通过以上结果分析,酱卤鸭翅产品在贮藏初期的初始污染菌群有不动杆菌、莫拉氏菌及链球菌等,其中不动杆菌为贮藏初期的主要菌群(条带2、6、10)。随着贮藏时间的延长,由DGGE图谱可看出大部分不动杆菌未发生明显变化(条带10除外),部分条带变淡,且贮藏末期未产生新的不动杆菌菌株,说明本产品受不动杆菌初始污染,但可能受产品成分和环境条件的抑制,在贮藏过程中未见增长。同时,产品贮藏末期主要菌群为嗜冷杆菌、莫拉氏菌、链球菌等,由DGGE图谱发现嗜冷杆菌在产品初期未检出,在贮藏过程中条带出现并逐渐加深,最终成为贮藏末期的优势菌(条带1、3、9、12)。
2.5 相似性分析
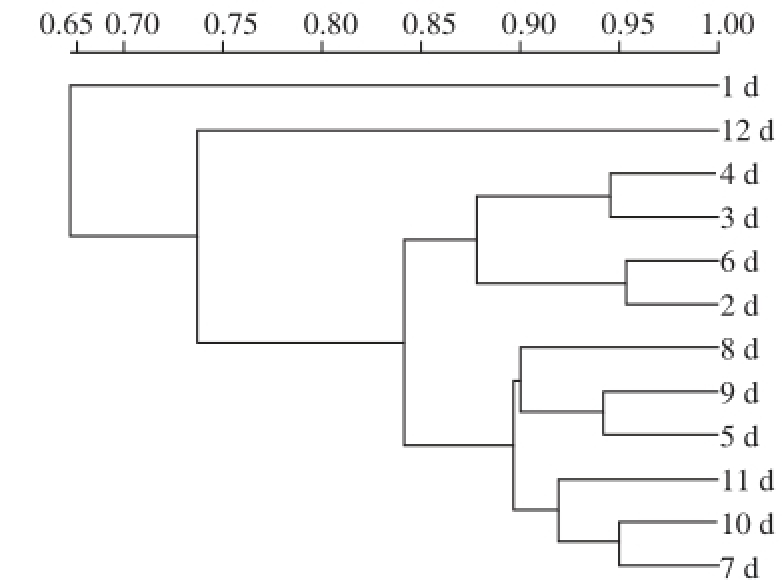
图4 气调包装酱卤鸭翅16S rRNA基因V3区DGGE图谱UPGMMAA相似性分析
Fig.4 UPGMA cluster analysis of the DGGE profiles of the V3 region of bacterial 16S rRNA genes from pot-stewed duck wings
对DGGE图谱采用UPGMA法进行相似性分析,结果见图4。第1天的样品与其他样品不在同一簇中,相似性仅为65%,贮藏第12天的样品也与其他样品存在一定的差异,相似性小于75%。同时,贮藏前6 d和后6 d的样品之间也存在一定不同,可进一步表明产品贮藏前期与后期细菌相似性可能有所差异。
3 讨 论
酱卤肉制品是中国典型的传统肉制品,通过气调包装来延长产品货架期已成为此类产品的发展趋势。但是,此类产品的二次污染环节较多,导致产品中初始污染微生物种类和数量各不相同,对酱卤肉制品的质量安全产生重要影响。虽然许多酱卤肉制品放置于低温贮藏,但在初始污染的微生物中仍有许多嗜冷细菌的存在导致产品的腐败,直接影响产品的质量安全。同时,在产品的贮藏过程中细菌之间存在相互竞争、拮抗、共生等作用,以适应环境并促进生长和繁殖,从而构成产品腐败微生物的菌相。国内外应用传统微生物培养方法和PCR-DGGE技术分析不同肉及肉制品中微生物的菌相变化已有相关报道,包括冷却肉、发酵肉制品等
[16-20],对气调包装条件下酱卤产品中微生物的菌群结构了解甚少,因此,本实验以传统酱卤鸭翅为例,应用PCR-DGGE技术分析酱卤鸭翅15 ℃贮藏过程的菌群结构变化。
酱卤鸭翅的气调包装材料采用阻隔性较好的盖膜(PE/EVOH/PE/黏合剂/OPP)和底膜结构(APET/黏合剂/PE),可有效地阻隔外界空气,保证产品包装内气体成分的稳定性。实验结果表明,产品包装盒内气体比例在贮藏过程中未发生很大变化,也证明包装材料的阻隔性较好,可对产品中好氧细菌起到抑制作用。其中CO
2含量在贮藏过程中有所升高,可能是由于产品中厌氧细菌的呼吸作用产生的。本实验传统微生物培养结果可看出,15 ℃贮藏条件下产品中的细菌在第5天左右度过迟滞期,开始生长,对不同初始污染菌数的样品,该时间是一个影响产品货架期的重要时间点。在本实验中,加工车间不同工序点微生物监测结果表明此车间卫生条件良好,可保证产品的初始污染菌数低,为了达到更好的贮藏效果,工厂在生产过程中严格控制产品初始污染菌量是非常必要的。但在本实验中,至贮藏第9天左右产品细菌总数超过4(lg(CFU/g)),之后可能超过GB 2726—2005《熟肉制品卫生标准》规定酱卤产品细菌总数80 000 CFU/g。
DGGE图谱分析表明,不动杆菌为气调包装酱卤鸭翅的主要初始污染菌群,由于此类细菌在环境中广泛存在,可能在产品煮制后的切割、包装等环节存在二次污染,因此,工厂应尽量控制加工环境卫生,减少初始污染菌数。而嗜冷杆菌在贮藏过程中出现并生长,最终成为贮藏末期的优势菌,说明此类细菌能适应产品的环境,是产品卫生控制的关键细菌之一。有许多文献
[21-25]报道,嗜冷杆菌属耐盐且具有渗透耐压性,含低温酶使其适应寒冷环境,因此在本产品中具有一定的致腐作用。现有酱卤鸭肉制品菌相变化的研究甚少,大部分文献主要监测酱卤鸭肉产品贮藏过程中细菌总数的变化,仅见殷雪
[5]通过传统微生物培养方法对真空包装卤鸭脖中的菌落总数、大肠菌群、嗜冷菌、耐热菌、乳酸菌、假单胞菌、肠杆菌科等进行监测,发现贮藏过程中的优势腐败菌主要为热杀索丝菌、肠杆菌科、假单胞菌等,而本实验应用DGGE结合16S rRNA基因序列,分析气调包装酱卤鸭翅的菌群多样性,确定产品贮藏末期的优势菌群为嗜冷杆菌,为进一步研究气调包装酱卤鸭翅的保鲜措施提供一定的科学依据。
参考文献:
[1] 周光宏. 肉品加工学[M]. 北京: 中国农业出版社, 2008.
[2] 赵改名, 李苗云, 柳燕霞. 酱卤肉制品加工[M]. 北京: 化学工业出版社, 2008: 64-65.
[3] 段昌圣. 酱卤鸭脖的贮藏特性及其保水性研究[D]. 武汉: 华中农业大学, 2012.
[4] 张海彬. 风味卤鸭的加工工艺研究[D]. 重庆: 西南大学, 2008.
[5] 殷雪. 低温禽肉制品(卤鸭脖)综合保鲜技术研究[D]. 武汉: 武汉工业学院, 2008.
[6] 海丹, 黄现青, 柳艳霞, 等. 酱牛肉气调和真空包装保鲜效果比较分析[J]. 食品科学, 2014, 35(2): 297-300. doi:10.7506/spkx1002-6630-201402058.
[7] 谢彬. 风味卤鸭脖工艺优化研究及其HACCP体系的建立[D]. 长沙:湖南农业大学, 2012.
[8] 王强. 酱鸭与香辛料风味物质及其在加工过程中的变化[D]. 南昌:南昌大学, 2011.
[9] 赵双卷. 卤鸭滋味物质在加工和储藏过程中的变化研究[D]. 武汉:华中农业大学, 2012.
[10] 陈海光, 白卫东, 徐伟安, 等. 酱卤鸭肉综合保藏技术研究[J]. 中国家禽, 2007, 29(20): 45-46.
[11] STOOPS J, RUYTERS S, BUSSCHAERT P. Bacterial community dynamics during cold storage of minced meat packaged under modifi ed atmosphere and supplemented with different preservatives[J]. Food Microbiology, 2015, 48: 192-199.
[12] BAGDATLI A, KAYAARDI S. Influence of storage period and packaging methods on quality attributes of fresh beef steaks[J]. CYTAJournal of Food, 2015, 13(1): 124-133.
[13] ROSSAINT S, KLAUSMANN S, KREYENSCHMIDT J. Effect of high-oxygen and oxygen-free modifi ed atmosphere packaging on the spoilage process of poultry breast fillets[J]. Poultry Science, 2015,94(1): 96-103.
[14] del OLMO A, CALZADA J, NUNEZ M. Effect of high-pressureprocessing and modified-atmosphere-packaging on the volatile compounds and odour characteristics of sliced ready-to-eat “lacon”,a cured-cooked pork meat product[J]. Innovative Food Science and Emerging Technologies, 2014, 26: 134-142.
[15] JIANG Yun, GAO Feng, XU Xinglian, et al. Changes in the composition of the bacterial fl ora on tray-packaged pork during chilled storage analyzed by PCR-DGGE and real-time PCR[J]. Journal of Food Science, 2011, 76(1): 27-33.
[16] DIAS F S, RAMOS C L, SCHWAN R F. Characterization of spoilage bacteria in pork sausage by PCR-DGGE analysis[J]. Food Science and Technology, 2013, 33(3): 468-474.
[17] OSES S M, DIEZ A M, MELERO B, et al. Characterization by culture-dependent and culture-independent methods of the bacterial population of suckling-lamb packaged in different atmospheres[J]. Food Microbiology, 2013, 36(2): 216-222.
[18] MERTZ A W, KOO O K, O'BRYAN C A, et al. Microbial ecology of meat slicers as determined by denaturing gradient gel electrophoresis[J]. Food Control, 2014, 42: 242-247.
[19] LUCIA A, SARA S, GLORIA S, et al. The microbial ecology of a typical Italian salami during its natural fermentation[J]. International Journal of Food Microbiology, 2007, 120: 136-145.
[20] KRIS A, KLAAS D, KATHY M, et al. Diversity of lactic acid bacteria from modified atmosphere packaged sliced cooked meat products at sell-by date assessed by PCR-denaturing gradient gel electrophoresis[J]. Food Microbiology, 2010, 27: 12-18.
[21] 岑璐伽, 唐善虎, 郝小倩, 等. 冷却牦牛肉贮藏过程中优势菌的PCR-变性梯度凝胶电泳分析[J]. 肉类研究, 2012, 26(1): 36-40.
[22] 陈韵, 胡萍, 湛剑龙, 等. 运用PCR-DGGE技术分析贵州侗族酸肉中细菌多样性[J]. 食品与机械, 2014, 30(2): 188-191.
[23] 张红琳, 周红霞, 周东蕊, 等. 烤鸭肉在储存过程中菌群结构变化研究[J]. 南京晓庄学院学报, 2011, 11(6): 37-40.
[24] YU Yuanshan, QIU Liping, WU Hui, et al. Degradation of zearalenone by the extracellular extracts of Acinetobacter sp. SM04 liquid cultures[J]. Biodegradation, 2011, 22: 613-622.
[25] MORADI S, RAZAVI S H, MOUSAVI S, et al. Optimization and partial purification of a high-activity lipase synthesized by a newly isolated Acinetobacter from offshore waters of the Caspian Sea under solid-state fermentation[J]. RSC Advances, 2015, 5(16): 12052-12061.
Analysis of Microbial Communities of Pot-Stewed Duck Wings Packaged in Modified Atmosphere during Storage
YE Keping
1, LIU Jia
1, LIU Mei
1, LI Chunbao
1, GUO Chengxiang
2
(1. Synergetic Innovation Center of Food Safety and Nutrition, National Center of Meat Quality and Safety Control,College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China;2. College of Food Science and Light Industry, Nanjing Technology University, Nanjing 211800, China)
Abstract:The changes in microbial communities and counts of pot-stewed duck wings packaged in modified atmosphere during storage at 15 ℃ were explored by traditional bacterial cultivation and polymerase chain reaction-denaturing gradient gel electrophoresis (PCR-DGGE). Results showed that the sanitation condition during the process of pot-stewed duck wings was favorable, which led to lower initial contaminant bacteria counts (< 2 (lg(CFU/g)) and total bacterial counts of products after about 9 days of storage were more than 4 (lg(CFU/g)). Results of DGGE profiles indicated that Acinetobacter sp. was the main bacterial species at the early stage. In contrast, the major bacteria in pot-stewed duck wings at the end of storage included Psychrobacter sp., Moraxella sp., Streptococcus sp. etc., with Psychrobacter sp. being the most predominant spoilage bacterial species.
Key words:pot-stewed duck wings; modified atmosphere packaging (MAP); storage; microbial community; PCR-DGGE
中图分类号:TS205
文献标志码:A
文章编号:1002-6630(2015)14-0201-05
doi:10.7506/spkx1002-6630-201514039
收稿日期:2015-04-10
基金项目:国家自然科学基金青年科学基金项目(31401558);中央高校基本科研业务费专项(KJQN201548)
作者简介:叶可萍(1986—),女,讲师,博士,研究方向为肉品质量安全控制。E-mail:kpye@njau.edu.cn






