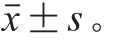 采用
IBM SPSS Statistics 19软件对数据进行单因素方差分析和相关性分析,如果方差分析差异性显著(P<
0.05),则使用
Duncan’
s进行多重比较。采用
Peakfit Version 4.12软件进行图谱分析处理,采用
Origin 8.0软件进行图表制作。
采用
IBM SPSS Statistics 19软件对数据进行单因素方差分析和相关性分析,如果方差分析差异性显著(P<
0.05),则使用
Duncan’
s进行多重比较。采用
Peakfit Version 4.12软件进行图谱分析处理,采用
Origin 8.0软件进行图表制作。
刘春雷 1,孙立斌 2,李相昕 2,梁宝生 2,齐晓芬 2,任 悦 2,李 丹 1,2,江连洲 2,*
(1.宁德师范学院生物系,福建 宁德 352100;2.东北农业大学食品学院,黑龙江 哈尔滨 150030)
摘 要:以 6个具有代表性的大豆品种作为实验材料提取 7S和 11S蛋白,并经 Superdex 200凝胶柱层析进行纯化,采用十二烷基硫酸钠 -聚丙烯酰胺凝胶电泳验证其纯度均在 90%以上。采用傅里叶红外光谱分析 7S和 11S蛋白的二级结构,采用 ANS荧光探针法测定 7S和 11S蛋白的表面疏水性,利用相关性分析探讨 7S和 11S蛋白表面疏水性与二级结构的构效关系。经分析得出:大豆蛋白的表面疏水性与 α -螺旋含量成负相关;与 β -折叠含量成负相关;与 β -转角含量成正相关,与无规卷曲含量成正相关。
关键词:7S和 11S蛋白;二级结构;傅里叶红外光谱;表面疏水性;相关性
蛋白质的表面疏水性影响蛋白质分子间的相互作用,相比于整体的疏水性,表面疏水性对蛋白质的功能具有更大的影响,是衡量蛋白质功能性质的关键指标之一 [1]。大豆蛋白质的结构及性质随大豆种类和产地的不同而有所不同 [2-6],且目前对大豆蛋白质构象的研究结论各有不同 [7-10]。基于以上事实,本研究选择我国常用的、具有区域代表性的 6个大豆品种做为实验材料,研究大豆蛋白二级结构对表面疏水性的影响。以提取纯化的 7S和 11S大豆蛋白组分为研究对象,其目的是为了最大限度地排除大豆蛋白 7S和 11S组分协同作用的影响。并且,在实验中严格控制使不同品种的 7S和 11S蛋白制备条件完全一致,以消除实验条件差异对大豆蛋白结构及性质的影响,准确分析不同品种大豆 7S和 11S蛋白的二级结构及表面疏水性,探讨大豆 7S和 11S蛋白二级结构对表面疏水性的影响。最终明确大豆蛋白质二级结构与表面疏水性的构效关系,为今后开发 大豆分离蛋白( soybean protein isolate, SPI)特定功能性产品而进行分子设计和重组提供重要的理论指导和技术支持。
1.1材料与试剂
大豆:东农 42东北农业大学大豆研究所;黑农 46、合丰 55黑龙江省农业科学院大豆所;冀豆 12河北省农林科学院粮油作物研究所;皖豆 28安徽省农业科学院作物研究所;福豆 234福建省农业科学院作物研究所。大豆粉碎后过 40目筛,用正己烷脱脂,得脱脂大豆粉。
1-苯胺基 -8-萘磺酸( 1-anilino-8-naphthalisene sulfonate acid, ANS) 美国 Sigma公司;其余试剂均为国产分析纯。
1.2仪器与设备
AKTA Explorer蛋白质纯化仪 美国 GE公司; Mini-Protean 4电泳仪 美国 Bio-Rad公司; Tanon凝胶成像系统 上海天能科技有限公司; F-4500荧光分光光度计日本 Hitachi公司; MAGNA-IR560傅里叶变换红外光谱系统 美国尼高力仪器公司。
1.3方法
1.3.1 7S和 11S蛋白的制备
参照 Nagano [11]、 Liu Chun [12]、孙鹏 [13]等方法稍加修改。
11S蛋白制备流程如下:脱脂豆粉→ 0.03 mol/L Tris-HCl缓冲液(料液比 1∶15(m /V))、 pH 8.5、 45℃水浴中搅拌 1 h→离心( 4℃, 9 600×g, 30 min)→上清液→加固体至 0.01 mol/L,调 pH 6.4, 4℃过夜→离心( 4℃, 6 500×g, 20 min)→沉淀→溶于 pH 7.6的磷酸盐缓冲液( phosphate buffer solution, PBS)( 2.6 mmol/L KH 2 PO 4、 32.5 mmol/L K 2 HPO 4、 0.4 mol/L NaCl、 10 mmol/Lβ -巯基乙醇,离子强度 0.5, pH 7.6)→离心( 4℃, 9 600×g, 30 min)→上清液→凝胶柱层析纯化( Superdex 200凝胶柱,流速 1 mL/min,洗脱液为 pH 7.6的 PBS)→收集液→透析→冻干→ 11S蛋白。
7S蛋白制备流程如下: 4 ℃过夜冷沉离心上清液→调 pH 4.8→离心( 4 ℃, 6 500×g, 20 min)→沉淀→复溶于 4 ℃、 pH 8.5的 0.03 mol/L Tris-HCl缓冲液→调 pH 6.2→离心( 4 ℃, 9 600×g, 30 min)→上清液→调 pH 7.6→ 51%的饱和硫酸铵盐析→离心( 4 ℃, 9 600×g, 30 min)→上清液→ 100%的饱和硫酸铵盐析→离心( 4 ℃, 6 500×g, 20 min)→沉淀溶于 pH 7.6的 PBS→凝胶柱层析纯化(条件同 11S)→收集液→透析→冻干→ 7S蛋白。
1.3.2 7S和 11S蛋白的纯度鉴定
采用十二烷基硫酸钠 -聚丙烯酰胺凝胶电泳( sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)还原电泳方法测定 7S和 11S蛋白的纯度。 SDS-PAGE采用不连续垂直板状凝胶电泳 [14-15]。凝胶厚度 1 mm, 5%浓缩胶, 12%分离胶。电泳凝胶分析采用 Tanon凝胶成像系统软件分析。
1.3.3表面疏水性的测定
采用 ANS荧光探针法 [16-17]。分别称取 0.25 g蛋白样品溶于 50 mL PBS( 2.6 mmol/L KH 2 PO 4、 32.5 mmol/L K 2 HPO 4, pH 7.6),室温下搅拌 1 h, 20 ℃、 10 000 r/min离心 30 min,上清液用同一 PBS依次稀释(采用 Lowry法测定蛋白质质量浓度在 0.07~ 0.67 mg/mL之间)。分别取不同质量浓度的稀释样品 4 mL,加入 40μL浓度为 8 mmol/L的 ANS溶液(采用上述 PBS配制),迅速混匀后静置 3 min,在 390 nm的激发波长和 470 nm的发射波长下测定荧光强度,狭缝 5 nm,同时测定未加 ANS的相应浓度的样品溶液的荧光强度做空白。以蛋白质质量浓度为横坐标,荧光强度为纵坐标作图,曲线初始阶段的斜率即为蛋白质分子的表面疏水性指数S 0。
1.3.4傅里叶红外光谱( Fourier transform infrared spectroscopy,FT-IR)分析
采用溴化钾压片法。室温下以空气为背景,测量波数范围为 4 000~ 400 cm -1,分辨率 4 cm -1,扫描次数 64次 [18]。对谱图酰胺Ⅰ带( 1 600~ 1 700 cm -1)进行基线校正、 Savitsk-Go1ay函数平滑处理 [19],在二阶导数谱基础上采用 Gauss分峰拟合 [20],多次拟合使残差最小(r 2≥ 0.999)。计算拟合图谱中各子峰积分面积得到二级结构 4种类型的相对百分含量。
1.4数据统计与分析
单项实验重复
3次,结果表示为
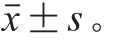 采用
IBM SPSS Statistics 19软件对数据进行单因素方差分析和相关性分析,如果方差分析差异性显著(P<
0.05),则使用
Duncan’
s进行多重比较。采用
Peakfit Version 4.12软件进行图谱分析处理,采用
Origin 8.0软件进行图表制作。
采用
IBM SPSS Statistics 19软件对数据进行单因素方差分析和相关性分析,如果方差分析差异性显著(P<
0.05),则使用
Duncan’
s进行多重比较。采用
Peakfit Version 4.12软件进行图谱分析处理,采用
Origin 8.0软件进行图表制作。
2.1 7S和 11S蛋白的纯度鉴定
SDS-PAGE纯度鉴定结果为:东农 42-11S 95.05%,黑农 46-11S 97.30%,合丰 55-11S 99.07%,冀豆 12-11S 95.97%,皖豆 28-11S 96.08%,福豆 234-11S 97.05%,东农 42-7S 93.46%,黑农 46-7S 93.74%,合丰 55-7S 92.18%,冀豆 12-7S 94.75%,皖豆 28-7S 92.68%,福豆 234-7S 93.53%。可见, 7S和 11S蛋白的纯度均在 90%以上,满足实验要求。
2.2 7S和 11S蛋白的红外光谱分析
不同品种 7S和 11S蛋白的 FT-IR谱图如图 1所示。 6个大豆品种的 7S和 11S蛋白的红外光谱相似,在酰胺Ⅰ带有很强的吸收,说明样品蛋白质含量非常高。
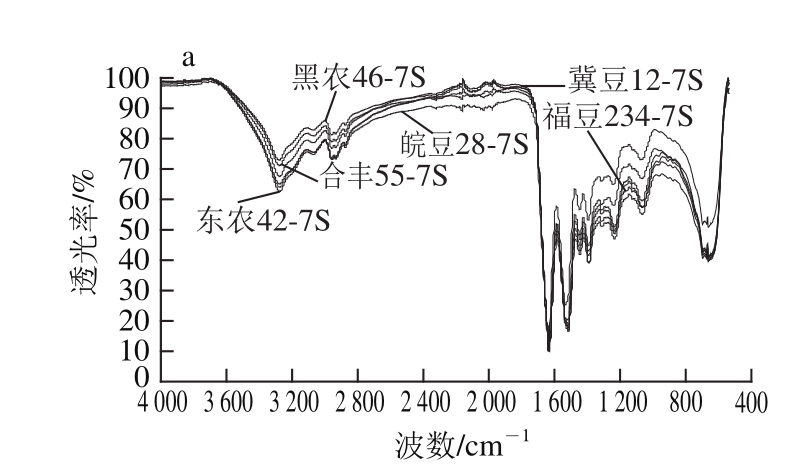

图1 不同品种大豆7S蛋白(a)和11S蛋白(b)的FT-IR谱图
Fig.1 FT-IR spectra of 7S (a) and 11S (b) proteins derived from different soybean varieties
不同品种 7S和 11S蛋白的二级结构信息重叠在红外光谱的酰胺Ⅰ带里,本实验利用波段缩小技术将 FT-IR谱图中的酰胺Ⅰ带细分,得到α -螺旋、β -折叠、β -转角和无规卷曲等二级结构的定性定量信息。蛋白质二级结构的定量方式有多种,采用分析结果较为准确的二阶导数红外去卷积光谱拟合 [21]。对不同品种 7S和 11S蛋白的 FT-IR分析依次进行基线校正、去卷积处理、二阶导数拟合处理,经多次拟合确保拟合残差最小。不同品种 7S和 11S蛋白的 FT-IR酰胺Ⅰ带去卷积二阶导数拟合图谱如图 2、 3所示。
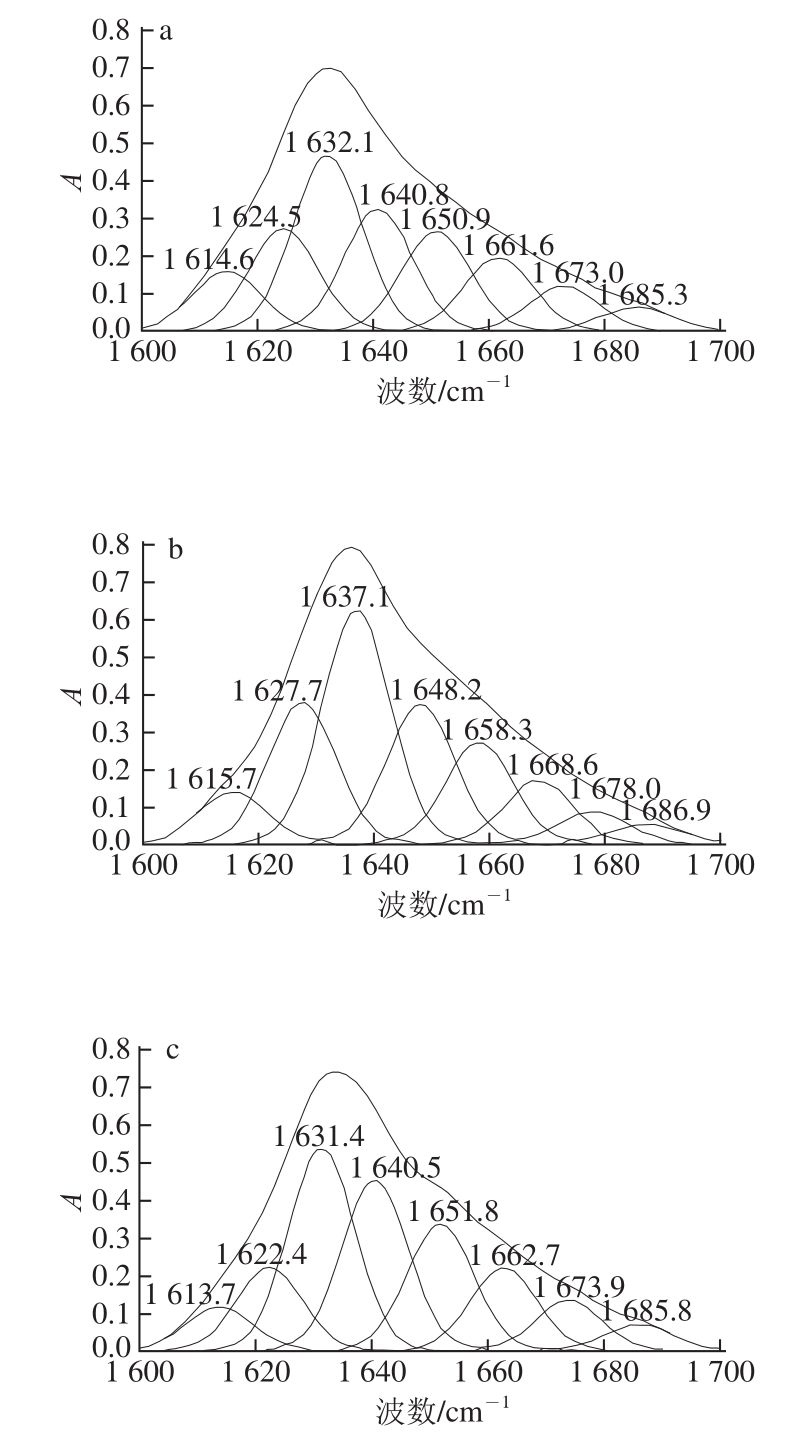

图2 不同品种大豆7S蛋白的酰胺I带拟合图谱
Fig.2 Second-derivative FT-IR spectra in the amide I region and Gaussian curve fitting for 7S proteins derived from different soybean varieties
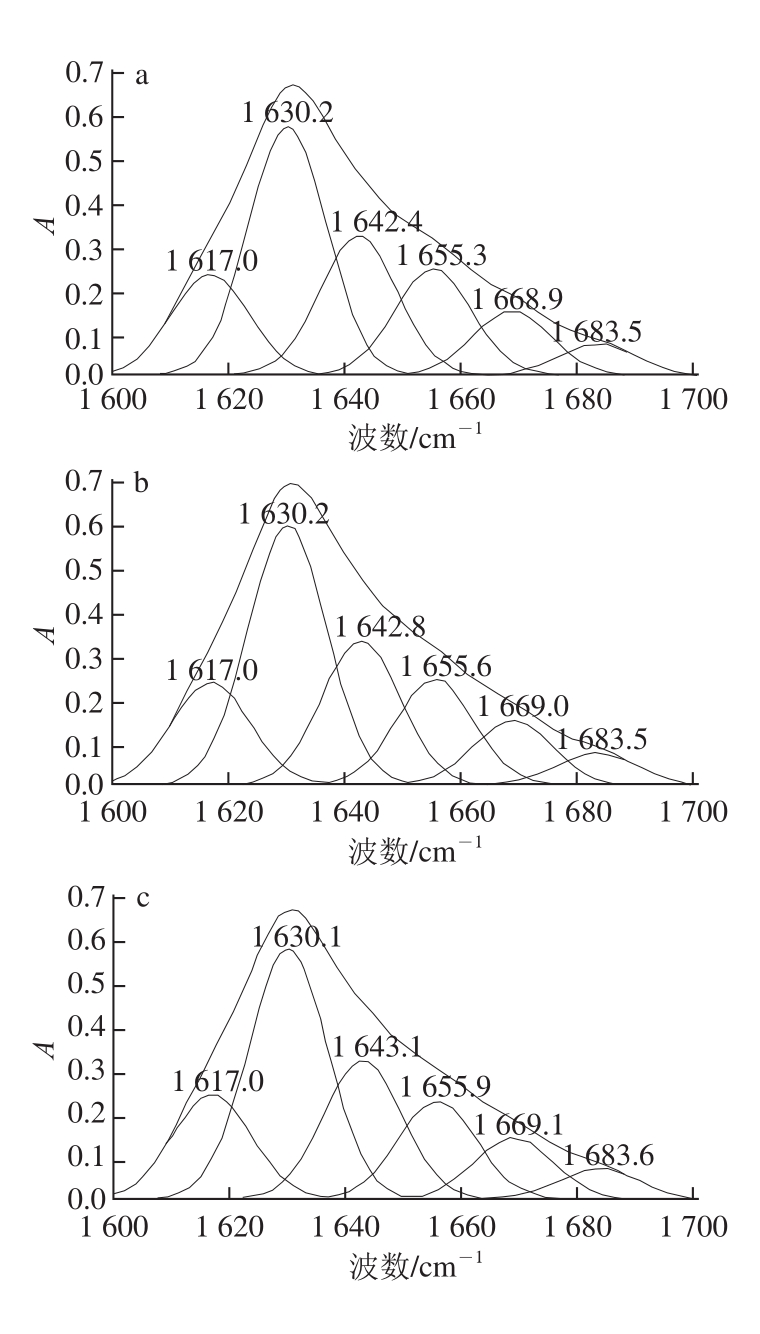

图3 不同品种大豆11S蛋白的酰胺I带拟合图谱
Fig.3 Second-derivative FT-IR spectra in the amide I region and Gaussian curve fitting for 11S protein derived from different soybean varieties
拟合图谱中各子峰与二级结构对应关系为: 1 612 cm -1附近的吸收峰为蛋白质和多肽的侧链吸收, 1 623~ 1 632 cm -1为β -折叠结构; 1 640~ 1 649 cm -1为无规卷曲结构; 1 650~ 1 660 cm -1为α -螺旋结构; 1 661~ 1 700 cm -1为β -转角结构 [22]。通过计算各子峰积分面积得到不同品种 7S和 11S蛋白的二级结构定量信息,即α -螺旋、β -折叠、β-转角和无规卷曲的相对百分含量,见表 1。
表1 不同品种大豆7S和11S蛋白的FT-IR酰胺I带拟合结果
Table1 Secondary structure contents of 7S and 11S protein from different soybean varieties based on second-derivative FT-IR spectrum in the amide I regionn
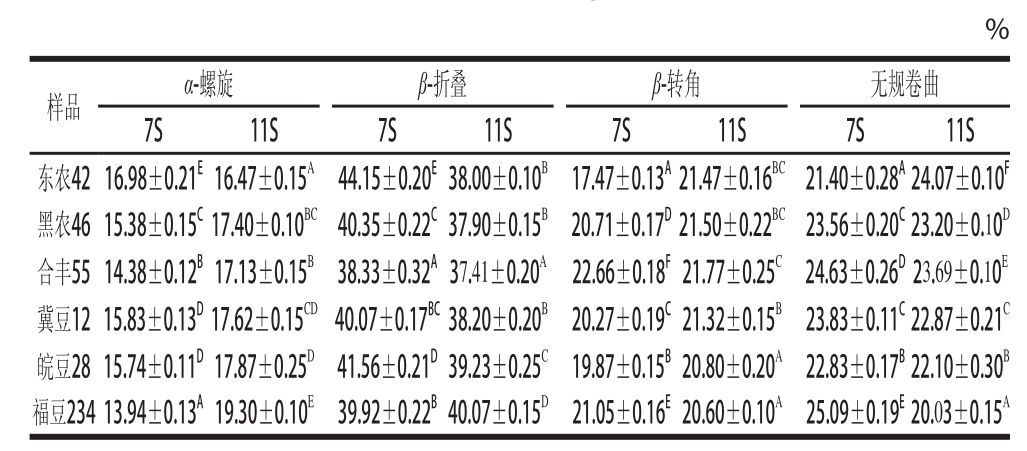
注:同列大写字母不同表示差异显著(P<0.01)。下同。
%样品α-螺旋β-折叠β-转角无规卷曲7S11S7S11S7S11S7S11S东农42 16.98±0.21 E16.47±0.15 A44.15±0.20 E38.00±0.10 B17.47±0.13 A21.47±0.16 BC21.40±0.28 A24.07±0.10 F黑农46 15.38±0.15 C17.40±0.10 BC40.35±0.22 C37.90±0.15 B20.71±0.17 D21.50±0.22 BC23.56±0.20 C23.20±0.10 D合丰55 14.38±0.12 B17.13±0.15 B38.33±0.32 A37.41±0.20 A22.66±0.18 F21.77±0.25 C24.63±0.26 D23.69±0.10 E冀豆12 15.83±0.13 D17.62±0.15 CD40.07±0.17 BC38.20±0.20 B20.27±0.19 C21.32±0.15 B23.83±0.11 C22.87±0.21 C皖豆28 15.74±0.11 D17.87±0.25 D41.56±0.21 D39.23±0.25 C19.87±0.15 B20.80±0.20 A22.83±0.17 B22.10±0.30 B福豆234 13.94±0.13 A19.30±0.10 E39.92±0.22 B40.07±0.15 D21.05±0.16 E20.60±0.10 A25.09±0.19 E20.03±0.15 A
由表 1可知, 6个品种 7S蛋白的二级结构以β -折叠含量最高,α -螺旋含量最少。 6个品种 7S蛋白的α -螺旋含量、β -折叠含量、β -转角含量和无规卷曲含量均存在极显著差异(P< 0.01)。东农 42-7S的α -螺旋含量和β -折叠含量显著高于其他 5个品种,β -转角含量和无规卷曲含量显著低于其他 5个品种。合丰 55-7S的β -折叠含量显著低于其他 5个品种,β -转角含量显著高于其他 5个品种。福豆 234-7S的α -螺旋含量显著低于其他 5个品种,无规卷曲含量显著高于其他 5个品种。 6个品种 11S蛋白的二级结构以β -折叠含量最高,α -螺旋含量最少。 6个品种 11S蛋白的α -螺旋含量、β -折叠含量、β -转角含量和无规卷曲含量均存在极显著差异(P< 0.01)。东农 42-11S的α -螺旋含量显著低于其他 5个品种,无规卷曲含量显著高于其他 5个品种。合丰 55-11S的β-折叠含量显著低于其他 5个品种。福豆 234-11S的α -螺旋含量和β-折叠含量显著高于其他 5个品种,无规卷曲含量显著低于其他 5个品种。
2.3 7S和 11S蛋白的表面疏水性

图4 不同品种大豆蛋白纯品7S(a)和11S(b)的表面疏水性
Fig.4 Surface hydrophobicity of 7S (a) and 11S (b) derived from different soybean varieties
本研究测定的是未经任何处理的大豆 7S和 11S蛋白的表面疏水性,并且实验中严格控制使测定环境条件一致,排除环境因素及测定条件对表面疏水性的影响,以准确分析不同大豆品种的 7S和 11S蛋白的表面疏水性与其二级结构之间的构效关系。如图 4所示, 6个品种 7S蛋白的表面疏水性指数存在极显著差异(P< 0.01),S 0数值在 707.14~ 868.54之间,从大到小依次为 868.54(合丰 55-7S)> 832.51(福豆 234-7S)> 816.98(黑农 46-7S)> 749.06(冀豆 12-7S)> 729.02(皖豆 28-7S)> 707.14(东农 42-7S)。 6个品种 11S蛋白的表面疏水性指数存在极显著差异(P< 0.01),S 0数值在 1 432.73~ 1 623.00之间,从大到小依次为 1 623.00(东农 42-11S)> 1 588.43(合丰 55-11S)> 1 561.13(黑农 46-11S)> 1 486.93(冀豆 12-11S)> 1 463.93(皖豆 28-11S)> 1 432.73(福豆 234-11S)。
2.4 7S和 11S蛋白二级结构与表面疏水性的关系
相关性分析表明, 7S蛋白的表面疏水性与α -螺旋含量成显著负相关,相关性系数为- 0.890(P =0.018);与β -折叠含量成显著负相关,相关性系数为 -0.852(P =0.031);与β -转角含量成显著正相关,相关性系数为 0.897(P =0.015);与无规卷曲含量成显著正相关,相关性系数为 0.848(P =0.033)。 11S蛋白的表面疏水性与α -螺旋含量成显著负相关,相关性系数为- 0.898(P =0.015);与β -折叠含量成显著负相关,相关性系数为 -0.850(P =0.032);与β -转角含量成显著正相关,相关性系数为 0.873(P =0.023);与无规卷曲含量成显著正相关,相关性系数为 0.892(P =0.017)。相关性分析结果说明大豆蛋白的表面疏水性随着二级结构中α -螺旋含量和β -折叠含量的减少而增大,随着β -转角含量和无规卷曲含量的升高而增大。
综上分析,大豆蛋白质的二级结构与表面疏水性相关性显著: 大豆蛋白质的表面疏水性与α -螺旋含量成显著负相关(r =-0.890~-0.898),与β -折叠含量成显著负相关(r =-0.850~-0.852),与β -转角含量成显著正相关(r =0.873~0.897),与无规卷曲含量成显著正相关(r =0.848~0.892)。
参考文献:
[1] SHEARD P R, FELLOWS A, LEDWARD D A, et al. Macromolecular charges associated with the heat treatment of soya isolate[J]. Food Technology, 1988, 21(12)∶ 55-60.
[2] WANG Wenyi, BRINGE N A, BERHOW M A, et al. β-Conglycinins among sources of bioactives in hydrolysates of different soybean varieties that inhibit leukemia cells in vitro[J]. Journal of Agricultural and Food Chemistry, 2008, 56(11)∶ 4012-4020.
[3] NATARAJAN S, XU Chenping, BAE H, et al. Proteomic and genetic analysis of glycinin subunits of sixteen soybean genotypes[J]. Plant Physiology and Biochemistry, 2007, 45(6/7)∶ 436-444.
[4] KHATIB K A, HERALD T J, MUINO P L. The characterization of soybean varieties by fluorescence spectroscopy[J]. International Journal of Food Science and Technology, 2005, 40(5)∶ 545-555.
[5] HUA Yufei, CUI S W, WANG Qi, et al. Heat induced gelling properties of soy protein isolates prepared from different defatted soybean flours[J]. Food Research International, 2005, 38(4)∶ 377-385.
[6] 段春红, 孙婉, 潘思轶. 大豆分离蛋白亚基及7S/11S比例对肉肠品质的影响[J]. 中国粮油学报, 2010, 25(1)∶ 8-21.
[7] PLEITZ P, DAMASCHUN G. The structure of the 11S seed globulins from various plant species∶ comparative investigations by physical methods[J]. Studia Biophysica, 1986, 116(3)∶ 153-173.
[8] DEV S B, KELLER J T, RHA C K, et al. Secondary structure of 11S globulin in aqueous solution[J]. Biochimica et Biophysica Acta, 1988, 957(2)∶ 272-280.
[9] MARCONE M F, BONDI M C, YADA R Y. Isolation of soybean 11S globulin by isoelectric precipitation and Sephacryl S-300 gel filtration chromatography∶ a new purification technique[J]. Bioscience Biotechnology Biochemistry, 1994, 58(2)∶ 413-415.
[10] 陈林. 物理预处理-蛋白酶控制水解联合改性对大豆分离蛋白功能特性的影响研究[D]. 广州∶ 华南理工大学, 2010.
[11] NAGANO T, HIROTSUKA M, MORI H. Dynamic viscoelastic study on the gelation of 7S globulin from soybeans[J]. Journal of Agricultural and Food Chemistry, 1992, 40(6)∶ 941-944.
[12] LIU Chun, WANG Hongling, CUI Zhumei, et al. Optimization of extraction and isolation for 11S and 7S globulins of soybean seed storage protein[J]. Food Chemistry, 2007, 102(4)∶ 1310-1316.
[13] 孙鹏, 秦贵信. 蒸汽处理对纯化大豆抗原含量及免疫原性的影响[J].中国兽医学报, 2006(5)∶ 551-554.
[14] LIU Gang, XIONG L.Yongling. Electrophoretic pattern, thermal denaturation, and in vitro digestibility of oxidized myosin[J]. Journal of Agricultural and Food Chemistry, 2000, 48(3)∶ 624-630.
[15] 王显生, 麻浩, 向世鹏, 等. 不同SDS-PAGE分离胶浓度下大豆贮藏蛋白亚基的分辨效果[J]. 中国油料作物学报, 2004, 26(2)∶ 75-80.
[16] SHIMADA K, CHEFTEL J C. Determination of sulfhydryl groups and disulfide bonds in heat-induced gels of soy protein isolate[J]. Journal of Agricultural and Food Chemistry, 1988, 36(1)∶ 147-153.
[17] 王中江, 江连洲, 魏冬旭, 等. pH值对大豆分离蛋白构象及表面疏水性的影响[J]. 食品科学, 2012, 33(11)∶ 47-51.
[18] 张忠慧, 华欲飞. 大豆分离蛋白与低浓度尿素相互作用红外光谱分析[J]. 粮食与油脂, 2007, 7(1)∶ 20-21.
[19] 刘媛, 谢孟峡, 康娟. 三七皂苷对牛血清白蛋白溶液构象的影响[J].化学学报, 2003, 61(8)∶ 1305-1310.
[20] SUREWICZ W K, MANTSCH H H. New insight into protein secondary structure from resolution-enhanced infrared spectra[J]. Biochimica et Biophysica Acta, 1988, 952(2)∶ 115-130.
[21] ALEXANDER M, GEOFFREY L. Changes in the amide I FT-IR bands of poly-L-lysine on spray-drying from α-helix, β-sheet or random coil conformations[J]. European Journal of Pharmaceutics & Biopharmaceutics, 2006, 62(6)∶ 131-142.
[22] 中国分析网. YY-SW-DB-0087 蛋白质/多肽二级结构的测定傅里叶变换红外光谱法[EB/OL]. [2014-12-12]. http∶//www.analysis.org.cn.
Correlation of Secondary Structures of 7S and 11S Soybean Proteins and Their Surface Hydrophobicity
LIU Chunlei
1
, SUN Libin
2
, LI Xiangxin
2
, LIANG Baosheng
2
, QI Xiaofen
2
, REN Yue
2
, LI Dan
1,2
, JIANG Lianzhou
2,*
(1. Department of Biology, Ningde Normal University, Ningde 352100, China; 2. College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Abstract: 7S and 11S proteins were extracted from six representative soybean varieties, and purified with Superdex 200 gel column chromatography to a purity more than 90% as determined by using sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE).The secondary structures of7S and 11S proteins were analyzed with Fourier transform infrared spectroscopy. The surface hydrophobicities of 7S and 11S proteins were determined with 1-anilinonaphthalene-8-sulfonic acid (ANS) fluorescence probe method. The structure-activity relationship was discussed with correlation analysis. It was concluded that the surface hydrophobicity of the soybean proteins was negatively related to alpha helix content and beta folding content but was positively correlated with beta angle content and random curl content.
Key words: 7S and 11S protein; secondary structure; Fourier transform infrared spectroscopy; surface hydrophobicity; correlation
中图分类号: TS251.1
文献标志码: A 文章编号:1002-6630(2015)17-0028-05
文章编号:1002-6630(2015)17-0028-05
doi:10.7506/spkx1002-6630-201517006
收稿日期:2015-02-09
基金项目:国家自然科学基金面上项目(C200504);福建省科学技术厅农业引导性(重点)项目(2013N0028)
作者简介:刘春雷(1981—),男,讲师,硕士,研究方向为农产品加工。E-mail:chunleiliu@163.com
*通信作者:江连洲(1960—),男,教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:jlzname@163.com