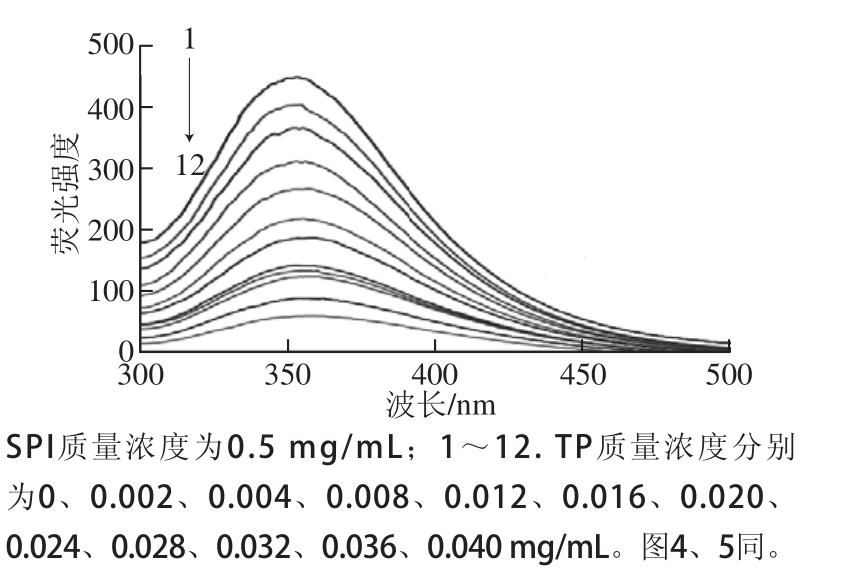
图1 TP对SPI荧光光谱的影响
Fig.1 Effect of TP on the fluorescence of SPI
刘勤勤,朱科学,郭晓娜,彭 伟,周惠明*
(江南大学食品学院,江苏 无锡 214122)
摘 要:利用荧光光谱、紫外 -可见光谱和傅里叶变换红外光谱法,研究茶多酚与大豆分离蛋白之间的相互作用。结果表明:茶多酚对大豆分离蛋白有较强的荧光猝灭作用且为静态猝灭,其中,茶多酚与大豆分离蛋白在 291、 298、 310 K时相互作用的表观结合常数分别为 4.571× 10 5、 2.955× 10 5、 2.672× 10 5 L/mol,对应的结合位点数分别为 1.316、 1.299、 1.286。热力学数据分析结果表明:茶多酚与大豆分离蛋白反应的作用力主要是范德华力和氢键作用;同步荧光光谱和紫外 -可见光谱表明茶多酚改变了芳香氨基酸残基在空间结构中所处的微环境,使大豆分离蛋白的分子构象发生改变,且同步荧光光谱显示茶多酚与大豆分离蛋白中色氨酸残基发生相互作用,使其周围的疏水作用减少。傅里叶变换红外光谱表明茶多酚引起大豆分离蛋白的二级结构发生改变。
关键词:茶多酚;大豆分离蛋白;荧光光谱;紫外 -可见光谱;傅里叶变换红外光谱
茶是世界上最受欢迎的饮料之一,拥有多种保健功效,如抗氧化、抗癌、抑菌等,其主要活性成分为茶多酚。茶多酚又名茶单宁、茶鞣质,是茶叶中所含的一类多羟基酚类化合物的总称,占绿茶干质量的 15%~ 30% [1]。
近年来,人们喜欢把茶添加到牛奶中制备奶茶,因为牛奶可以改善茶的感官特性,降低多酚引起的收敛性 [2],但同时茶的抗氧化性和蛋白质的功能特性也发生了变化,故学者主要着眼于在分子水平上研究茶多酚与牛奶蛋白的相互作用 [3-5]。如今,由于大豆蛋白的营养价值与动物蛋白等同,且不含胆固醇,极适宜妇女及老年人食用,故逐渐有人用豆奶替代牛奶制备奶茶,不仅成本低、营养丰富,而且还可以满足乳糖不耐症患者的需求。郭兴凤等 [6]报道了茶多酚对大豆分离蛋白功能性质的影响,茶多酚可以提高大豆分离蛋白的起泡性及乳化性。 Ryan等 [7]研究了不同豆奶对不同红茶抗氧化性的影响。然而目前从分子水平研究茶多酚与大豆分离蛋白相互作用的报道相对较少。
本实验运用荧光光谱、紫外 -可见光谱和傅里叶变换红外光谱,详细研究茶多酚与大豆分离蛋白相互作用之间的表观结合常数、结合位点数、作用力等重要信息,为了解茶多酚与大豆分离蛋白的结合方式,以及茶多酚在大豆制品中的应用提供理论依据。
1.1材料与试剂
茶多酚( tea polyphenols, TP),纯度> 90%,购自无锡太阳绿宝科技有限公司;大豆分离蛋白( soybean protein isolate, SPI),蛋白质含量 92.04%,购自谷神生物科技集团有限公司。
实验中所用试剂均为分析纯;所用水为去离子水。
1.2仪器与设备
UV-1800分光光度计、 F-7000型荧光分光光度计日本 Shimadzu公司;傅里叶变换红外光谱仪 美国 Thermo Nicolet公司;电子分析天平 奥豪斯仪器(上海)有限公司;电磁搅拌器 上海司乐仪器有限公司;恒温水浴锅 金坛市岸头国瑞实验仪器厂; pH计 梅特勒 -托利多仪器(上海)有限公司。
1.3方法
1.3.1溶液配制
茶多酚溶液:将茶多酚用去离子水溶解,配制成 3.2 mg/mL的溶液,实验时稀释至所需质量浓度。
大豆分离蛋白溶液:用 pH值为 7.5的缓冲液溶解大豆分离蛋白,磁力搅拌 2 h,配制成 0.5 mg/mL的溶液备用。
1.3.2荧光光谱分析
向 4 mL大豆分离蛋白溶液( 0.5 mg/mL)中逐滴加入 50μL不同质量浓度的茶多酚溶液,充分混合后,分别在 18、 25、 37℃的恒温水浴锅中保温 5 min。选择激发波长为 280 nm、激发和发射狭缝均为 5 nm、扫描速率为 12 000 nm/min,于 F-7000荧光光谱仪的 1 cm石英比色池中扫描 300~ 500 nm波长范围内的荧光光谱。样品的同步荧光光谱测定条件如下:室温条件下,分别固定Δλ= 15 nm和Δλ= 60 nm,进行同步荧光光谱扫描。
1.3.3紫外 -可见光谱分析
移取 4 mL 0.5 mg/mL的大豆分离蛋白溶液于石英比色池中,扫描 250~ 350 nm波长范围内的吸收光谱。扫描完毕后,加入 50μL不同质量浓度的茶多酚溶液到含有大豆分离蛋白液的比色池中,混匀,放置 5 min后扫描吸收光谱。以相同质量浓度的大豆分离蛋白溶液作空白,记录大豆分离蛋白溶液的紫外 -可见吸收差谱。
1.3.4傅里叶变换红外光谱分析
将大豆分离蛋白溶液和大豆分离蛋白溶液与茶多酚的混合溶液(大豆分离蛋白溶液质量浓度为 0.5 mg/mL,茶多酚质量浓度为 0.04 mg/mL)冷冻干燥,按样品粉末与溴化钾粉末 1∶100(m /m)的比例混合,研细均匀后,置于模具中压片,在 32 cm -1的分辨率条件下扫描 32次, 4 000~ 400 cm -1波数范围内扫描红外光谱。
2.1茶多酚与大豆分离蛋白相互作用的荧光光谱
2.1.1茶多酚质量浓度对大豆分离蛋白内源荧光光谱的影响
蛋白质分子存在色氨酸、酪氨酸和苯丙氨酸,因为其含有苯环结构或共轭双键,在一 定的激发波长下能够产生荧光,故蛋白质具有内源荧光 [8]。色氨酸、酪氨酸和苯丙氨酸具有不同的生色基团,因而具有不同的荧光光谱,分别会在 348、 303、 282 nm波长处出现荧光峰。在天然蛋白质分子中苯丙氨酸荧光极弱,对荧光有贡献的只有酪氨酸和色氨酸 [9]。在 280 nm激发波长下,大豆分离蛋白的最大发射波长为 353 nm,在 303 nm波长处未见荧光峰的形成,而茶多酚本身的荧光发射信号非常弱,对大豆分离蛋白荧光信号的干扰可以忽略,因此本研究中不用考虑“内滤光效应”的干扰问题。茶多酚与大豆分离蛋白作用的荧光光谱见图 1。

图1 TP对SPI荧光光谱的影响
Fig.1 Effect of TP on the fluorescence of SPI
由图 1可知,茶多酚对大豆分离蛋白的荧光具有明显的猝灭作用,在一定质量浓度大豆分离蛋白溶液条件下,随着茶多酚质量浓度的增加,大豆分离蛋白的荧光逐渐被猝灭。茶多酚使得大豆分离蛋白的最大发射峰红移,从 353 nm处红移至 362 nm,大约红移 9 nm,这表明茶多酚与大豆分离蛋白可能发生相互作用,使大豆分离蛋白分子的空间构象发生了变化,进而使色氨酸周围的微环境由疏水性环境向亲水性环境发生转变,肽链变得更加伸展 [10]。
2.1.2茶多酚 -大豆分离蛋白复合物的结合常数、结合位点数及作用力
荧光猝灭有多种作用机理,通常可分为动态猝灭和静态猝灭 [11]。动态猝灭表现为温度的升高将增加离子有效碰撞的数目,加剧电子的转移,使荧光物质的猝灭常数随着温度的升高而增大;静态猝灭则主要是荧光分子与生物活性小分子形成复合物,从而使荧光物质的荧光发生猝灭,且随着温度升高,复合物的稳定性下降,故而荧光物质的猝灭常数减小。因此,可根据不同温度条件下两者相互作用的结果来帮助判定猝灭机制 [12]。
在研究蛋白质 -多酚的相互作用时,可利用 Stern-Volmer方程对其所涉及的猝灭类型进行判断 [13]:
式中:F 0和F分别是未加入和加入茶多酚时大豆分离蛋白溶液的荧光强度; [Q ]为茶多酚的总浓 度/(mol/L);K q为双分子猝灭速率常数 /(L/(mol·s)),K sv为动态猝灭常数 /(L/mol),K q=K sv /τ 0,各类荧光猝灭剂对生物大分子的最大猝灭常数约为 2.0× 10 10 L/( mol· s);τ 0为猝灭剂不存在时荧光体的寿命,生物大分子的平均寿命约为 10 -8 s [14]。
根据 Stern-Volmer方程,以 [Q ]为自变量,F 0 /F为因变量,通过线性拟合得图 2,由图中直线的斜率和τ 0可得到不同温度条件下茶多酚与大豆分离蛋白相互作用的K sv和K q,结果见表 1。
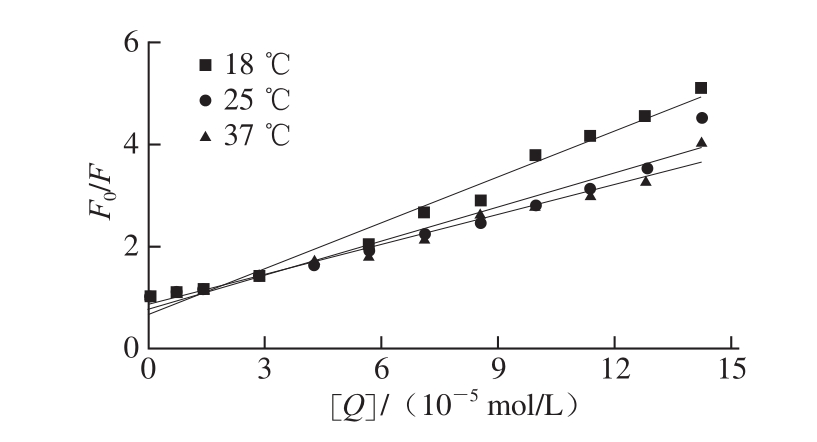
图2 不同温度条件下TP猝灭SPI的Stern-Volmeerr图
Fig.2 Stern-Volmer plots of SPI quenched by TP at different temperatures
表1 TP-SPI复合物的荧光猝灭常数及线性相关系数
Table1 Quenching rate constants and correlation coefficients of SPI andd TTPP
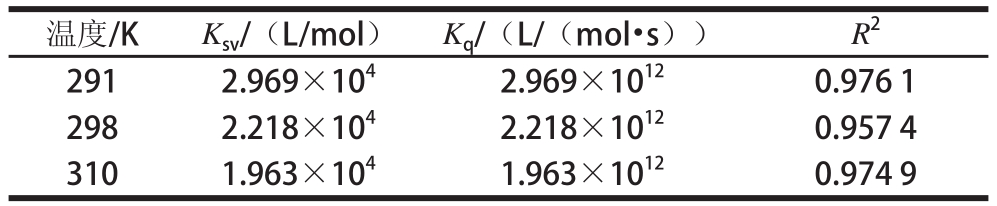
温度/KK sv/(L/mol)K q/(L/(mol·s))R 22912.969×10 42.969×10 120.976 1 2982.218×10 42.218×10 120.957 4 3101.963×10 41.963×10 120.974 9
以上结果表明,茶多酚对大豆分离蛋白的 Stern-Volmer曲线均呈现一定的线性关系,且随着温度的升高,大豆分离蛋白的 Stern-Volmer曲线斜率呈现不断减小的趋势,即静态猝灭常数下降,这说明茶多酚对大豆分离蛋白的荧光猝灭机制属于静态猝灭。对于生物大分子,各类猝灭剂由扩散碰撞产生的最大猝灭常数为 2× 10 10 L/( mol· s) [15],显然,茶多酚对大豆分离蛋白的荧光猝灭速率均比扩散控制的K q大,这进一步说明它们的猝灭过程是分子之间结合形成化合物所引起的静态猝灭,而不是由分子扩散和碰撞所引起的动态猝灭。
对于静态猝灭,可采用下式计算结合常数K A和结合位点数n [16]:
式中:F和F 0分别表示有和无猝灭剂时荧光体的荧光强度;K A为表观结合常数;n为结合位点数; [Q ]为猝灭剂的浓度 /(mol/L)。
按公式( 2),以 lg[(F 0-F) /F ]对 lg[Q ]作图,曲线经线性拟合得图 3,可计算出不同温度条件下茶多酚与大豆分离蛋白相互作用的表观结合常数K A和结合位点数n(表 2)。这表明茶多酚与大豆分离蛋白在 291、 298、 310 K这 3个温度点都存在着强烈的相互作用,均形成了结合位点数接近于 1的复合物,且随温度的变化不明显。
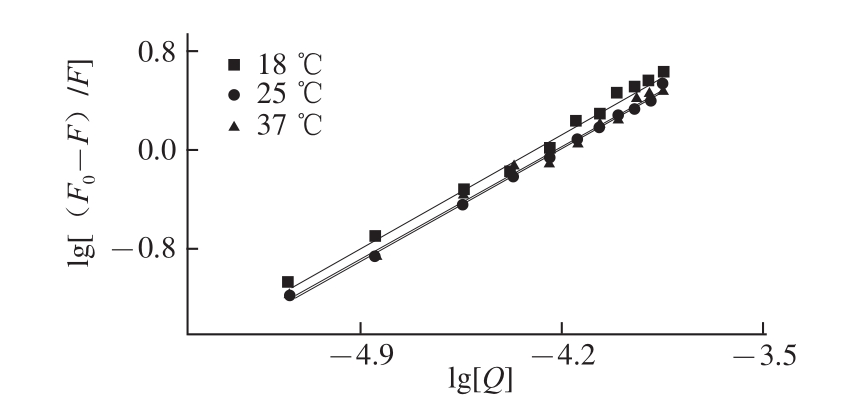
图3 不同温度条件下TP猝灭SPI的双对数图
Fig.3 Double logarithmic curves of SPI quenched by TP at different temperatures
表2 TP-SPI复合物的结合位点数、表观结合常数及线性相关系数
Table2 Apparent binding constants, binding sites numbers and correlation coefficients of SPI and TP

温度/KnK A/(L/mol)R 22911.3164.571×10 50.993 4 2981.2992.955×10 50.996 4 3101.2862.672×10 50.992 7
当温度相差不大时,结合反应的焓变可视为常数 [17],可由 van’ t Hoff方程判定茶多酚与大豆分离蛋白之间的作用力类型。
式中:R为气体状态常数 ,8.314 J/(K· mol);T为实验温度 /K;K为相应温度下反应体系的结合常数 /(L/mol)。
由式( 3)、( 4)计算出的热力学参数见表 3。
表3 TP与SPI结合的相关热力学参数Table3 Thermodynamic parameters for interaction between TP and SPI
Table3 Thermodynamic parameters for interaction between TP and SPI

温度/KΔ H/(kJ/mol)Δ S/(J/(mol·K))Δ G/(kJ/mol)291-44.942-46.086-31.531 298-44.942-46.086-31.208 310-44.942-41.083-32.206
生物活性小分子和生物大分子之间的作用力主要包括氢键、范德华力、疏水作用及静电作用 4种类型:
1)若 ΔH> 0、 ΔS> 0,则主要是疏水作用; 2)若 ΔH< 0、 ΔS< 0,则主要是范德华力和氢键作用; 3)若 ΔH< 0、 ΔS> 0,则是静电作用 [18],故可根据熵变(ΔS)和焓变(ΔH)判定两者的作用方式 [19]。由表 3可知,ΔG< 0,说明茶多酚与大豆分离蛋白的结合可以自发进行。该反应的ΔH< 0,表明茶多酚与大豆分离蛋白之间的相互作用为放热反应,降温有利于反应的进行,这与结合常数K A随着温度的升高而逐渐降低相吻合。由体系的ΔH< 0和ΔS< 0可说明茶多酚与大豆分离蛋白之间的作用力主要是范德华力和氢键。
2.2茶多酚对大豆分离蛋白构象的影响
2.2.1茶多酚与大豆分离蛋白相互作用的同步荧光光谱
同步荧光光谱法是一种广泛应用的通过测量发射波长偏移来研究氨基酸残基微环境的方法,能够反映出茶多酚对大豆分离蛋白构象的影响。固定激发和发射单色器的波长差( Δλ),以固定的 Δλ得到同步荧光光谱,从而获得关于生色团分子周围环境的信息。当 Δλ= 15 nm时,只显示酪氨酸残基的特征荧光光谱;当 Δλ= 60 nm时,只显示色氨酸残基的特征荧光光谱,由此可判断大豆分离蛋白中酪氨酸残基和色氨酸残基微环境的极性变化 [20]。

图4 TP-SPI体系的同步荧光光谱
Fig.4 Synchronous fluorescence spectra of TP-SPI at room temperature
由图 4可知,随着茶多酚质量浓度的增加,大豆分离蛋白中酪氨酸残基( Δλ= 15 nm)和色氨酸残基( Δλ= 60 nm)的特征荧光吸收峰不断猝灭, Δλ= 15 nm和 Δλ= 60 nm的最大发射峰均有红移,表明加入茶多酚后,大豆分离蛋白中色氨酸和酪氨酸附近的微环境有所改变,亲水性增加。该现象表明大豆分离蛋白的二级结构发生了一定变化。色氨酸最大发射峰红移 7 nm(从 285 nm红移至 292 nm)(图 4B),酪氨酸最大发射峰红移 2 nm(从 293 nm红移至 295 nm)(图 4A),说明茶多酚与大豆分离蛋白作用的结合位点更接近于色氨酸残基 [21]。
2.2.2茶多酚与大豆分离蛋白相互作用的紫外 -可见吸收光谱
紫外 -可见光谱广泛应用于小分子与生物大分子作用的研究中。一般来说,峰的强度变化大小是两者相互作用强弱的标志,而峰位的改变通常认为是蛋白质大分子疏水氨基酸残基微环境变化引起构象变化导致的。
大多数蛋白质分子由于色氨酸( Trp)和酪氨酸( Tyr)等氨基酸中芳香杂环对光的吸收,故在 270 nm波长附近有一个吸收峰。蛋白质分子中芳香族氨基酸残基所处微环境发生改变,会引起蛋白质吸收波长变化,因而可以利用蛋白质的紫外 -可见吸收光谱初步探讨蛋白质结构的变化 [22-23]。
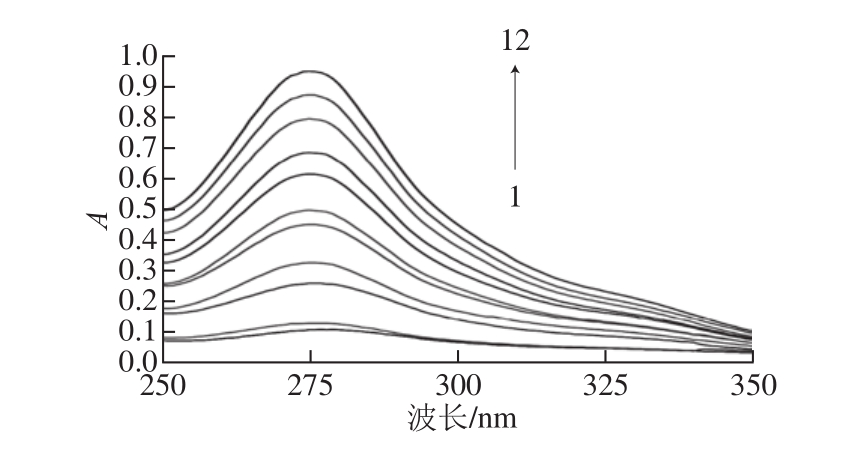
图5 不同质量浓度TP对SPI溶液紫外-可见吸收光谱的影响
Fig.5 Effect of TP concentration on the UV-Vis absorption spectrum of SPI
图 5显示了不同质量浓度茶多酚对大豆分离蛋白紫外 -可见吸收光谱的影响。从图中可以看出,随着茶多酚质量浓度增加,大豆分离蛋白的紫外 -可见吸收光谱峰值依次升高,并且发生蓝移,最大吸收峰波长由 279 nm蓝移至 275 nm,说明茶多酚诱导大豆分离蛋白分子肽链伸展,使得深埋在大豆分离蛋白分子内部酪氨酸残基和色氨酸残基中的芳香杂环疏水基团裸露出来,造成了大豆分离蛋白构象发生改变,进而增强了吸光度。这种构象的改变更有利于大豆分离蛋白分子中色氨酸残基和酪氨酸残基中芳香杂环的π -π *跃迁 [24]。
2.2.3茶多酚与大豆分离蛋白相互作用的傅里叶变换红外光谱
通过红外光谱来进一步考察蛋白质构象的变化,蛋白质酰胺Ⅰ带在 1 700~ 1 600 cm -1范围内(主要是 C= O伸缩振动)有吸收;酰胺Ⅱ带在 1 600~ 1 500 cm -1范围内(主要是 C— N伸缩振动和 N— H弯曲振动)有吸收 [25]。酰胺Ⅰ带和酰胺Ⅱ带红外吸收峰的变化反映了蛋白质二级结构的变化。由图 6可知,茶多酚的加入引起了大豆分离蛋白酰胺Ⅰ带从 1 654.62 cm -1蓝移至 1 649.42 cm -1,酰胺Ⅱ带从 1 538.92 cm -1蓝移至 1 519.83 cm -1,说明茶多酚引起了大豆分离蛋白二级结构的变化。
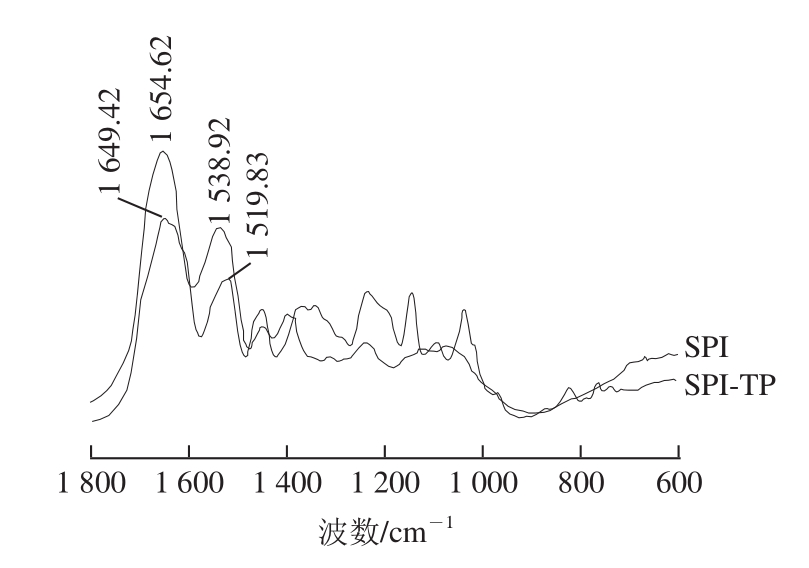
图6 SPI和SPI-TP的傅里叶变换红外光谱图
Fig.6 Fouriertransform infrared spectra of SPI and SPI-TP
茶多酚与大豆分离蛋白之间有较强的相互作用,范德华力和氢键作用是其主要作用力;且两者相互作用引起大豆分离蛋白构象发生改变。同步荧光光谱和紫外 -可见光谱表明茶多酚能改变芳香氨基酸残基在空间结构中所处的微环境,使大豆分离蛋白分子的构象发生改变,且同步荧光光谱显示茶多酚与大豆分离蛋白中色氨酸残基发生相互作用,使其周围的疏水作用减少。傅里叶变换红外光谱表明茶多酚引起大豆分离蛋白的二级结构发生改变。
参考文献:
[1] 杜淑霞, 欧仕益, 贝惠玲, 等. 茶多酚与牛奶蛋白互作对蛋白质离体消化率的影响[J]. 食品与发酵工业, 2010, 36(2)∶ 76-79.
[2] BOHIN M C, VINCKEN J P, van der HIJDEN H T W M, et al. Efficacy of food proteins as carriers for flavonoids[J]. Journal of Agricultural and Food Chemistry, 2012, 60(16)∶ 4136-4143.
[3] KANAKIS C D, HASNI I, BOURASSA P, et al. Milk β-lactoglobulin complexes with tea polyphenols[J]. Food Chemistry, 2011, 127(3)∶1046-1055.
[4] HASNI I, BOURASSA P, HAMDANI S, et al. Interaction of milk αand β-caseins with tea polyphenols[J]. Food Chemistry, 2011, 126(2)∶630-639.
[5] YE Jianhui, FAN Fangyuan, XU Xinqing, et al. Interaction of black and green tea polyphenols with whole milk[J]. Food Research International, 2013, 53(1)∶ 449-455.
[6] 郭兴凤, 石晶, 薛园园, 等. 茶多酚对大豆蛋白乳化性和泡沫特性影响[J]. 粮食与油脂, 2010(4)∶ 12-14.
[7] RYAN L, SUTHERLAND S. Comparison of the effects of different types of soya milk on the total antioxidant capacity of black tea infusions[J]. Food Research International, 2011, 44(9)∶ 3115-3117.
[8] 雍克岚, 吕敬慈, 吕蔚. 应用三维荧光光谱和可变角同步荧光扫描分析天然荧光氨基酸的含量[J]. 化学世界, 2000, 41(11)∶ 601-605.
[9] 张丽娟, 张宜欣, 许子华. 姜黄素与牛血清白蛋白结合的反应机制研究[J]. 中医药导报, 2010, 16(2)∶ 65-68.
[10] CALLIS P R. 1L aand 1L btransitions of tryptophan∶ applications of theory and experimental observations to fluorescence of proteins[J]. Methods in Enzymology, 1997, 278∶ 113-150.
[11] 蔡春生, 胡勇, 高永清, 等. 基于非共价键作用的山梨酸钾对植物蛋白荧光淬灭性能研究[J]. 现代食品科技, 2013, 29(10)∶ 2420-2424.
[12] WU Xuli, WU Hui, LIU Meixia, et al. Analysis of binding interaction between(-)-epigallocatechin(EGC) and beta-lactoglobulin by multispectroscopic method[J]. Spectrochimica Acta Part A-Molecular and Biomolecular Spectroscopy, 2011, 82(1)∶ 164-168.
[13] 于兵川, 吴洪特, 周培疆, 等. 五氯酚对牛血清白蛋白的荧光猝灭作用[J]. 环境科学, 2006(5)∶ 977-980.
[14] WANG Qisui, ZHANG Xiaolei, ZHOU Xiaolan, et al. Interaction of different thiol-capped CdTe quantum dots with bovine serum albumin[J]. Journal of Luminescence, 2012, 132(7)∶ 1695-1700.
[15] TIAN Fangfang, JIANG Fenglei, HAN Xin, et al. Synthesis of a novel hydrazone derivative and biophysical studies of its interactions with bovine serum albumin by spectroscopic, electrochemical, and molecular docking methods[J]. The Journal of Physical Chemistry B, 2010, 114(46)∶ 14842-14853.
[16] GONG Aiqin, ZHU Xiashi, HU Yanyan, et al. A fluorescence spectroscopic study of the interaction between epristeride and bovine serum albumin and its analytical application[J]. Talanta, 2007, 73(4)∶668-673.
[17] 姚惠芳, 景浩. 笃斯越橘花青素与牛血清白蛋白的相互作用[J]. 食品科学, 2013, 34(23)∶ 6-10. doi∶ 10.7506/spkx1002-6630-201323002.
[18] ROSS P D, SUBRAMANIAN S. Thermodynamics of protein association reactions∶ forces contributing to stability[J]. Biochemistry, 1981, 20(11)∶ 3096-3102.
[19] YAMASAKI K, MARUYAMA T, YOSHIMOTO K, et al. Interactive binding to the two principal ligand binding sites of human serum albumin∶ effect of the neutral-to-base transition[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 1999, 1432(2)∶ 313-323.
[20] LAKOWICZ J R, WEBER G. Quenching of protein fluorescence by oxygen, detection of structural fluctuations in proteins on the nanosecond time scale[J]. Biochemistry, 1973, 12(21)∶ 4171-4179.
[21] 卢雁, 高胜华, 王运来, 等. 光谱法研究吡嗪酰胺与人血清白蛋白的作用机制[J]. 科学通报, 2009, 54(14)∶ 2071-2075.
[22] 盛良全, 闰向阳, 徐华杰, 等. 烟碱与牛血清白蛋白相互作用的光谱研究[J]. 光谱学与光谱分析, 2007, 27(2)∶ 306-308.
[23] KROLL N G, RAWEL H M, ROHN S. Review∶ reactions of plant phenolics with food proteins and enzymes under special consideration of covalent bonds[J]. Food Science and Technology Research, 2003, 9(3)∶ 205-218.
[24] 王斌. 中药小分子与牛血清白蛋白的相互作用[D]. 武汉∶ 中南民族大学, 2011∶ 38-41.
[25] LIU Yuan, XIE Mengxia, KANG Juan, et al. Studies on the interaction of total saponins of panax notoginseng and human serum albumin by Fourier transform infrared spectroscopy[J]. Spectrochimica Acta Part A∶Molecular and Biomolecular Spectroscopy, 2003, 59(12)∶ 2747-2758.
Spectroscopic Analysis of Interaction between Tea Polyphenol and Soy Protein Isolate
LIU Qinqin, ZHU Kexue, GUO Xiaona, PENG Wei, ZHOU Huiming*
(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
Abstract: The interaction between tea polyphenol and soy protein isolate was studied by fluorescence, ultraviolet-visible (UV-Vis) and Fourier transform infrared (FTIR) spectroscopies. The results suggested that tea polyphenol had a strong ability to quench the fluorescence of soy protein isolate in a static mode. The binding constants ( K A ) and site numbers ( n ) obtained at different temperatures were 4.571× 10 5 L/mol, 1.316 (291 K); 2.955× 10 5 L/mol, 1.299 (298 K); and 2.672 × 10 5 L/mol, 1.286 (310 K), respectively. According to the thermodynamic parameters, van der Waals force and hydrogen bond played a dominant role in the interaction between tea polyphenol and soy protein isolate. The synchronous fluorescence and UV-Vis spectra showed that tea polyphenol changed the microenvironment of the aromatic amino acid residues in the space structure and the conformation of soy protein isolate. The synchronous fluorescence spectra also revealed that tea polyphenol interacted with tryptophan residues in soy protein isolate, and the vicinity of tryptophan residues was less hydrophobic. The FTIR spectra revealed that secondary structure of soy protein isolate was changed by tea polyphenol.
Key words: tea polyphenol; soy protein isolate; fluorescent spectroscopy; ultraviolet-visible spectroscopy; Fourier transform infrared spectroscopy
中图分类号: TS201
文献标志码: A文章编号:1002-6630(2015)17-0043-05
文章编号:1002-6630(2015)17-0043-05
doi:10.7506/spkx1002-6630-201517009
收稿日期:2014-10-16
基金项目:“十二五”国家科技支撑计划项目(2012BAD36B06)
作者简介:刘勤勤(1987—),女,硕士研究生,研究方向为主食与方便食品。E-mail:annie_1115@yeah.net
*通信作者:周惠明(1957—),男,教授,博士,研究方向为主食与方便食品。E-mail:hmzhou@jiangnan.edu.cn