
罗爽妍 1,2,王 超 1,2,段翰英 1,*,罗尧欣 1,虞 兵 1
(1.暨南大学食品科学与工程系,广东 广州 510632;2.暨南大学-萨斯喀切温大学 油料生物炼制与营养联合实验室,广东 广州 510632)
摘 要:本实验研究了野生桃金娘( Rhodomyrtus tomentosa)的抗氧化能力、总多酚含量、总黄酮含量、抗坏血酸含量和花青素类成分。采用超高效液相串联光电二极管阵列( photo-diode array, PDA)检测器和离子肼质谱法( ultra performance liquid chromatography coupled to photo-diode array and ion-trap mass spectrometry, UPLC-PDAIT-MS)鉴定花青素类化合物,通过高通量的自由基清除方法测定抗氧化能力。结果表明:野生桃金娘具有较高的抗氧化能力。每克桃金娘的 1,1-二苯基 -2-三硝基苯肼( 1,1-diphenyl-2-picrylhydrazyl, DPPH)自由基清除能力相当于 67.2μmol的抗坏血酸和 28.5μmol没食子酸;过氧化氢自由基清除能力( PSC单位)相当于 23.2μmol的抗坏血酸和 14.3μmol没食子酸; 2,2’ -联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’ -azinobis(3-ethylbenzothi azoline-6-sulfonic acid) ammonium salt,ABTS)自由基( ABTS +·)清除能力相当于 30.4μmol的抗坏血酸和 7.8μmol没食子酸;对三价铁的还原能力相当于 28.7μmol的抗坏血酸和 3.1μmol没食子酸。野生桃金娘的总多酚含量和总黄酮含量分别是 4 976 mg没食子酸 /100 g(以干质量计)和 49.7 mg儿茶酚 /100 g(以干质量计),总抗坏血酸含量是 9 mg/100 g(以鲜质量计)。总花青素含量相当于 414 mg矢车菊素 /100 g(以干质量计),共有飞燕草素 3- O -葡萄糖苷等 7种花青素类化合物被鉴别出来。
关键词:桃金娘;花青素;抗氧化成分;抗氧化能力
花青素是分布最广的多酚类物质 [1],是食品工业中应用最广的天然色素。它具有降低慢性疾病发病率的功能 [2],还能预防乳腺癌、肠癌、胰腺癌、肺癌和前列腺癌 [3]。目前已发现了 6种基本糖苷类和酰基葡萄糖苷类花青素衍生物:天竺葵色素、矢车菊素、锦葵色素、飞燕草色素、芍药色素和牵牛花色素 [4]。
桃金娘(Rhodomyrtus tomentosa)属桃金娘科,是亚热带常绿灌木丛植物,产于中国南部各省和南亚 [5]。桃金娘属于传统中药中的滋补性药物,其干果、根茎、叶子和种子可用于治疗月经不调、更年期综合征、肝炎、尿路感染、贫血、失眠症和耳鸣 [6]。桃金娘的果实呈深紫色,具有诱人的颜色和气味,且果实的产量相当高。因此,在广东省翁源县,桃金娘尽管没有经过常规的种植,其年产量也达 3 000~ 5 000 t。桃金娘果实具有潜在改善人体健康的功能,且是花青素、多酚、抗坏血酸和其他抗氧化物质的丰富来源,但其贮藏寿命短且受深加工条件的限制,只有 10%的果实能用于鲜食,其余 90%的果实都被丢弃。目前,有关桃金娘果实的抗氧化活性报道较少 [7]。
本实验对野生成熟桃金娘的抗氧化能力[包括 1,1-二苯基 -2-三硝基苯肼( 1,1-diphenyl-2-picrylhydrazyl, DPPH)自由基清除能力、过氧化物自由基( ROO·)清除能力、 2,2’ -联苯 -二( 3-乙基 -苯并噻唑 -6-磺酸)二铵盐自由基( 2,2’ -azinobis-( 3-ethylbenzthiazoline-6-sulphonate) radical, ABTS +·)清除能力和铁离子还原能力( ferric reducing antioxidant power, FRAP)]、总多酚含量、总黄酮含量、抗坏血酸含量和花青素类成分进行研究,并用超高效液相串联光电二极管阵列检测器和离子肼质谱( ultra performance liquid chromatography coupled to photo-diode array and ion-trap mass spectrometry, UPLC-PDA-IT-MS)鉴定花青素类化合物。
1.1材料与试剂
桃金娘,主要产地为广东省翁源县(收获时间为 2014年 9月)。鲜果用自来水冲洗干净表皮的泥土后,立即放于- 20℃中冷冻并于同日运至实验室。果实进一步在液氮中用研钵和杵研磨成粉末并立即用冷冻干燥机干燥 24 h。干燥后的样品再次用搅拌机磨碎,后过 200目筛并混合。混合粉末用聚乙烯管密封后保存于- 80℃用于进一步分析。
液相色谱 -质谱联用仪( liquid chromatograph-mass spectrometer, LC-MS)超纯水、甲醇、乙腈 德国默克公司;甲酸(纯度≥ 99%) 美国 Acros公司; Folin-酚试剂、抗坏血酸(纯度≥ 99%)、 1,4-二硫苏糖醇( 1,4-dithiothreitol, DTT)、 2’ ,7’ -二氯荧光素 -二乙酸盐( 2’ ,7’ -dichloroflorescein-diacetate, DCFH-DA)、 ABTS、 DPPH、 2,4,6-三 -( 2-氮苯基) -1,3,5三嗪( 2,4,6-tri-2-pyridinyl-1,3,5-triazine, TPTZ)、儿茶素 美国 Sigma公司; KCl、 KH 2 PO 3、 Na 2 CO 3、 K 2 S 2 O 8、没食子酸、 CH 3 COONa、乙二胺四乙酸( ethylene diamine tetraacetic acid, EDTA)四钠、 FeCl 3· 6H 2 O、 AlCl 3、 NaNO 2、 HCl、 NaOH(分析试剂级) 天津大茂化学试剂公司; 2,2’ -偶氮二异丁基脒二盐酸盐( 2,2’ -azobis( 2-amidinopropane) dihydrochloride, ABAP) 日本和光纯药工业株式会社。
1.2仪器与设备
FD-10冷冻干燥机 北京博医康实验仪器有限公司; SB-5200D75超声波清洗机 宁波新艺超声设备有限公司; LC-20AD/T高效液相色谱仪(检测器 SPD-M20A)日本岛津公司; LTQ XL质谱(包括 Accela 1250二元液相泵、自动进样器、 Accela PDA检测器和 Accela柱温箱)、 Fluoroskan Ascent荧光分析仪 美国赛默飞世尔科技公司; Victor X3全波长酶标仪 芬兰 Perkin-Elmer公司。
1.3方法
1.3.1矢车菊素葡萄糖苷储备溶液的准备
取 1 mg矢车菊素葡萄糖苷标准品溶于 1 mL体积分数为 90%的甲醇(含体积分数为 0.5%的甲酸),超声提取 10 min。储备液质量浓度为 1 mg/mL,储备液保存于- 20℃备用。
1.3.2多酚类化合物的提取 [8]
取 100 mg的冷冻干燥粉末,溶于 10 mL 90%甲醇(含 0.5%甲酸)中,超声提取 10 min, 6 000 r/min离心 5 min后取上清液。按照上述方法重复提取沉淀物 3次,直到上清液变为无色。混合所有的上清液,并在 40℃旋转蒸发甲醇。用 3 mL 100%甲醇回收旋转蒸发后的剩余物,后用 0.45 nm的 PTFE注射器式过滤器过滤提取物。提取物于- 20℃保存备用。整个提取过程在避光橱中进行。
1.3.3固相提取
在用 UPLC-PDA-IT-MS测定花青素的组成前,需要用 C 18固相萃取柱对样品进行预处理。使用前,先注入 5 mL酸化甲醇(含 0.1%甲酸)后用 5 mL酸化水(含 0.1%甲酸)激活萃取柱。提取物过柱后,用 5 mL酸化水(含 0.1%甲酸)将水溶性成分(还原糖、氨基酸和 VC)冲洗出来。再用 5 mL酸化甲醇(含 0.1%甲酸)将酚类物质洗脱出。洗脱物用氮气吹干后,再用 1 mL酸化水(含 0.1%甲酸)溶解。提取物于—20 ℃保存备用。
1.3.4总花青素含量的测定
运用 pH-示差分光光度法 [9]测定总花青素含量。矢车菊 -3-葡萄糖苷在 510 nm波长处的摩尔分子吸光系数为 26 900 L/( cm· mol),分子质量为 449.2 g/mol。总花青素含量以矢车菊 -3-葡萄糖苷当量表示( mg/100 g,以干质量计)。
1.3.5总多酚含量的测定 [10]
取 20 ☒L样品提取物或者没食子酸标准品溶液与 1.6 mL水和 100 ☒L Folin-酚试剂混合,混合后室温静置 8 min。然后加入 300 ☒L体积分数为 20%的碳酸钠溶液,混合并于室温下放置 2 h,在 765 nm波长处用紫外 -可见分光光度计测定吸光度。以没食子酸质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,得到回归方程为y= 0.001x+ 0.004 3(R 2= 0.999 3)。总多酚含量以没食子酸当量( gallic acid equivalent, GAE)表示( mg GAE/100 g,以干质量计)。
1.3.6鉴别桃金娘中花青素类化合物
运用由 Thermo LTQ XL质谱(包括 Accela 1250二元液相泵,自动进样器, Accela PDA检测器和 Accela柱温箱)组成的 UPLC-PDA-IT-MS鉴别花青素类化合物。色谱柱: Symmetry C 18柱( 150 mm× 4.6 mm, 5 ☒m)进行花青素的色谱分离。色谱条件:流速: 1 mL/min;流动相: A液为 5%甲酸 -水, B液为 5%甲酸 -乙腈。线性梯度洗脱: 0~ 30 min, B液 0~ 40%; 30~ 32 min, B液 40%~ 100%; 32~ 38 min,回复到初始条件。进样量: 25 ☒L;自动进样器温度: 4℃;柱温: 40℃; PDA扫描波长: 200~ 700 nm。 UPLC洗出液以 1∶5的比例被微分流阀分离,并连接于 Thermo LTQ XL质谱仪上。质谱条件:电离方式: ESI +;喷雾电压: 3.5 kV;金属毛细管温度: 350℃;鞘气压力: 70 arb;辅助气压力: 15 arb;扫描模式:全扫描方式(m /z 150~ 2 000),氦气作鞘气,氮气作辅助气。为了获取 MS/MS信息,所采用的碰撞能量为 20。取 1 ☒g/mL矢车菊素葡萄糖苷标准溶液,以 10 ☒L/min的速率注入离子源,在 ESI +模式下,分别对喷雾电压、金属毛细管温度、鞘气压力、辅助气压力和碰撞能量等参数进行优化。
1.3.7抗坏血酸含量测定 [11]
取 10 g冷冻保藏的桃金娘在室温下解冻 15 min,然后加入 40 mL 0.1% DTT,均质机中均质 10 min,后以 6 000 r/min的速率离心 10 min。收集上清液并用 0.1 mol/L NaOH调节 pH值至 5~ 5.2。在室温下放置 2 h。进行 HPLC检测前,样品用 0.45 nm的 PTFE注射器式过滤器过滤。
高效液相色谱仪色谱条件:色谱柱: Symmetry C 18柱( 150 mm× 4.6 mm, 3.5 ☒m);流速: 0.5 mL/min;流动相: 2% KH 2 PO 4( pH 2.5,含 0.1% DTT);洗脱时间: 15 min;进样量: 20 ☒L;进样器温度: 25℃;柱温: 40℃;检测波长: 243 nm。
1.3.8抗氧化活性测定
1.3.8.1过氧化物自由基( ROO·)清除能力 [12]
通过在 1 mmol/L KOH中水解 55 ☒L 6 mmol/L的 DCFH-DA制得 DCFH溶液, DCFH-DA与 KOH的体积比为 1∶10。在水解液中加入 100 mmol/L磷酸盐缓冲液( pH 7.4)至总体积为 10 mL。每天用磷酸盐缓冲液( pH 7.4)新鲜配制 200 mmol/L ABAP工作液并在 4℃条件下避光保存。用 50%丙酮配制 1 mg/mL的抗坏血酸溶液和没食子酸溶液并保存在 4℃条件下。使用荧光分析仪进行高通量实验。在检测过程中 96孔板需盖上盖以防溶液蒸发。每一组反应混合物都包含 100 ☒L不同质量浓度的样品,本实验中取了 6个不同质量浓度的桃金娘样品( 0.05、 0.1、 0.15、 0.3、 0.4 mg/mL)。用移液枪在每一个孔中加入 50 ☒L DCFH后在暗盒中 2 000 r/min振荡 10 s以保证混合均匀。再加入 50 ☒L ABAP用于激发反应,并在自动振荡仪上振荡均匀。在加入激发剂( ABAP)后立刻测定荧光吸收值,激发波长 485 nm,发射波长 538 nm。每一 96孔板连续读值 1 h,时间间隔为 1 min。每一反应混合物的总体积是 200 ☒L,操作在 37℃中进行,每一样品重复 3次。空白值与对照值在相同条件下测量。空白值包括 100 ☒L 50%丙酮和 100 ☒L 100 mmol/L磷酸盐缓冲液( pH 7.4)。对照值包括 100 ☒L 50%丙酮, 50 ☒L DCFH和 50 ☒L ABAP。使用 Workout 2.5软件进行数据收集。荧光值为 3次实验的平均值。控制值和样品值都在 40 min时达到最大吸收。 ROO·抑制能力( PSC单位)根据公式( 1)进行计算:

式中: AUC 样品和 AUC 对照分别表示样品和对照的曲线下面积。
样品、对照和抗坏血酸、没食子酸标准品的 AUC值通过公式( 2)进行计算。
式中:f 0为在 0 min时样品初始荧光强度、对照值减去空白的初始荧光强度;f i为在反应时间i时样品荧光强度、对照减去空白荧光强度,这里i =40 min。
AUC值使用 Microsoft Excel软件进行计算。使用半最大效应浓度( concentration for 50% of maximal effect, EC 50)( PSC单位 =0.5)来表示 ROO·抑制能力, EC 50以抗坏血酸和 GAE表示。
1.3.8.2 ABTS + ·清除能力 [13]
用 50%丙酮配制 6.25 mmol/L的抗坏血酸储备液和 5 mmol/L的没食子酸储备液,并于 4℃条件下保存。通过混合 7 mmol/L ABTS储备液和过硫酸钾水溶液来制备 ABTS + ·,并使最终溶液里的过硫酸钾浓度为 2.5 mmol/L。待过硫酸钾完全溶化后,将溶液置于室温中避光保存 16 h后再使用。在阳离子基生成后,所有的 ABTS储备液用 95%乙醇稀释 7.5倍使其吸光度为 0.7。新鲜的 ABTS工作液需在每次测定前制备。将 25 ☒L、 7个稀释度的桃金娘提取物、抗坏血酸、没食子酸及 50%丙酮(作为空白)分别与 200 ☒L ABTS工作液混合,并用自动振荡器混合均匀。然后立即使用 Victor X3全波长酶标仪测定在 734 nm波长处的吸光度。 EC 50来表示 ABTS +·的清除能力, EC 50以抗坏血酸和没食子酸当量表示。
1.3.8.3 DPPH自由基清除能力 [14]
0.625 mmol/L的 DPPH储备液需每月配制并于 4℃条件下避光保存。通过用 50%丙酮稀释储备液来配制 0.208 mmol/L新鲜的 DPPH工作液,工作液需当天使用配制。用 50%丙酮配制 6.25 mmol/L的抗坏血酸储备液和 5 mmol/L的没食子酸储备液,并于 4℃条件下保存。将 100 ☒L、 7个稀释度的桃金娘提取物、抗坏血酸、没食子酸及 50%丙酮(作为空白)分别与 100 ☒L, 0.208 mmol/L新鲜的 DPPH工作液混合,并于室温中避光保存 40 min。然后立即使用 Victor X3全波长酶标仪测定在 515 nm波长处的吸光度。用 EC 50来表示 DPPH自由基的清除能力, EC 50以抗坏血酸和没食子酸当量表示。
1.3.8.4 FRAP抗氧化能力 [11]
将 2.5 mL TPTZ溶液( 90 mmol/L TPTZ溶于 40 mmol/L HCl中)、 25 mL醋酸盐缓冲液( 300 mmol/L, pH 3.6)和 2.5 mL FeCl 3· 6H 2 O溶液( 180 mmol/L)混合,并于 37℃条件下反应 4 min来制得 FRAP试剂。用 50%丙酮配制 6.25 mmol/L的抗坏血酸储备液和 5 mmol/L的没食子酸储备液,并于 4℃保存。将 30 ☒L、 7个稀释度的桃金娘提取物、抗坏血酸、没食子酸及 50%丙酮(作为空白)分别与 100 ☒L FRAP工作液及 90 ☒L蒸馏水混合均匀。然后立即使用 Victor X3全波长酶标仪测定在 593 nm波长处的吸光度。用 EC 50来表示 FRAP的抗氧化能力,以抗坏血酸和没食子酸当量表示。
1.3.9总黄酮含量测定 [15]
分别取 0.2 mL桃金娘提取物、儿茶酚标准溶液于 50 mL容量瓶中,再加入 10 mL体积分数为 30%乙醇溶液和 0.3 mL体积分数为 5% NaNO 2溶液。 10 min后加入 0.3 mL质量分数为 10% AlCl 3· 6H 2 O溶液,再于室温中反应 10 min,后再加入 4 mL 5% NaOH溶液。最后立即用蒸馏水稀释溶液至 50 mL,混合均匀。混合物放置 10 min后用 UV-1800紫外 -可见分光光度计测定 510 nm波长处的吸光度。以儿茶酚质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,得到的回归方程为:y= 0.104 9x- 0.008 4(R 2= 0.999 8),儿茶酚质量浓度范围为 0.4~ 6 mg/L。总黄酮含量以儿茶酚当量( catechol equivalent, CE)表示( mg CE/100 g,以干质量计)。
2.1 总花青素含量
为提高提取物中花青素的稳定性和达到最大提取率,采用酸性条件进行提取( 90%甲醇中含 0.5%甲酸) [16]。桃金娘中的总花青素含量是 414 mg/100 g。为了便于与其他浆果类中的花青素含量进行比较,将干质量换算成湿质量,每 100 g湿质量的桃金娘中总花青素的含量是 78.6 mg/100 g(新鲜桃金娘的含水量是 81%)。此含量与中国杨梅和一些醋栗相近 [17-18],但低于黑莓 [19]。本实验中的总花青素含量用矢车菊素 3-O -葡萄糖苷当量表示,因为此化合物是桃金娘中花青素的主要存在形式。
2.2 桃金娘中花青素的组成
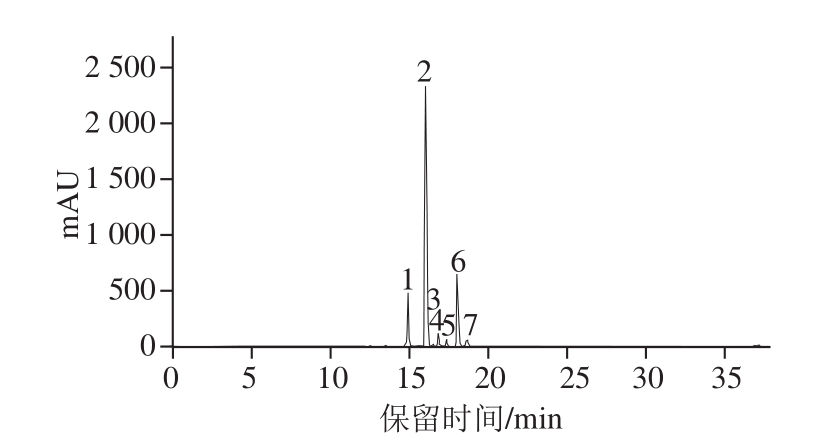
图1 桃金娘的UPLC色谱图
Fig.1 UPLC chromatogram of anthocyanins in hill gooseberry (Rhodomyrtus tomentosa)
不同花青素类物质的鉴别基于其洗脱曲线、紫外可见光谱图、 LC-MS数据和文献记载。通过图 1,采用优化的分离条件可以使桃金娘中的花青素物质完全基线分离。在 520 nm波长处的高效液相色谱( high performance liquid chromatography, HPLC)色谱图中,检测出 7个花青素类化合物。桃金娘中花青素的分布见表 1。质谱鉴定基于全扫描的正电喷雾模式和进一步的 MS/MS实验 (图2)。从桃金娘中花青素的质谱数据(表 1)中看到,峰 1母离子m /z为 465处及最大的子离子m /z为 303,表明其是飞燕草素 3-O -己糖苷;峰 2母离子m /z为 449其最大的子离子m /z为 287处,表明其为矢车菊素 3-O -己糖苷;峰 3母离子m /z为 419及最大的子离子m /z为 287,表明其为矢车菊素 3-O -戊糖苷。峰 4~ 7母离子m /z分别为 479、 433、 463、 493及最大的子离子m /z为 317、 271、 301、 331,表明它们分别是牵牛花色素、天竺葵色素、芍药色素和锦葵色素己糖苷。除峰 3以外, 162质量单位的丢失相当于一分子己糖的分子质量。因此,共有 7种不同的花青素被鉴别出来,分别为飞燕草素 3-O -己糖苷、矢车菊素 3-O -己糖苷、矢车菊素 3-O -戊糖苷、牵牛色素 3-O -己糖苷、天竺葵素 3-O -己糖苷、芍药色素 3-O -己糖苷、锦葵色素 3-O -己糖苷。根据 Lai等 [20]的报道,这里的己糖苷确定为葡萄糖苷。这些花青素的碎片特征与之前报道的单一或串联四极质谱仪得到的数据相似。另外,桃金娘中花青素的洗脱顺序与其他研究植物的文献一致 [21]。随着极性的减小,花青素的保留时间会延长。通过计算峰面积百分比可知,矢车菊素 3-O -葡萄糖苷的相对百分含量为 61.0%,随后的芍药色素 3-O -葡萄糖苷为 17.7%,飞燕草素 3-O -葡萄糖苷为 12.8%,牵牛色素 3-O -葡萄糖苷为 3.9%,天竺葵素 3-O -葡萄糖苷为 2.2%,锦葵色素 3-O -葡萄糖苷为 2.0%,含量最少的矢车菊素 3-O -戊糖苷为 0.5%。
表1 桃金娘中花青素的色谱、质谱及光谱特征
Table1 Chromatographic, mass spectral and spectroscopic characteristics of anthocyanins detected in hill gooseberry
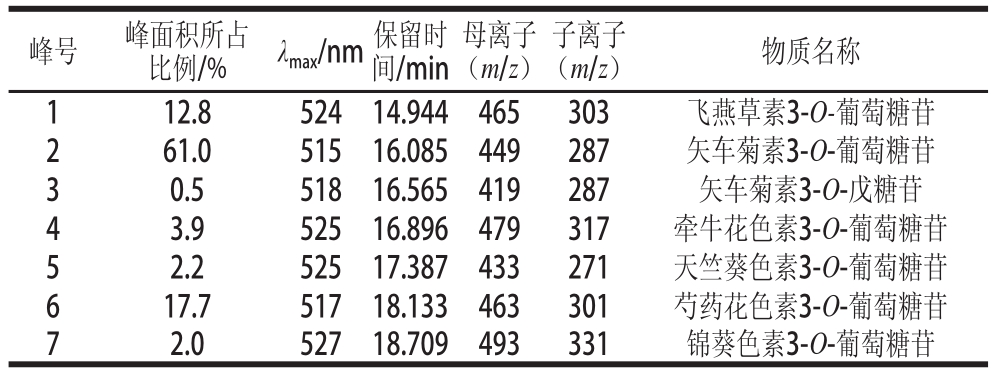
峰号峰面积所占比例/%λ max/nm保留时间/min母离子(m/z)子离子(m/z)物质名称112.852414.944465303飞燕草素3-O-葡萄糖苷261.051516.085449287矢车菊素3-O-葡萄糖苷30.551816.565419287矢车菊素3-O-戊糖苷43.952516.896479317牵牛花色素3-O-葡萄糖苷52.252517.387433271天竺葵色素3-O-葡萄糖苷617.751718.133463301芍药花色素3-O-葡萄糖苷72.052718.709493331锦葵色素3-O-葡萄糖苷
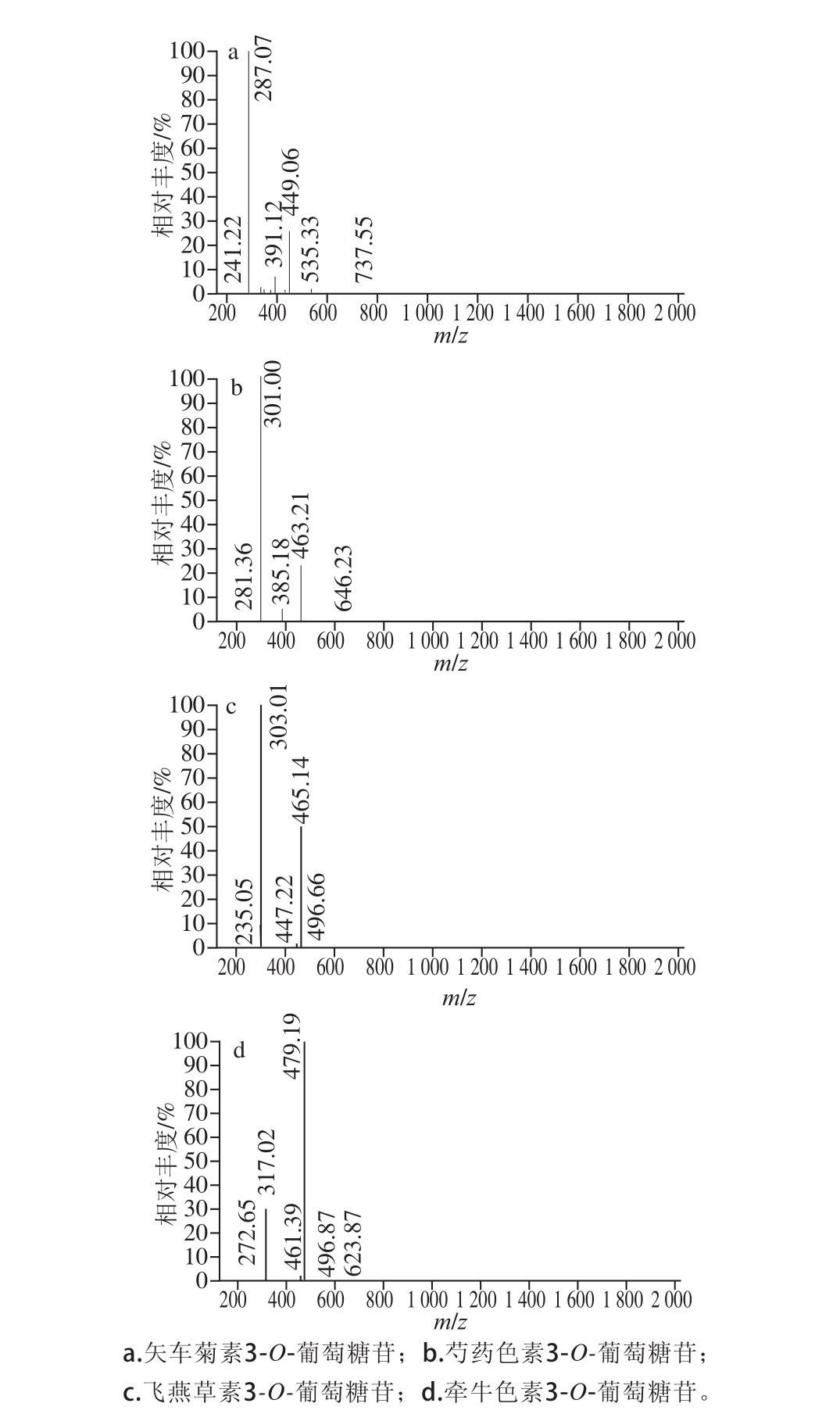
图2 桃金娘中主要花青素单体的MS/MS光谱图
Fig.2 MS/MS spectra of major anthocyanins in hill gooseberry (Rhodomyrtus tomentosa)
2.3 总多酚含量
桃金娘中的总多酚含量是 4 976 mg GAE/100 g,此水平高于 Huang等 [7]的报道,其报道中产于太平山的桃金娘中总多酚含量是 2 400 mg GAE/100 g。这些差异可能归因于多种变量如产地、成熟度、不同的提取方法和其他。数据表明,产自翁源县的桃金娘有与野樱桃( 4 210 mg GAE/100 g)具有相近的多酚含量,远高于越橘( 3 300~ 3 820 mg GAE/100 g)、黑醋栗( 2 230~ 2 790 mg GAE/100 g)、波哥大越橘( 2 910 mg GAE/100 g)、云莓( 1 510~ 1 840 mg GAE/100 g)、越橘( 2 600~ 2 780 mg GAE/100 g)、蔓越橘( 2 200 mg GAE/100 g)、醋栗( 1 320 mg GAE/100 g)、覆盆子( 2 730~ 2 990 mg GAE/100 g)、红醋栗( 1 400 mg GAE/100 g)、花楸浆果( 2 090 mg GAE/100 g)、草莓( 1 600~ 2 410 mg GAE/100 g) [17]。
2.4 总抗坏血酸含量
桃金娘中的抗坏血酸含量是 9 mg/100 g,此含量与 Huang等 [7]报道的相当。桃金娘中的总抗坏血酸含量与蓝莓( 9.7 mg/100 g)相近,但低于黑莓( 21 mg/100 g)和黑加仑( 181 mg/100 g)等 [22]。
2.5 抗氧化活性
结果发现过氧化物自由基( PSC单位)清除能力为:抗坏血酸、没食子酸和桃金娘的 EC 50分别是 2.7、 1.6μg /mL和 0.66 mg/mL。桃金娘相当于 23.2μmol抗坏血酸和 14.3μmol没食子酸量。基于 EC 50值,桃金娘过氧化物自由基清除能力明显高于苹果、蔓越橘、玉米、小麦、燕麦和稻谷,但低于葡萄和小麦 [12]。
表2 桃金娘提取物的抗氧化能力
Table2 Antioxidant activity of hill gooseberry extract
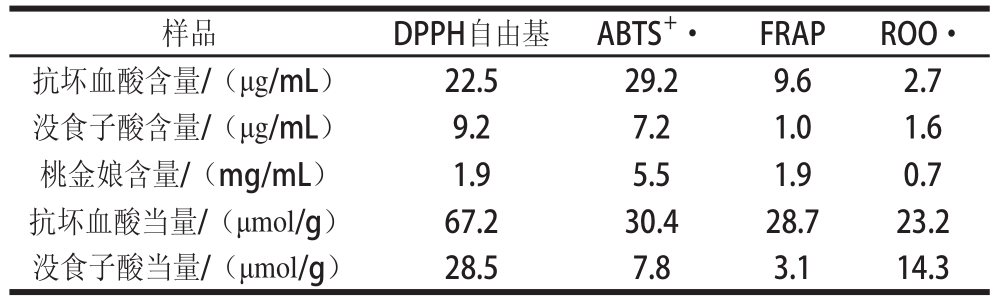
注:表中数据为EC 50值(以没食子酸和抗坏血酸当量表示)。
样品DPPH自由基ABTS +·FRAPROO·抗坏血酸含量/(μg/mL)22.529.29.62.7没食子酸含量/(μg/mL)9.27.21.01.6桃金娘含量/(mg/mL)1.95.51.90.7抗坏血酸当量/(μmol/g)67.230.428.723.2没食子酸当量/(μmol/g)28.57.83.114.3
对 DPPH自由基、 ABTS +·和 FRAP的实验, EC 50、抗坏血酸当量和没食子酸当量见表 2。 ABTS +·清除能力的 EC 50:每克桃金娘相当于 30.4μmol抗坏血酸和 7.8μmol没食子酸当量; FRAP还原能力的 EC 50:每克桃金娘相当于 28.7μmol抗坏血酸和 3.1μmol没食子酸当量; DPPH自由基清除能力的 EC 50:每克桃金娘相当于 67.2μmol抗坏血酸和 28.5μmol没食子酸当量。 ABTS和 DPPH方法测定的是抗氧化物清除 ABTS +·或 DPPH自由基的能力,而 FRAP方法测定的是抗氧化物将黄色的 Fe 3+ -TPTZ化合物还原成蓝色的 Fe 2+ -TPTZ化合物的能力。桃金娘具有较高抗氧化能力,这可能归因于其中含有较多的多酚物质。在研究中发现,桃金娘中的多酚类物质含量远远高于其他水果和谷物 [23-24]。多酚化合物主要包括黄酮类、酚酸、奎宁、单宁及其他 [25]。过去的报道指出多酚含量和抗氧化能力之间有较强的相关性 [26]。桃金娘中的抗坏血酸含量并不高,因此抗坏血酸可能不是其抗氧化能力的主要来源。此现象同样在草莓和浆果的研究中发现,即抗坏血酸不是主要抗氧化物,而多酚类物质才是主要的抗氧化物 [27]。
2.6 总黄酮含量
桃金娘中的总黄酮含量为 49.7 mg CE/100 g。此含量是鲜西红柿( 9.42μg /g)的 9倍 [15],也远高于其他叶用蔬菜 [28]。高黄酮含量也是桃金娘具有高抗氧化能力的原因。
本实验报道了桃金娘抗氧化能力( DPPH自由基、 ROO·、 ABTS +·和 FRAP)、总多酚含量、总黄酮含量、抗坏血酸含量和花青素类成分。研究表明,桃金娘是诸如花青素、黄酮、多酚等植物类化合物的优质来源,具有较高的抗氧化能力。因此桃金娘可作为天然抗氧化物质、天然色素和功能性食品的原料。
参考文献:
[1] FIELD T S, LEE D W, HOLBROOK N M. Why leaves turn red in autumn. The role of anthocyanins in senescing leaves of red-osier dogwood[J]. Plant Physiology, 2001, 127(2)∶ 566-574.
[2] KONG J M, CHIA L S, GOH N K, et al. Analysis and biological activities of anthocyanins[J]. Phytochemistry, 2003, 64(5)∶ 923-933.
[3] WANG L S, STONER G D. Anthocyanins and their role in cancer prevention[J]. Cancer Letters, 2008, 269(2)∶ 281-290.
[4] GIUSTI M M, WROLSTAD R E. Characterization and measurement of anthocyanin by UV-visible spectroscopy[M]//Current protocols in food analytical chemistry. New York∶ John Wiley, Sons, 2001∶ 19-31.
[5] 谭杰凤. 桃金娘的研究现状及发展前景[J]. 中国热带农业, 2011, 39(2)∶ 63-64.
[6] CHEN Lizhen. Advances in the research of active ingredients and medicine and edible function of Frutus rhodomyrti[J]. Asia-Pacific Traditional Medicine, 2012, 8(6)∶ 212-213.
[7] HUANG W Y, CAI Y Z, CORKE H, et al. Survey of antioxidant capacity and nutritional quality of selected edible and medicinal fruit plants in Hong Kong[J]. Journal of Food Composition and Analysis, 2010, 23(6)∶ 510-517.
[8] TIAN Q, GIUSTI M M, STONER G D, et al. Screening for anthocyanins using high-performance liquid chromatography coupled to electrospray ionization tandem mass spectrometry with precursorion analysis, production analysis, common-neutral-loss analysis, and selected reaction monitoring[J]. Journal of Chromatography A, 2005, 1091(1/2)∶ 72-82.
[9] LEE J, DURST R W, WROLSTAD R E. Determination of total monomeric anthocyanin pigment content of fruit juices, beverages, natural colorants, and wines by the pH differential method∶ collaborative study[J]. Journal of AOAC International, 2005, 88(5)∶ 1269-1278.
[10] WATERHOUSE L. Determination of total phenolics[M]//Current protocols in food analytical chemistry. New York∶ John Wiley, Sons, 2001∶ 1073-1080.
[11] GARZON G A, RIEDL K M, SCHWARTZ S J. Determination of anthocyanins, total phenolic content, and antioxidant activity in Andes Berry (Rubus glaucus Benth)[J]. Journal of Food Science, 2009, 74(3)∶227-232.
[12] ADOM K K, LIU R H. Rapid peroxyl radical scavenging capacity (PSC) assay for assessing both hydrophilic and lipophilic antioxidants[J]. Journal of Agricultural and Food Chemistry, 2005, 53(17)∶ 6572-6580.
[13] RE R, PELLEGRINNI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine, 1999, 26(9/10)∶ 1231-1237.
[14] CHENG Z H, MOORE J, YU L. High-throughput relative DPPH radical scavenging capacity assay[J]. Journal of Agricultural and Food Chemistry, 2006, 54(20)∶ 7429-7436.
[15] DEWANTO V, WU X Z, ADOM, et al. Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity[J]. Journal of Agricultural and Food Chemistry, 2002, 50(10)∶3010-3014.
[16] LACOBUCCI G A, SWEENY J G. The Chemistry of anthocyanins, anthocyanidins and related flavylium salts[J]. Tetrahedron, 1983, 39(19)∶ 3005-3038.
[17] KAHKONEN M P, HOPIA A I, HEINONEN M. Berry phenolics and their antioxidant activity[J]. Journal of Agricultural and Food Chemistry, 2001, 49(8)∶ 4076-4082.
[18] FANG Z, BHANDARI B. Effect of spray drying and storage on the stability of bayberry polyphenols[J]. Food Chemistry, 2011, 129(3)∶1139-1147.
[19] FUKUMOTO L R, MZAAZ G. Assessing antioxidant and prooxidant activity of phenolic compounds[J]. Journal of Agricultural and Food Chemistry, 2000, 48(8)∶ 3597-3604.
[20] LAI T N H, HERENT M F, QUETIN-LECLERCQ J, et al. Piceatannol, a potent bioactive stilbene, as major phenolic component in Rhodomyrtus tomentosa[J]. Food Chemistry, 2013, 138(2/3)∶ 1421-1430.
[21] GAVRILOVA V, KAJDZANOSKA M, GJAMOVSKI V, et al. Separation, characterization and quantification of phenolic compounds in blueberries and red and black currants by HPLC-DAD-ESI-MS n[J]. Journal of Agricultural and Food Chemistry, 2011, 59(8)∶ 4009-4018.
[22] USDA Database. Welcome to the USDA National Nutrient Database for Standard Reference[EB/OL]. (2011-12-07) [2013-01-22]. http∶// ndb.nal.usda.gov.
[23] CHUN O K, KIM D O, SMITH N, et al. Daily consumption of phenolics and total antioxidant capacity from fruit and vegetables in the American diet[J]. Journal of the Science of Food and Agriculture, 2005, 85(10)∶ 1715-1724.
[24] ADOM K K, LIU R H. Antioxidant activity of grains[J]. Journal of Agricultural and Food Chemistry, 2002, 50(21)∶ 6182-6187.
[25] SAKAKIBARA H, HONDA Y, NAKAGAWA S, et al. Simultaneous determination of all polyphenols in vegetables, fruits, and teas[J]. Journal of Agricultural and Food Chemistry, 2003, 51(3)∶ 571-581.
[26] PIOR R L, CAO G H, MARTIN A, et al. Antioxidant capacity as influenced by total phenolic and anthocyanin content, maturity and variety of Vaccinium species[J]. Journal of Agricultural and Food Chemistry, 1998, 46(7)∶ 2686-2693.
[27] KALT W, FORNEY C F, MARTIN A, et al. Antioxidant capacity, vitamin C, phenolics and anthocyanins after fresh storage of small fruits[J]. Journal of Agricultural and Food Chemistry, 1999, 47(11)∶4638-4644.
[28] KHANAM U K S, OBA S, YANASE E, et al. Phenolic acids, flavonoids and total antioxidant capacity of selected leafty vegetables[J]. Journal of Functional Foods, 2012, 4(4)∶ 979-987.
Main Antioxidant Components and Antioxidant Activity of Wild Hill Gooseberry Fruits (Rhodomyrtus tomentosa) from Southern China
LUO Shuangyan
1,2
, WANG Chao
1,2
, DUAN Hanying
1,*
, LUO Yaoxin
1
, YU Bing
1
(1. Department of Food Science and Engineering, Jinan University, Guangzhou 510632, China; 2. Guangdong Saskatchewan Oilseeds Joint Laboratory, Jinan University & University of Saskatchewan, Guangzhou 510632, China)
Abstract:The ripe fruit of wild hill gooseberry ( Rhodomyrtustomentosa) was analyzed for its antioxidant activity, total phenolics, total flavonoids, ascorbic acid contents, and anthocyanin composition. Ultra performance liquid chromatography coupled to photo-diode array and ion-trap mass spectrometry (UPLC-PDA-IT-MS) was used to identify the anthocyanin composition. The antioxidant activity was determined by high-throughput free radical scavenging assay. As a result, the wild hill gooseberry had a higher antioxidant capacity. The 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging activity was expressed as 67.2 μmol of ascorbic acid and 28.5 μmol of gallic acid equivalents per g of hill gooseberry. The peroxyl radical scavenging capacity (PSC) was expressed as 23.2 μmol of ascorbic acid and 14.3 μmol of gallic acid equivalents per g of hill gooseberry. The 2,2’-azinobis-(3-ethylbenzothiazoline-6-sulfonic acid) (ABTS) radical scavenging activity was expressed as 30.4 μmol of ascorbic acid and 7.8 μmol of gallic acid equivalents per g of hill gooseberry. The ferric reducing antioxidant power (FRAP) was expressed as 28.7 μmol of ascorbic acid and 3.1 μmol of gallic acid equivalents per g of hill gooseberry. Total phenolics and total fl avonoids contents (on a dry weight basis) were 4 976 mg GAE/100 g m dand 49.7 mg catechin/100 g m d,respectively, and total ascorbic acid content (on a fresh weight basis) was 9 mg/100 g m f .Total monomeric anthocyanin content (on a dry weight basis) was 414 mg/100 g m d. Seven anthocyanins including delphinidin 3- O-glucoside were identifi ed. Cyanidin 3- O-glucoside was the most predominated form, followed by peonidin 3- O-glucoside and delphinidin 3- O-glucoside.
Key words: hill gooseberry; anthocyanins; antioxidant components; antioxidant properties
中图分类号: TS201.2
文献标志码: A 文章编号:1002-6630(2015)17-0077-06
文章编号:1002-6630(2015)17-0077-06
doi:10.7506/spkx1002-6630-201517015
收稿日期:2014-11-22
基金项目:中央高校基本科研业务费专项资金项目(21612315);广东省自然科学基金项目(S2012040006809)
作者简介:罗爽妍(1991—),女,硕士研究生,研究方向为功能性食品。E-mail:932124045@qq.com
*通信作者:段翰英(1978—),女,讲师,博士,研究方向为食品加工与保藏。E-mail:tduhy@jnu.edu.cn