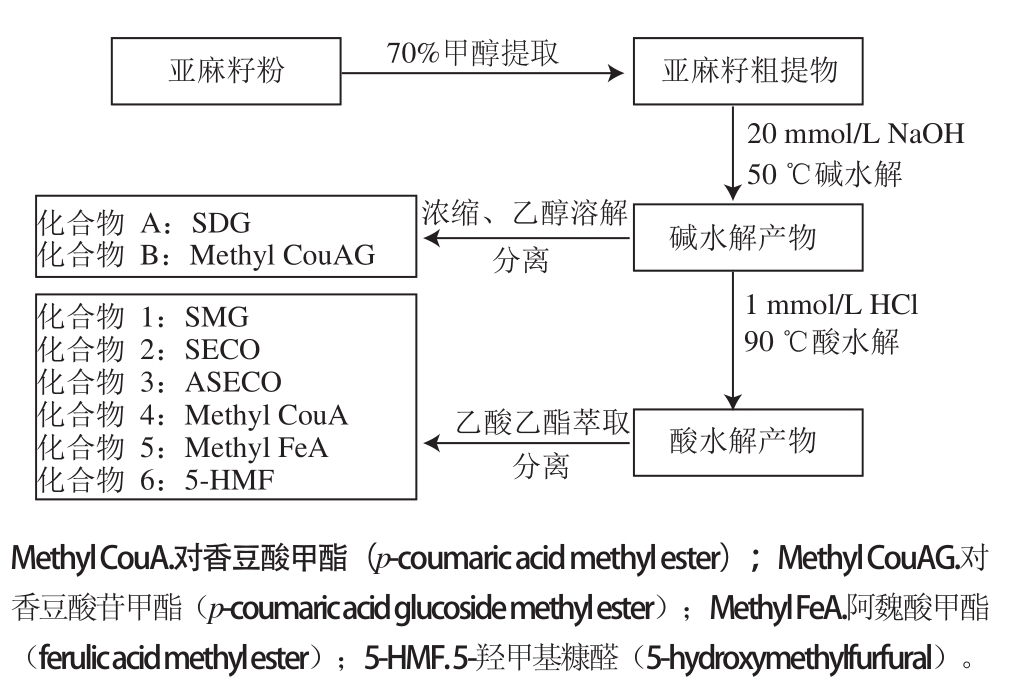
图1 亚麻籽SDG及主要水解产物提取路线
Fig.1 Separation procedures of SDG and the main hydrolysates from flaxseeds
李 欣 1,2,何 敏 1,袁建平 2,王江海 2,*
(1.广东科贸职业学院生物技术系,广东 广州 510430;2.中山大学海洋学院,广东省海洋资源与近岸工程重点实验室,广东 广州 510006)
摘 要:采用快速柱层析和制备薄层色谱相结合的新方法,从亚麻籽中分离木脂素开环异落叶松脂酚二糖苷和对香豆酸苷甲酯。同时发现,亚麻籽开环异落叶松脂酚二糖苷在酸水解时除生成开环异落叶松脂酚和无水开环异落叶松脂酚,还部分转化为开环异落叶松脂酚单糖苷。从亚麻籽的酸水解产物中分离出 6个化合物,分别鉴定为:开环异落叶松脂酚单糖苷、开环异落叶松脂酚、无水开环异落叶松脂酚、对香豆酸甲酯、阿魏酸甲酯和 5-羟甲基糠醛;其中对香豆酸苷甲酯、对香豆酸甲酯和阿魏酸甲酯为首次从亚麻籽水解产物中分离获得,分别由对香豆酸苷、对香豆酸和阿魏酸在水解时与甲醇发生酯交换形成。体外抗氧化测试结果表明,开环异落叶松脂酚二糖苷、开环异落叶松脂酚单糖苷和开环异落叶松脂酚对 1,1-二苯基 -2-三硝基苯肼( 1,1-diphenyl-2-picrylhydrazyl, DPPH)自由基、羟自由基(· OH)和超氧阴离子自由基( O 2 -·)均具有清除作用,且呈明显的量效关系。
关键词:亚麻籽;木脂素;水解产物;抗氧化活性
木脂素是植物中广泛存在的酚类化合物,是植物雌激素中的一类 [1-2]。在所有谷物、豆类、蔬菜和水果中,亚麻籽(Linum usitatissimum)木脂素开环异落叶松脂酚( secoisolariciresinol, SECO)含量最高 [3-4]。 SECO在肠道微生物作用下可代谢为动物雌激素肠二醇和肠内脂 [5-6]。木脂素具有降低血清胆固醇及减少Ⅱ型糖尿病、乳腺癌、前列腺癌和直肠癌等发病风险的生物活性 [7-10]。亚麻籽中的 SECO与糖苷结合,以开环异落叶松脂酚二糖苷( secoisolariciresinol diglucoside, SDG)形式存在, SDG与 3-羟基 -3甲基戊二酸、对香豆酸苷、阿魏酸苷和草棉素糖苷等结合形成分子质量约为 4 000 D的 SDG聚合物 [4,11-12]。亚麻籽木脂素在分离提取时需通过水解将其酯键和糖苷键打断 [13-15]。 SDG聚合物在碱水解后, SDG会游离出来,然后通过酸水解或酶水解使糖苷键断裂,从 SDG中释放出 SECO;在酸性条件下, SECO中相邻的两个羟基会发生缩合而脱去一个水分子,生成无水开环异落叶松脂酚( anhydrosecoisolariciresinol, ASECO) [2,16]。研究发现,开环异落叶松脂酚单糖苷( secoisolariciresinol monoglucoside, SMG)是 SDG在人类肠道微生物作用下脱掉糖苷生成 SECO过程中的中间产物 [4];然而,在酸水解时是否产生 SMG则未见报道。分离纯化亚麻籽中木脂素的方法目前主要有反相高效液相制备色谱、高速逆流色谱、固相萃取和柱色谱等 [11,17-20]。本实验采用快速柱层析分离( flash columnar chromatography, FCC)和制备薄层色谱( preparative thin layer chromatography, PTLC)相结合的方法,从亚麻籽粉中分离制备了 SDG纯品。并对亚麻籽木脂素酸水解产物进行了分离和结构鉴定,明确了化合物间的转化关系。通过测定 SDG及其酸水解产物 SMG、 SECO、 ASECO的体外抗氧化活性,为亚麻籽木脂素的高效利用提供参考。
1.1材料与试剂
亚麻籽粉(含 SDG约 40%) 湖南德瑞生物产业集团有限公司。
SECO(纯度 95%)、 5-羟甲基糠醛(纯度 95%)美国 Sigma-Aldrich公司; 1,1-二苯基 -2-三硝基苯肼( 1,1-diphenyl-2-picrylhydrazyl, DPPH) 上海晶纯实业有限公司;邻苯三酚(焦性没食子酸)、邻二氮菲 上海国药集团化学试剂有限公司; Tris-HCl生工生物工程(上海)股份有限公司;硅胶 H(薄层层析用,粒度 10~ 40μm) 青岛海洋化工厂;可剪截型薄层层析板(铝基硅胶 G板) 天津市天河医疗有限公司; C 18柱( 500 mg/3 mL) 美国 Supelco公司; PTLC板:玻璃板( 20 cm× 20 cm, 2 mm)铺 10 g活化后的硅胶,硅胶层厚度约 0.5 mm;制备柱(Φ= 20 mm,L = 30 cm)。
1.2仪器与设备
Alpha 1-4真空冷冻干燥仪 香港 HUA-YEE仪器公司; Varian INOVA 500NB傅里叶变换超导核磁共振谱仪 美国 Varian公司;双聚焦磁质谱仪 英国 VG公司; Muhiskan Spectrum全波长酶标仪 美国赛默飞世尔科技公司; 732N紫外分光光度计 上海精密科学仪器有限公司; Heidolph-4001旋转蒸发仪 北京博励行仪器有限公司; SHZ-D( III)循环水式真空泵 巩义市英峪予华仪器厂。
1.3亚麻籽碱水解产物的提取
称取 10 g亚麻籽粉,加入 60 mL体积分数为 70%的甲醇水溶液后提取 3次;提取液合并后浓缩至约 20 mL时进行碱水解(反应液 NaOH浓度约为 20 mmol/L);在 50℃水浴中保持 1 h后,用醋酸调节 pH值至 5.0;低温浓缩,加入无水硫酸钠静置过夜后,用甲醇洗涤回收;提取液经减压浓缩得到 5.6 g浸膏,见图 1。取适量用少量乙醇溶解后,加入 4倍量的硅胶吸附,再进行 FCC。依次用 150 mL乙酸乙酯 -乙醇( 8.5∶1.5,V /V)、 100 mL乙酸乙酯 -乙醇( 8∶2,V /V)和 50 mL乙酸乙酯 -乙醇( 7∶3,V /V)的混合溶液梯度洗脱,每 20 mL洗脱液收集一管,分离过程用薄层色谱法监控,合并组成类似的收集物,用 PTLC纯化(展开剂:乙酸乙酯 -乙醇 8∶2,V /V),纯化后的样品经浓缩后进行冷冻干燥,得到 2个化合物;其中化合物 A为 2.6 g,化合物 B为 290 mg。
1.4亚麻籽粉提取液水解产物的纯化和鉴定
称取 20 g亚麻籽粉的甲醇提取物,加 25 mL水溶解,碱水解后,在 1 mol/L HCl条件下,于 95℃水浴中振荡 3 h;再用乙酸乙酯萃取 3次,收集水相用 C 18柱纯化;甲醇洗脱回收 SMG后,用 PTLC纯化 [展开剂:乙酸乙酯 -乙醇( 8.5∶1.5,V /V) ],得到化合物 1为白色固体,其质量约 44 mg。有机相合并浓缩后,再用硅胶吸附、上样;采用 FCC分离,分别用乙酸乙酯 -石油醚( 5∶5,V /V),乙酸乙酯 -石油醚( 8∶2,V /V)和乙酸乙酯淋洗,收集合并组分类似的收集液;采用 FCC和 PTLC纯化,得到化合物 2( 38 mg)、化合物 3( 47 mg)、化合物 4( 17 mg)、化合物 5( 14 mg)和化合物 6( 13 mg) 5个化合物。过程见图 1。

图1 亚麻籽SDG及主要水解产物提取路线
Fig.1 Separation procedures of SDG and the main hydrolysates from flaxseeds
1.5 SDG及其酸水解产物的抗氧化活性测定
参照周先丽等 [21]方法,采用酶标仪微量法和紫外 -可见光分光光度法,以 VC为阳性对照,分别测定 SDG及其酸水解产物 SMG、 SECO和 ASECO对 DPPH自由基、羟自由基(· OH)和超氧阴离子自由基( O 2 -·)的清除能力。上述实验均设 3次重复,计算清除率和半数清除率( IC 50, Logit法计算)。
2.1亚麻籽碱水解产物的分离
刘大川等 [18]采用硅胶柱层析甲醇 -氯仿 -冰醋酸混合溶剂洗脱分离木脂素。为了提高提取效率和木脂素的纯度,本实验采用乙酸乙酯 -乙醇梯度洗脱 FCC分离、 PTLC纯化亚麻籽木脂素 SDG。通过液相色谱测定 SDG峰面积占总峰面积的比例,确定 SDG的纯度约为 96%。结合核磁共振和质谱分析结果,对 SDG的结构进行了确认。该方法所需的仪器简单,提取试剂无毒、无污染,提高了木脂素分离方法的安全性并降低了成本。
化合物 A:白色无定形粉末; FAB-MSm /z 686[M] +; 1 H NMR( CD 3 OD, 500 MHz)δ: 6.59( 2H, d,J = 1.8 Hz, H-2, 2’), 6.64( 2H, d,J = 8.0 Hz, H-5, 5’), 6.56( 2H, dd,J = 1.8, 8.0 Hz, H-6, 6’), 2.61( 2H, dd,J = 7.9, 13.8 Hz, H-7, 7’ a), 2.68( 2H, dd,J = 6.9, 13.8 Hz, H-7, 7’ b), 2.12( 2H, m, H-8, 8’), 4.06( 2H, dd,J = 5.6, 9.9 Hz, H-9, 9’ a), 3.47( 2H, dd,J = 6.4, 9.9 Hz, H-9, 9’ b), 3.73( 3H, s, OCH 3), 4.23( 2H, d,J = 7.8 Hz, H-1a, 1a’), 3.21( 2H, t,J = 7.8, 9.0 Hz, H-2a, 2a’), 3.25( 2H, m, H-5a, 5a’), 3.84( 2H, brd,J = 2.3, 11.8 Hz, H-6a-a/6a’ -a), 3.68( 2H, dd,J = 5.5, 11.8 Hz, H-6a-b/6a’ -b)。以上数据与文献 [15]报道的波谱数据一致,确定化合物 A为 SDG。
化合物 B:白色无定形粉末; FAB-MSm /z 343[M-H] +; 1 H NMR( CDCl 3 , 500 MHz)δ: 7.55( 1H, d,J = 8.7 Hz, H-2), 7.12( 2H, d,J = 8.8 Hz, H-3,5), 7.55( 1H, d,J = 8.6 Hz, H-6), 7.65( 1H, d,J = 15.8 Hz, H-7), 6.41( 1H, d,J = 16.0 Hz, H-8), 3.77( 3H, s, OCH 3), 4.844( 1H, s, Aro-OH), 4.96( 1H, d,J = 7.3 Hz, H-1a), 3.70( 1H, dd,J = 2.8, 10.4 Hz, H-6a), 4.96( 1H, dd,J = 2.4, 9.8 Hz, H-6b)。根据 1 H-NMR和质谱分析结果,确定化合物 B为 Methyl CouAG。
研究表明,亚麻籽中的 SDG与 3-羟基 -3甲基戊二酸连接构成亚麻籽多聚体结构的链状骨架;对香豆酸苷和阿魏酸苷分别以酯键连接在该多聚体骨架上 [4,22]。 CouAG甲酯的形成说明碱水解后多聚体酯键断裂,并使对香豆酸苷和阿魏酸苷的糖苷配基的 —COOH基团暴露出来,与反应液中的甲醇发生酯交换,生成 CouAG甲酯和阿魏酸苷甲酯。
2.2亚麻籽粉提取液酸水解产物的分离
SDG在体内的代谢需借助特定的肠道菌群。若体内缺失该菌群,则 SDG不能被人体吸收利用。因此,对亚麻籽木脂素酸水解产物的鉴别非常必要,且具有重要的应用价值,有助于寻找更易吸收利用的木脂素衍生物。本实验对亚麻籽粉的酸水解液进行了分离鉴定。水解液用乙酸乙酯萃取后,分别从水相和有机相中分离得到 6种化合物,化合物结构如图 2所示。
化合物 1:白色无定形粉末;其结构参数为: FAB-MSm /z 524[M] +; 1 H NMR( CD 3 OD, 500 MHz)δ: 6.60( 1H, d,J = 1.8 Hz, H-2), 6.60( 1H, d,J = 1.8 Hz, H-2’), 6.65( 2H, d,J = 7.9 Hz, H-5, 5’), 6.56( 1H, dd,J = 1.9, 5.3 Hz, H-6), 6.54( 1H, dd,J = 2.0, 5.3 Hz, H-6’) , 2.67( 1H, dd,J = 7.3, 13.6 Hz, H-7b), 2.10( 1H, m, H-8), 1.94( 1H, m, H-8’), 4.05( 1H, dd,J = 6.1, 9.8 Hz, H-9a), 3.47( 1H, dd,J = 6.2, 9.9 Hz, H-9b), 3.64( 1H, dd,J = 6.4, 11.2 Hz, H-9’ a), 3.55( 1H, dd,J = 6.0, 11.0 Hz, H-9’ b), 4.21( 1H, d,J = 7.8 Hz, H-1a), 3.20( 1H, t,J = 7.9, 9.0 Hz, H-2a), 3.23( 1H, m, H-5a), 3.84( 1H, dd,J = 2.4, 11.9 Hz, H-6a-a), 3.68( 1H, dd,J = 5.6, 11.9 Hz, H-6a-b), 3.74( 3H, s, OCH 3); 13 C NMR( CD 3 OD, 500 MHz) δ: 134.0( C-1), 133.8( C-1’), 113.5( C-2), 113.5( C-2’), 148.7( C-3/3’), 145.4( C-4/4’), 115.7( C-5/5’), 122.8( C-6), 122.8( C-6’), 35.9( C-7b), 35.9( C-7a), 35.5( C-7’ a, 7’ b), 41.4( C-8), 43.9( C-8’), 71.1( C-9a), 71.1( C-9b), 62.6( C-9’ a), 62.6( C-9’ b), 104.7( C-1a), 75.2( C-2a), 78.2( C-3a), 71.7( C-4a), 77.9( C-5a), 62.8( C-6a-a), 62.8( C-6a-b)和 56.2( OCH 3)。根据 1 H-NMR和 13 C-NMR谱及质谱( fast atom bombardment mass spectrometry, FAB-MS)数据,确定化合物 1为 SMG。 Clavel等 [5]发现,梭状芽孢杆菌能使 SDG脱去 2个糖基形成 SECO和脱去 1个糖基形成 SMG,本研究表明,在酸水解时 SDG也能部分脱去糖基生成 SMG。
化合物 2:白色无定形粉末;与 SECO标准品的多个溶剂系统进行薄层色谱鉴别,发现两者的薄层色谱斑点 Rf一致。用硫酸 -乙醇显色均呈蓝色,结合 1 H-NMR谱和 FAB-MS分析结果,确定化合物 2为 SECO。其结构参数为: FAB-MSm /z 362[M] +; 1 H NMR( CD 3 OD, 500 MHz)δ: 6.59( 2H, d,J = 1.9 Hz, H-2, 2’), 6.66( 2H, d,J = 7.9 Hz, H-5, 5’), 6.54( 2H, dd,J = 1.9, 7.9 Hz, H-6, 6’), 2.56( 2H, dd,J = 7.5, 13.7 Hz, H-7, 7’ a), 2.66( 2H, dd,J = 6.8, 13.8 Hz, H-7, 7’ b), 1.90( 2H, brd,J = 6.1 Hz, H-8, 8’), 3.58( 2H, m, H-9, 9’ a), 3.31( 2H, m, H-9, 9’ b), 3.74( 3H, s, OCH 3)。
化合物 3:白色无定形粉末;其结构参数为: FABMSm /z 344[M] +; 1 H NMR( CDCl 3, 500 MHz)δ: 6.84( 2H, d,J = 1.7 Hz, H-2, 2’), 7.13( 2H, d,J = 8.0 Hz, H-5, 5’), 6.92( 2H, dd,J = 1.7, 8.0 Hz, H-6, 6’), 2.85( 2H, dd,J = 7.8, 13.8 Hz, H-7, 7’ a), 2.92( 2H, dd,J = 6.6, 13.7 Hz, H-7, 7’ b), 2.50( 2H, m, H-8, 8’), 4.25( 2H, dd,J = 6.5, 8.6 Hz, H-9, 9’ a), 3.86( 2H, dd,J = 5.6, 8.7 Hz, H-9, 9’ b), 4.16( 3H, s, OCH 3)。数据与文献报道 [8]数据一致,确定化合物 3为 ASECO。
化合物 4:白色无定形粉末;其结构参数为: FAB-MSm /z 179[M-H] +; 1 H NMR( CDCl 3, 500 MHz)δ: 7.54( 1H, d,J = 8.6 Hz, H-2), 6.89( 1H, d,J = 8.7 Hz, H-3), 6.89( 1H, d,J = 8.7 Hz, H-5), 7.54( 1H, d,J = 8.6 Hz, H-6), 7.60( 1H, d,J = 16.0 Hz, H-7), 6.34( 1H, d,J = 16.0 Hz, H-8), 3.72( 3H, s, OCH 3)。 1 H-NMR谱和质谱分析结果表明,化合物 4为 Methyl CouA。
化合物 5:白色无定形粉末;其结构参数为: FAB-MSm /z 209[M-H] +; 1 H NMR( CDCl 3, 500 MHz)δ: 7.32( 1H, d,J = 8.6 Hz, H-2), 6.87( 1H, d,J = 8.7 Hz, H-5), 7.14( 1H, dd,J = 2.0, 8.2 Hz, H-6), 7.59( 1H, d,J = 15.9 Hz, H-7), 6.39( 1H, d,J = 15.9 Hz, H-8), 3.72( 3H, s, OCH 3), 3.91( 3H, s, AroOCH 3)。 1 H-NMR谱和质谱分析结果表明,化合物 5为 Methyl FeA。
化合物 6:白色无定形粉末;与 5-HMF标准品的多个溶剂系统进行薄层色谱鉴别,发现两者的薄层色谱斑点 Rf一致。用硫酸 -乙醇显色均呈蓝色,确定化合物 6为 5-HMF。 5-HMF是己糖在酸性条件下的降解产物 [23]。在 SDG多聚体中含大量葡萄糖残基 [24]。前人在亚麻籽提取物中也曾分离出蔗糖 [25]。 5-HMF可能是亚麻籽中的己糖(如蔗糖等)或糖苷中的葡萄糖残基经酸水解形成的。
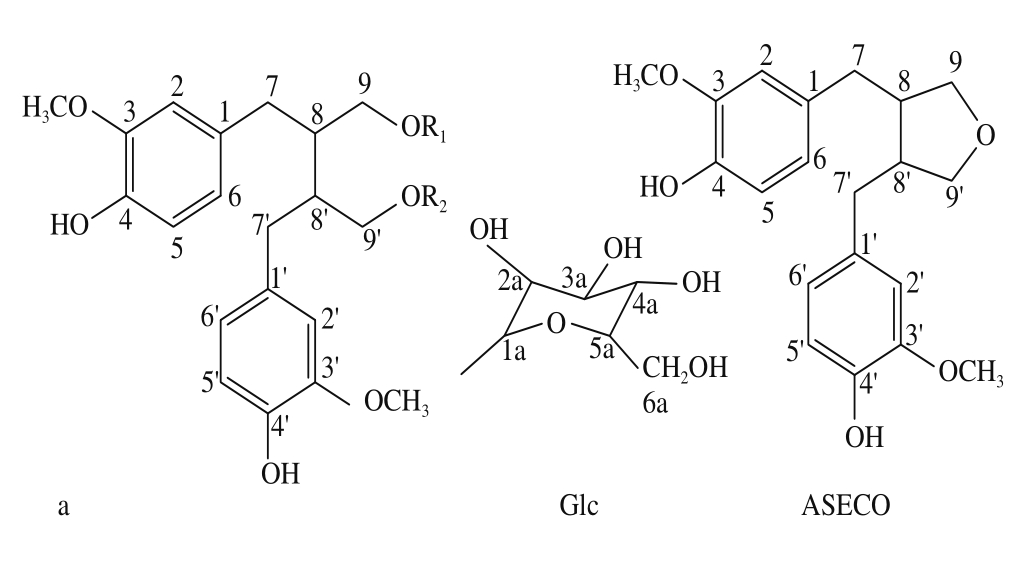
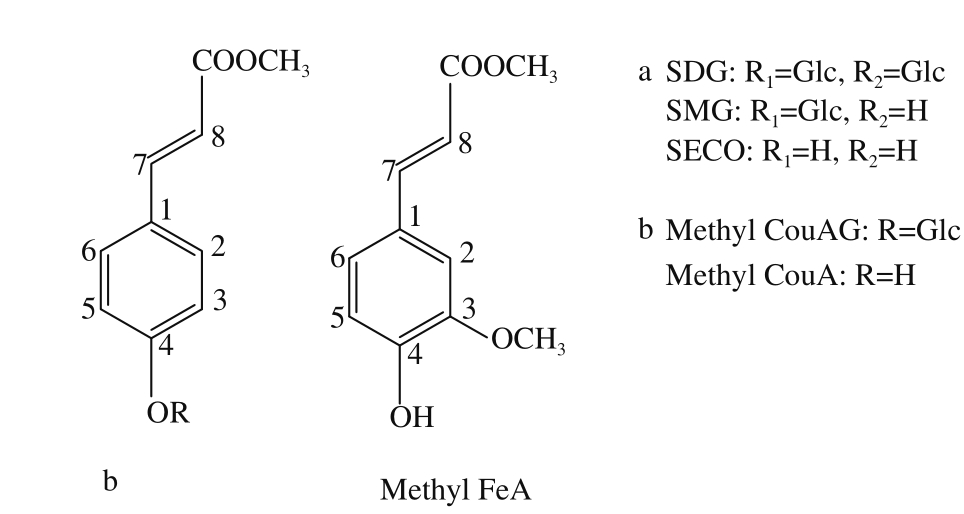
图2 亚麻籽中SDG及其主要水解产物的结构
Fig.2 Structures of SDG and its hydrolysates from flaxseeds
2.3 SDG及其酸水解产物的抗氧化活性
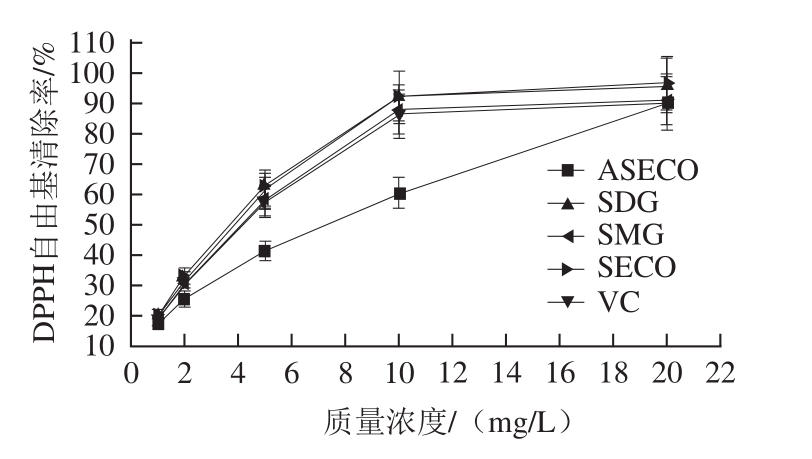
图3 SDG、SMG、SECO和ASECO对DPPH自由基的清除作用
Fig.3 Scavenging capability of SDG, SMG, SECO and ASECO against DPPH free radical
由图 3可知, SDG及其酸水解产物 SMG、 SECO和 ASECO对 DPPH自由基的清除率随着质量浓度增加而增加,呈明显量效关系, IC 50分别为 2.85、 3.32、 2.75 mg/L和 4.86 mg/L(对照 VC的 IC 50为 3.34 mg/L);对· OH的清除作用随着质量浓度的增大,清除作用不断增大(图 4), IC 50分别为 11.11、 11.59、 10.82 mg/L和 19.88 mg/L(对照 VC的 IC 50为 11.90 mg/L);对 O 2 -·的清除能力同样呈明显的量效关系(图 5), IC 50分别为 7.40、 8.25、 6.91 mg/L和 16.85 mg/L(对照 VC的 IC 50为 8.40 mg/L)。由此可见,木脂素 SDG、 SECO和 SMG能够有效清除自由基,具有较强的抗氧化活性。
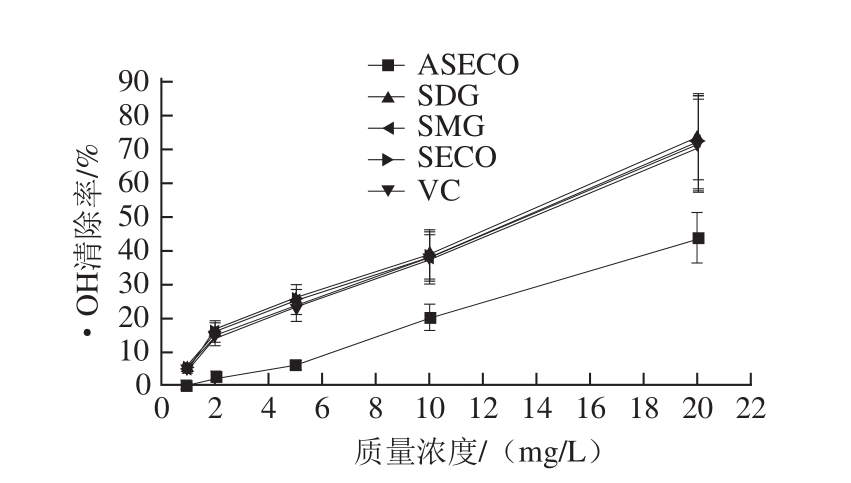
图4 SDG、SMG、SECO和ASECO对·OH的清除作用
Fig.4 Scavenging capability of SDG, SMG, SECO and ASECO against hydroxyl free radical
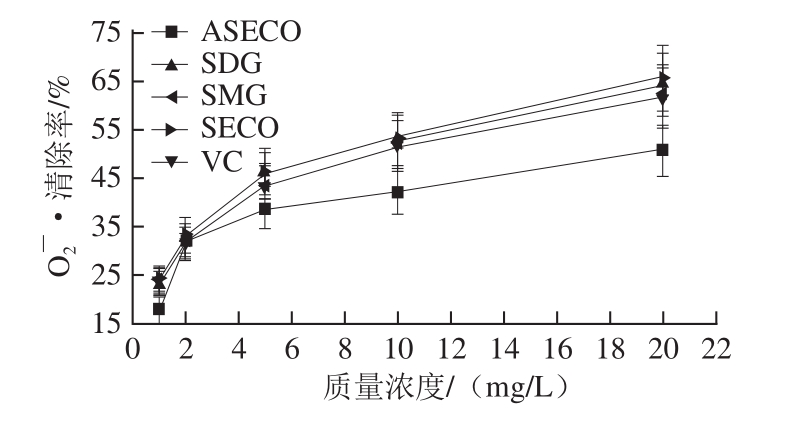
图5 SDG、SMG、SECO和ASECOO对
 的清除作用
的清除作用
Fig.5 Scavenging capability of SDG, SMG, SECO and ASECO against superoxide anion radical
采用快速柱层析分离和制备薄层色谱相结合的方法,从亚麻籽粉中分离制备 SDG,纯度高,所用试剂无毒、无污染,提高了分离纯化工艺的安全性和经济性。研究发现亚麻籽 SDG在酸水解时除生成 SECO和 ASECO外,还会部分脱糖苷转化为 SMG。另外本实验从水解产物中分离出对香豆酸苷甲酯、对香豆酸甲酯和阿魏酸甲酯,它们分别是亚麻籽多聚体中的对香豆酸苷、对香豆酸和阿魏酸在水解时游离,并与甲醇发生酯交换形成的。体外抗氧化活性研究表明,亚麻籽 SDG及其酸水解产物 SMG、 SECO、 ASECO在体外均有较好的抗氧化活性,且呈明显的量效关系。有学者认为亚麻籽木脂素的抗肿瘤活性与它的抗氧化活性密切相关,需进一步明确亚麻籽木脂素成分在体内的转化及其抗氧化活性。
参考文献:
[1] OSOSKI A L, KENNELLY E J. Phytoestrogens∶ a review of the present state of research[J]. Phytotherapy Research, 2003, 17(8)∶ 845-869.
[2] LIGGINS J, GRIMWOOD R, BINGHAM S A. Extraction and quantification of lignan phytoestrogens in food and human samples[J]. Analytical Biochemistry, 2000, 287(1)∶ 102-109.
[3] ZHANG Wenbin, XU Shiying. Microwave-assisted extraction of secoisolariciresinol diglucoside from flaxseed hull[J]. Journal of the Science of Food and Agriculture, 2007, 87(8)∶ 1455-1462.
[4] KAMAL-ELDIN A, PEERLKAMP N, JOHNSSON P, et al. An oligomer from flaxseed composed of secoisolariciresinol diglucoside and 3-hydroxy-3-methyl glutaric acid residues [J]. Phytochemistry, 2001, 58(4)∶ 587-590.
[5] CLAVEL T, HENDERSON G, ENGST W, et al. Phylogeny of human intestinal bacteria that activate the dietary lignan secoisolariciresinol diglucoside[J]. FEMS Microbiology Ecology, 2006, 55(3)∶ 471-478.
[6] JACOBS E, KULLING S E, METZLER M. Novel metabolites of the mammalian lignans enterolactone and enterodiol in human urine[J]. Journal of Steroid Biochemistry and Molecular Biology, 1999, 68(5/6)∶211-218.
[7] SAARINEN N M, W☒RRI A, AIRIO M, et al. Role of dietary lignans in the reduction of breast cancer risk[J]. Molecular Cancer Therapeutics, 2007, 51(7)∶ 857-866.
[8] WESTCOTT N D, MUIR A D. Flax seed lignan in disease prevention and health promotion[J]. Phytochemistry Reviews, 2003, 2(3)∶ 401-417.
[9] BYLUND A, SAARINEN N, ZHANG Jiexia, et al. Anticancer effects of a plant lignan 7-hydroxymatairesinol on a prostate cancer model in vivo[J]. Experimental Biology and Medicine, 2005, 230(3)∶ 217-223.
[10] POOL-ZOBEL B L, ADLERCREUTZ H, GLEI M, et al. Isoflavonoids and lignans have different potentials to modulate oxidative genetic damage in human colon cells[J]. Carcinogenesis, 2000, 21(6)∶1247-1252.
[11] STRUIJS K, VINCKEN J P, VERHOEF R, et al. The flavonoid herbacetin diglucoside as a constituent of the lignan macromolecule from flaxseed hulls[J]. Phytochemistry, 2007, 68(8)∶ 1227-1235.
[12] STRUIJS K, VINCKEN J P, VERHOEF R, et al. Hydroxycinnamic acids are ester-linked directly to glucosyl moieties within the lignan macromolecule from flaxseed hulls[J]. Phytochemistry, 2008, 69(5)∶1250-1260.
[13] SCHWARTZ H, SONTAG G. Determination of secoisolariciresinol, lariciresinol and isolariciresinol in plant foods by high performance liquid chromatography coupled with coulometric electrode array detection[J]. Journal of Chromatography B, 2006, 838(2)∶ 78-85.
[14] MILDER I E J, ARTS I C W, van de PUTTE B, et al. Lignan contents of Dutch plant foods∶ a database including lariciresinol, pinoresinol, secoisolariciresinol and matairesinol[J]. British Journal of Nutrition, 2005, 93(3)∶ 393-402.
[15] MEAGHER L P, BEECHER G R, FLANAGAN V P, et al. Isolation and characterization of the lignans, isolariciresinol and pinoresinol, in flaxseed meal[J]. Journal of Agriculture and Food Chemistry, 1999, 47(8)∶ 3173-3180.
[16] WILLF☒R S M, SMEDS A I, HOLMBOM B R. Chromatographic analysis of lignans[J]. Journal of Chromatography A, 2006, 1112(1/2)∶64-77.
[17] DEGENHARDT A, HABBEN S, WINTERHALTER P. Isolation of the lignan secoisolariciresinol diglucoside from flaxseed (Linum usitatissimum L.) by high-speed counter-current chromatography[J]. Journal of Chromatography A, 2002, 943(2)∶ 299-302.
[18] 刘大川, 庞美霞, 吴波. 亚麻籽木脂素∶ 开环异落叶松树脂酚二葡萄糖苷提取工艺的研究[J]. 中国油脂, 2002, 27(5)∶ 83-86.
[19] 王涛, 崔哲, 张春枝. 开环异落叶松树脂酚二葡萄糖苷的分离与纯化[J]. 大连工业大学学报, 2008, 27(3)∶ 211-214.
[20] 刘振春, 范国婷, 苏彤, 等. 响应面法优化超临界CO 2萃取亚麻籽木脂素[J]. 食品科学, 2013, 34(10)∶ 82-85. doi∶ 10.7506/spkx1002-6630-201310018.
[21] 周先丽, 李映新, 温庆伟, 等. 六月青一种木脂素苷的体外抗氧化活性[J]. 中国实验方剂学杂志, 2013, 19(7)∶ 200-202.
[22] FORD J D, HUANG K S, WANG H B, et al. Biosynthetic pathway to the cancer chemopreventive secoisolariciresinol diglucosidehydroxyl methyl glutaryl ester-linked lignan oligomers in flax (Linum usitatissimum) seed[J]. Journal of Natural Products, 2001, 64(11)∶1388-1397.
[23] CHEN Juan, LIU Xia, SHI Yanping, et al. Determination of the lignan secoisolariciresinol diglucoside from flaxseed (Linum usitatissimum L.) by HPLC[J]. Journal of Liquid Chromatography & Related Technologies, 2007, 30(4)∶ 533-544.
[24] JOHNSSON P, PEERLKAMP N, KAMAL-ELDIN A, et al. Polymeric fractions containing phenol glucosides in flaxseed[J]. Food Chemistry, 2002, 76(2)∶ 207-212.
[25] LUYENGI L, PEZZUTO J M, WALLER D P, et al. Linusitamarin, a new phenylpropanoid glucoside from Linum usltatissimum[J]. Jo urnal of Natural Products, 1993, 56(11)∶ 2012-2015.
Separation, Identification and Antioxidant Activities of Lignans and Their Hydrolysates in Flaxseeds
LI Xin 1,2 , HE Min 1 , YUAN Jianping 2 , WANG Jianghai 2,* (1. Department of Biotechnology, Guangdong Vocational College of Science and Trade, Guangzhou 510430, China; 2. Guangdong Provincial Key Laboratory of Marine Resources and Coastal Engineering, School of Marine Sciences, Sun Yat-Sen University, Guangzhou 510006, China)
Abstract: In the present study, secoisolariciresinol diglucoside and p -coumaric acid methyl ester were separated from flaxseeds by a novel method combining flash column chromatography with preparative thin layer chromatography. Secoisolariciresinol diglucoside was transformed into secoisolariciresinol and anhydrosecoisolariciresinol or into secoisolariciresinol monoglucosides during the acid hydrolysis. Six compounds were isolated from the acid hydrolysates of flaxseeds, and were respectively identified as secoisolariciresinol monoglucoside, secoisolariciresinol, anhydrosecoisolariciresinol, p -coumaric acid methyl ester, ferulic acid methyl ester, and 5-hydroxymethyl-2-furfural on the basis of their spectral data. p -Coumaric acid glucoside methyl ester, p -coumaric acid methyl ester and ferulic acid methyl ester were separated for the first time from the flaxseed hydrolysates, which were produced by the transesterification of p -coumaric acid glucoside, p -coumaric acid, and ferulic acid with methanol in hydrolysis. Interestingly, secoisolariciresinol diglucoside, secoisolariciresinol monoglucoside, and secoisolariciresinol had scavenging capabilities against 1,1-diphenyl-2-picrylhydrazyl (DPPH) free radical, hydroxy radical and superoxide aion radicals, and had a good dose-effect relationship between their concentrations and antioxidant activities.
Key words: flaxseed; lignans; hydrolysates; antioxidant activities
中图分类号: TS201.2
文献标志码: A 文章编号:1002-6630(2015)17-0099-05
文章编号:1002-6630(2015)17-0099-05
doi:10.7506/spkx1002-6630-201517019
收稿日期:2014-11-30
基金项目:教育部高等学校博士学科点专项科研基金项目(20090171110015);广东省科技攻关计划项目(2013B020311005)
作者简介:李欣(1980—),女,副教授,博士,研究方向为天然产物分离与应用。E-mail:lylx08@126.com
*通信作者:王江海(1965—),男,研究员,博士,研究方向为海洋生物学。E-mail:wangjhai@mail.sysu.edu.cn