苦丁茶冬青苦丁茶提取物与3,5-双咖啡酰奎尼酸对肠道微生物体外发酵的影响
谢旻皓,王晴川,徐冬兰,刘天囡,孙 怡*,曾晓雄
(南京农业大学食品科技学院,江苏 南京 210095)
摘 要:制备苦丁茶冬青苦丁茶的水提物和醇提物,并通过
HP-20大孔树脂层析和半制备色谱分离纯化得到苦丁茶多酚中含量较高的
3,5-双咖啡酰奎尼酸(
3,5-dicaffeoylquinic acid,
3,5-diCQA)组分。运用体外厌氧发酵和荧光原位杂交技术,探究了苦丁茶提取物和
3,5-diCQA对肠道微生物菌群的影响,并测定了发酵体系中短链脂肪酸和乳酸的含量。结果表明,苦丁茶冬青苦丁茶水提物、醇提物和
3,5-diCQA能促进双歧杆菌、乳酸菌
/肠球菌的生长,同时抑制溶组织梭状菌、普雷沃勒氏菌的生长;与空白对照相比,它们还能促进甲酸、乙酸和丙酸的生成,但对丁酸的合成没有影响。因此,苦丁茶冬青苦丁茶及
3,5-diCQA具有一定的调节肠道微生态的作用。
关键词:苦丁茶冬青苦丁茶;多酚;
3,5-双咖啡酰奎尼酸;肠道微生物
苦丁茶是一类中国传统代茶饮料的统称,在我国已有
2 000多年的饮用历史
[1]。它广泛分布于我国海南、广西、浙江、贵州、福建、江西等省份,涉及
12个科
13个属共
30多种植物,主要包括木犀科苦丁茶和冬青科苦丁茶两大类
[2]。冬青科苦丁茶包含苦丁茶冬青(Ilex kudingcha
C.J. Tseng)、大叶冬青(I. latifolia
Thunb)以及枸骨(I. cornuta
Lindl)等。目前苦丁茶市场上主流的商品原植物为苦丁茶冬青、大叶冬青和粗壮女贞(Ligustrum robustum(
Roxb.)
Blume)
[3]。苦丁茶富含多酚类、萜类、黄酮类、多糖等活性物质,具有清热、解毒、消肿止痛、除烦解渴、除风祛湿、降血糖、降血脂、降血压、抗血栓、活血脉等药理功能
[4-7]。苦丁茶冬青富含的多酚类物质具有抗氧化活性并且被证明是咖啡酰奎尼酸类化合物(
caffeoylquinic acids,
CQAs)
[8]。冬青科苦丁茶中的主要多酚是
CQAs,包括
3-O
-咖啡酰奎尼酸(
3-CQA)、
4-O
-咖啡酰奎尼酸(
4-CQA)、
5-O
-咖啡酰奎尼酸(
5-CQA)、
3,5-O
-双咖啡酰奎尼酸(
3,5-diCQA)和
4,5-O
-双咖啡酰奎尼酸(
4,5-diCQA),与木犀科苦丁茶中所含有的多酚成分完全不同
[9]。
膳食中的多酚在经过小肠时,大约只有
5%~
10%左右能够被吸收,而剩余绝大部分的多酚类物质会进入大肠,与肠道微生物发生作用
[10]。肠道微生物是人体消化系统的重要组成部分,其菌群组成高度复杂、多样,它们广泛地参与机体中食物的消化吸收、免疫调节以及抵抗病原微生物感染等生理过程,对机体正常生理功能的维持具有不可忽视的作用
[11-12]。研究表明,肠道菌群的结构与肥胖存在密切关系。肠道菌群可以通过多种方式影响宿主能量的储存机制,例如,肠道菌群可以将食物中机体本身不能够消化吸收的物质转化为短链脂肪酸(
short-chain fatty acids,
SCFAs)而为机体提供相应的能量,肠道菌群的存在还可以促进一些能量代谢有关酶的基因表达,如
AMP活化蛋白激酶
[13]。因此,肠道菌群在脂肪形成和堆积过程中发挥了重要作用。膳食多酚进入大肠后,会被肠道微生物进一步代谢,这可能是多酚发挥生物活性的方式
[10]。近年来,关于肠道微生物转化多酚的报道大量涌现,例如,绿原酸(
5-CQA)会被代谢成咖啡酸、阿魏酸、二氢咖啡酸、二氢阿魏酸、
3-(
3-羟基苯基)丙酸等
11种产物
[14]。另一方面,膳食多酚也会影响肠道微生物的菌群结构。本课题组之前的研究表明,乌龙茶中的表没食子儿茶素没食子酸酯(
epigallocatechin gallate,
EGCG)、没食子儿茶素没食子酸酯(
gallocatechin-3-gallate,
GCG)以及甲基化
EGCG(
EGCG3”
Me)等儿茶素类能影响菌群组成
[15]。但到目前为止,本课题组对膳食多酚与肠道微生物的交互作用以及多酚进一步对机体影响的了解还很有限。
本课题组建立了苦丁茶冬青苦丁茶
CQAs的高效液相色谱(
high performance liquid chromatography,
HPLC)分析方法,并且通过大孔树脂层析和半制备液相色谱制备了高纯度的
CQA单体
[16]。本研究采用体外厌氧培养粪便中肠道微生物和荧光原位杂交(
fluorescencein situ
hybridization,
FISH)的方法,探究苦丁茶冬青苦丁茶提取物和含量较高的组分
3,5-diCQA对体外发酵菌群结构的影响,并分析相应发酵体系中
SCFAs的产量。以期为阐述饮用苦丁茶冬青苦丁茶如何通过调节肠道微生态的方式影响机体健康提供一定的理论基础。
1 材料与方法
1.1材料、试剂与培养基
苦丁茶冬青苦丁茶,购自海南椰仙生物科技有限公司。
序列
5’端连接荧光基团吲哚二羧菁(
Cy3)的
16S rRNA寡核苷酸单链探针(探针名称、靶菌种属及探针序列见表
1) 生工生物工程(上海)股份有限公司;刃天青、氯化血红素、L
-半胱氨酸、
VK、甲酸、乙酸、丙酸、丁酸、乳酸、甲醇(色谱纯) 美国
Sigma公司;
90%低聚果糖(
fructooligosaccharide,
FOS)量子高科(中国)生物股份有限公司;大孔树脂
HP-20日本三菱公司;厌氧混合气体(
80%
N
2、
10%
H
2和
10%
CO
2) 南京特种气体厂;
4,6-联眯
-2-苯基吲哚二盐酸(
4’
,6-diamidino-2-phenylindole,
DAPI) 德国
Roche公司;其他化学试剂均为国产分析纯。
表1 16S rRNA寡核苷酸单链探针
Table1 Specific 16S rRNA-targeted oligonucleotide probes

探针名称靶细菌种/属探针序列(5’→3’)Bif164双歧杆菌属(Bifi dobacterium spp.)CATCCGGCATTACCACCC Bac303拟杆菌-普雷沃勒氏菌属(Bacteroides-Prevotella spp.)CCAATGTGGGGGACCTT Lab158乳酸菌/肠球菌属(Lactobacillus/Enterococcus spp.)GGTATTAGCAYCTTCCA Chis150溶组织梭状菌(Clostridium histolyticum group)(clusters Ⅰ、Ⅱ)TTATGCGGTATTAATAT(C/T)CCTT Erec482真杆菌-直肠梭菌(Eubacterium rectale-Clostridium group)(Cluster CⅣ)GCTTCTTAGTCARGTACCG
基础培养基
[17-18]:蛋白胨
2.0 g/L、酵母膏
2.0 g/L、
NaCl 0.1 g/L、
K
2
HPO
4
0.04 g/L、
KH
2
PO
4
0.04 g/L、
MgSO
4
·7H
2
O 0.01 g/L、
CaCl
2
·7H
2
O 0.01 g/L、
NaHCO
3
2.0 g/L、氯化血红素
0.02 g/L、L
-半胱氨酸
0.5 g/L、胆汁酸盐
0.5 g/L、吐温
-80 2.0 mL/L、
VK 10μL
/L、
0.25 g/L刃天青溶液
4 mL/L。
1.2仪器与设备
AY-120型分析天平 日本
Shimadzu公司;
Heidolph Laborota 4000真空旋转蒸发仪 德国
Heidolph公司;
☒KTA Purifier蛋白纯化系统 美国通用电气公司;
LyoQuest-55真空冷冻干燥机 西班牙
Telstar公司;
Agilent 1100高效液相色谱仪 美国
Agilent公司;
YQX-I型厌氧培养箱 上海跃进医疗器械厂;
Zeiss Axio Imager A1型荧光正置显微镜 德国
Carl Zeiss公司。
1.3 方法
1.3.1样品的制备
苦丁茶冬青苦丁茶水提物的制备:称取
10 g粉碎过筛的苦丁茶冬青苦丁茶粉末,加入
100 mL沸水(料液比为
1∶10(m
/V
,下同)),并于
95℃水浴中浸提
30 min,浸提液经过
5 000×g离心
10 min后,取出上清液,浓缩、冷冻干燥得到粗提物。
苦丁茶冬青苦丁茶醇提物的制备:称取一定量苦丁茶冬青苦丁茶粉末,按料液比
1∶10加入
70%乙醇溶液,
80℃热水浴浸提
30 min,浸提液经过
5 000×g离心
10 min后,取出上清液,浓缩、冷冻干燥得到多酚粗提物。
3,5-diCQA的制备
[16]:苦丁茶冬青苦丁茶水提物经过
HP-20大孔树脂吸附后,先后用
2个柱床体积(
BV)的水和
70%乙醇洗脱。乙醇洗脱组分浓缩冻干后采用
☒KTA Purifier系统做进一步纯化,纯化流程使用
YMC-PACK ODS-A色谱柱(
10 mm×
250 mm,
5μm),检测波长为
280 nm,每次进样
200μL,流速为
1.5 mL/min的
40%甲醇洗脱。根据紫外检测器的实时监控结果收集洗脱液,多次上样后,将所需的
3,5-diCQA收集起来,旋转蒸发、浓缩冻干。
1.3.2肠道微生物体外发酵
选取
3位受试者,年龄均为
25岁左右,身体状况良好、健康,且
2个月内未服用过抗生素。收集受试对象的新鲜全便,混合均匀后称取
1 g并加入
9 mL经脱氧处理的磷酸盐缓冲液(
phosphate buffered saline,
PBS),立即放入厌氧手套箱,旋涡振荡混匀配制成粪便悬液。
称取苦丁茶冬青苦丁茶水提物、醇提物、
3,5-diCQA各
15 mg,提前放在厌氧培养箱中,并加入
1.35 mL灭菌的基础培养基,涡旋振荡至混匀后,加入
150μL粪便样液,放入
37℃厌氧培养箱中进行发酵。在发酵
0、
12、
24、
36、
48 h时,分别取
150μL发酵液用于
SCFA分析,
100μL用于
FISH统计菌数。各个处理设置
3组平行,设置空白组不添加任何样品,阳性对照组加入相同量的
FOS。
1.3.3肠道菌群
FISH计数
肠道菌群计数参照
Vernazza
[18]和
Sánchez-Patán
[19]等的方法并略作修改。将
1.3.2节中得到的
100μL发酵液放入离心管,各加入
300μL过滤除菌的体积分数为
4%的多聚甲醛,放入
4℃冰箱固定
16 h。菌体完成固定后,
10 000 r/min离心
10 min,除去上清液,经
PBS两次洗涤后用
600μL缓冲液悬浮。
向经过铬明胶预先包埋的
10孔油漆示载玻片的圆孔内滴加
6μL固定后的菌体悬液,放在阴暗通风处自然风干,再先后经过
50%、
80%和
96%的乙醇脱水后自然晾干。
载玻片各孔滴加
10μL探针溶液,迅速放入含有杂交缓冲液(含
5%
NaCl、
0.1%十二烷基硫酸钠(
sodium dodecyl sulfate,
SDS)的
20 mmol/L Tris-HCl,
pH 7.2)的不透光湿盒中。杂交
10 h以上,杂交温度分别为:
50℃(
Bif164、
Chis150)、
45℃(
Lab158、
Bac303)和
37℃(
Erec482)。杂交结束后,用清洗缓冲液(含
5%
NaCl的
20 mmol/L Tris-HCl,
pH 7.2)清洗
2次,再用超纯水清洗,除去未杂交上的探针、缓冲液和
SDS,最后避光晾干。测定总菌时,滴加
10μL
1.25 ng/μL
DAPI染液于杂交后的载玻片上,染色
10 min,用超纯水清洗,避光晾干。
观察计数前,在载玻片上滴加护色液,盖上盖玻片。使用
Zeiss Axio Imager A1型荧光正置显微镜观察,并使用
AxioVision荧光成像系统随机选取
5~
9个视野拍照。采用
Image J软件进行图像分析,记录每个视野中的荧光点数,即该探针特异性杂交的细菌,从而进行菌体计数。通过视野范围内的映光点数以及稀释倍数,算出不同样品处理和对照组发酵液中不同种属微生物的数量。
1.3.4 SCFAs和乳酸的测定
肠道微生物体外发酵产生的
SCFAs和乳酸采用
HPLC测定。色谱条件:
C
18色谱柱(
4.6 mm×
250 mm,
5μm);流动相
A相为超纯水,
B相为
100%甲醇,洗脱梯度:
0~
10 min,
10%~
30%
B,
10~
15 min,
30%
B;检测波长为
210 nm;柱温为
30℃;流速为
0.8 mL/min,进样量
20μL。分别配制浓度梯度在
20~
100 mmol/L范围内的甲酸、乙酸、丙酸、丁酸、乳酸标准溶液,分别以其浓度为横坐标,对应色谱峰的峰面积为纵坐标,绘制各酸的标准曲线。
1.4统计分析
实验结果用
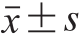 表示。实验数据采用
SPSS 16.0软件,最小显著差异(
least significant difference,
LSD)和邓肯(
Duncan’
s)多重比较做方差分析(
analysis of variance,
ANOVA),P<
0.05为差异显著。
表示。实验数据采用
SPSS 16.0软件,最小显著差异(
least significant difference,
LSD)和邓肯(
Duncan’
s)多重比较做方差分析(
analysis of variance,
ANOVA),P<
0.05为差异显著。
2 结果与分析
2.1苦丁茶提取物纯度
一定量的苦丁茶茶粉经热水浸提,浓缩和冻干,得到苦丁茶水提物。由于水提物中含有一定量茶多糖、生物碱、脂类、蛋白质类等杂质,所以另用
70%乙醇溶液浸提苦丁茶茶粉,降低杂质的含量,同时保持苦丁茶中
CQA类物质的含量不受影响。用
Folin-酚法测定苦丁茶粉末浸提得到的水提物,多酚含量达到
10.33%;醇提物中,多酚含量达到
18.11%。经过大孔树脂、半制备色谱分离纯化之后,得到的
3,5-diCQA产量较高;经
HPLC分析,纯度在
95%以上。
2.2苦丁茶提取物和
3,5-diCQA对肠道菌群和总菌的影响
厌氧粪样混合培养法在研究食源性物质对肠道菌群的影响时被广泛运用,主要是该方法取自健康人体的粪便中包含了所有的人体肠道菌群,同时体外厌氧粪样混合培养评价系统具备发酵时间短、用量少、操作简便、定量准确等优点。此外,本实验采用
FISH技术对菌体数目进行测定。带有荧光标记的特异性寡核苷酸探针,能靶向结合已经固定的菌体细胞
DNA,当这种特异性的杂交完成后,特定的菌体带有了荧光,通过荧光显微镜捕捉荧光信号,从而对菌体进行观察和计数。由于人体粪便中包含所有肠道菌群,在体外模拟肠道厌氧发酵,可以初步探究样品对肠道菌群的作用。图
1为空白对照和苦丁茶醇提物发酵
12 h后,使用不同探针对发酵样液进行
FISH处理或
DAPI染色后,荧光显微镜下观察的结果。
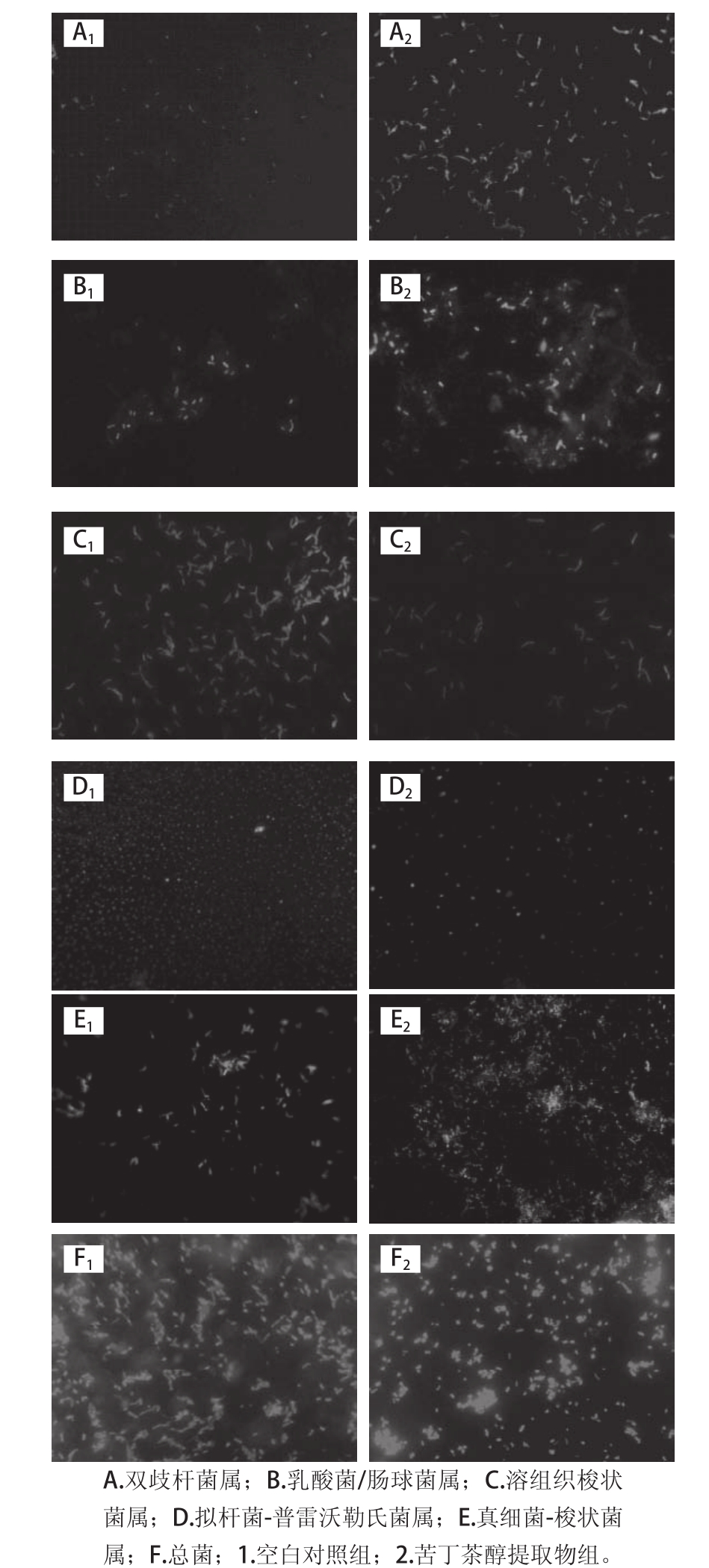
图1 不同探针杂交以及DAPI染色后荧光显微镜下对照组和苦丁茶醇提物体外发酵后各菌群的照片(1 000×) 00
Fig.1 Images of microbial communities cultured in vitro in the presence of Kudingcha ethanol extract after FISH or DAPI dying under fluorescent microscope (1 000×)
由图
1可知,苦丁茶冬青苦丁茶提取物对不同肠道微生物菌群体外发酵有显著影响。总体来说,苦丁茶冬青苦丁茶提取物和
3,5-diCQA能促进不同发酵时间下双歧杆菌(Bifidobacterium
spp.)、乳酸菌
/肠球菌(Lactobacillus/Enterococcus
spp.)的生长,而抑制了溶组织梭状菌(Clostridium histolyticum)、普雷沃勒氏菌(Bacteroides-Prevotella
spp.)的生长,对双歧杆菌的生长效果尤其明显,对总菌的数目没有显著影响(P>
0.05)。苦丁茶不同提取物样品在不同发酵时间对双歧杆菌的增殖效果如表
2所示。与空白对照组相比,
12、
36、
48 h时,苦丁茶水提物、醇提物、
3,5-diCQA及阳性对照组均对双歧杆菌起到促进增殖的显著效果(P<
0.05)。与
12 h相比,
36 h时苦丁茶水提物样品开始对双歧杆菌有显著的促进增殖作用(P<
0.05),而醇提物和
3,5-diCQA在
24 h时对双歧杆菌的增殖有显著促进效果(P<
0.05),其后,醇提物组的双歧杆菌仍有增殖趋势,而
3,5-diCQA组的双歧杆菌则在
36 h开始有下降趋势。
表2 不同发酵时间后双歧杆菌生长情况
Table2 Numbers of Bififi dobacterium in anaerobic fermentation broth
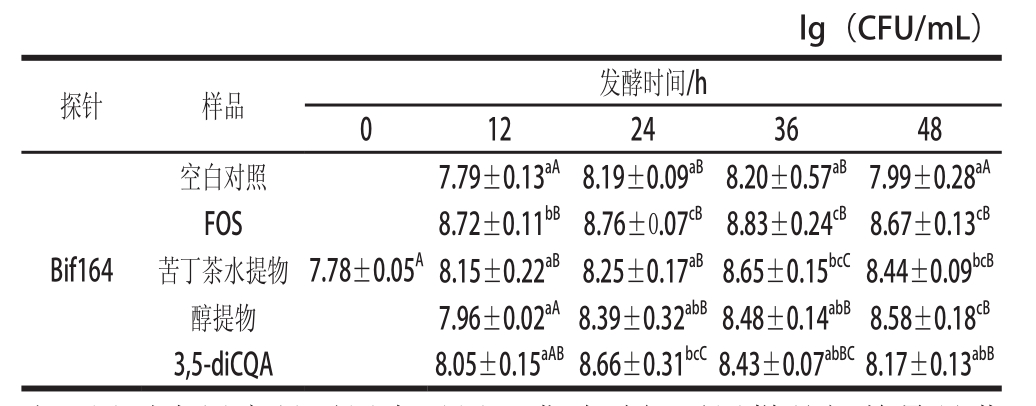
注:同列小写字母不同表示同一发酵时间不同样品间差异显著(P<0.05);同行大写字母不同表示同一样品不同发酵时间差异显著(P<0.05)。表3同。
lg(CFU/mL)探针样品发酵时间/h 012243648 Bif164空白对照7.78±0.05
A7.79±0.13
aA8.19±0.09
aB8.20±0.57
aB7.99±0.28
aAFOS8.72±0.11
bB8.76±0.07
cB8.83±0.24
cB8.67±0.13
cB苦丁茶水提物8.15±0.22
aB8.25±0.17
aB8.65±0.15
bcC8.44±0.09
bcB醇提物7.96±0.02
aA8.39±0.32
abB8.48±0.14
abB8.58±0.18
cB3,5-diCQA8.05±0.15
aAB8.66±0.31
bcC8.43±0.07
abBC8.17±0.13
abB
双歧杆菌和乳酸菌
/肠球菌属是益生菌,具有增强免疫、阻止有害菌黏附以及帮助宿主消化吸收营养物质等多种生理功能
[20-21]。虽然拟杆菌门微生物广泛参与了多糖、胆汁酸和类固醇物质的代谢,对维持肠道功能有重要作用,但其中的普雷沃勒氏菌属数量异常增高与溃疡性结肠炎和肥胖密切相关
[22-23];溶组织梭状菌和球形菌是肠道中参与代谢的重要菌群,但它们数量过多也会增加肠道溃疡和结肠癌的风险
[24-27]。普雷沃勒氏菌和溶链梭菌数量增多还会破坏人体肠道菌群的平衡,引起感染、腹泻、痢疾等疾病
[28-29]。苦丁茶冬青苦丁茶提取物以及
3,5-diCQA能够促进双歧杆菌和乳酸菌
/肠球菌等益生菌的增殖,抑制溶组织梭状菌、普雷沃勒氏菌的增殖,表明苦丁茶冬青苦丁茶具有一定的调节肠道微生态和益生的功效。据报道,各种膳食多酚具有调节肠道微生态结构的作用,如姜黄素可以降低糖尿病大鼠肠道中
Melainabacteria的丰度,还可以减小厚壁菌
/拟杆菌比例
[30];乌龙茶多酚可以促进双歧杆菌、乳酸菌
/肠球菌并且抑制溶组织梭状菌、拟杆菌
-普雷沃勒氏菌的生长
[15],表现出和苦丁茶冬青苦丁茶类似的作用趋势。食品来源的成分有些可以被特定的菌群分解利用,促进该菌群的生长;有些多酚成分对特定菌群表现出毒性,从而导致其他耐受菌群丰度的提高
[31]。这可能是苦丁茶冬青苦丁茶表现出肠道微生态调节作用的机制。
2.3苦丁茶提取物及
3,5-diCQA对肠道微生物体外发酵
SCFAs和乳酸产量的影响
添加了不同苦丁茶提取物的发酵体系中,各种
SCFAs和乳酸的含量如表
3所示。结果表明,除空白对照外,水提物、醇提物和
3,5-diCQA在发酵至
48 h后,甲酸产量最高,但与空白对照组相比,苦丁茶提取物以及
3,5-diCQA对肠道微生物体外发酵的甲酸产量没有显著影响。加入苦丁茶冬青苦丁茶水提物培养
48 h后,乙酸含量达到最高;苦丁茶醇提物组在发酵至
36 h时乙酸含量达到最高,在发酵至
48 h时,含量显著下降;基础培养基中仅添加
3,5-diCQA,在
0~
36 h的发酵过程中,乙酸含量变化不显著,发酵至
48 h时,乙酸产量上升。苦丁茶冬青苦丁茶水提物和
3,5-diCQA经过
48 h发酵后,丙酸和乳酸含量达到最高且显著高于空白对照,而醇提物在
36 h发酵后,丙酸产量就达到最高。但是,肠道微生物体外发酵模型中,与肠道营养密切联系的丁酸在添加了苦丁茶的体系中含量很低或没有被检测到。
表3 各种苦丁茶提取物对SCFAs和乳酸产量的影响
Table3 Effects of Kudingcha extracts and 3,5-diCQA on production of SCFAs and lactic acid

mmol/L种类样品发酵时间/h 012243648甲酸空白对照97.5±8.7
A182.9±35.9
aB202.9±49.3
aB206.3±35.9
aB267.1±16.4
abCFOS272.5±28.0
bB419.2±36.3
cC649.1±23.8
cD646.0±61.4
dD水提物242.1±40.6
bB273.8±13.2
bBC308.7±6.7
bC319.8±11.9
cC醇提物191.0±22.4
aB208.7±11.1
aB222.7±21.7
aB235.3±4.7
aB3,5-diCQA197.9±15.8
aB223.3±3.2
aB228.8±17.7
aB305.4±51.5
bcC乙酸空白对照56.1±3.3
A30.9±7.3
aA60.3±8.4
aA91.6±25.9
aB113.5±23.6
aBFOS195.9±12.2
cB203.8±4.4
cB220.1±5.0
dBC233.7±14.5
dC水提物58.5±18.4
aA160.5±13.4
bB238.4±9.2
dC402.8±15.8
eD醇提物47.4±14.7
aA135.5±20.0
bB176.8±43.3
cC147.9±20.2
bBC3,5-diCQA132.1±3.4
bB132.1±6.4
bB138.1±26.0
bB209.3±15.3
cC丙酸空白对照58.7±5.1
A54.9±7.3
aA58.9±3.5
aA67.5±3.4
aA75.5±15.6
aAFOS146.7±5.7
bB164.1±14.7
bBC177.6±23.0
bC180.6±12.5
bcC水提物146.0±12.1
bB168.5±14.4
cC175.4±28.2
cC198.7±31.0
bB醇提物144.8±15.0
bB235.1±19.7
cCD258.9±21.7
cC163.5±21.7
bB3,5-diCQA57.4±2.1
aA179.3±23.3
bB190.5±13.3
bB230.0±26.1
dC乳酸空白对照56.7±9.3
A59.2±3.7
aA62.6±25.9
aA73.5±18.7
aA116.9±22.8
aBFOS63.4±22.7
aA127.3±7.1
bB140.7±7.8
bB132.6±4.2
aB水提物141.8±24.6
bB238.5±19.0
cC357.7±6.0
dD398.3±22.0
bD醇提物41.4±3.4
aA70.6±8.0
aAB90.7±26.2
aB143.3±16.1
aC3,5-diCQA64.5±5.8
aA159.4±7.4
bB315.0±23.1
cC337.5±25.3
bC
SCFAs对肠道具有维持水电解质平衡、抗病原微生物和抗炎、调节菌群平衡及改善肠道功能、抗肿瘤和调控基因表达等重要作用
[32]。膳食中的碳水化合物,尤其是抗性淀粉和膳食纤维,是肠道微生物发酵产生
SCFAs的主要底物
[33]。另外,
SCFAs也是蛋白质降解和氨基酸发酵的产物。梭菌可利用多种氨基酸生成相应的有机酸
[34]。在本实验模型中,碳水化合物较少,而很多微生物生长在多酚的作用下被抑制,以致
SCFAs尤其是丁酸的产生量有限。
其他文献也报道,多酚可能引起肠道内微生物数量和种类的变化,改变微生物代谢及产酶的种类和数量;多酚代谢产物可与细菌细胞表面作用,抑制酶的活性,从而影响能量代谢
[35]。综合以上结果,可以初步判断,苦丁茶冬青苦丁茶提取物及多酚可以改变肠道菌群结构和调节微生物代谢,具有一定的益生效果。
3 结 论
本实验以苦丁茶冬青苦丁茶水提物、醇提物及
3,5-diCQA单体为实验样品,通过体外模拟人体肠道厌氧环境,对粪样中微生物群进行混合培养,使用
FISH技术对菌群结构变化进行研究比较,并使用
HPLC对培养过程中
SCFAs的含量进行监控。结果显示,添加了苦丁茶冬青苦丁茶提取物和
3,5-diCQA的培养基中,双歧杆菌等有益菌的数量在
36 h内得到了一定的增长,溶组织梭状菌、普雷沃勒氏菌等的生长被抑制。与空白对照组相比,实验组的甲酸、乳酸、乙酸和丙酸含量都在
0~
36 h内呈升高趋势,但丁酸产量很少。本研究结果表明,苦丁茶冬青苦丁茶对改善人体肠道微生态、调节肠道平衡具有一定的作用,其作用机制有待进一步研究。
参考文献:
[1] 李丽, 许丽嘉, 彭勇, 等. 绿茶与其他4种别样茶的比较[J]. 中国中药杂志, 2011, 36(1)∶ 5-10.
[2] 张凤琴, 刘国民, 周鹏, 等. 用RAPD技术探讨冬青属苦丁茶的遗传差异、亲缘关系与分类地位[J]. 云南植物研究, 2004, 26(6)∶637-644.
[3] 易帆, 彭勇, 许利嘉, 等. 大叶苦丁茶的研究进展[J]. 中国现代中药, 2013, 15(8)∶ 710-717.
[4] 刘四君, 程齐来, 李洪亮. 冬青属药用植物研究进展[J]. 湖北农业科学, 2009, 48(10)∶ 2594-2597.
[5] 申梅淑, 张淑芹, 郭新民. 苦丁茶对大鼠血脂和载脂蛋白的影响[J].中国林副特产, 2002(4)∶ 7.
[6] 陈一, 李开双. 苦丁茶冬青叶的降压作用研究[J]. 中草药, 1995, 26(5)∶ 250-252.
[7] 刘彬, 许宏大. 苦丁茶降血脂的实验及临床研究[J]. 护理研究, 2005, 19(1)∶ 21-22.
[8] LIU Lixiang, SUN Yi, LAURA T, et al. Determination of polyphenolic content and antioxidant activity of kudingcha made from Ilex kudingcha C.J. Tseng[J]. Food Chemistry, 2009, 112(1)∶ 35-41.
[9] ZHU Fan, CAI Yizhong, SUN Mei, et al. Comparison of major phenolic constituents and in vitro antioxidant activity of diverseKudingcha genotypes from Ilex kudingcha, Ilex cornuta, and Ligustrum robustum[J]. Journal of Agricultural and Food Chemistry, 2009, 57(14)∶ 6082-6089.
[10] van DUYNHOVEN J, VAUGHAN E E, JACOBS D M, et al. Metabolic fate of polyphenols in the human superorganism[J]. Proceedings of the National Academy of Sciences, 2011, 108(Suppl 1)∶4531-4538.
[11] Human Microbiome Project Consortium. Structure, function and diversity of the healthy human microbiome[J]. Nature, 2012, 486∶ 207-214.
[12] STECHER B, HARDT W D. The role of microbiota in infectious disease[J]. Trends in Microbiology, 2008, 16(3)∶ 107-114.
[13] 赵立平, 费娜. 肠道菌群与肥胖症的关系研究进展[J]. 微生物与感染, 2013, 8(2)∶ 67-71.
[14] LUDWIG I A, de PE☒A M P, CID C, et al. Catabolism of coffee chlorogenic acids by human colonic microbiota[J]. BioFactors, 2013, 39(6)∶ 623-632.
[15] ZHANG Xin, ZHU Xiuling, SUN Yongkang, et al. Fermentation in vitro of EGCG, GCG and EGCG3” Me isolated from Oolong tea by human intestinal microbiota[J]. Food Research International, 2013, 54(2)∶ 1589-1595.
[16] 王晴川, 张鑫, 张文芹, 等. 苦丁茶冬青苦丁茶中咖啡酰奎尼酸类物质的分离纯化和高效液相色谱法分析[J]. 食品科学, 2013, 34(22)∶119-122. doi∶ 10.7506/spkx1002-6630-201322024.
[17] RECHNER A R, SMITH M A, KUHNLE G, et al. Colonic metabolism of dietary polyphenols∶ influence of structure on microbial fermentation products[J]. Free Radical Biology & Medicine, 2004, 36(2)∶ 212-225.
[18] VERNAZZA C L, GIBSON G R, RASTALL R A. in vitro fermentation of chitosan derivatives by mixed cultures of human faecal bacteria[J]. Carbohydrate Polymers, 2005, 60(4)∶ 539-545.
[19] S☒NCHEZ-P☒TAN F, CUEVA C, MONAGAS M, et al. in vitro fermentation of a red wine extract by human gut microbiota∶ changes in microbial groups and formation of phenolic metabolites[J]. Journal of Agricultural and Food Chemistry, 2012, 60(9)∶ 2136-2147.
[20] 吴淑清, 王顺余, 谭克, 等. 双歧杆菌的研究现状[J]. 长春大学学报, 2007, 17(4)∶ 57-61.
[21] MENARD S, CANDALH C, BAMBOU J C, et al. Lactic acid bacteria secrete metabolites retaining anti-inflammatory properties after intestinal transport[J]. Gut, 2004, 53(6)∶ 821-828.
[22] WEXLER H M. Bacteroides∶ the good, the bad, and the nitty-gritty[J]. Clinical Microbiology Reviews, 2007, 20(4)∶ 593-621.
[23] LUCKE K, MIEHLKE S, JACOBS E, et al. Prevalence of Bacteroides and Prevotella spp. in ulcerative colitis[J]. Journal of Medical Microbiology, 2006, 55(5)∶ 617-624.
[24] 王子恺, 杨云生. 肠道微生物与人类疾病[J]. 解放军医学杂志, 2012, 37(12)∶ 1168-1176.
[25] FRANKS A, HARMSEN H J M, RAANGS G, et al. Variations of bacterial populations in human feces measured by fluorescent in situ hybridization with group-specifi 16S rRNA-targeted oligonucleotide probes[J]. Applied and Environmental Microbiology, 1998, 64(9)∶3336-3345.
[26] HOLD G L, SCHWIERTZ A, AMINOV R I, et al. Oligonucleotied probes that detect quantitatively significant groups of butyrateproducing bacteria in human feces[J]. Applied and Environmental Microbiology, 2003, 69(7)∶ 4320-4324.
[27] 郭世奎, 包维民, 龚昆梅, 等. 实时荧光定量PCR法研究结直肠癌患者肠道拟杆菌属、梭杆菌属和梭状菌属量的变化[J]. 中国微生态学杂志, 2010, 22(1)∶ 24-28.
[28] RASTALL R A. Bacteria in the gut∶ friends and foes and how to alter the balance[J]. The Journal of Nutrition, 2004, 134(Suppl 8)∶2022-2026.
[29] TUOHY K M, ROUZAUD G C, BR☒CK W M, et al. Modulation of the human gut microflora towards improved health using prebioticsassessment of efficacy[J]. Current Pharmaceutical Design, 2005, 11(1)∶75-90.
[30] 刘硒碲, 夏宁, 梁瑜祯. 姜黄素通过调节肠道菌群可改善脂多糖诱导糖尿病[J]. 基因组学与应用生物学, 2014, 33(5)∶ 970-974.
[31] TOMA☒S-BARBERA☒N F A, MINE Y. A key to understanding the effects of food bioactives in health, gut microbiota[J]. Journal of Agricultural and Food Chemistry, 2013, 61(41)∶ 9755-9757.
[32] 刘小华, 李舒梅, 熊跃玲. 短链脂肪酸对肠道功效及其机制的研究进展[J]. 肠外与肠内营养, 2012, 19(1)∶ 56-58.
[33] WONG J M, de SOUZA R, KENDALL C W, et al. Colonic health∶fermentation and short chain fatty acids[J]. Journal of Clinical Gastroenterology, 2006, 40(3)∶ 235-243.
[34] 陈燕, 曹郁生, 刘晓华. 短链脂肪酸与肠道菌群[J]. 江西科学, 2006, 24(1)∶ 38-41.
[35] 肖俊松, 单静敏, 曹雁平, 等. 多酚通过肠道菌群调节能量代谢研究进展[J]. 食品科学, 2012, 33(3)∶ 300-303.
Comparative Study of the Effects on Colonic Microbiota Fermentation in vitro of Extracts from Ilex kudingcha C.J. Tseng and 3,5-Dicaffeoylquinic Acid
XIE Minhao, WANG Qingchuan, XU Donglan, LIU Tiannan, SUN Yi*
, ZENG Xiaoxiong
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:
We prepared aqueous and ethanolic Kudingcha extracts from
Ilex kudingcha
C.J. Tseng and3,5-dicaffeoylquinic acid,the main fraction of Kudingcha polyphenols, purified from the aqueous extract by HP-20 macroporous resin chromatography and semi-preparative chromatography. Anaerobic fermentation technology and fluorescence
in situ
hybridization were employed to investigate the effects of the Kudingcha extracts and 3,5-diCQA on fermentation characteristics
in vitro
of the human gut mictobiota, and the production of short-chain fatty acids and latic acid during the culture we re also examined. The results showed that both Kudingcha extracts and 3,5-diCQA could promote the growthof
Bifi dobacterium
spp. and
Lactobacillus/Enterococcus
spp., and inhibit
Bacteroides-Prevotella
spp. and
Clostridiumhistolyticum
group. The concentrations of formic, acetic and proponic acids in cultures with Kudingch extracts were relatively higher than those of the control, but there was no difference in butyric acid. The results suggest that both Kudingcha from
I. kudingcha
C.J. Tseng and its polyphenol 3,5-diCQA have potential prebiotic-like activity by modulating the intestinal microbiota.
Key words:
Kudingcha; polyphenol; 3,5-dicaffeoylquinic acid (3,5-diCQA); colonic microbiota
中图分类号:
TS272;
TS201.3
文献标志码:
A 文章编号:1002-6630(2015)17-0124-06
文章编号:1002-6630(2015)17-0124-06
doi:10.7506/spkx1002-6630-201517024
收稿日期:2014-12-22
基金项目:国家自然科学基金面上项目(31171666);江苏高校优势学科建设工程资助项目
作者简介:谢旻皓(1990—),男,博士研究生,研究方向为食品生物技术。E-mail:2014208020@njau.edu.cn
*通信作者:孙怡(1966—),女,高级实验师,博士,研究方向为食品生物技术。E-mail:zengxx@njau.edu.cn

 表示。实验数据采用
表示。实验数据采用


