王璐莎,陈玉连,黄 明*,周光宏
(南京农业大学食品科技学院,农业部畜产品加工重点实验室,江苏 南京 210095)
摘 要:为了解酶解时间、蛋白酶种类对鸭肉蛋白酶解产物抗氧化特性的影响,分别用复合蛋白酶、风味蛋白酶和胰酶对鸭肉进行单酶酶解和双酶分步酶解(胰酶+复合蛋白酶、胰酶+风味蛋白酶),制备不同时间段的酶解产物,并对其自由基清除能力( 1,1-二苯基 -2-三硝基苯肼( 1,1-diphenyl-2-picrylhydrazyl, DPPH)自由基、羟自由基 (hydroxyl radical,· OH)和超氧阴离子自由基( superoxide radical, O 2 -·))和总还原力进行分析。结果表明:各鸭肉蛋白酶解产物的 DPPH自由基清除率随着酶解时间的延长而增加,但· OH和 O 2 -·清除率及总还原力随着酶解时间的延长先增加后降低( P< 0.05)。在 5种鸭肉蛋白酶解产物中,复合蛋白酶酶解物表现出最强的 DPPH自由基清除能力( 75.70± 1.54)%、· OH清除能力( 59.41± 1.24)%和 O 2 -·清除能力( 98.50± 4.51)%,但用双酶分步酶解得到的酶解产物表现出最强的总还原力( 0.330± 0.017)。因此鸭肉蛋白酶解产物的抗氧化特性受酶解时间和蛋白酶种类的影响,复合蛋白酶是制备鸭肉蛋白源抗氧化肽的最适蛋白酶。
关键词:鸭肉;酶解时间;蛋白酶;抗氧化性
自由基是生物体通过正常的氧化代谢活动所产生的,它包括活性氧(羟自由基( hydroxyl radical,· OH)、超氧阴离子自由基( superoxide radical, O 2 -·)和过氧化氢( H 2 O 2)等)和活性氮( NO、 ONOO -和 ONOOH等) [1-2]。自由基在机体内的产生是不可避免的,低浓度时,自由基在机体内发挥着重要作用,如防止病毒的入侵和作为细胞信号等 [3]。但是当机体处于氧化应激状态时,过多的自由基就会攻击大分子物质,如蛋白质、脂质和核酸等,破坏其结构与功能,导致各种疾病的发生。现研究发现,癌症、动脉粥样硬化、糖尿病、关节炎和老年痴呆症等疾病都与自由基存在着一定的关系 [4-5]。
自由基也是致使油脂氧化而最终导致食品变质的重要原因。一些人工合成的抗氧化剂如二丁基羟基甲苯( butylated hydroxytoluene, BHT)、丁基羟基茴香醚( butylated hydroxyanisole, BHA)、特丁基对苯二酚(tert -butylhydroquinone, TBHQ)等已在食品中广泛使用,但这些物质具有一定的副作用,会威胁人体健康;而一些天然抗氧化剂因成本过高或对食品感官有影响,在使用上存在着局限性 [4,6]。因此急需寻找一种安全健康高效的抗氧化剂。动植物蛋白来源的抗氧化肽成为了近几年的研究热点。抗氧化肽是蛋白质中具有抗氧化功能的特殊片段,可通过水解等方法将其释放出来 [3]。目前已经从毛鳞鱼 [7]、鳕鱼 [6]、墨鱼 [8]、鸡肉 [9]、鹿肉 [10]、大豆 [11]、玉米 [12]、花生 [13]等动植物蛋白酶解液中获得了抗氧化肽。
我国是世界上最大的鸭肉生产国,根据联合国粮食及农业组织( Food and Agricultural Organization of the United Nations, FAO)的统计数据显示, 2012年我国的鸭肉生产量约占全世界的 69%,位居世界第一。同时鸭肉的蛋白质含量高( 16%~ 25%) [14],可能会是一种制备抗氧化肽的好原料。研究发现,酶解时间和蛋白酶的种类会影响抗氧化肽的抗氧化活性 [4,15]。因此本实验的目的是以鸭肉为原料,研究酶解时间和蛋白酶种类对鸭肉蛋白酶解产物抗氧化特性的影响,以确定用来制备鸭肉蛋白源抗氧化肽的最适蛋白酶。
1.1材料与试剂
鸭胸肉 江苏省南京市苏果超市。
胰酶( P1750, 4× USP) 美国 Sigma公司;风味蛋白酶( 500 LAPU/g)和复合蛋白酶( 1.51 AU-N/g) 丹麦 Novozyme公司; 1,1-二苯基 -2-三硝基苯肼( 1,1-diphenyl-2-picrylhydrazyl, DPPH)自由基 梯希爱(上海)化成工业发展有限公司;其他试剂均为分析纯。
1.2仪器与设备
HH-W恒温水浴箱 恒丰仪器制造有限公司; T25匀浆机 德国 IKA公司; Spectral Max M2e酶标仪美国伯腾仪器有限公司; Avanti J-E高速离心机 美国 Beckman Coulter公司; Kjeltec TM 2300全自动凯氏定氮仪 瑞典 FOSS公司; Hitachi L-8900A氨基酸自动分析仪日本 Hitachi公司。
1.3方法
1.3.1氨基酸分析
参照 GB/T 5009.124— 2003《食品中氨基酸的测定》的方法将鸭肉用 6 mol/L HCl,在 110℃真空条件下水解 24 h,酸解后的样品采用氨基酸自动分析仪进行氨基酸含量测定。氨基酸评分( amino acid score, AAS)的计算见下式。
1.3.2酶解产物的制备
将鸭胸肉放在 4℃解冻后去除脂肪和结缔组织,然后加入一定量的 0.2 mol/L的磷酸盐缓冲液,使混合物的最终蛋白质量浓度为 4 g/mL,并匀浆( 8 000 r/min, 4次,每次 15 s)。匀浆液分为 5组处理,第 1组加入质量分数 0.5%的复合蛋白酶,将所得到的酶解液定义为 PH;第 2组加入 0.5%的风味蛋白酶,将所得到的酶解液定义为 FH;第 3组加入 0.5%的胰酶,将所得到的酶解液定义为 TH;第 4组样品先用 0.5%的胰酶酶解 8 h,然后加入 0.5%的风味蛋白酶接着酶解,将所得到的酶解液定义为 TFH;第 5组样品先用 0.5%的胰酶酶解 8 h,然后加入 0.5%的复合蛋白酶接着酶解,将所得到的酶解液定义为 TPH。每隔一定时间( 0、 20、 40 min, 1、 1.5、 2、 3、 4、 5、 6、 7、 8、 9、 10 h)取出样品沸水浴灭酶 10 min,冷却后离心( 10 000×g, 10 min),取上清液测水解度和抗氧化性。各酶的最适酶解条件为:复合蛋白酶,最适 pH 6.0,最适温度 40℃;风味蛋白酶,最适 pH 6.5,最适温度 50℃;胰酶,最适 pH 7.0,最适温度 40℃。
1.3.3水解度的测定
水解度的测定参照 Fonkwe等 [16]的方法并稍做修改。即将 20 mL的酶解液与等量的 20 g/100 mL三氯乙酸( trichloroacetic acid, TCA)混合,在室温下振荡混匀 5 min后离心( 16 000×g, 10 min),取上清液用凯氏定氮法测其 10 g/100 mL TCA可溶性蛋白含量。
1.3.4 DPPH自由基清除率的测定
参照 Wang Qiukuan等 [17]的方法对样品进行 DPPH自由 基清除率测定。将 0.125 mL样品与 0.375 mL H 2 O, 0.5 mL DPPH自由基( 0.2 mmol/L)充分混合,在室温下避光反应 30 min后测其 517 nm波长处的吸光度,记为A 1。清除率计算见下式。空白为 0.5 mL蒸馏水加入 0.5 mL 100%乙醇调零。
式中:A 1为 0.5 mL样品液与 0.5 mL DPPH自由基在 517 nm波长处的吸光度;A 2为 0.5 mL样品液与 0.5 mL 100%乙醇在 517 nm波长处的吸光度;A 3为 0.5 mL DPPH自由基溶液与 0.5 mL蒸馏水在 517 nm波长处的吸光度。
1.3.5
![]() 清除率的测定
清除率的测定
参照 Zhang Yufeng等 [18]的方法进行 O 2 -·清除能力的测定。将邻苯三酚溶于 10 mmol/L HCl中配成浓度为 3 mmol/L的溶液。取 100 mmol/L Tris-HCl缓冲液( pH 8.2) 4.5 mL于 25℃水浴中保温 20 min。取出后立即加入样品 0.5 mL,蒸馏水 3.7 mL及邻苯三酚 0.3 mL后迅速混匀,恒温下每隔 30 s测定一次A 320 nm值,反应 4.5 min后结束,样品抑制邻苯三酚自养化的速率作为A 样。空白管以 10 mmol/L HCl代替样品,反应启动后 4.5 min内邻苯三酚自氧化速率作为A 自。计算见下式。
1.3.6总还原力的测定
参照 Jiang Haiping等 [19]的方法并稍做修改。将 75μL样品与 0.5 mL磷酸盐缓冲液( 0.2 mol/L, pH 6.6)和 0.5 mL铁氰化钾( 10 mg/mL)充分混合,在 50℃水浴中反应 20 min。然后加入 0.5 mL 10 g/100 mL TCA),离心( 2 000×g, 10 min),取 0.5 mL上清液与 0.5 mL蒸馏水以及 100μL 0.1 g/100 mL FeCl 3在室温下反应, 10 min后测定其在 700 nm波长处的吸光度。吸光度增加表明总还原力增加。
1.3.7· OH清除率的测定
参照 You Lijun等 [20]的方法并稍做改变。将 0.6 mL 5 mmol/L邻二氮菲, 0.4 mL 0.2 mol/L磷酸盐缓冲液( pH 7.4), 0.6 mL 5 mmol/L FeSO 4, 0.6 mL 15 mmol/L乙二胺四乙酸( ethylenediamine tetraacetic acid, EDTA)和 1 mL样品充分混合后加入 0.4 mL 0.1% H 2 O 2,在 37℃条件下反应 1 h,测样品管在 536 nm波长处的吸光度(A 样品)。用蒸馏水代替样品重复上述操作,得损伤管吸光度(A 损伤),用蒸馏水代替样品和 H 2 O 2,得到未损伤管吸光度(A 未损伤)。清除率计算见下式。
1.4数据处理
实验重复 3次,采用 SAS 8.1软件进行统计分析,用单因素方差分析( one-way analysis of variance, ANOVA)方法进行方差分析,采用 Duncan’ s multiple range test进行多重比较,显著水平设为P< 0.05。
2.1氨基酸分析
蛋白质的营养价值主要由氨基酸含量和配比决定,特别是必需氨基酸的含量及比例。如表 1所示,鸭肉的氨基酸组成合理,必需氨基酸的总量所占比例为 43.82%,其中赖氨酸( Lys)和亮氨酸( Leu)含量最高,分别占总蛋白的 9.42%和 8.46%,对婴儿来说也是必需氨基酸的 His的含量占总蛋白的 3.05%。鸭肉富含 Glu( Gln)、 Asp( Asn)、 Lys、 Leu、 Arg和 Ala。研究发现一些特定氨基酸的存在(如 Glu、 Asp、 Lys、 Leu和 Ala)能够增强肽的抗氧化性。 Lys、 Asp和 Glu因其侧链有氨基或羧基而具有螯合金属离子或清除自由基的作用 [21]。 Leu的侧链具有很强的疏水性,提高抗氧化肽的油溶性,并使肽能够很好的通过磷脂双分子层,在细胞内发挥抗氧化作用 [22]。
表1 鸭肉氨基酸组成
Table1 Amino acid composition of duck meat

注:a.必需氨基酸。
氨基酸相对含量/(g/100 g pro) 氨基酸相对含量/(g/100 g pro)天冬氨酸+天冬酰胺(Asp+Asn)9.45±0.01异亮氨酸(Ile) a4.73±0.02苏氨酸(Thr) a4.80±0.03亮氨酸(Leu) a8.46±0.03丝氨酸(Ser)4.25±0.03酪氨酸(Tyr) a3.87±0.01谷氨酸+谷氨酰胺(Glu+Gln)17.35±0.36苯丙氨酸(Phe) a4.53±0.08甘氨酸(Gly)4.64±0.19赖氨酸(Lys) a9.42±0.04丙氨酸(Ala)6.26±0.06组氨酸(His)3.05±0.24半胱氨酸(Cys)0.52±0.12精氨酸(Arg)7.02±0.04缬氨酸(Val) a5.05±0.02脯氨酸(Pro)3.63±0.11甲硫氨酸(Met) a2.94±0.01总含量100
食物蛋白质的各种必需氨基酸必须有一定比例才能在体内被充分吸收利用。世界卫生组织( World Health Organization, WHO)和 FAO提出了一个理想的蛋白质中必需氨基酸含量模式谱。表 2列出了这一模式谱和鸭肉中必需氨基酸的相对含量,可见鸭肉中的必需氨基酸的含量远远超过 FAO/WHO所推荐的成人模式。在必需氨基酸评分中,异亮氨酸的评分最高,其次是赖氨酸。鸭肉蛋白氨基酸组成合理,必需氨基酸含量和配比合适,对抗氧化肽的抗氧化功能起增强作用的氨基酸含量高,因此鸭肉是一种制备抗氧化肽的优质原料。
表2 鸭肉蛋白营养价值的评价
Table2 Nutritional evaluation of duck meat protein
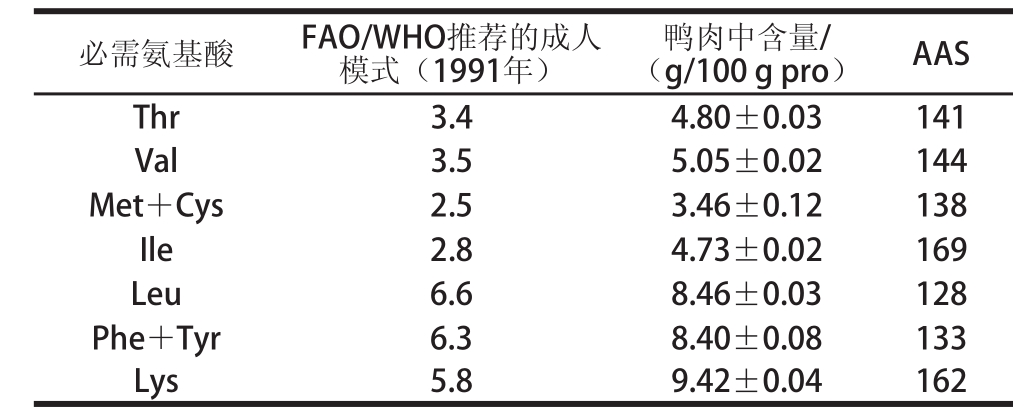
必需氨基酸FAO/WHO推荐的成人模式(1991年)鸭肉中含量/(g/100 g pro)AAS Thr3.44.80±0.03141 Val3.55.05±0.02144 Met+Cys2.53.46±0.12138 Ile2.84.73±0.02169 Leu6.68.46±0.03128 Phe+Tyr6.38.40±0.08133 Lys5.89.42±0.04162
2.2 鸭肉酶解产物的制备
研究发现蛋白质酶解产物的抗氧化性受底物性质、酶的种类、水解度和酶解时间等因素的影响 [4]。在本实验中,选择复合蛋白酶、风味蛋白酶和胰酶为酶解反应催化剂,并采用了单酶酶解和双酶分步酶解两种方法来酶解鸭肉。酶解曲线如图 1所示,用不同酶处理得到的鸭肉蛋白酶解产物的水解度都随着时间的延长而显著增加(P< 0.05)。所有酶解产物在最初的 2 h内水解度增加较快,随着时间的延长,水解度的变化逐渐减小,酶解 8 h后水解度达到稳定值。这和 Guérard等 [23]水解黄鳍金枪鱼( yellowfin tuna), Bougatef等 [4]水解星鲨( smooth hound)获得的水解曲线一致。这表明在最初的 2 h内,蛋白酶对鸭肉蛋白的酶解作用最强,随着酶解体系中氨基酸和肽含量的增多,蛋白酶的酶解作用逐渐受到抑制,水解度变化逐渐变小。
由单酶酶解实验可知,胰酶能有效地酶解鸭肉蛋白,在 8 h时其水解度可达( 42.11± 1.10)%;而复合蛋白酶和风味蛋白酶对鸭肉蛋白有相似的酶解能力,在 8 h时其水解度分别为( 27.87± 1.57)%、( 27.30± 1.84)%(P> 0.05)。有研究发现肽的抗氧化性随着水解度的增加而增加,因此为了得到较大水解度的酶解液,在分步酶解过程中,选择对鸭肉蛋白有较大酶解能力的胰酶进行第一步酶解,然后分别再用风味蛋白酶和复合蛋白酶进行第二步酶解。在酶解 8 h后,得到的最大水解度分别为( 62.64± 1.38)%、( 62.96± 1.89)%,明显高于用单酶酶解得到的水解度(P< 0.05)。

图1 鸭肉酶解曲线
Fig.1 Hydrolysis curves of duck meat with various enzyme preparations
2.3鸭肉酶解产物的抗氧化活性
2.3.1酶解产物的 DPPH自由基清除能力
DPPH自由基有一个单电子并在 517 nm波长处有最大吸光值,当有供氢能力的抗氧化剂存在时,其吸收值就会下降,褪色程度与其接受的电子呈定量关系。因此 DPPH自由基被广泛的用于评价抗氧化剂的自由基清除能力 [24]。由图 2可知,用单酶酶解得到的鸭肉蛋白酶解液,其 DPPH自由基清除率在开始的 8 h内随着时间的延长而增加(P< 0.05),在 8 h时达到稳定值(P> 0.05)。这和水解度的变化规律一致。 PH的 DPPH自由基清除率最强( 75.70± 1.54)%,其次是 TH, FH的 DPPH自由基清除能力最弱。但通过两种酶分步酶解得到的酶解液,其 DPPH自由基清除率随着时间的延长保持不变,清除率为 52%左右,与 8 h时的 TH没有显著差异(P< 0.05)。不同的 DPPH自由基清除率说明酶的种类是影响鸭肉蛋白酶解产物抗氧化性的重要原因之一。这是因为用不同的酶酶解得到的肽具有不同的氨基酸组成,而肽的氨基酸组成是影响肽抗氧化能力强弱的重要因素。由于 DPPH自由基是脂溶性氧化剂,因此可以推断用复合蛋白酶酶解得到的抗氧化肽含有较多的疏水性氨基酸,具有一定的疏水性。有研究发现一些疏水性氨基酸的存在能提高肽的抗氧化性,如色氨酸( Trp)、苯丙氨酸( Phe)因分别含有吲哚基、苯基而起到电子供体的作用 [25]、甲硫氨酸( Met)因含有巯基而具有清除自由基的作用 [26]、脯氨酸( Pro)的氮杂环通过影响肽的二级结构而影响其抗氧化性 [27]。
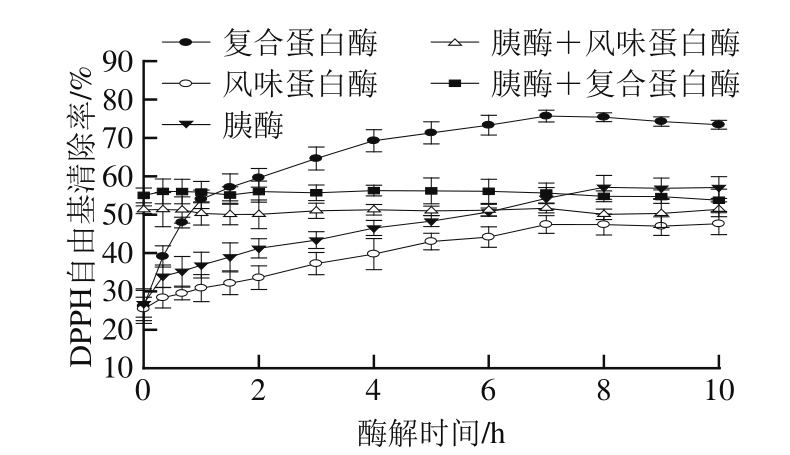
图2 酶解时间、酶的种类对鸭肉蛋白酶解产物DPPH自由基清除率的影响
Fig.2 Effects of hydrolysis time and protease type on the DPPH radical scavenging activity of duck meat protein hydrolysates
2.3.2酶解产物的· OH清除能力
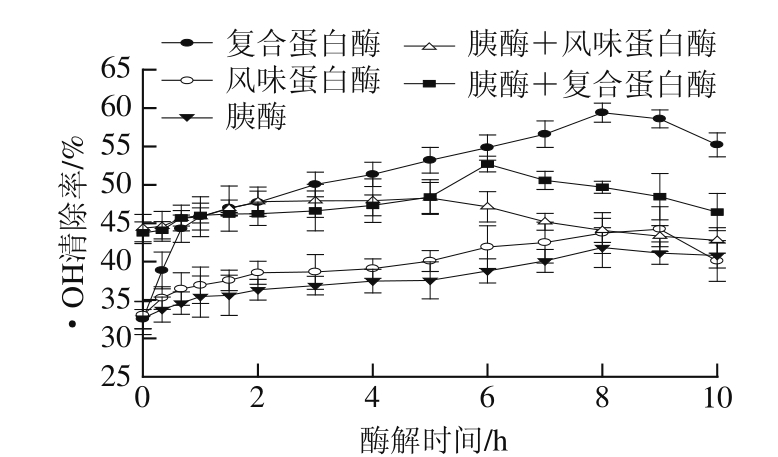
图3 酶解时间、酶的种类对鸭肉蛋白酶解产物·OH清除率的影响
Fig.3 Effects of hydrolysis time and protease type on hydroxyl radical scavenging activity of duck meat protein hydrolysates
· OH是最活跃的一种活性分子,也是进攻性最强的化学物质之一,几乎可以和所有的生物分子、有机物或无机物发生各种不同类型的化学反应。· OH是目前所知活性氧自由基中对生物体毒性最强、危害最大的一种自由基,可以通过电子转移、加成以及脱氢等方式与生物体内的多种分子作用,造成生物分子如糖类、蛋白质、核酸和脂类等的氧化损伤。研究还发现羟自由基与衰老、癌症以及其他一些疾病有关 [28]。因此,清除· OH对人体预防各种疾病有重要意义。如图 3所示,鸭肉蛋白酶解液的· OH清除率随着时间的延长先增加后减小(P< 0.05)。用单酶酶解得到的酶解液在 8 h时达到最大值,并且复合蛋白酶酶解液表现出最强的· OH清除能力( 59.41± 1.24)%;用胰酶+风味蛋白酶分步酶解得到的酶解液,其· OH清除能力在 2 h时达到最强( 47.81± 1.91)%;胰酶+复合蛋白酶分步酶解得到的酶解液,其抗氧化性在 6 h时达到最大值( 52.72± 1.03)%。这可能是因为在反应初期,酶的作用使原本隐藏在蛋白质内部并且能够增强肽抗氧能力的氨基酸残基暴露出来 [29],由于底物蛋白充足,抗氧化肽得到积累,因此酶解液的抗氧化性在酶解初期表现为随着时间的延长而增强。但随着反应的进行,具有抗氧化活性的肽被再次降解,从而使酶解液的抗氧化活性下降 [29]。这与 You Lijun等 [30]的结论相似。他们用木瓜蛋白酶和复合蛋白酶分别酶解泥鳅蛋白,发现酶解物的· OH清除能力随着时间的延长先增加后降低。
2.3.3酶解产物的 O 2 -·清除能力

图4 酶解时间、酶的种类对鸭肉蛋白酶解产物
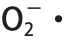 清除率的影响
清除率的影响
Fig.4 Effects of hydrolysis time and protease type on superoxide anion radical scavenging activity of duck meat protein hydrolysates
O
2
-·是生物体产生的第一个自由基,是所有自由基的前身。超氧阴离子的活性不是很活泼,毒性小,但存在寿命长,它的损伤效用主要是使核酸断裂,多糖解聚,酶失活等。超氧阴离子可能还是诱导不饱和脂肪酸等易氧化物质过氧化的重要原因,并且该离子会在金属离子的催化下发生
Fenton反应产生具有高活性的·
OH。人体内过剩的超氧阴离子会促使衰老并引发如癌症、糖尿病等各种疾病
[31]。因此常用样品对
![]() 的清除能力来反映抗氧化活性。如图
4所示,
PH和
TPH的
的清除能力来反映抗氧化活性。如图
4所示,
PH和
TPH的
![]() 清除率随着酶解时间的延长而增加,最终趋于稳定。但
FH、
TH和
TFH的
清除率随着酶解时间的延长而增加,最终趋于稳定。但
FH、
TH和
TFH的
![]() 清除率随着时间的延长先增加后降低(P<
0.05)。
PH具有最强的
清除率随着时间的延长先增加后降低(P<
0.05)。
PH具有最强的
![]() 清除能力,接近
100%;其次为
TPH,其最大值约为
98%;
TFH在
5 h时达到最大值(
92.30±
4.81)%;
FH在
6 h时达到最大值(
67.67±
3.89)%;
TH在
8 h时达到最大值(
67.63±
3.64)%。由结果可知,由复合蛋白酶酶解产生的肽具有很强的
清除能力,接近
100%;其次为
TPH,其最大值约为
98%;
TFH在
5 h时达到最大值(
92.30±
4.81)%;
FH在
6 h时达到最大值(
67.67±
3.89)%;
TH在
8 h时达到最大值(
67.63±
3.64)%。由结果可知,由复合蛋白酶酶解产生的肽具有很强的
![]() 清除能力。
清除能力。
2.3.4酶解产物的总还原力
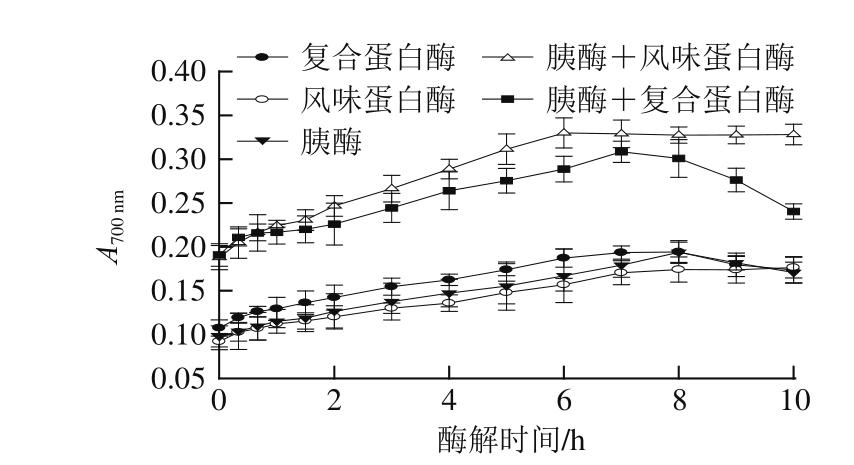
图5 酶解时间、酶的种类对鸭肉蛋白酶解产物总还原力的影响
Fig.5 Effects of hydrolysis time and protease type on reducing power of duck meat protein hydrolysates
还原力是基于加入酶解产物(还原性物质)后,体系中 Fe 3+转化为 Fe 2+来检测的,在波长 700 nm处的吸光度越大,则样品的还原力越强。如图 5所示, FH和 TFH的还原力随着时间的延长先增加后趋于稳定,这和 Wu Huichun等 [32]的结果相似。但 PH、 TH和 TPH的总还原力随着时间的延长先增加后减小(P< 0.05)。用双酶分步酶解得到的鸭肉蛋白酶解液的总还原力显著高于用单酶酶解得到的酶解液(P< 0.05),其中 TFH的最大值为 0.330± 0.017, TPH在 7 h时达到最大值 0.308± 0.012, PH在 7 h时达到最大值 0.193± 0.007, TH在 8 h时达到最大值 0.194± 0.011, FH的最大值为 0.174± 0.013。 TFH和 TPH具有较大的总还原力是因为其具有较大的水解度,一些极性或带电的氨基酸侧链较多地暴露出来,从而增强了氧化还原能力 [33]。
用复合蛋白酶、风味蛋白酶和胰酶通过单酶酶解和双酶分步酶解得到的鸭肉蛋白酶解产物都具有一定的 DPPH自由基、· OH、 O 2 -·清除能力和总还原力。酶解时间和蛋白酶种类是影响鸭肉蛋白酶解产物抗氧化性的重要因素。其中酶解时间为 8 h时的复合蛋白酶酶解产物具有最强的 DPPH自由基清除能力( 75.70± 1.54)%,· OH清除能力( 59.41± 1.24)%和 O 2 -·清除能力( 98.50± 4.51)%,而胰酶+风味蛋白酶的酶解产物具有最强的还总原力。因此复合蛋白酶是酶解鸭肉蛋白制备抗氧化肽的最适蛋白酶( 0.330± 0.017)。
参考文献:
[1] JE J Y, QIAN Zhongji, BYUN H G, et al. Purification and characterization of an antioxidant peptide obtained from tuna backbone protein by enzymatic hydrolysis[J]. Process Biochemistry, 2007, 42(5)∶840-846.
[2] NAKAJIMA K, YOSHIE-STARK Y, OGUSHI M. Comparison of ACE inhibitory and DPPH radical scavenging activities of fish muscle hydrolysates[J]. Food Chemistry, 2009, 114(3)∶ 844-851.
[3] SARMADI B H, ISMAIL A. Antioxidative peptides from food proteins∶ a review[J]. Peptide, 2010, 31(10)∶ 1949-1956.
[4] BOUGATEF A, HAJJI M, BALTI R, et al. Antioxidant and free radical-scavenging activities of smooth hound (Mustelus mustelus) muscle protein hydrolysates obtained by gastrointestinal protease[J]. Food Chemistry, 2009, 114(4)∶ 1198-1205.
[5] QIAN Zhongji, JUNG W K, BYUN H G, et al. Protective effect of an antioxidative peptide purified from gastrointestinal digests of oyster, Crassostrea gigas against free radical induced DNA damage[J]. Bioresource Technology, 2008, 99(9)∶ 3365-3371.
[6] CHEUNG I W Y , CHEUNG L K Y, TAN N Y, et al. The role of molecular size in antioxidant activity of peptide fractions from Pacifi c hake (Merluccius productus) hydrolysates[J]. Food Chemistry, 2012, 134(3): 1297-1306.
[7] AMAROWICZ R, SHAHIDI F. Antioxidant activity of peptide fractions of capelin protein hydrolysates[J]. Food Chemistry, 1997, 58(4): 355-359.
[8] HMIDET N, BALTI R, NASRI R, et al. Improvement of functional properties and antioxidant activities of cuttlefish (Sepia officinalis) muscle proteins hydrolyzed by Bacillus mojavensis A21 protease[J]. Food Research International, 2011, 44(9): 2703-2711.
[9] SUN Yangying, PAN Daodong, GUO Yuxing, et al. Purification of chicken breast protein hydrolysate and analysis of its antioxidant activity[J]. Food and Chemical Toxicology, 2012, 50(10): 3397-3404.
[10] KIM E K, LEE S J, JEON B T, et al. Purifi cation and characterization of antioxidative peptides from enzymatic hydrolysates of venison protein[J]. Food Chemistry, 2009, 114(4): 1365-1370.
[11] CHEN Huaming, MURAMOTO K, YAMAUCHI F. Structural analysis of antioxidative peptides from soybean β-conglycinin[J]. Journal of A gricultural and Food Chemistry, 1995, 43: 574-578.
[12] ZHOU Kequan, SUN Shi, CANNING Corene. Production and functional characterization of antioxidative hydrolysates from corn protein via enzymatic hydrolysis and ultrafi ltration[J]. Food Chemistry, 2012, 135(3): 1192-1197.
[13] JAMDAR S N, RAJALAKSHMI V, PEDNEKAR M D, et al. Infl uence of degree of hydrolysis on functional properties, antioxidant activity and ACE inhibitory activity of peanu t protein hydrolysate[J]. Food Chemistry, 2010, 121(1): 178-184.
[14] 唐婧苗, 刘章武, 杜金平. 酶法水解鸭肉蛋白制备鸭肉肽[J]. 食品研究与开发, 2010, 31(4): 75-78.
[15] NAWAPORN L, JIRAWAT Y. Production and purification of antioxidant peptides from a mungbean meal hydrolysate by Virgibacillus sp. SK37 protenase[J]. Food Chemistry, 2013, 141(2): 992-999.
[16] FONKWE L G, SINGH R K. Protein recovery from mechanically deboned turkey residue by enzymic hydrolysis[J]. Process Biochemistry, 1996, 31(6): 605-616.
[17] WANG Qiukuan, LI Wei, HE Yunhai, et al. Novel antioxidative peptides from the protein hydrolysate of oysters (Crassostrea talienwhanensis)[J]. Food Chemistry, 2014, 145: 991-996.
[18] ZHANG Yufeng, DUAN Xiu, ZHUANG Yongliang. Purification and characterization of novel antioxidant peptides from enzymatic hydrolysates of tilapia (Oreochromis niloticus) skin gelatin[J]. Peptides, 2012, 38(1): 13-21.
[19] JIANG Haiping, TONG Tianzhe, SUN Jianhua, et al. Purifi cation and characterization of antioxidative peptides from found scad (Decapterus marauds) muscle protein hydrolysate[J]. Food Chemistry, 2014, 154: 158-163.
[20] YOU Lijun, ZHAO Mouming, REGENSTEIN J M, et al. Changes in the antioxidant activity of loach (Misgurnus anguillicaudatus) protein hydrolysates during a simulated gastrointestinal digestion[J]. Food Chemistry, 2010, 120(3): 810-816.
[21] CHOMPOONUCH W, BENJAMART C, JIRAWAT Y. Antioxidant activity of protein hydrolysates derived from threadfi n bream surimi byproducts[J]. Food Chemistry, 2012, 132(1): 104-111.
[22] KONG Baohua, PENG Xinyan, XIONG Youling, et al. Protection of lung fibroblast MRC-5 cells against hydrogen peroxide-induced oxidative damage by 0.1-2.8 kDa antioxidative peptides isolated from whey protein hydrolysate[J]. Food Chemistry, 2012, 135(2): 540-547.
[23] GUÉRARD F, DUFOSSE L, BROISE D L, et al. Enzymatic hydrolysis of proteins from yellowfin tuna (Thunnus albacores) wastes using Alcalase[J]. Journal of Molecular Catalysis, 2001, 11: 1051-1059.
[24] ESCUDERO E, ARISTOY M C, NISHIMURA H, et al. Antihypertensive effect and antioxidant activity of peptide fractions extracted from Spanish dry-cured ham[J]. Meat Science, 2012, 91(3): 306-311.
[25] ZHANG Miao, MU Taihua, SUN Minjie. Purifi cation and identifi cation of antioxidant peptides from sweet potato protein hydrolysates by Alcalase[J]. Journal of Functional Foods, 2014, 7: 191-200.
[26] REN Jiaoyan, ZHAO Mouming, SHI J, et al. Purification and identifi cation of antioxidant peptides from grass carp muscle hydrolysates by consecutive chromatography and electrospray ionization-mass spectrometry[J]. Food Chemistry, 2008, 108(2): 727-736.
[27] ALEMAN A, GIMENEZ B, PEREZ-SANTIN E, et al. Contribution of Leu and Hyp residues to antioxidant and ACE-inhibitory activities of peptide sequences isolated from squid gelatin hydrolysate[J]. Food Chemistry, 2011, 125(2): 334-341.
[28] 祝超智, 张万刚, 徐幸莲, 等. 金华火腿粗肽液的体外抗氧化活性[J].肉类研究, 2013, 27(6): 5-9.
[29] 黄群, 杨万根, 余佶, 等. 杜仲籽粕蛋白酶解制备抗氧化肽工艺优化[J].食品科学, 2013, 34(17): 205-209. doi: 10.7506/spkx1002-6630-201317044.
[30] YOU Lijun, ZHAO Mouming, CUI Chun, et al. Effect of degree of hydrolysate on the antioxidant activity of loach (Misgurnus anguillicaudatus) protein hydrolysates[J]. Innovative Food Science & Emerging Technologies, 2009, 10(2): 235-240.
[31] BAMDAD F, WU Jianping, CHEN Lingyun. Effects of enzymatic hydrolysis on molecular structure and antioxidant activity of barley hordein[J]. Journal of Cereal Science, 2011, 54(1): 20-28.
[32] WU Huichun, CHEN Huaming, SHIAU C Y. Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel (Scomber austriasicus)[J]. Food Research International, 2003, 36: 949-957.
[33] ZHU Lijuan, CHEN Jie, TANG Xueyan, et al. Reducing, radical scavenging, and chelation properties of in vitro digests of Alcalasetreated zein hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2008, 56: 2714-2721.
Antioxidant Activities of Protein Hydrolysates from Duck Meat
WANG Lusha, CHEN Yulian, HUANG Ming* , ZHOU Guanghong (Key Laboratory of Animal Product Processing, Ministry of Agriculture, College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract: Protein hydrolysates were prepared by enzymatic hydrolysis ofduck meat for different times with protamex, flavourzyme, trypsin and sequential hydrolysis using trypsin followed by protamex or flavourzyme, respectively, and investigated for antioxidant activities as a function of hydrolysis time and protease type. The antioxidant activities were evaluated by 1,1-diphenyl-2-picrylhydrazyl (DPPH), hydroxyl and superoxide anion radical scavenging capabilities as well as reducing power. The results showed that the DPPH radical scavenging activity of each hydrolysate was positively dependent on hydrolysis time, while the hydroxyl and superoxide anion radical scavenging activities and reducing power first increased and then decreased ( P < 0.05). The protamex hydrolysate exhibited the strongest radical scavenging activities, which could scavenge (75.70± 1.54)% of DPPH radical, (59.41± 1.24)% of hydroxyl radical and (98.50± 4.51)% of superoxide anion radical, while the hydrolysate prepared with trypsin plus flavourzyme displayed the highest reducing power (0.330± 0.017). Therefore, the antioxidant activities of duck meat hydrolysates were determined by the hydrolysis time and protease types. Protamex was the best candidate for preparation of antioxidant peptides derived from duck meat.
Key words: duck meat; hydrolysis time; protease; antioxidant activity
中图分类号: TS251.1
文献标志码: A 文章编号:1002-6630(2015)17-0146-06
文章编号:1002-6630(2015)17-0146-06
doi:10.7506/spkx1002-6630-201517028
收稿日期:2014-10-16
基金项目:国家自然科学基金面上项目(31171706);公益性行业(农业)科研专项(201303083-2)
作者简介:王璐莎(1989—),女,硕士研究生,研究方向为肉品质量与安全控制。E-mail:2012108029@njau.edu.cn
*通信作者:黄明(1970—),男,教授,博士,研究方向为肉品质量与安全控制。E-mail:mhuang@njau.edu.cn