表1 菌种组合及配比Table1 Bacterial strains and their combinations

编号菌种及配比编号菌种及配比处理1对照(不添加任何发酵剂)处理5L. s∶L. p =1∶1处理2L. s处理6L. s∶P. p =1∶1处理3L. p处理7L. p∶P. p =1∶1处理4P. p处理8L. s∶L. p∶P. p=1∶1∶1
白菊红,唐善虎*,李思宁,王 柳,卢付青,闫利国
(西南民族大学生命科学与技术学院,四川 成都 6 10041)
摘 要:本实验探讨了3 株乳酸菌发酵剂及其组合在发酵牦牛肉灌肠过程中对肽变化规律的影响。人工接种米酒乳杆菌( Lactobacillus sake, L. s)、植物乳杆菌( Lactobacillus plantarum, L. p)、戊糖片球菌( Pediococcus pentosaceus, P. p)及其组合菌种于牦牛肉灌肠,每隔24 h测定其pH值,分别在主发酵2 d(32 ℃),再自然风干发酵10、20、30 d后取样,采用反相高效液相色谱(reversed phase high performance liquid chromatography,RP-HPLC)对不同 发酵时期牦牛肉灌肠中肽的含量进行检测和分析。结果表明,在主发酵2 d,再自然风干发酵10、20 d(除 P. p与 L. p+ P. p外)和30 d后,不同乳酸菌发酵剂对牦牛肉灌肠中总肽含量的影响均显著( P≤0.05)。按发酵时间由短及长的顺序,在4 个不 同发酵时期检出最大总肽含量的发酵菌种依次是 L. s(1.73×10 5mAU·s)、 P. p(1.62×10 5mAU·s)、对照组(1.81×10 5mAU·s)和 L. p(1.83×10 5mAU·s)。随着发酵时间的延长,发酵牦牛肉灌肠中的总肽含量发生了明显的变化,相对极性较弱的肽减少了,存在的主要是相对极性较大的肽;主发酵结束时, L. s发酵的处理组检出最大总肽含量,且 L. s与其参与发酵 L. s+ P. p和 L. s+ L. p+ P. p组合中检出总肽含量的变化呈现出相似的趋势, L. s是牦牛肉灌肠中快速生成肽的良好发酵剂;在4 个发酵时期, L. p+ L. s发酵的处理组检出肽的含量均小于其单一菌种的发酵, L. p+ L. s对牦牛肉灌肠中肽的生成具有一定的拮抗作用; L. s与 P. p作用不明显,但能快速降低pH值,保证产品的安全性。本实验结果为进一步生产优质牦牛肉灌肠奠定了良好的基础。
关键词:乳酸菌;发酵;牦牛肉灌肠;肽类;反相高效液相色谱
牦牛是我国特有的牛品种,世界上90%以上的牦牛都集中在我国境内,牦牛肉中含有丰富的蛋白质、必需氨基酸、矿物质(Fe、Zn、Se)和VB,是优质的动物源食材 [1]。目前,市场上牦牛肉产品基本上是采用传统加工工艺加工而成,特别是风干牦牛肉,因历史悠久、风味独特在牦牛肉制品市场占有主导地位。但是,传统加工方式多以自然风干为主,时间周期长,容易导致牦牛肉中的脂肪氧化变质,不仅会产生难以接受的哈喇味,而且也会产生有毒有害的物质 [2]。
近年来研究发现,将乳酸菌应用于食品中可以缩短产品的加工周期,降低亚硝酸盐含量,提高产品品质 [3-4]。因此,应用乳酸菌开发新型的牦牛肉制品,对丰富牦牛肉制品市场有着重要的意义。
许慧卿等 [5]研究了米酒乳杆菌对风鸭肌肉蛋白质降解的影响,发现米酒乳杆菌能促进肌浆蛋白与肌原纤维蛋白的降解,能够显著增加游离氨基酸的总量。徐幸莲等 [6]研究了植物乳杆菌6003对肌肉蛋白的分解能力,结果表明植物乳杆菌6003的活细胞和细胞裂解液增加肌浆蛋白提取液中肽、游离氨基酸含量,活细胞和细胞裂解液两者混合后的效果更为显著。Rizzello等 [7]对乳酸菌发酵谷类食物生成抗癌肽Lunasin进行了研究,他们发现乳酸菌发酵谷类食品比对照产品中检出的Lunasin含量增加了2~4 倍。但是,目前应用乳酸菌及其复配发酵剂加工发酵牦牛肉灌肠,并研究其中肽变化规律尚未见报道。
肽是由20 种L-氨基酸中部分或全部种类以不同的排列方式和组成比例构成的简单二、三肽或复杂线性或环形结构不同肽类的总称,是由蛋白质降解或生物体内直接合成的多功能化合物 [8]。国内外大量研究报道认为:肽在人体中可以像氨基酸一样被吸收并直接进入血液循环,具有增强免疫、抗菌、抗病毒、调节激素、抗氧化、抗衰老,降血脂,降胆固醇等功能 [9-11]。由于肽在微量状态下具有强大的生物活性,并且具有食用安全性,肽类研究已成为当前极具发展前景的功能因子和食品界最热门的研究课题之一 [12]。
本实验将米酒乳杆菌、植物乳杆菌、戊糖片球菌及其组合菌种接种于牦牛肉灌肠中,采用反相高效液相色谱技术 (reversed phase high performance liquidchromatography,RP-HPLC)对不同发酵时期的牦牛肉灌肠中的肽进行检测,旨在探索3 株乳酸菌发酵剂及其组合对发酵牦牛肉灌肠中肽变化规律的影响,筛选出具有潜在市场价值的牦牛肉灌肠乳酸菌发酵剂,以此为牦牛肉新产品的开发提供参考。
1.1 材料、菌种、培养基与试剂
牦牛肉、猪肥膘、食盐、蔗糖、五香粉、亚硝酸钠(食品级)、味精、天然猪肠衣,均购于成都高升桥好又多超市。
米酒乳杆菌(Lactobacillus sake,L. s)、戊糖片球菌(Pediococcus pentosaceus,P. p)、植物乳杆菌(Lactobacillus plantarum,L. p),购于中国工业微生物菌种保藏管理中心。
MRS增菌培养基、MRS培养基购于杭州微生物试剂有限公司。
NaCl、NaH 2PO 4、Na 2HPO 4(分析纯)、三氟乙酸、乙腈(色谱纯) 成都市科龙化工试剂厂;氮气 成都泰芋有限责任公司。
1.2 仪器与设备
Agilent 1100型高效液相色谱仪(配自动进样器和紫外检测器) 美国Agilent公司;pH-Star仪 德国Matthaus公司;Centrifuge 5804离心机 德国Eppendorf公司;绞肉灌肠一体机 永康市卓越塑胶有限公司;PL303电子天平 瑞士Mettler Toledo公司;BCD-221TMBA冷冻冰箱 青岛海尔股份有限公司;FSH-2A高速匀浆机 江苏金坛市医疗仪器厂;YGC-12型氮吹仪 成都雅源科技有限公司;DHP-9052电热恒温培养箱 上海齐欣科学仪器有限公司;SW-CJ-1F超净工作台苏净集团安泰公司。
1.3 方法
1.3.1 发酵剂制备
参考蒋云升 [13]和王永霞 [14]等的方法并修改进行。将L. s、P. p、L. p分别按V(菌种) ∶V(培养基)=1 ∶20接种于MRS增菌培养基,30 ℃条件下恒温培养24 h左右,重复此操作两次,当培养基呈明显混浊时,活化完成,保存于4 ℃冰箱。应用MRS培养基对活化好的菌种进行平板活菌计数。
1.3.2 牦牛肉灌肠制作工艺
工艺流程:原料肉→切块→混匀→腌制→绞肉→接种→灌肠→结扎、排气→主发酵→自然风干发酵→成熟→成品。
操作要点: 1)配方:主料:牦牛肉80%、猪肥膘20%;辅料:以主料100%计,食盐3.5%、蔗糖5.6%、亚硝酸钠0.05%、五香粉0.45%、味精0.4%;2)切块:分别将清洗并修整除去筋膜、筋腱的牦牛肉和猪肥膘切成约2 cm×2 cm×2 cm大小的块状,并沥干表面水分;3)混匀与腌制:将肉块与辅料混合均匀后置于4 ℃冰箱腌制约24 h,当肉呈现出内外一致的鲜红色、不绵软、有汁液渗出,且用手触摸时有坚实感、滑腻感时,完成腌制;4)绞肉:用绞肉机将腌制好的肉块绞为均匀的肉馅。5)接种:按表1菌种组合及配比,以1×10 6CFU/g接种量分别接种于绞好的肉馅。6)灌装:灌装时要掌握肠体的饱满程度,不能松软,也不宜过饱。7)结扎、排气:灌装好的肠体每隔10~20 cm用线绳结扎成一节,用排气针有规律地扎眼,排除肠体中的空气。8)主发酵:用清水漂洗干净灌装好的肠体,32 ℃恒温发酵2 d,当接种乳酸菌发酵剂的灌肠pH值降至5.3~5.0时,主发酵结束。9)自然风干发酵:主发酵结束后,将灌肠悬挂于阴凉通风处,于自然条件(13~22 ℃)下继续发酵30 d。
表1 菌种组合及配比Table1 Bacterial strains and their combinations

编号菌种及配比编号菌种及配比处理1对照(不添加任何发酵剂)处理5L. s∶L. p =1∶1处理2L. s处理6L. s∶P. p =1∶1处理3L. p处理7L. p∶P. p =1∶1处理4P. p处理8L. s∶L. p∶P. p=1∶1∶1
1.3.3 测定方法
在整个发酵过程中,每24 h测定一次pH值,至第15天。分别在主发酵(2 d)、继续自然发酵10、20、30 d结束后取样,均保存于-18 ℃冰箱,用于蛋白肽检测。
1.3.3.1 pH值测定
用pH Star仪测定牦牛肉灌肠的pH值,每个样本重复3 次,取平均值。
1.3.3.2 肽含量的测定方法
参考文献:[15-17]略做修改进行。
样品前处理和制备:准确称取3 g待测样品,加入30 mL 0.2 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)(NaH 2PO 4、Na 2HPO 4,pH 6.5),高速匀浆5 min(6 000 r/min),然后高速离心20 min(10 000×g)。取上清液2.5 mL,加入5 mL乙腈,高速离心20 min(15 000×g),取上清液5 mL,用氮吹仪吹去溶剂,用400 μL体积分数为0. 05%三氟乙酸溶解残留物,过0.22 μm滤膜后进行HPLC测定,每个样本重复3 次。
色谱条件:色谱柱:Waters Symmetry C 18色谱柱(4.6 mm×250 mm,5 μm);流动相:A相(甲醇)、B相(乙腈-水-三氟乙酸(60 ∶40 ∶0.04,V/V));洗脱程序:A相加1%洗脱液B相洗5 min,然后B相由1%逐步上升至100%,洗脱25 min;流速:0.9 mL/min;进样量:20 μL;柱温:40 ℃;检测波长:214 nm。
样品测定:利用配自动进样器和紫外检测器的Agilent 1100型高效液相色谱仪对样品肽含量进行测定。
1.4 数据处理
数据采用SPSS 13.0统计软件包进行分析处理,并采用Duncan’s方法对各处理进行均值的多重比较分析。
2.1 发酵牦牛肉灌肠过程中pH值的变化
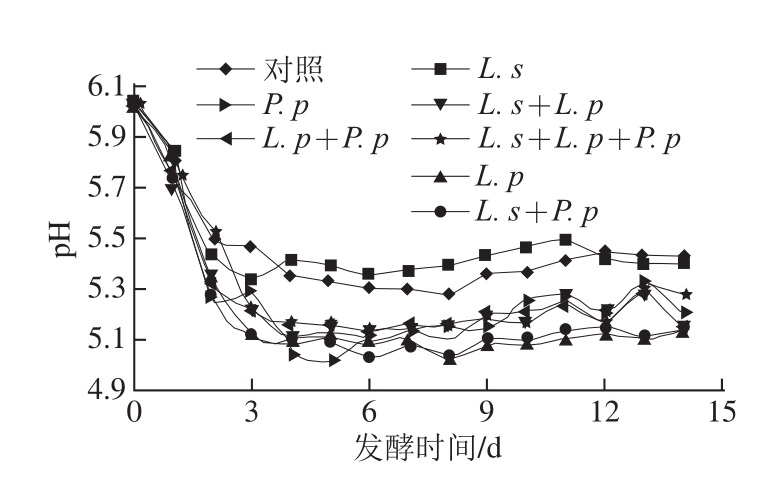
图1 牦牛肉发酵灌肠在发酵过程中pH值变化
Fig.1 Changes in pH value during the fermentation process of yak meat sausage
由图1可知,在整个发酵过程中各个处理之间pH值均先在主发酵阶段快速下降,此阶段接种了乳酸菌灌肠的pH值下降速率大于对照组;其后在自然发酵过程中pH值均缓慢继续下降到一定值后趋于稳定,在此阶段接种了L. s处理组的pH值稳定于5.30~5.40,明显高于其他处理;接种其他乳酸菌处理组的pH值均小于5.30,明显小于对照组。乳酸菌能将牦牛肉灌肠中的碳水化合物快速降解为乳酸,致使处理组中的pH值快速下降;L. s含有大量的中性活性蛋白酶 [18],将肉中蛋白快速分解生成碱性物质,使接种了L. s处理组的pH值明显高于其他处理组。
2.2 发酵牦牛肉灌肠过程中总肽含量及其变化
国内外多名学者 [19-22]研究表明:乳酸菌促进发酵肉制品中肽的生成主要有两种途径:1)通过乳酸菌发酵作用,产生乳酸降低pH值,激活肌肉本身组织蛋白酶的活性,加速肌肉蛋白的降解,促使牦牛肉灌肠产生肽类;2)乳酸菌分泌的细胞外蛋白酶降解肌肉蛋白产生肽类。但乳酸菌作用于蛋白分解成肽的过程中,不同的菌种会有差异。
2.2.1 不同发酵时期牦牛肉灌肠中肽的HPLC图

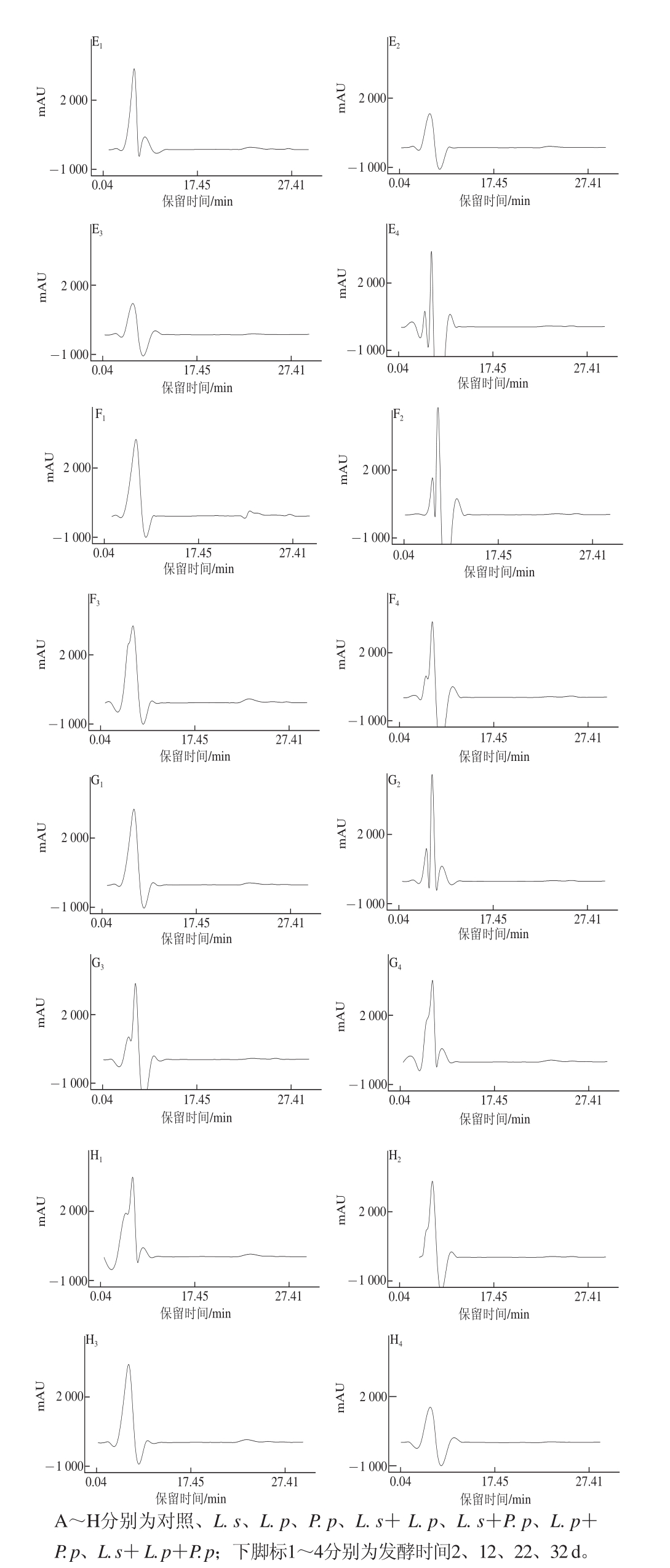
图2 不同处理在不同发酵时间牦牛肉灌肠中肽的HPLC图
Fig.2 HPLC chromatography of peptides of yak meat sausage during different fermentation periods
由图2可知,对照组在主发酵结束2 d时检出了多条洗脱峰,其后在自然风干发酵的3个时期检出了峰形相似的洗脱峰,集中于保留时间在1~5 min,即在发酵过程中,保留时间在6~17 min,用大于0.6%乙腈参与洗脱出的相对极性较弱的肽明显减少了,这与陆应林等 [19]在南京板鸭加工过程中发现非极性肽的减小相似。与对照组相比,此3 株乳酸菌及其组合在整个发酵过程中检出肽的色谱图与对照组在自然风干发酵的极为相似,主要是保留时间在1~5 min,0.05%三氟乙酸洗脱出相对极性较强的肽,可能此3 株乳酸菌发酵加速了牦牛肉灌肠中相对极性较弱肽的降解,但机理尚不明确,有待于进一步研究。
2.2.2 发酵牦牛肉灌肠中总肽含量及其变化
表2 发酵牦牛肉灌肠中的总肽含量及其变化
Table2 Changes in total peptide content of fermented yak meat sausage
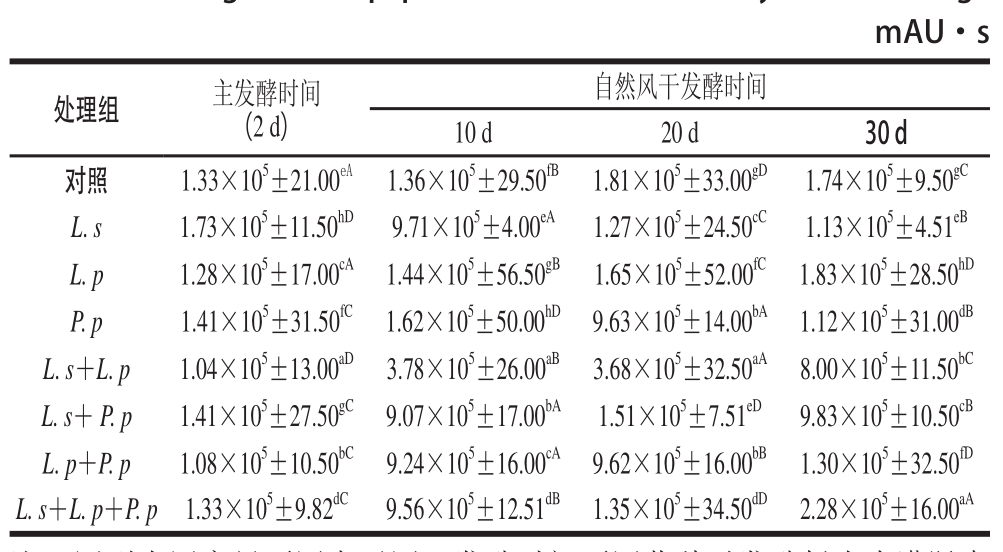
注:同列小写字母不同表示同一发酵时间不同菌种对发酵牦牛肉灌肠中总肽含量的影响差异显著(P≤0.05);同行大写字母不同表示同一菌种不同发酵时间对发酵牦牛肉灌肠中总肽含量的影响差异显著(P≤0.05)。
mAU·s处理组主发酵时间(2 d)自然风干发酵时间10 d20 d30 d对照1.33×10 5±21.00 eA1.36×10 5±29.50 fB1.81×10 5±33.00 gD1.74×10 5±9.50 gCL. s1.73×10 5±11.50 hD9.71×10 5±4.00 eA1.27×10 5±24.50 cC1.13×10 5±4.51 eBL. p1.28×10 5±17.00 cA1.44×10 5±56.50 gB1.65×10 5±52.00 fC1.83×10 5±28.50 hDP. p1.41×10 5±31.50 fC1.62×10 5±50.00 hD9.63×10 5±14.00 bA1.12×10 5±31.00 dBL. s+L. p1.04×10 5±13.00 aD3.78×10 5±26.00 aB3.68×10 5±32.50 aA8.00×10 5±11.50 bCL. s+ P. p1.41×10 5±27.50 gC9.07×10 5±17.00 bA1.51×10 5±7.51 eD9.83×10 5±10.50 cBL. p+P. p1.08×10 5±10.50 bC9.24×10 5±16.00 cA9.62×10 5±16.00 bB1.30×10 5±32.50 fDL. s+L. p+P. p1.33×10 5±9.82 dC9.56×10 5±12.51 dB1.35×10 5±34.50 dD2.28×10 5±16.00 aA
由表2可知,主发酵(32 ℃,2 d)结束时,乳酸菌发酵剂对牦牛肉灌肠中总肽含量影响显著(P≤0.05),肽含量从大到小依次为L. s>L. s+P. p>P. p>对照组>L. s+L. p+P. p>L. p>L. p+P. p>L. s+L. p。在此阶段,接种了L. s的牦牛肉灌肠检出肽的峰面积和为1.73×10 5mAU·s,显著高于其他样品,可能是因为L. s中含有较多与肌肉蛋白降解相关的中性活性酶类。
继续自然风干发酵10 d,即发酵12 d后,发酵剂对牦牛肉灌肠中总肽含量的影响仍显著(P≤0.05),P. p发酵的处理组检出最大,峰面积和为1.62×10 5mAU·s,其含量是此阶段检出最低总肽含量L. s+L. p处理组的42.8 倍。产生这一结果的可能原因是P. p快速降解牦牛肉灌肠中的碳水化合物产酸,降低样品pH值,进而激活牦牛肉灌肠中的组织蛋白酶,生成了大量的肽类 [20]。
发酵22 d后,除P. p与L. p+P. p发酵处理组检出差异不显著(P>0.05)外,其余样差异均显著(P≤0.05)。牦牛肉灌肠中检出的总肽含量的大小依次为对照组>L. p>L. s+P. p>L. s>L. s+L. p>P. p>L. p+P. p>L. s+ L. p。对照组的峰面积和(1.81×10 5mAU·s)是L. s+ L. p组合发酵处理组的5 倍;L. s+P. p检出峰面积和为1.51×10 5mAU·s,是复配菌种在本实验中检出的最大值。
发酵32 d后,乳酸菌发酵牦牛肉灌肠中检出总肽含量依次为L. p>对照组>L. p+P. p>L. s>P. p>L. s+P. p>L. s+L. p>L. s+L. p+P. p。L. p检测出总肽含量最多,峰面积和为1.83×10 5mAU·s;L. s+L. p+P. p检测出肽含量最少,峰面积和为2.28×10 5mAU·s。在此阶段,接种了L. p的牦牛肉灌肠中的肽含量高于其他处理。
在整个发酵过程中,不同乳酸菌发酵牦牛肉灌肠中,检测出的总肽含量从高到低依次为L. p(1.83×10 5mAU·s)、对照组(1.81×10 5mAU·s)、L. s(1.73×10 5mAU·s)、P. p(1.62×10 5mAU·s)、L. s+P. p(1.51×10 5mAU·s)、L. s+L. p+P. p(1.35×10 5mAU·s)、L. p+P. p(1.30×10 5mAU·s)、L. s+L. p(1.04×10 5mAU·s)。
由表2可知,同一乳酸菌菌种在发酵牦牛肉灌肠的4 个不同时期,检出发酵时间对灌肠中总肽含量的影响差异均显著,但因发酵菌种的不同,总肽含量的变化趋势有差异。
单一乳酸菌L. p发酵的处理组在整个发酵过程中检出总肽含量基本呈现出上升的趋势,与L. p极强的环境适应能力和蛋白酶分泌能力有关 [23]。在4 个发酵时期,L. p+L. s组合发酵的处理组和L. p+P. p组合发酵的处理组检出总肽含量均低于L. p单一菌种的发酵,其中L. s+L. p检出值均低于L. p+P. p。说明发酵牦牛肉灌肠过程中L. p与L. s、P. p在肽的生成作用中可能具有一定的拮抗作用,且与L. s的拮抗性强于P. p。
随发酵时间的延长,对照组、L. s、L. s+P. p、L. s+L. p+P. p检出总肽含量呈现出相似的趋势,即先下降后上升再略有下降。其中对照组的变化不大,与自然微生物较强的环境适应能力有关,从12~22 d总肽含量略有升高是因为牦牛肉灌肠利用环境与自身携带的微生物经过12 d的发酵,分解碳水化合物产酸,降低pH值,激活肌肉内源性蛋白酶,使其分解蛋白产生肽 [19]。L. s与其参与发酵L. s+P. p和L. s+L. p+P. p呈现出相似的变化,在发酵第2天、第22天均检出了较高的总肽含量,与L. s中含有大量的肽酶有直接的关系 [24]。在发酵第12天、第32天均检出较低的总肽含量,可能原因主要有3 个:1)由L. s从适宜的主发酵环境到自然环境的不适应引起;2)与环境中其他腐败微生物对肽的降解有关;3)低pH值加速了水分的蒸发,快速降低了样品的水分活度,造成了L. s的不良生存环境 [25]。但偏重程度不同,12 d的偏于前一个原因,32 d的主要由后两个原因引起。L. s+P. p从发酵第2天到第12天降低幅度小于L. s,从12~22 d范围增加幅度大于L. s,并在22 d检出的总肽含量显著高于由单一乳酸菌发酵L. s和P. p发酵的处理组,32 d检出值略小于由两个单一菌种发酵的处理组,L. s与P. p同时作用于发酵牦牛肉灌肠过程中对肽的生成可能具有一定的协同作用。
在发酵牦牛肉灌肠中,检出总肽含量先上升后下降再略有所上升的是P. p,从主发酵到自然风干发酵12 d含量上升,说明P. p具有一定的环境适应能力和蛋白的分解能力 [26]。随发酵时间的延长,牦牛肉灌肠水分活度的降低,可能是P. p适应低水分活度的环境能力较差,加之,肽类自身的易消耗性,导致了从12~22 d急剧的下降。
在3 株乳酸菌发酵牦牛肉灌肠过程中,发酵菌种和发酵时间均是影响灌肠中总肽含量变化的显著性因素,主要通过分泌蛋白酶或降低pH值激活组织蛋白酶使肌肉蛋白降解成肽。Fadda等 [27]采用超滤、RP-HPLC、基质辅助激光解吸电离飞行时间质谱测序等技术,对市场品质优良的5 种阿根廷干发酵肠中的水解酶体系进行了研究,结果发现,酶解后的氨基酸组成极其复杂,间接反映出了水解体系的复杂性,所以乳酸菌酶系对发酵肉制品蛋白降解的具体作用机制尚不明确,有待于进一步的研究。
乳酸菌发酵剂菌种、发酵时间对发酵牦牛肉灌肠过程中肽的变化规律均有显著影响。随着发酵时间的延长,发酵牦牛肉灌肠中的肽发生了明显的变化,相对极性较弱的肽减小了,相对极性较强的肽集中在保留时间为1~5 min。在32 ℃条件下发酵2 d后,L. s发酵处理组中检出了最大的总肽含量,且其参与发酵的L. s+P. p和L. s+L. p+P. p组合中检出总肽含量的变化趋势与单一L. s发酵处理组相似,L. s是牦牛肉灌肠中快速生成肽的良好发酵剂;在4 个发酵时期,L. p+L. s组合发酵处理组检出的总肽含量均小于单一L. p与L. s发酵处理组,L. p与L. s在同时作用于发酵牦牛肉灌肠中肽的生成作用中,两者之间具有一定的拮抗作用;L. s与P. p组合在降解牦牛肉蛋白生成肽的整个发酵过程中,产生较多的肽,也能迅速降低发酵牦牛肉灌肠pH值,保证产品的安全性,为开发生产高营养、安全性能好等优质牦牛肉制品提供了新技术方案。
参考文献:
[1] 万红玲, 雒林通, 吴建平. 牦牛肉品质特性研究进展[J]. 畜牧兽医杂志, 2012, 31(1): 36-40.
[2] 李平兰, 王成涛. 发酵食品安全生产与品质控制[M]. 北京: 化学工业出版社, 2005: 50-55.
[3] 刘晓蓉, 邓毛程, 连晓蔚. 腌肉中乳酸菌的分离选育[J]. 中国酿造, 2009, 28(1): 46-48.
[4] 何煜波. 乳杆菌属发酵过程中变化的研究[J]. 肉类工业, 2002(5): 23-28.
[5] 许慧卿, 蒋云升, 王畏畏, 等. 米酒乳杆菌对风鸭肌肉蛋白质降解的影响[J]. 食品与发酵工业, 2008, 34(2): 145-148.
[6] 徐幸莲, 徐为民, 周光宏, 等. 植物乳杆菌6003对肌肉蛋白质的分解能力(Ⅰ)[J]. 食品科学, 2003, 24(2): 56-61.
[7] RIZZELLO C G, NIONELLI L, CODA R, et al. Synthesis of the cancer preventive peptide lunasin by lactic acid bacteria during sourdough fermentation[J]. Nutrition & Cancer, 2012, 64(1)∶ 111-120.
[8] 吴少辉, 张成桂, 刘光明. 高效液相色谱法在蛋白质分离检测中的应用[J]. 畜牧与饲料科学, 2011, 32(8): 63-65.
[9] HERN☒NDEZ-LEDESMA B, HSIEH C C, de LUMEN B O. Lunasin, a novel seed peptide for cancer prevention[J]. Peptides, 2009, 30(2)∶426-430.
[10] CAVAZOS A, de MEJIA E G. Identification of bioactive peptides from cereal Storage proteins and their potential role in prevention of chronic diseases[J]. Comprehensive Reviews in Food Science and Food Safety, 2013, 12(4)∶ 364-380.
[11] PINS J J, KEENAN J M. Effects of whey peptides on cardiovascular disease risk factors[J]. The Journal of Clinical Hypertension, 2006, 8(11)∶ 775-782.
[12] GIESSEN T W, MARAHIEL M A. Ribosome-independent biosynthesis of biologically active peptides∶ application of synthetic biology to generate structural diversity[J]. FEBS Letters, 2012, 586(15)∶ 2065-2075.
[13] 蒋云升, 汪志君, 于海, 等. 如式香肠用发酵剂多菌种混培养技术的研究[J]. 食品科学, 2008, 29(8): 410-413.
[14] 王永霞, 牛天贵. 肉品混合发酵剂的筛选及应用研究[J]. 食品科技, 2004, 29(8): 34-38.
[15] SILVINA F, YOLANDA S, GRACIELA V, et al. Hydrolysis of pork muscle sarcoplasmic proteins by lactobacillus curvatus and lactobacillus sake[J]. Applied and Environmental Microbiology, 1999, 65(2): 578-584.
[16] MOYA V J, FLORES M, ARISTOY M C, et al. Evolution of hydrophobic polypeptides during the ageing of exudative and nonexudative pork meat[J]. Meat Science, 2001, 57(4): 395-401.
[17] FADDA S, SANZ Y, VIGNOLO G, et al. Characterization of muscle sarcoplasmic and myofibrillar protein hydrolysis caused by Lactobacillus plantarum[J]. Applied and Environmental Microbiology, 1999, 65(8): 3540-3546.
[18] 陈倩, 韩齐, 孔保华, 等. 乳酸菌对发酵肉制品中肌肉蛋白降解作用的研究进展[J]. 食品科学, 2014, 35(9): 279-284. doi: 10.7506/ spkx1002-6630-201409055.
[19] 陆应林, 周光宏, 徐幸莲, 等. 南京板鸭加工过程中肌肉蛋白降解的研究[J]. 食品科学, 2006, 27(7): 44-47.
[20] 陆应林. 南京板鸭加工过程中蛋白降解及风味物质的研究[D]. 南京: 南京农业大学, 2012.
[21] 白风翎, 张柏林, 赵宏飞. 乳酸菌蛋白代谢研究进展[J]. 食品科学, 2010, 31(19): 381-384.
[22] SAVIJOKI K, INGMER H, VARMANEN P. Proteolytic systems of lactic acid bacteria[J]. Applied Microbiology and Biotechnology, 2006, 71(4)∶ 394-406.
[23] 陈臣, 任婧, 周方方, 等. 植物乳杆菌的比较基因组学研究[J]. 中国生物工程杂志, 2013, 33(12): 35-44.
[24] MOLLY K, DEMEYER D, JOHANSSON G, et al. The importance of meat enzymes in ripening and fl avour generation in dry fermented sausages. First results of a European project[J]. Food Chemistry, 1997, 59(4): 539-545.
[25] 谢爱英, 张富新, 陈颖. 发酵香肠的pH值、水分含量与水分活度(A w)的关系及其对制品贮藏性的影响[J]. 食品与发酵工业, 2004, 30(11): 143-146.
[26] 戴梦婕, 许艳顺, 姜启兴, 等. 戊糖片球菌产蛋白酶对发酵 鲢鱼鱼糜凝胶性能的影响[J]. 食品与发酵工业, 2014, 40(6): 17-21.
[27] FADDA S, LÓPEZ C, VIGNOLO G. Role of lactic acid bacteria during meat conditioning and fermentation peptides generated as sensorial and hygienic biomarkers[J]. Meat Science, 2010, 86(1): 66-79.
Effects of Three Strains of Lactic Acid Bacteria and Their Combinations on the Peptide Changes in Fermented Yak Meat Sausage
BAI Juhong, TANG Shanhu*
, LI Sining, WANG Liu, LU Fuqing, YAN Liguo
(College of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, China)
Abstract:This study has explored the effects of different starter cultures including three strains of lactic acid bacteria and their combinations on the peptide changes of fermented yak meat sausage. Lactobacillus sake( L. s), Lactobacillus plantarum( L. p), Pediococcus pentosaceus( P. p) and their combination were artifi cially inoculated for the fermentation of yak meat sausage. pH values were determined at intervals of 24 hours. Samples were collected after 2 days of primary fermentation (32 ℃) and after 10, 20, and 30 days of natural air-dry fermentation. Peptide content of yak meat sausages was analyzed by reversed phase high performance liquid chromatography (RP-HPLC). The results showed that all different lactic acid bacteria and their combinations except P. pand L. p+ P. phad signifi cant effects on the peptide contents of yak meat sausage after 2 days of primary fermentation and after 10, 20, and 30 days of natural air dry fermentation ( P< 0.05). The highest peptide contents of 1.73 × 10 5, 1.62 × 10 5, 1.81 × 10 5and 1.83 × 10 5mAU·s in yak meat sausages fermented with L. s, P. p, control (no starter culture) and L. p,respectively, were detected at the above four fermentation times sequentially. With the extension of fermentation time, notable changes were observed in the peptide content of fermented yak meat sausage. The content of peptides with relatively weak polarity was reduced, whereas peptides with relatively strong polarity largely remained unchanged. At the end of primary fermentation, the L.sgroup showed the maximum total peptide content, and the changes in the total peptide contents of the L. s, L. s+P. p, L. s + L. p + P. pgroups presented similar trends. L. sfermentation was able to quickly generate peptides in yak meat sausage. At the four fermentation periods, the peptide content of the L. p+L. sgroup were lower than that of the single strain groups, and L. p + L. seven showed inhibition on the production of peptides in yak meat sausage. L. sand P. pdemonstrated no observable differences in peptide production, but could quickly reduce the pH value, ensuring the safety of the product. These results may provide useful information for the commercial production of yak meat sausage with high quality.
Key words: lactic acid bacteria; fermentation; yak meat sausage; peptides; reversed phase high perf ormance liquid chromatography (RP-HPLC)
中图分类号:TS251.1
文献标志码:A
文章编号:
doi:10.7506/spkx1002-6630-201517035
收稿日期:2014-11-26
基金项目:西南民族大学2014年研究生“创新型科研项目”硕士重点项目(CX2014SZ83);四川省科技支撑计划项目(2014NZ0052)
作者简介:白菊红(1989—),女,硕士研究生,研究方向为畜产品加工与安全。E-mail:18215526804@163.com
*通信作者:唐善虎(1964—),男,教授,博士,研究方向为食品科学与工程。E-mail:stang01@126.com