
韩晓鹏 1,牟德华 1,赵英莲 1,李 艳 1,2,*
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.河北省发酵工程技术研究中心,河北 石家庄 050018)
摘 要:目的:以冀紫薯1号为原料,采用酶解淀粉与酵母菌酒精发酵相结合,制得感官色泽酷似红葡萄酒的紫甘薯红酒。方法:通过正交试验优化淀粉液化、糖化和发酵的工艺条件,气相色谱-质谱联用技术分析检测紫甘薯红酒的香气成分,高效液相色谱技术分析检测氨基酸和有机酸含量。结果:当料液比为1 ∶3( m/V),淀粉酶添加量3 U/g,92 ℃液化60 min,再加入糖化酶300 U/g,控制50 ℃、pH 4.5、糖化60 min,淀粉水解率达92%。在紫甘薯汁中接入2×10 6个/mL安琪活性干酵母菌,于23 ℃、pH 4.0,发酵7 d,酒精体积分数12.4%。紫甘薯红酒中含有46 种香气物质、17 种氨基酸和9 种有机酸,花色苷含量为145 mg/L。结论:冀紫薯1号所酿造的紫甘薯红酒风味独特、营养物质齐全,具有开发价值。
关键词:紫甘薯红酒;工艺优化;成分分析
紫甘薯又称黑薯,薯肉呈现紫色或者深紫色,为甘薯类植物 [1]。目前,在我国河北、江苏、山东等省乃至全国已普遍种植。与普通的红薯相比,紫甘薯营养更加丰富,尤其是花色苷含量远高于其他品种。而花色苷是迄今为止科学界发现的对人类健康最有效、最直接、最安全的自由基清除剂 [2]。紫甘薯酒因保留了原料中的花色苷,因而受到消费者喜爱。
紫甘薯因淀粉含量较高,酿酒工艺不同于果蔬原料,在接种酵母发酵前需要对淀粉进行水解将其分解为可发酵糖类 [3]。杨雅利等 [4]以四川达州的紫甘薯为原料,研究了淀粉水解条件,应用微生物发酵技术,获得了酒精体积分数为10%左右的一种新型紫薯发酵酒;张明 [5]以湖南娄底的川山紫甘薯粉为原料酿造出酒精体积分数13.0%的紫甘薯酒,并对紫甘薯酒的抗氧化性做了研究;潘年龙 [6]等酿造出紫甘薯酒并检测出35 种香气物质;Duvernay等 [7]研究了将紫甘薯淀粉水解后发酵产酒精的条件;洪秀景 [8]研究了不同酵母种类对紫甘薯酒发酵的影响。本实验利用新鲜紫甘薯原料,对淀粉液化、糖化、发酵和成品特征成分检测进行系统研究报道,产品色泽酷似红葡萄酒、香气和风味独特。
本实验以河北省农业科学院培育的紫甘薯品种冀紫薯1号为原料,采用酶水解淀粉技术和酵母菌酒精发酵技术相结合,优化紫甘薯红酒生产工艺,酿造出酷似红葡萄酒色泽,酒精体积分数12%的紫甘薯发酵红酒,并对成品酒进行了香气物质、氨基酸、有机酸和花色苷含量的分析检测,为冀紫甘薯1号的工业应用奠定基础。
1.1 材料
冀紫薯1号(水分含量67.2%、淀粉含量20.5%、还原糖含量5.0%、蛋白质含量3.63%、花色苷含量0.95%),由河北省农业科学院提供。
1.2 试剂与仪器
α-淀粉酶(1 800 U/g,地衣芽孢杆菌发酵产)、糖化酶(10 000 U/g,黑曲霉发酵产)由统万珍极食品有限公司提供;市售商用活性干酵母:安琪、BM45、F15,蔗糖及理化指标检测试剂(分析纯),气相、液相用试剂(色谱纯)。
7820-5975C气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)联用仪(配有HP-5MS毛细管色谱柱(30 m×0.25 mm,0.25 μm)) 美国安捷伦公司;LC-20A高效液相色谱仪(high performance liquid chromatography,HPLC) 日本岛津公司;DIKMA Platisil ODS C 18(4.6 mm×250 mm,5 μm)色谱柱迪马科技有限公司;DK-98-1型恒温水浴锅 巩义市英峪予华仪器厂;DELTA 320型pH计 梅特勒-托利多仪器(上海)有限公司;SW-GJ-1BU型洁净工作台 苏净集团苏州安泰空气技术有限公司;DH3600AB型恒温培养箱 天津泰斯特仪器有限公司。
1.3 工艺流程
新鲜紫甘薯清洗→切片(8~10 mm厚)蒸煮30 min→加水打浆→淀粉液化→调节pH值后淀粉糖化→接种发酵→发酵结束后过滤除渣→原酒→陈酿→成品酒
1.4 方法
1.4.1 紫甘薯淀粉液化条件研究
1.4.1.1 液化条件单因素优化试验
选择料液比、α-淀粉酶添加量、液化时间、液化温度作为影响因素,进行单因素试验。考察料液比的影响:m(紫甘薯) ∶m(水)=1 ∶2、1 ∶3、1 ∶4,加酶量2 U/g、80 ℃、液化60 min;考察α-淀粉酶添加量的影响:选择最佳料液比,α-淀粉酶添加量分别为1、2、3、 4 U/g、80 ℃、液化60 min;考察液化时间的影响:最佳料液比和加酶量,80 ℃、液化时间分别为30、60、90 min;考察液化温度的影响:在上述最优单因素试验基础上,液化温度选择为68、80、92 ℃。以液化后还原糖含量为指标确定淀粉水解率 [8]。

1.4.1.2 液化条件正交试验优化
在1.4.1.1节的基础上考虑各个因素的交互影响,设计四因素三水平的正交试验,以液化后还原糖含量为指标确定淀粉水解率 [9-10]。
1.4.2 紫甘薯淀粉糖化条件研究
1.4.2.1 糖化条件单因素试验
在1.4.1节最优条件基础上,选择pH值、糖化温度、糖化酶添加量、糖化时间为影响因素,进行单因素试验,1)pH值为3.5、4.5、5.5,糖化温度50 ℃、加酶量200 U/g、糖化时间60 min;2)最优pH值,选择糖化温度为35、50、65 ℃,加酶量200 U/g,糖化时间60 min;3)最优pH值和糖化温度,糖化酶添加量选择200、300、400、500 U/g,糖化时间60 min;4)前面最优条件的基础上,糖化时间30、60、90 min,以糖化液中还原糖含量为指标确定最终淀粉水解率 ,计算见公式(1)。
1.4.2.2 糖化条件正交试验优化
在1.4.2.1节的单因素试验基础上,考虑各个因素间的交互作用,设计四因素三水平的正交试验,以糖化液中还原糖含量为指标确定最终淀粉水解率 [11] 计算见公式(1)。
1.4.3 紫甘薯酒发酵条件研究
选择发酵温度、发酵液pH值、酵母菌品种和接种量为影响因素,发酵液接种前补糖至220 g/L,以最终产酒精体积分数为指标,进行四因素三水平正交试验,优化紫甘薯红酒的发酵工艺条件。
1.4.4 紫甘薯酒成分分析
1.4.4.1 紫甘薯红酒的香气成分测定
对酒样进行正戊烷液液萃取,V(酒样):V(正戊烷)=1 ∶1,重复3 次萃取,合并后浓缩10 倍待测。采用GC-MS法测定紫甘薯红酒的香气物质 [12-14]。气相条件:载气为氦气(99.999%),柱流速1.0 mL/min;初始温度40 ℃,保持12 min;以3 ℃/min升至108 ℃,保持2 min;再以5 ℃/min升至250 ℃,保持5 min。进样量1.0 μL,采用分流进样,分流比50 ∶1,进样口温度250 ℃。质谱条件:离子源温度230 ℃;电离方式EI,电子能量70 eV,扫描质量范围45~550 amu,检索谱库为NIST质谱数据库,溶剂延迟1 min。
1.4.4.2 紫甘薯红酒游离氨基酸的测定
采用2,4-二硝基氟苯进行柱前衍生,HPLC检测紫甘薯红酒中的游离氨基酸。色谱条件为:流动相A为40 mmol/L的乙酸钠水溶液(pH 6.20),流动相B为乙腈-水溶液(1 ∶1,V/V),流速1.0 mL/min,检测波长360 nm,进样量20 μL,柱温26 ℃ [15-16]。
1.4.4.3 紫甘薯红酒中有机酸的检测
采用HPLC测定紫甘薯红酒中的有机酸。色谱条件为:流动相A ∶20 mmol/L磷酸氢二铵,流动相B:乙腈,其体积比98 ∶2,流速0.5 mL/min,检测波长213 nm,进样量20 μL,柱温30 ℃ [17-19]。
1.4.4.4 紫甘薯红酒中花色苷总量的测定
紫甘薯红酒中的花色苷总量用pH示差法测定 [20-21]。吸取样品2 mL,加入48 mL pH 1.0的缓冲溶液,避光放置15 min,在530 nm和700 nm波长处测定吸光度。根据以下公式计算花色苷总量。
其中,A=(A 530 nm-A 700 nm) pH1.0-(A 530 nm-A 700 nm) pH4.5(3)
式中:M w为449.2 g/mol,3-葡萄糖苷-矢车菊色素的分子质量;ε为摩尔消光系数/(L/(mol·cm)),取26 900。
1.4.4.5 紫甘薯酒感官评价
挑选从事果酒领域工作者8 名,参照GB/T 15038—2006《葡萄酒、果酒通用的分析方法》进行紫甘薯酒的感官评定。
1.5 数据处理
实验中的理化指标的检测包括淀粉、酒精体积分数的测定分别按照GB/T 5009.9—2008《食品中淀粉的测定》、GB/T 15038—2006进行。色谱分析采用仪器自带Waters-Empower软件。所有线性方程、重复性和准确性实验的数据均由Excel 2010计算得出。样品处理的数据及结果分析采用Origin V8.0。正交试验数据采用Minitable进行方差分析。所有实验进行3 组平行。
2.1 紫甘薯淀粉液化条件的研究
2.1.1 液化条件单因素试验研究
各种单因素对紫甘薯淀粉水解率的影响结果见图1。料液比直接影响酶与底物的浓度关系,料液比小,酶与底物即使能够充分接触,但体系的黏度大也妨碍反应的进行;料液比过大,体系黏度降低,但也降低了酶与底物接触的概率,当料液比为1 ∶3时,淀粉水解率最大(图1A)。随着温度升高,水解反应速率越快,淀粉的水解率增加,考虑能源消耗及设备维护,选择液化温度92 ℃(图1B)。随着加酶量的增加,水解效果增加,当酶浓度达到一定量水解效果将趋近于最大值,当加酶量达到3 U/g时水解效果与4 U/g相差不大,所以选择加酶量为3 U/g(图1C)。随着水解时间延长,淀粉水解率增加,在液化时间60 min时,水解率达到最大(图1D)。α-淀粉酶主要水解α-1,4-糖苷键,只能缓慢水解α-1,6-糖苷键。随着水解程度的加深,α-1,4-糖苷键减少,剩余α-1,6-糖苷键水解变得缓慢 [5],与此同时不断积累的酶解产物会抑制酶的活性,使淀粉的水解率逐渐变慢。
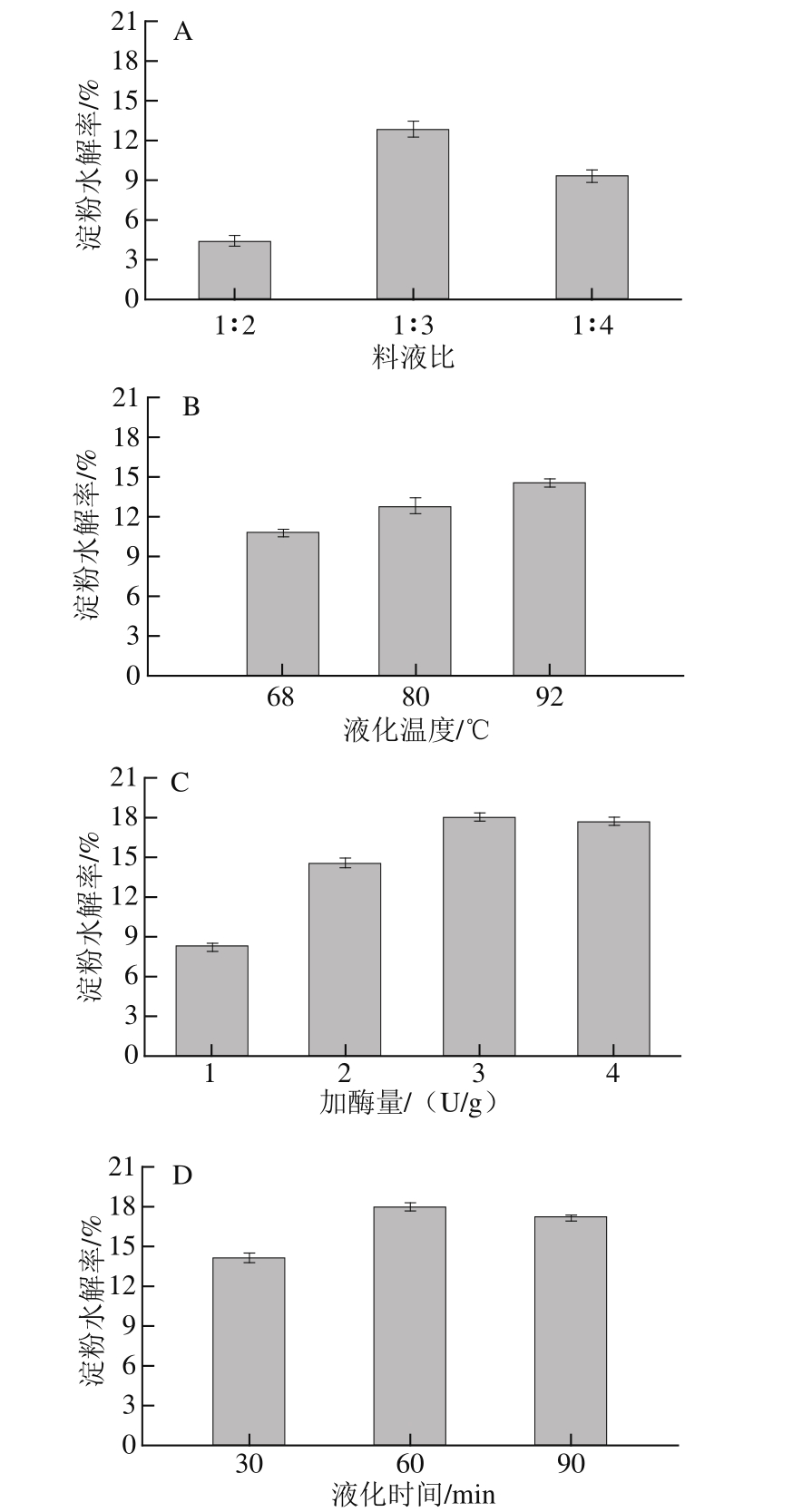
图1 料液比(A)、液化温度(B)、加酶量(C)、液化时间(D)对紫甘薯淀粉水解率的影响
Fig.1 Effects of solid/solvent ratio (A), temperature (B), amylase concentration (C) and liquefaction time (D) on the hydrolysis efficiency of starch
2.1.2 液化正交试验结果
表1是液化正交试验的结果及分析,由极差分析4 个因素对淀粉液化效果影响程度的大小为A>B>D>C,由方差分析(表2)可以看出料液比、液化温度、液化时间都对淀粉水解率有显著性影响。其中以第6组淀粉水解效果最好,最终淀粉水解率为18%。由均值可以得出最优水平组合为A 2B 3C 2D 2。即料液比1 ∶3、液化温度92 ℃、加酶量3 U/g、液化时间60 min,最优组合没有出现在正交表中,重复最优组合最终淀粉水解率为19%。
表1 紫甘薯淀粉液化正交试验结果
Table1 Orthogonal experimental results for the optimization of liquefaction conditions

试验号A料液比B液化温度/℃C加酶量/(U/g)D液化时间/min Y淀粉水解率/% 11(1∶2)1(68)1(2)1(30)2 2 12(80)2(3)2(60)7 3 13(92)3(4)3(90)5 42(1∶3)12314 5 2 2 3 1 17 6 2 3 1 2 18 73(1∶4)1328 8 3 2 1 3 7 9 3 3 2 110 k 14.6678.0009.0009.667 k 216.33310.33310.33311.000 k 38.33311.00010.0008.667 R11.6663.0001.3332.333最优组合A 2B 3C 2D 2
表2 紫甘薯淀粉液化正交试验结果方差分析
Table2 Analysis of variance (ANOVA) for liquefaction conditions

变异来源平方和自由度均方FP A料液比427.1112213.556240.250.000 B液化温度29.778214.88916.750.001 C加酶量5.77822.8893.250.087 D液化时间16.44428.2229.250.007总和479.1118
2.2 紫甘薯淀粉糖化条件的优化
2.2.1 糖化条件单因素试验结果
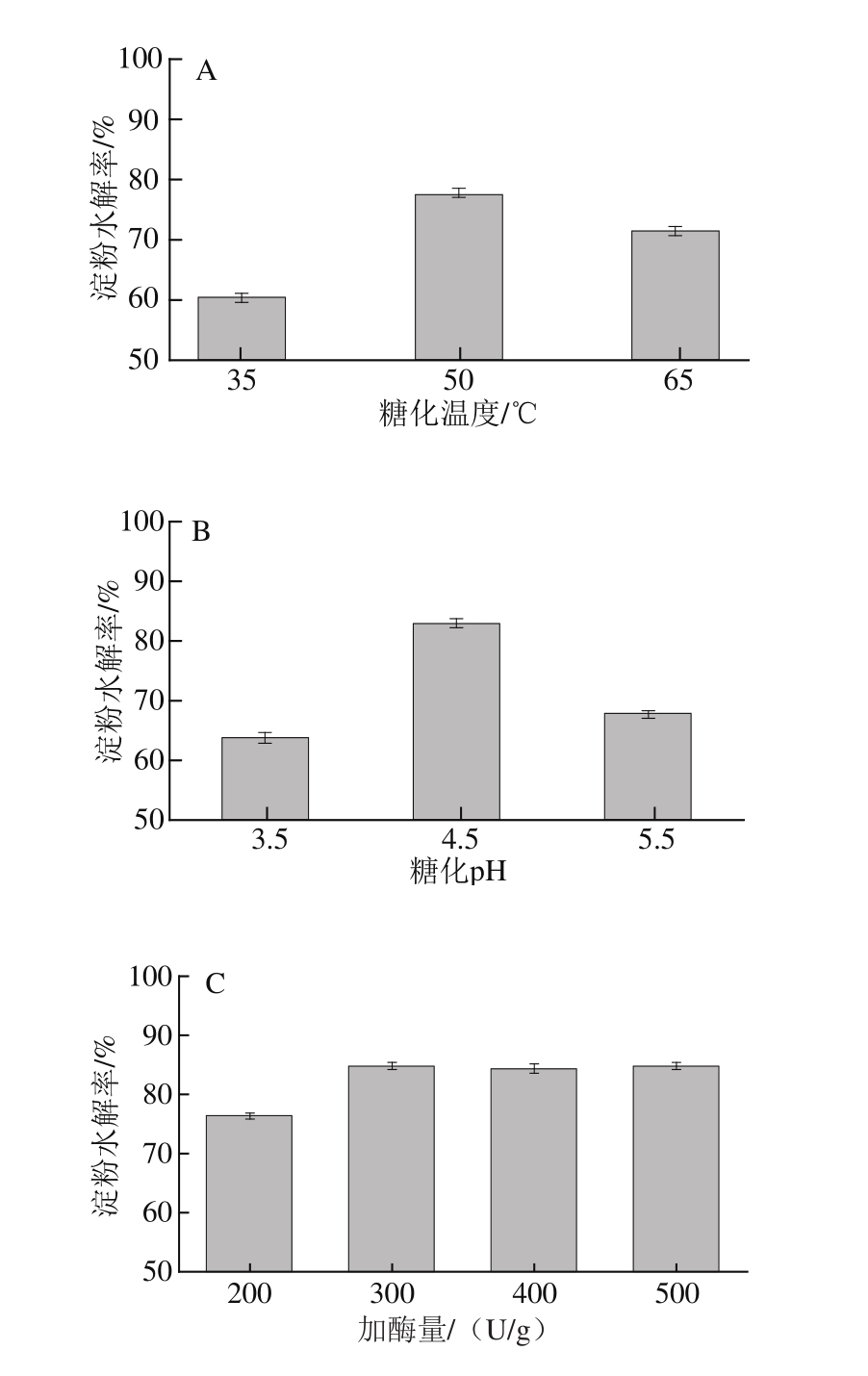
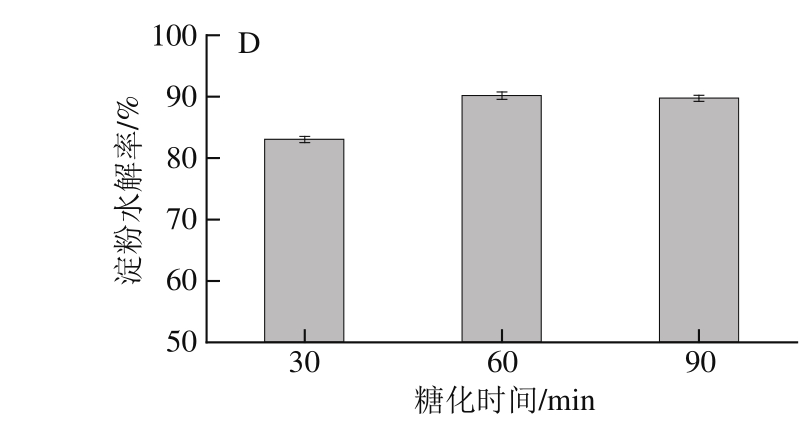
图2 糖化温度(A)、pH值(B)、加酶量(C)和糖化时间(D)对紫甘薯淀粉水解率的影响
Fig.2 Effects of solid/solvent ratio (A), temperature (B), amylase amount (C) and saccharification time (D) on the hydrolysis efficiency of gltcation
糖化条件单因素试验结果见图2。温度影响糖化效果,随着温度升高,反映的活化能降低,糖化效果提高,但是温度太高会抑制酶活性甚至使酶失活。由图2可知,35 ℃条件下糖化效果最差只达到60%,而当温度达到50 ℃时水解效果显著提高达77%,65 ℃时水解率下降。pH值过高或者过低都会抑制酶活性,pH值为4.5时糖化效果明显优于pH 3.5和pH 5.5,达到83%。加酶量影响酶与底物的关系,酶浓度达到一定值时,酶促反应达到饱和,反应速率不会随着酶浓度的增加而增加,加酶量实验结果表明加酶量由200 U/g增加至300 U/g时,水解率增加8.5%,但加酶量超过300 U/g,水解率不会再有明显增加,故加酶量定为300 U/g。水解随着时间的推移底物浓度降低,反应速率明显下降,水解率亦会保持不变,当水解时间为60 min时水解率基本达到最大为90%,超过60 min水解率没有明显变化。
2.2.2 糖化条件正交试验结果
表3 紫甘薯淀粉糖化条件正交试验结果分析
Table3 Orthogonal experimental results for the optimization of saccharification conditions
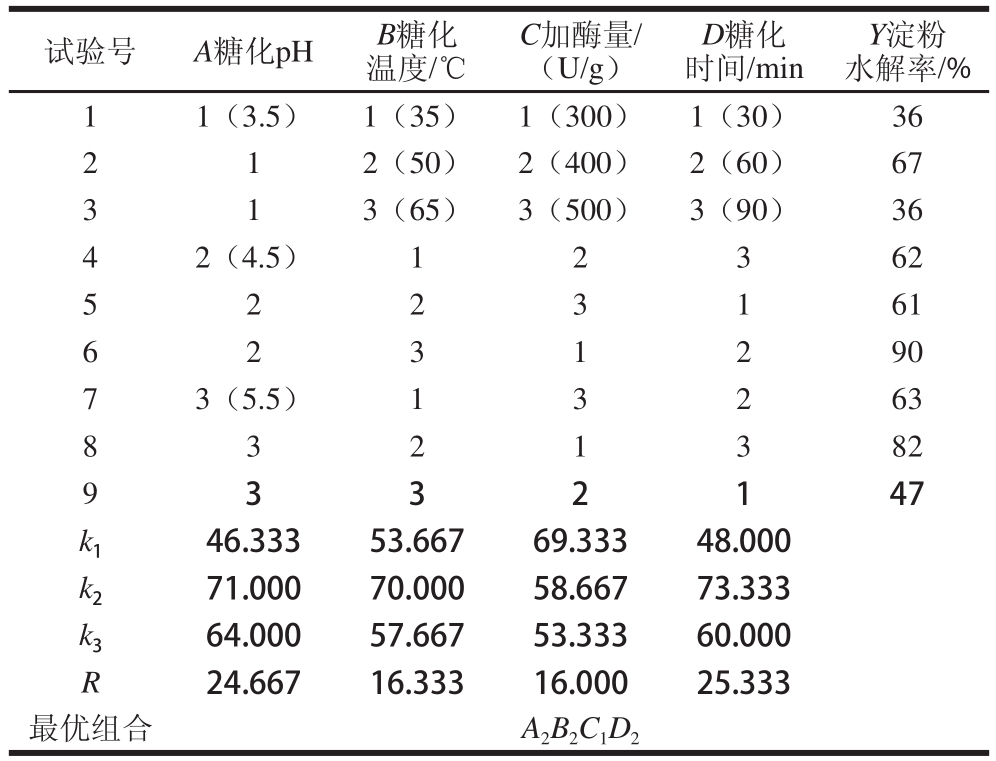
试验号A糖化pHB糖化温度/℃C加酶量/(U/g)D糖化时间/min Y淀粉水解率/% 11(3.5)1(35)1(300)1(30)36 2 12(50)2(400)2(60)67 3 13(65)3(500)3(90)36 42(4.5)12362 5 2 2 3 1 61 6 2 3 1 290 73(5.5)13263 8 3 2 1 3 82 9 3 3 2 147 k 146.33353.66769.33348.000 k 271.00070.00058.66773.333 k 364.00057.66753.33360.000 R24.66716.33316.00025.333最优组合A 2B 2C 1D 2
糖化条件正交试验结果及分析见表3。由极差分析4 个因素对紫甘薯淀粉糖化效果的影响程度大小依次为D>A>B>C,得出最优组合为A 2B 2C 1D 2。由方差分析(表4)可知,4 个因素水解效率均有很显著影响。正交表中以第6组的糖化效果最好,淀粉水解率可达90%,因加酶量为边值,所以重复实验中条件为pH 4.5、糖化温度50 ℃、糖化酶添加量200 U/g、糖化时间60 min,最终淀粉水解率为70%。以A 2B 2C 1D 2为试验优化后的最佳条件,最终淀粉水解率为92%。
表4 紫甘薯淀粉糖化条件正交试验结果方差分析
Table4 Analysis of variance (ANOVA) for saccharification conditions

变异来源平方和自由度均方FP A糖化pH1 939.112969.56198.320 B糖化温度869.782434.8988.950 C加酶量796.442398.2281.450 D糖化时间1 927.112963.56197.090总和5 532.448
2.3 紫甘薯发酵条件的确定
表5 紫甘薯酒发酵条件正交试验结果分析
Table5 Orthogonal experimental results for the optimization of fermentation conditions
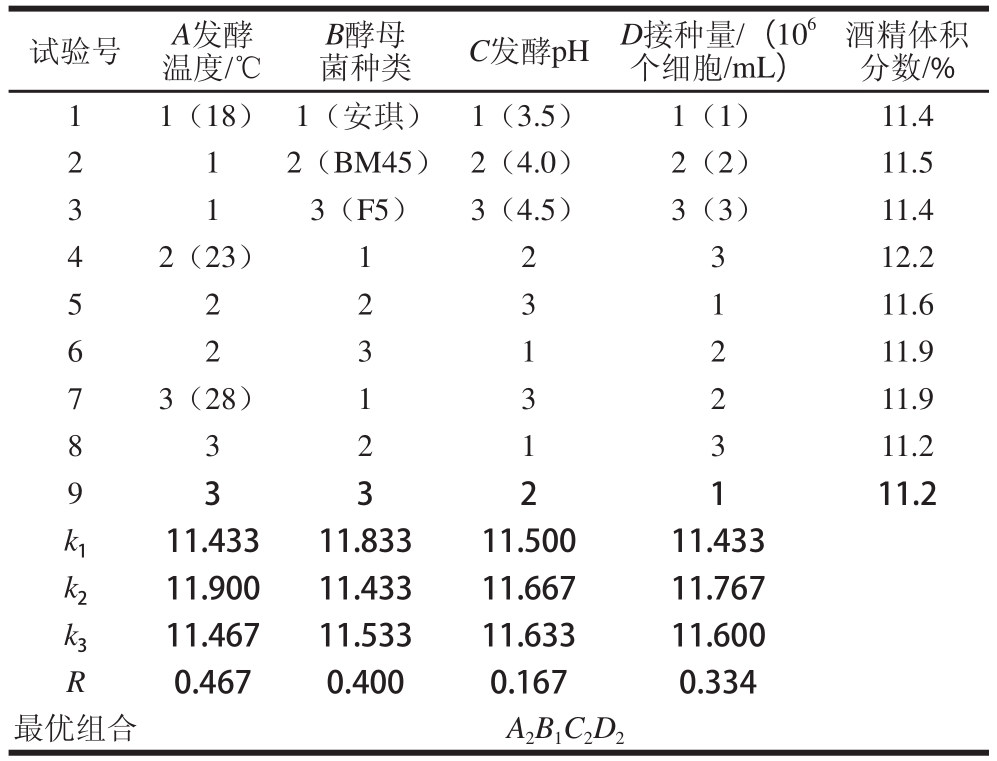
试验号A发酵温度/℃B酵母菌种类C发酵pHD接种量/(10 6个细胞/mL)酒精体积分数/% 11(18)1(安琪)1(3.5)1(1)11.4 212(BM45)2(4.0)2(2)11.5 313(F5)3(4.5)3(3)11.4 42(23)12312.2 5223111.6 6231211.9 73(28)13211.9 8321311.2 9332111.2 k 111.43311.83311.50011.433 k 211.90011.43311.66711.767 k 311.46711.53311.63311.600 R0.4670.4000.1670.334最优组合A 2B 1C 2D 2
表6 紫甘薯酒发酵条件正交试验结果方差分析
Table6 Analysis of variance (ANOVA) for fermentation conditions

变异来源平方和自由度均方FP A发酵温度0.813 3320.406 6714.080.002 B酵母菌种类0.5220.269.000.007 C发酵pH0.093 3320.046 671.620.252 D接种量0.333 320.166 675.770.024总和1.760 08
紫甘薯酒发酵优化试验结果及分析见表5。由极差分析对紫甘薯酒发酵酒精体积分数的影响程度大小为A>B>D>C,均值分析最优水平组合为A 2B 1C 2D 2,由方差分析(表6),4 个因素中温度和菌种对酒精体积分数有极显著影响,接种量具有显著影响,pH值不是显著影响因素。按照分析得最优组合重复验证实验最终酒精体积分数为12.4%。温度为影响发酵的主要因素,当温度较低时,接种酵母后启动延滞期较长,发酵周期亦长。温度较高时延滞期较短,发酵周期也短。当温度适中时,酒精体积分数最高。
2.4 紫甘薯红酒的成分分析
2.4.1 紫甘薯红酒香气成分分析
对紫甘薯红酒进行香气成分测定,共检测出46 种香气物质,结果见表7。按照峰面积归一化法定量香气物质,表中相对含量在0.1%以上的20 种香气成分,这些物质的含量之和占总香气物质量的99.18%。
表7 紫甘薯红酒中20 种主要的香气物质
Table7 Twenty main aroma components of purple sweet potato wine
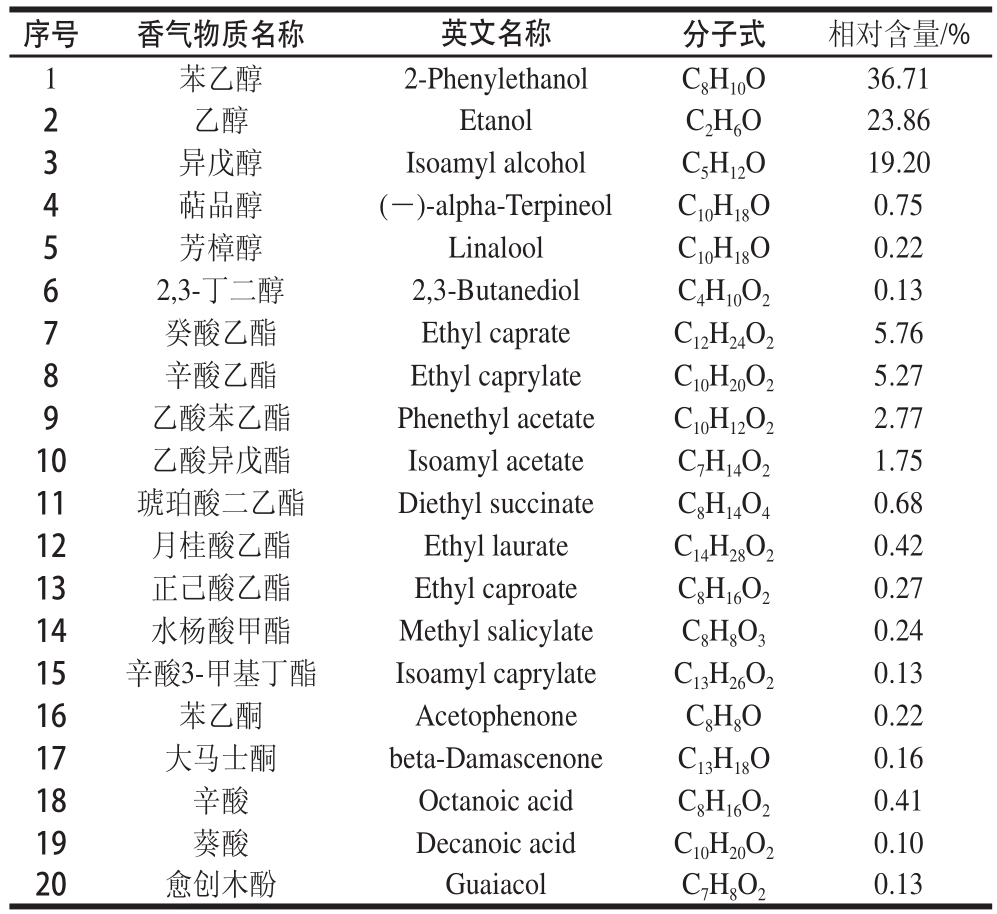
序号香气物质名称英文名称分子式相对含量/% 1苯乙醇2-PhenylethanolC 8H 10O36.71 2乙醇EtanolC 2H 6O23.86 3异戊醇Isoamyl alcoholC 5H 12O19.20 4萜品醇(-)-alpha-TerpineolC 10H 18O0.75 5芳樟醇LinaloolC 10H 18O0.22 62,3-丁二醇2,3-ButanediolC 4H 10O 20.13 7癸酸乙酯Ethyl caprateC 12H 24O 25.76 8辛酸乙酯Ethyl caprylateC 10H 20O 25.27 9乙酸苯乙酯Phenethyl acetateC 10H 12O 22.77 10乙酸异戊酯Isoamyl acetateC 7H 14O 21.75 11琥珀酸二乙酯Diethyl succinateC 8H 14O 40.68 12月桂酸乙酯Ethyl laurateC 14H 28O 20.42 13正己酸乙酯Ethyl caproateC 8H 16O 20.27 14水杨酸甲酯Methyl salicylateC 8H 8O 30.24 15辛酸3-甲基丁酯Isoamyl caprylateC 13H 26O 20.13 16苯乙酮AcetophenoneC 8H 8O0.22 17大马士酮beta-DamascenoneC 13H 18O0.16 18辛酸Octanoic acidC 8H 16O 20.41 19葵酸Decanoic acidC 10H 20O 20.10 20愈创木酚GuaiacolC 7H 8O 20.13
由表7可知,紫甘薯红酒样品中主要的香气物质是醇酯类物质,醇类和酯类物质分别占表中所列物质的81.54%和17.43%。其中醇类物质中以苯乙醇、乙醇和异戊醇为主。酯类物质中以癸酸乙酯、辛酸乙酯、乙酸苯乙酯和乙酸异戊酯为主。苯乙醇具有玫瑰香味,异戊醇具有苦杏仁和焦香味,癸酸乙酯具有水果味和适宜的醋味,辛酸乙酯具有酒香、奶香、果香和甜味 [22-23]。这些醇类和酯类物质赋予冀紫薯1号红酒独特的香气特征。
2.4.2 紫甘薯红酒中的游离氨基酸种类及相对含量
表8 紫甘薯酒中的氨基酸种类及相对含量
Table8 Amino acid composition of purple sweet potato wine
注:*.人体必需氨基酸。
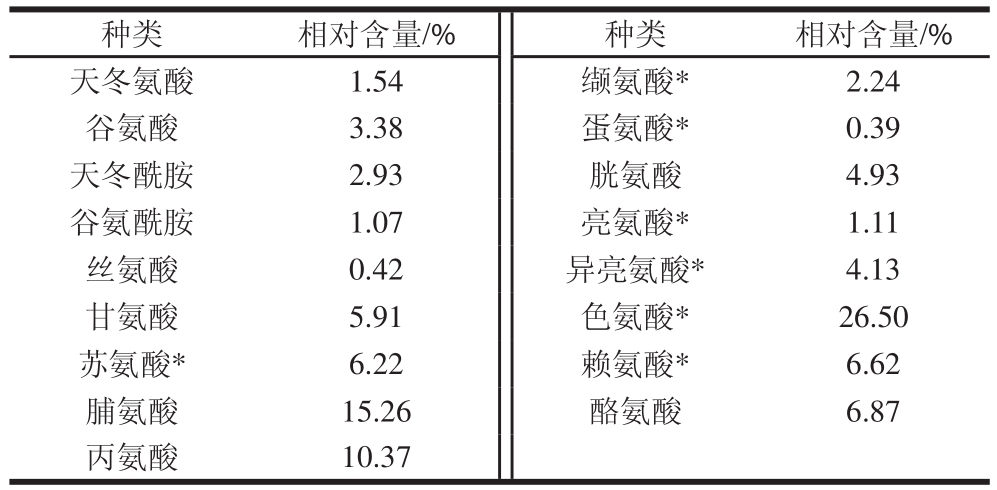
种类相对含量/%种类相对含量/%天冬氨酸1.54缬氨酸*2.24谷氨酸3.38蛋氨酸*0.39天冬酰胺2.93胱氨酸4.93谷氨酰胺1.07亮氨酸*1.11丝氨酸0.42异亮氨酸*4.13甘氨酸5.91色氨酸*26.50苏氨酸*6.22赖氨酸*6.62脯氨酸15.26酪氨酸6.87丙氨酸10.37
由表8可知,紫甘薯红酒中共检测出17 种游离氨基酸,含7 种人体必需氨基酸。必需氨基酸含量达到检出游离氨基酸总量的47.21%。色氨酸含量最高,达到游离氨基酸总量的26.5%。色氨酸具有改善睡眠和抗血压的功效 [24],可见这款紫甘薯红酒不仅具有较高的营养价值,还体现了一定的保健作用。
2.4.3 紫甘薯红酒中的有机酸种类及含量
紫甘薯红酒中有机酸含量的测定结果见表9。紫甘薯红酒中共检出9 种有机酸,以L-苹果酸、酒石酸和琥珀酸为主,占总有机酸含量的68.49%。
表9 紫甘薯酒中有机酸种类及含量Table9 Organic acid composition of purple sweet potato wine
有机酸种类草酸酒石酸丙酮酸L-苹果酸乳酸乙酸柠檬酸D-苹果酸琥珀酸含量/(mg/L)46.750 1 142.315 65.680 1 211.215 308.405 249.08 335.485498.575915.565
2.4.4 紫甘薯红酒中花色苷的含量
经测定,紫甘薯红酒中总花色苷含量达到(145±5)mg/L。
2.4.5 紫甘薯酒感官评定结果
紫甘薯酒经8 个有经验的品酒员进行品尝,结果得出(83.9±3.6)%。
本实验针对冀紫薯1号紫甘薯的工业应用,研究了以此为原料酿造色泽、酒精体积分数等酷似红葡萄酒的紫甘薯红酒。对酿酒过程中淀粉液化、糖化及发酵条件进行优化,可使糖对淀粉的最终总水解率达到92%,发酵产生12.2%酒精。检测出46 种香气物质,17 种游离氨基酸中包含7 种人体必需氨基酸,9 种有机酸以L-苹果酸和酒石酸为主,花色苷含量达到145 mg/L,花色苷为类黄酮物质,具有清除体内自由基、抗肿瘤、抗癌、抗炎、预防糖尿病、高血压、减肥、保护视力等功效 [21,25],从而增加了这款紫甘薯红酒的保健功效。充分体现了该酒的营养保健潜质。冀紫薯1号紫甘薯具有良好的工业开发价值和市场潜能。
参考文献:
[1] 白津榕. 紫薯产品的开发研究现状[J]. 食品工程, 2013(4): 17.
[2] 刘军伟, 胡志和. 紫薯功能及产品开发研究进展[J]. 食品研究与开发, 2012, 33(9): 231-235.
[3] 周苏果, 付湘晋. 紫薯酒发酵工艺研究[J]. 食品研究与开发, 2012, 33(11): 122-125.
[4] 杨雅利, 阚建全, 沈海亮, 等. 紫甘薯酒发酵工艺条件的优化[J]. 食品科学, 2012, 33(3): 157-162.
[5] 张明. 紫甘薯酒加工工艺以及抗氧化性研究[D]. 长沙: 湖南农业大学, 2011.
[6] 潘年龙, 王孝荣. 响应面法优化紫薯酒的发酵工艺及香气分析[J].食品工业科技, 2013, 34(6): 202-206.
[7] DUVERNAY W H, CHINN M S, YENCHO G C. Hydrolysis and fermentation of sweetpotatoes for production of fermentable sugars and ethanol[J]. Industrial Crops and Products, 2013, 42: 527-537.
[8] 洪秀景. 紫甘薯酒发酵工艺研究[D]. 雅安: 四川农业大学, 2013.
[9] TSUKUI A, MURAKAMI T, SHIINA R, et al. Effect of alcoholic fermentation on the st ability of purple sweet potato anthocyanins[J]. Food Science and Technolo gy Research, 2002, 8(1): 4-7.
[10] 罗仓学, 肖琼, 韩颖. 甘薯浓缩汁加工过程中营养成分变化的研究[J].食品科技, 2013, 38(2): 52-59.
[ 11] 吕晓玲, 张涛, 陈泽芳, 等. 酶解法生产紫甘薯汁的工艺优化[J]. 现代食品科技, 2011, 27(9): 1101-1104.
[12] 马斐. 淀粉型甘薯深加工技术[J]. 粮油食品, 2011(4): 28-30.
[13] KANG Wenhua, XU Yan, QIN Ling, et al. Effects of different β-D-glycosidases on bound aroma compounds in muscat grape determined by HS-SPME and GC-MS[J]. Journal of the Institute of Brewing, 2010, 116(1): 70-77.
[14] RODRÍGUEZ-BENCOMO J J, CABRERA-VALIDO H M, PÉREZTRUJILLO J P, et al. Bound aroma compounds of Gual and Listán blanco grape varieties and their infl uence in the elaborated wines[J]. Food Chemistry, 2011, 127(3): 1153-1162.
[15] NASI A, FERRANTI P, AMATO S, et al. Identification of free and bound vol atile compounds as typicalness and authenticity markers of non- aroma tic grapes and wines through a combined use of mass spectrometric techniques[J]. Food Chemistry, 2008, 110(3): 762-768.
[16] SOUFLEROS E H, BOULOUMPASI E, TSARCHOPOULOS C, et al. Primary amino acid profiles of Greek w hite wines and their use in classification according to variety, origin and vintage[J]. Food Chemistry, 2003, 80(2): 261-273.
[17] 唐涛. 氨基酸柱前衍生化HPLC方法发展及应用[D]. 南京: 南京理工大学, 2006.
[18] RODRIGUES C I, MARTA L, MAIA R, et al. Application of solid-phase extraction to brewed coffee caffeine and organic acid determination by UV/HPLC[J]. Journal of Food Composition and Analysis, 2007, 20(5): 440-448.
[19] SCHERER R, RYBKA A C P, BALLUS C A, et al. Validation of a HPLC method for simultaneous det ermination of main organic acids in fruits and juices[J]. Food Chemistry, 2012, 135(1): 150-154.
[20] MATO I, SUÁREZ-LUQUE S, HUIDOBRO J F. A review of the analytical methods to determine organic acids in grape juices and w ines[J]. Food Research International, 2005, 38(10): 1175-1188.
[21] FAN Gong jian, HAN Yongbin, GU Zhenxin. Composition and colour stability of anthocyanins extracted from fermented purple sweet potato culture[J]. LWT-Food Science and Technology, 2008, 41(8): 1412-1416.
[22] SAIGUSA N, KAWASHIM A N, OHBA R. Maintaining the anthocyanin content and improvement of the aroma of an alcoholic fermented beverage produced from raw purple-fl eshed sweet potato[J]. Food Science and Technology Research, 2007, 13(1): 23-27.
[23] 宋慧丽, 韩舜愈, 蒋玉梅, 等. 河西走廊地区赤霞珠干红葡萄酒中的香气成分分析[J]. 食品科学, 2004, 25(10): 257-260.
[24] 李剑欣, 张绪梅, 徐琪寿. 色氨酸的生理生化作用及其应用[J]. 氨基酸和生物资源, 2005, 27(3): 58-62.
[25] 倪勤学, 霍艳荣, 陆国权 . 花色苷保健功能的研究进展[J]. 安徽农业科学, 2010, 38(35): 20025-20028.
Optimization of Fermentation Conditions for Purple Sweet Potato Red Wine and Its Chemical Analysis
HAN Xiaopeng
1
, MOU Dehua
1
, ZHAO Yinglian
1
, LI Yan
1,2,*
(1. College of Bioscience and Bioengineering, Hebei University of Science and Technology, Shijiazhuang 050018, China; 2. R&D Center for Fermentation Engineering of Hebei Province, Shijiazhuang 050018, China)
Abstract:The tuber of purple sweet potato ( Ipomoea batatascultivar Jizishu No.1) was processed through combination of starch enzymatic hydrolysis and alcoholic yeast fermentation into a red wine similar in color to grape wine. The starch liquefaction and saccharifi cation as well as fermentation conditions were optimized using an orthogonal array design. The aroma components of the sweet potato wine were determined by gas chromatography-mass spectrometry (GC-MS) and the contents of amino acids and organic acids were detected by high performance liquid chromatography (HPLC). The maximum hydrolysis effi ciency of starch of 92% was obtained when the starch liquefaction was carried out at 92 ℃ for 60 min with 3 U/g of amylase at a material to water ratio of 1:3, followed by 60 min saccharifi cation at 50 ℃ and pH 4.5 with 300 U/g of glucomylase. The subsequent fermentation was performed for 7 days at 23 ℃ and pH 4.0 after inoculation with 2 × 10 6active dry yeast cells/mL, yielding an alcohol content of 12.4% ( V/ V). A total of 46 aroma components, 17 amino acids and 9 organic acids were identifi ed in the wine and it contained 145 mg/L anthocyanins. The purple potato red wine possesses a unique fl avor and various nutritional components and thus it has the potential for further development.
Key words:purple sweet potato red wine; process optimization; chemical analysis
中图分类号:TS262.7
文献标志码:A
文章编号:
doi:10.7506/spkx1002-6630-201517038
收稿日期:2014-10-16
基金项目:河北省科技支撑计划项目(12231009D)
作者简介:韩晓鹏(1990—),男,硕士研究生,研究方向为传统发酵工程创新技术。E-mail:625096834@qq.com
*通信作者:李艳(1958—),女,教授,学士,研究方向为传统发酵工程 创新技术。E-mail:lymdh5885@163.com