 表示,应用
SPSS 18.0软件进行数据处理。采用单因素方差分析(
analysis of variance,
ANOVA)和多重比较进行差异显著性分析,P<
0.05认为具有显著差异。
表示,应用
SPSS 18.0软件进行数据处理。采用单因素方差分析(
analysis of variance,
ANOVA)和多重比较进行差异显著性分析,P<
0.05认为具有显著差异。
唐明礼,王 勃,刘 贺,何余堂,惠丽娟,马 涛*
(渤海大学食品科学与工程学院,粮油科学与技术研究所,辽宁 锦州 121013)
摘 要:对煎饼发酵面糊中的优势菌种进行富集培养和划线分离,通过菌落形态、颜色、大小等进行初筛,通过生理生化实验、耐受性实验等进行复筛,采用VITEC-2 Compact微生物鉴定仪对其进行初步鉴定。结果表明:从煎饼发酵面糊中分离筛选得到的9 株乳酸菌和11 株酵母菌中,乳酸菌R 2 、R 8 和酵母菌Y 8 发酵性能良好,经鉴定R 2 为肠膜明串珠菌、R 8 为戊糖片球菌、Y 8 为酿酒酵母,可以作为煎饼专用复合发酵剂用菌。
关键词:煎饼面糊;乳酸菌;酵母菌;筛选;鉴定
煎饼是一种很受欢迎的全谷物制品,随着消费者健康意识的增强,一些流行病学研究发现全谷物中含有多种营养成分以及生物活性物质,如膳食纤维、维生素和矿物质等 [1] ,摄入全谷物食品也可预防癌症、心血管疾病、Ⅱ型糖尿病、肥胖等 [2] 。煎饼发酵面糊是由五谷杂粮研磨经过乳酸菌和酵母菌共同发酵而成,面糊中菌群的种类及数量会影响产品的质构、风味、老化、营养价值、货架期等 [3] 。煎饼的传统生产主要利用面糊及环境中的乳酸菌和酵母菌自然发酵进行摊制,但生产过程易受微生物二次污染、质量安全令人堪忧等问题将被煎饼专用复合发酵剂取代。
乳酸菌(lactic acid bacteria,LAB)通过产生乳酸、醋酸、乙醇、芳香化合物、细菌素、胞外多糖等来提高产品的货架寿命、微生物安全,改善产品的感官品质 [4-5]。 LAB也是重要的工业发酵剂,其蛋白水解系统能将蛋白质水解为氨基酸和小分子肽,这可促进其他微生物的生长及代谢,能增强风味物质的形成及改善面糊的流变学性质 [6-7],可应用在酸奶、奶酪、香肠、酸菜、酸面团等发酵食品的生产 [8]。酵母菌在发酵过程中能够产生二氧化碳及醇类、醛类、酯类和酮类等芳香族化合物 [9],使发酵产品具有良好的感官品质和独特的香味。发酵剂是传统产品的连续化、标准化生产的灵魂所在,可使地方特色产品区域化、全国化等。通过复合菌种制作的煎饼,不仅提高发酵时间、生产效率而且也提高了食用安全性。
传统表型方法如使用碳水化合物发酵的生化及形态特征对菌种的鉴定,具有较差的重现性及较低的分辨率 [10-11],快速、方便、可靠的鉴定技术势在必行。 VITEC-2 Compact微生物鉴定仪自动化程度高、检测时间短、准确度高等优点已成为大多数实验室鉴定菌株的有力工具 [12-13]。本实验主要内容是从自然发酵煎饼面糊中筛选优质乳酸菌和酵母菌,并使用 VITEC-2 Compact微生物鉴定仪对其进行鉴定,旨在为煎饼的工业化生产提供技术支持,同时也丰富了发酵面制品的菌种资源。
1.1菌种与培养基
菌种:乳酸菌为戊糖片球菌 (P e d i o c o c c u s pentosaceus)和肠膜明串珠菌(Leuconostoc mesenteroides),酵母菌为酿酒酵母(Saccharomyces cerevisiae),从煎饼发酵面糊中分离并由实验室保藏;煎饼发酵面糊( pH 4.0,乳酸菌: 8.7× 10 7 CFU/g,酵母菌: 5.8× 10 7 CFU/g,发酵时间: 10 h) 本溪寨香生态农业有限公司。
MRS培养基、MRS肉汤、YEPD培养基 北京奥博星生物技术有限责任公司;YEPD液体培养基为每1 000 mL培养基酵母粉10 g、蛋白胨20 g、葡萄糖20 g,pH 6.0;GP卡片、YST卡片(法国梅里埃公司)。
1.2 仪器与设备
VITEC-2 Compact全自动微生物鉴定仪 法国梅里埃公司;UV-2550紫外-可见分光光度计 日本岛津公司;GMSX-280手提式压力蒸汽灭菌器 北京市永光明医疗仪器有限公司;HS-1300无菌操作台 苏州安泰空气技术有限公司;DHP-9082电热恒温培养箱 上海一恒科学仪器有限公司;HH-6数显恒温水浴锅 金坛市鑫鑫试验仪器厂;AR224CN电子天平 奥豪斯仪器(上海)有限公司。
1.3方法
1.3.1菌种的分离与纯化
用无菌生理盐水对煎饼发酵面糊进行稀释,将不同稀释度的面糊分别接种在用于分离乳酸菌的MRS培养基和分离酵母菌的YEPD培养基中,36 ℃和28 ℃的恒温培养箱中倒置培养24~36 h,根据菌落的颜色、直径和表面特征等挑取单菌落,多次划线提纯直至菌落较纯,得到纯菌落后进行复筛及鉴定 [14-17] 。
1.3.2菌种的复筛
1.3.2.1乳酸菌产酸实验
挑取分离纯化后的乳酸菌以2% 的接种量加入250 mL的MRS液体培养基中36 ℃培养24 h,每隔2 h用pH计测定发酵液pH值。
1.3.2.2酵母菌的产气性能实验
将初筛后的酵母菌接种于 YEPD含有杜式发酵管的液体培养基中,置于 28℃恒温培养箱中培养,测定酵母菌株的起酵时间、产气泡的快慢、杜氏管满时间,比较各株酵母菌的起酵能力和发酵性能,筛出性能优良的酵母菌 [18-19]。
1.3.2.3菌株的生长曲线
将分离的菌株以体积分数2% 的接种量接种于250 mL的液体培养基中,乳酸菌在36 ℃、酵母菌在28 ℃恒温培养箱中培养,每2 h取出培养液,以未接种的培养基为空白对照。分别在波长600 nm和660 nm处测量光密度(OD)值,以时间为横坐标,菌液OD值为纵坐标,观察菌株的生长曲线 [20-22] 。
1.3.2.4菌株的耐受性实验
将乳酸菌接入MRS液体培养基,酒精的添加体积分数为1% 、1.5% 、2% 、2.5% 、3% ,温度为20、25、30、35、40 ℃。灭菌后,按2% 接种量接入活化好的乳酸菌,培养16 h,以未接种的空白培养基为对照,取出培养液测定OD 600 nm 值。以温度、酒精体积分数为横坐标,菌液OD 600 nm 值为纵坐标,观察乳酸菌的生长曲线。考察各菌株对酒精、温度的耐受性,筛选出发酵性能优良的乳酸菌作为发酵剂。
将酵母菌接入 YEPD液体培养基中,将培养基的 pH值分别调为 2.5、 3、 3.5、 4、 4.5、温度为 20、 25、 30、 35、 40℃。灭菌后,按 2%接种量接入活化好的酵母菌,培养 14 h,以未接种的空白培养基为对照,取出培养液测定 OD 660 nm值。以温度、 pH值为横坐标,菌液 OD 660 nm值为纵坐标,观察酵母菌的生长曲线。考察各菌株对 pH值、温度耐受性,筛选出发酵性能优良的酵母菌作为发酵剂 [23]。
1.3.3煎饼发酵面糊中优势菌种的鉴定
将筛选出的菌株培养悬浮于 0.45%的灭菌生理盐水中,并用浊度仪确定乳酸菌的浊度为 0.5~ 0.63,酵母菌的浊度为 1.8~ 2.2,将悬浮液分别填充于 GP和 YST卡片中进行鉴定。
1.4数据分析
所有数据以
 表示,应用
SPSS 18.0软件进行数据处理。采用单因素方差分析(
analysis of variance,
ANOVA)和多重比较进行差异显著性分析,P<
0.05认为具有显著差异。
表示,应用
SPSS 18.0软件进行数据处理。采用单因素方差分析(
analysis of variance,
ANOVA)和多重比较进行差异显著性分析,P<
0.05认为具有显著差异。
2.1煎饼发酵面糊中优势菌株的分离与纯化
通过对煎饼发酵面糊中乳酸菌的培养及革兰氏染色,从中分离出 R 1、 R 2、 R 3、 R 4、 R 5、 R 6、 R 7、 R 8、 R 9, 9株疑似乳酸菌,其菌落的颜色、直径和表面特征见表 1。从煎饼发酵面糊中分离出 Y 1、 Y 2、 Y 3、 Y 4、 Y 5、 Y 6、 Y 7、 Y 8、 Y 9、 Y 10、 Y 11共 11株酵母菌,其酵母菌的菌落形态特征见表 2。
表1 乳酸菌株的菌落形态特征
Table1 Colony characteristics of LAB strains

序号名称颜色直径/mm形态描述1R 1淡黄色1.8小而圆,表面光滑湿润,边缘整齐,有凸起,不透明,无黏液2R 2白色2.0小而圆,光滑湿润,边缘整齐,无凸起,不透明,无黏液3R 3白色1.0小而圆,光滑湿润,边缘整齐,无凸起,不透明,无黏液4R 4白色2.0表面光滑湿润,边缘整齐,有凸起,不透明5R 5淡黄色1.0表面光滑湿润,边缘整齐,有凸起的小圆点,不透明,无黏液6R 6淡黄1.0小而圆,表面比较干,边缘整齐,无凸起,不透明,无黏液7R 7白色0.8小而圆,表面光滑湿润,边缘整齐,有凸起,不透明,无黏液8R 8白色片状光滑湿润,边缘不整齐,不透明,无黏液9R 9白色2.0小而圆,表面光滑湿润,边缘整齐,无凸起
表2 酵母菌的菌落形态特征
Table2 Colony characteristics of yeast strains

序号名称颜色直径/mm形态描述1Y 1淡黄色2.4小而圆,表面光滑湿润,边缘整齐,有凸起,透明,无黏液2Y 2黄色1.2椭圆,表面光滑,边缘整齐,无凸起,不透明,无黏液3Y 3淡黄色2.3小而圆,表面光滑湿润,边缘整齐,无凸起,不透明,无黏液4Y 4白色1.0小而圆,表面光滑湿润,边缘整齐,无凸起,透明,无黏液5Y 5白色6.0片状,表面光滑湿润,边缘不整齐,无凸起,透明,无黏液6Y 6淡黄色5.0片状,表面光滑湿润,边缘整齐,无凸起,透明,无黏液7Y 7乳白色4.0圆形、片状,表面不光滑湿润,边缘整齐,凸起,不透明,无黏液8Y 8白色1.8表面光滑湿润,边缘整齐,有凸起,透明,无黏液9Y 9淡黄色6.0表面湿润,边缘不整齐,凸起,无黏液10Y 10白色5.0表面比较干,边缘不整齐,不透明,无黏液11Y 11淡黄色1.0小而圆,表面光滑湿润,边缘整齐,有凸起,透明,无黏液
2.2菌株的复筛
2.2.1乳酸菌的产酸速率
图 1为 4株菌株 24 h的 pH值曲线变化情况,最初 pH值为 6.3~ 6.7, R 1的 pH值下降速率较缓慢,产酸能力较弱,其他菌株的 pH值不断下降,产酸曲线表现出基本相似的曲线。与其他乳酸菌相比, R 2产酸速率较快,其最低 pH值可达 3.91。大多数的发酵食品如奶、肉、谷物等并不是无菌的,乳酸菌代谢产生的乳酸和乙酸等有机酸,不仅可与酵母菌产生的乙醇发生酯化反应可生成酯类等芳香物质,使煎饼香气浓郁外,也可抑制发酵过程中腐败菌及致病菌的生长,提高煎饼的食用安全性。
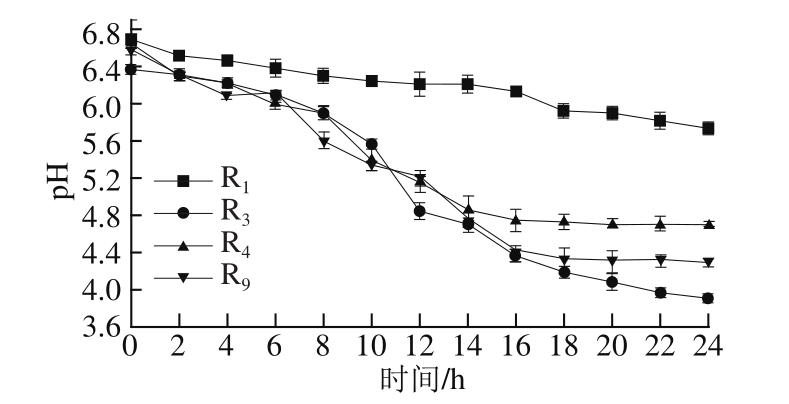
图1 乳酸菌产酸速率曲线
Fig.1 Acid production curves for LAB
2.2.2酵母菌的产气性能
Y 1、 Y 2、 Y 4、 Y 8等酵母菌的产气性能见表 3,其余均为产气。起酵时间和杜氏管管满时间越短,发酵性能越强,越有利于煎饼生产的生产效率及成本。根据表 3可知, 4株酵母菌在起酵时间和杜氏管管满时间均显著性, Y 8起酵时间及杜氏管管满时间较短,从生产效率及成本考虑,选取 Y 8为煎饼复合发酵剂专用菌株。但酵母菌除产气性能外,还会产生特定风味成分,实际生产中应给予具体考虑。
表3 酵母菌的产气性能
Table3 Gas-generating properties of yeasts
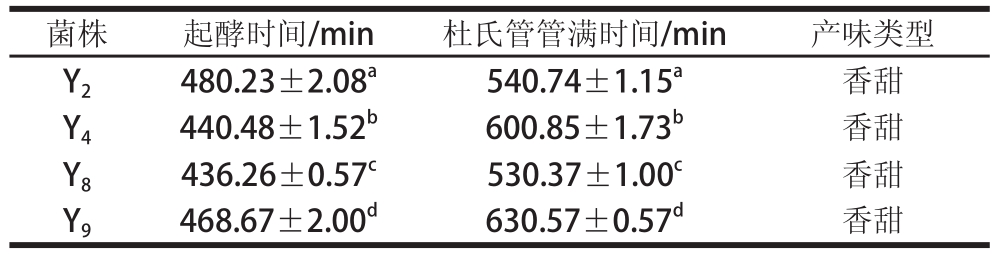
菌株起酵时间/min杜氏管管满时间/min产味类型Y 2480.23±2.08 a540.74±1.15 a香甜Y 4440.48±1.52 b600.85±1.73 b香甜Y 8436.26±0.57 c530.37±1.00 c香甜Y 9468.67±2.00 d630.57±0.57 d香甜
2.2.3 菌株的生长曲线
图 2a为乳酸菌的生长曲线, 0~ 2 h内 5株菌生长较缓慢,在 2~ 14 h内所有菌株繁殖迅速进入对数生长期, OD 600 nm值持续上升,但 R 2的 OD 600 nm值较大,最大可达 2.98。说明 R 2不仅产酸能力较强,且生长迅速。图 2b为酵母菌的生长曲线,同样它们的延滞期也为 2 h,在 2~ 14 h内所有菌株进入对数生长期繁殖迅速, OD 660 nm值持续上升, Y 8菌株 OD 660 nm值较大,生长迅速。
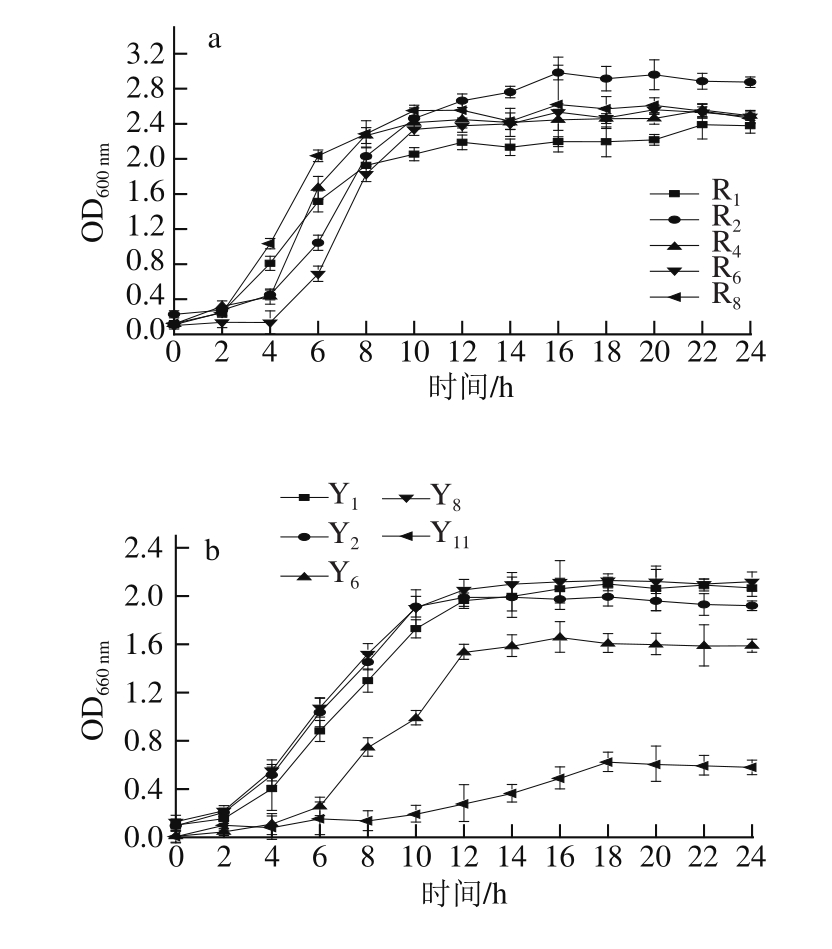
图2 乳酸菌(a)和酵母菌(b)的生长曲线
Fig.2 Growth curves of LAB (a) and yeasts (b)
2.2.4菌株的耐受性
对于煎饼发酵剂的选择不能仅立足于功能特性,而且要具备适应不同环境的能力,通过发酵温度、菌种添加量等环境条件的改变,可控制煎饼面糊的发酵时间,有利于煎饼的连续及淡旺季生产。所以对优势菌株耐受性的选择是当务之急。发酵温度对面糊中优势菌的影响如图 3所示,温度对菌种均有不同程度的影响,且随温度增加对其生长的抑制作用逐渐增强。 25~ 40℃,乳酸菌 OD 600 nm值随发酵温度的增加而增加,菌株生长迅速,但 45℃之后,温度的提高抑制了菌株生长;酵母菌 OD 660 nm值在 20~ 35℃范围内与温度成正比,酵母菌在 40℃之后受到抑制,可能高温导致了蛋白质和变性。在整个生长过程中,乳酸菌 R 8和酵母菌 Y 8的 OD值较大,受温度的影响较小。

图3 发酵温度对面糊中优势乳酸菌(a)和酵母菌(b)菌株的影响
Fig.3 Effect of fermentation temperature on the dominant strains in batter
由于煎饼面糊是由酵母菌和乳酸菌共同发酵,酵母菌在代谢过程中产生酒精,所以酒精体积分数会影响乳酸菌的生长,同时发酵过程中乳酸菌会使面糊的 pH值降低,所以对乳酸菌进行耐酒精筛选和对酵母菌进行耐酸性筛选。由图 4可知,菌株的 OD 600 nm值与酒精体积分数成反比,但各菌株对酒精均有一定耐受力,当酒精体积分数为 3%时,菌株的生长明显受到抑制,但 R 8菌株对酒精的耐受性较其他菌株好。图 5为 pH值对酵母菌的影响,随 pH值增加,酵母菌生长迅速,较低 pH值时,所有酵母菌生长受到抑制, Y 8菌株表现出良好的耐受性。根据以上菌株的耐受性,选取 Y 8和 R 8作为煎饼的混合直投式发酵剂。
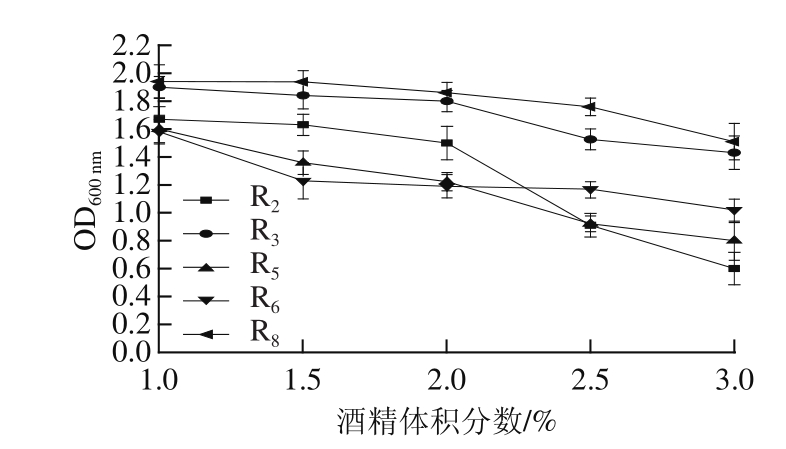
图4 酒精体积分数对乳酸菌生长的影响
Fig. 4 Effect of alcohol content on the growth of LAB

图5 pH值对酵母菌生长的影响
Fig.5 Effect of pH on the growth of yeast
2.3 VITEC-2 Compact全自动微生物鉴定仪对面糊中优势菌株的鉴定结果
由表 4可知,使用浊度仪将乳酸菌的菌悬液浊度调为 0.55,经过 5 h的分析鉴定,鉴定结果为 R 8是戊糖片球菌,可能性百分比为 97%, R 2是肠膜明串珠菌,可能性百分比为 96%,具有良好的鉴定结果。表 5为 VITEC-2 Compact微生物鉴定仪对 Y 8酵母菌的鉴定结果。使用浊度仪将酵母菌的菌悬液浊度调为 1.96,经过 18.25 h的鉴定,鉴定结果为酿酒酵母,可能性百分比为 97%,具有良好的鉴定结果。
表4 VITEC-2 Compact全自动微生物鉴定仪对乳酸菌的生化反应鉴定结果
Table4 Identification of LAB by LAB VITEC-2 Compact automated microbial identification system

戊糖片球菌生化反应肠膜明串珠菌生化反应编号特征结果编号特征结果编号特征结果编号特征结果编号特征结果编号特征结果编号特征结果编号特征结果2AMY-23ProA-42LAC 60sac-2AMY-23ProA-42LAC-60sac+ 4PIPLC-24BGURr-44NAG62dTRE-4PIPLC-24BGURr-44NAG-62dTRE-5dXYL-25AGAL-45dMAL-63 ADS2s-5dXYL-25AGAL-45dMAL-63ADS2s-8ADH1+26PyrA-46BACI+64 OPTO+8ADH1-26PyrA-46BACI+64OPTO+ 9BGAL-27BGUR-47NOVO-9BGAL-27BGUR-47NOVO+ 11AULU-28AlaA+50NC6.5+11AULU-28AlaA-50NC6.5-13APPA-29TyrA-52dMAN+13APPA-29TyrA-52dMAN-14CDEX-30dSOR-53dMNE+14CDEX-30dSOR-53dMNE+ 15AspA-31URE-54MBdG-15AspA-31URE-54MBdG-16BGAR-32 POLYB+56PUL+16BGAR-32POLYB-56PUL-17AMAN-37dGAL-57dRAF-17AMAN-37dGAL-57dRAF+ 19PHOS-38Drib-58O129R-19PHOS-38Drib-58O129R+ 20LeuA+39ILATk-59SAL-20LeuA+39ILATk-59SAL-
表5 VITEC-2 Compact全自动微生物鉴定仪对酵母菌生化反应的鉴定结果
Table5 Identification of yeasts by VITEC-2 Compact automated microbial identification system
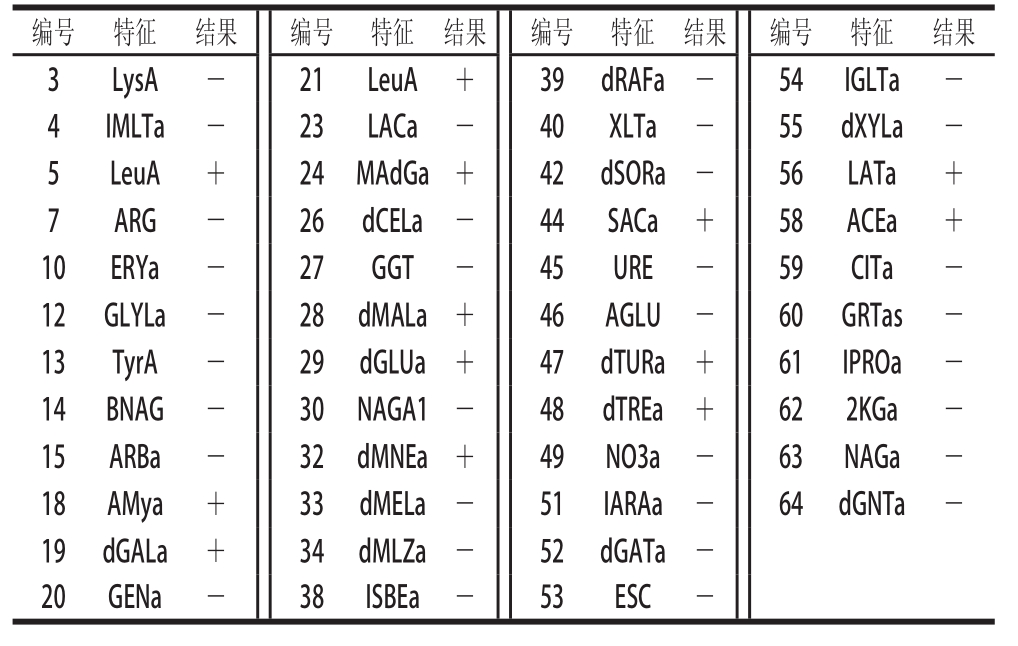
编号特征结果编号特征结果编号特征结果编号特征结果3LysA-21LeuA+ 39dRAFa-54IGLTa-4IMLTa-23LACa-40XLTa-55dXYLa-5LeuA+24MAdGa+42dSORa-56LATa+ 7ARG-26dCELa-44SACa+58ACEa+ 10ERYa-27GGT-45URE-59CITa-12GLYLa-28dMALa+46AGLU-60GRTas-13TyrA-29dGLUa+47dTURa+61IPROa-14BNAG-30NAGA1-48dTREa+622KGa-15ARBa-32dMNEa+49NO3a-63NAGa-18AMya+33dMELa-51IARAa-64dGNTa-19dGALa+34dMLZa-52dGATa-20GENa-38ISBEa-53ESC-
从煎饼发酵面糊中分离出 9种乳酸菌和 11种酵母菌, R 2菌株生长迅速,产酸、抗氧化能力较强, R 8对温度及酒精含量的耐受性较强, Y 8菌株生长迅速,产气性能好,对 pH值和温度的耐受性较强。综上,选取 R 2、 R 8
和 Y 8作为煎饼的专用复合发酵剂。 VITEC-2 Compact全自动微生物鉴定仪对筛选出的乳酸菌和酵母菌进行鉴定,鉴定结果 R 2为肠膜明串珠菌、 R 8为戊糖片球菌、 Y 8为酿酒酵母。
参考文献:
[1] SPIEGEL H, SAGER M, OBERFORSTER M, et al. Nutritionally relevant elements in staple foods∶ influence of arable site versus choice of variety[J]. Environmental Geochemistry and Health, 2009, 31(5)∶ 549-560.
[2] SLAVIN J. Why whole grains are protective∶ biological mechanisms[J]. Proceedings of the Nutrition Society, 2003, 62(1)∶ 129-134.
[3] ROBERT H, GABRIEL V, FONTAGN☒-FAUCHER C. Biodiversity of lactic acid bacteria in French wheat sourdough as determined by molecular characterization using species-specific PCR[J]. International Journal of Food Microbiology, 2009, 135(1)∶ 53-59.
[4] CAPLICE E, FITZGERALD G F. Food fermentations∶ role of microorganisms in food production and preservation[J]. International Journal of Food Microbiology, 1999, 50(1)∶ 131-149.
[5] ARGYRI A A, ZOUMPOPOULOU G, KARATZAS K A G, et al. Selection of potential probiotic lactic acid bacteria from fermented olives by in vitro tests[J]. Food Microbiology, 2013, 33(2)∶ 282-291.
[6] di CAGNO R, de ANGELIS M, LAVERMICOCCA P, et al. Proteolysis by sourdough lactic acid bacteria∶ effects on wheat flour protein fractions and gliadin peptides involved in human cereal intolerance[J]. Applied and Environmental Microbiology, 2002, 68(2)∶623-633.
[7] GOBBETTI M. The sourdough microflora∶ interactions of lactic acid bacteria and yeasts[J]. Trends in Food Science & Technology, 1998, 9(7)∶ 267-274.
[8] MESSENS W, de VUYST L. Inhibitory substances produced by lactobacilli isolated from sourdoughs∶ a review[J]. International Journal of Food Microbiology, 2002, 72(1)∶ 31-43.
[9] BIRCH A N, PETERSEN M A, HANSEN ☒ S. The aroma profile of wheat bread crumb influenced by yeast concentration and fermentation temperature[J]. LWT-Food Science and Technology, 2013, 50(2)∶ 480-488.
[10] TEMMERMAN R, HUYS G, SWINGS J. Identification of lactic acid bacteria∶ culture-dependent and culture-independent methods[J]. Trends in Food Science & Technology, 2004, 15(7)∶ 348-359.
[11] EHRMANN M A, VOGEL R F. Molecular taxonomy and genetics of sourdough lactic acid bacteria[J]. Trends in Food Science & Technology, 2005, 16(1)∶ 31-42.
[12] JIN W Y, JANG S J, LEE M J, et al. Evaluation of VITEK 2, MicroScan, and Phoenix for identification of clinical isolates and reference strains[J]. Diagnostic Microbiology and Infectious Disease, 2011, 70(4)∶ 442-447.
[13] NAKASONE I, KINJO T, YAMANE N, et al. Laboratory-based evaluation of the colorimetric VITEK-2 Compact system for species identification and of the Advanced Expert System for detection of antimicrobial resistances∶ VITEK-2 Compact system identification and antimicrobial susceptibility testing[J]. Diagnostic Microbiology and Infectious Disease, 2007, 58(2)∶ 191-198.
[14] 贺稚非, 李洪军, 任俊琦. 发酵蔬菜低温贮藏酵母菌动态变化研究[J].食品科学, 2011, 32(13)∶ 165-168.
[15] 胡丽花, 苏东民. 传统主食馒头发酵剂微生物的筛选及对馒头品质的影响[D]. 郑州∶ 河南工业大学, 2010.
[16] 吴鹏, 沈伊亮, 陈清婵, 等. 传统米发糕发酵剂中乳酸菌和酵母菌的分离鉴定[J]. 食品科学, 2009, 30(13)∶ 171-173.
[17] 崔艳莉, 蒋雪, 祁付云, 等. 酿酒葡萄中内生酵母菌的分离与初步鉴定[J]. 中国酿造, 2012, 31(9)∶ 82-84.
[18] 单艺, 张兰威, 崔宏斌. 传统法酿造糯米酒中酵母菌的筛选及发酵特性研究[J]. 食品工业科技, 2007, 28(8)∶ 88-90.
[19] 牛广财, 朱丹, 王军, 等. 沙棘果酒优良酵母菌的筛选及分子生物学鉴定[J]. 中国食品学报, 2009, 9(6)∶ 60-65.
[20] 陈晓平, 刘华英, 魏小川, 等. 自然发酵酸菜汁中乳酸菌的分离筛选与鉴定研究[J]. 食品科学, 2006, 27(2)∶ 91-94.
[21] 杨晓晖, 籍保平, 李博, 等. 泡菜中优良乳酸菌的分离鉴定及其发酵性能的研究[J]. 食品科学, 2005, 26(5)∶ 130-134.
[22] 李自红, 苏东民, 李里特. 传统发酵剂微生物的筛选, 鉴定及对馒头品质的影响[D]. 郑州∶ 河南工业大学, 2011.
[23] 徐大鹏, 李云杰, 张栩, 等. 耐高温酵母菌的筛选及特性[J]. 生物加工过程, 2011, 9(3)∶ 17-21.
Screening and Identification of Dominant Strains in Fermented Pancake Batter
TANG Mingli, WANG Bo, LIU He, HE Yutang, HUI Lijuan, MA Tao* (Grain and Oil Science and Technology Institute, College of Food Science and Engineering, Bohai University, Jinzhou 121013, China)
Abstract: Microbial strains responsible for naturally fermented pancake flavor with local characteristics were isolatedand screened from fermented pancake batter for providing the basis for industrial production of traditional foods. Usingenrichment culture and plate streaking, the dominant species in fermented pancake batter were isolated. The initial screeningwas performed by colony morphology, color and size, and the secondary screening was performed by physiological andbiochemical tests, and tolerance test. The final isolates were identified by VITEC-2 compact microbial identification system.The results showed that nine strains of lactic acid bacteria and eleven strains of yeasts were obtained from fermentedpancake batter, and lactic acid bacteria R 2 and R 8 and yeast Y 8 , which had good fermentation performance, could be used asfermentation starters in combination for panckage batter. R 2 was identified as Leuconostoc mesenteroides , R 8 as Pediococcuspentosaceus , and Y 8 as Saccharomyces cerevisiae .
Key words: pancake batter; lactic acid bacterium; yeast; screening; identification
中图分类号: TS201.3
文献标志码: A 文章编号:1002-6630(2015)17-0207-05
文章编号:1002-6630(2015)17-0207-05
doi:10.7506/spkx1002-6630-201517039
收稿日期:2014-08-17
作者简介:唐明礼(1988—),男,硕士研究生,研究方向为农产品加工与贮藏。E-mail:707334794@qq.com
*通信作者:马涛(1962—),男,教授,博士,研究方向为粮油与植物蛋白工程。E-mail:1040732408@qq.com