酪蛋白糖巨肽对小鼠肠道双歧杆菌增殖水平的影响
江 岩,陈庆森*,李俊洁,闫亚丽,赵 培
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
摘 要:采用实时荧光定量聚合酶链式反应(
real-time polymerase chain reaction,
real-time PCR)分析不同剂量酪蛋白糖巨肽(
cas ein glycomacropeptide,
CGMP)对小鼠肠道双歧杆菌增殖水平的影响,揭示乳源
CGMP是否有增殖肠道关键益生菌的功能。选用
50只健康
BALB/c小鼠,随机分为对照组,安慰组(灌胃生理盐水
0.2 mL),乳源
CGMP低、中、高剂量组(灌胃等体积不同质量浓度的乳源
CGMP),灌胃周期为
2周。于灌胃后第
0、
3、
5、
7、
9、
11、
15天及停止灌胃后
1周(第
21天)采集的小鼠新鲜粪便,并进行粪便菌体基因组
DNA抽提。依据双歧杆菌的
16S rRNA基因序列设计
5对种属特异性引物,以两歧双歧杆菌(
Bifidobacterium bifidum)
CICC6071的基因组
DNA作为标准品,进行梯度稀释制作标准曲线;分析样品
PCR扩增产物的熔解曲线,评价反应的特异性。结果表明:
Real-time PCR可准确定量小鼠肠道内双歧杆菌数量;且灌胃中剂量乳源
CGMP可以促进小鼠肠道内双歧杆菌的增殖,在灌胃第
11天时小鼠肠道内双歧杆菌数量达到最高值,即乳源
CGMP对小鼠肠道双歧杆菌的增殖作用存在剂量选择性。
关键词:实时荧光定量聚合酶链式反应;酪蛋白糖巨肽;双歧杆菌;小鼠粪便
自
1956年
Waugh等
[1]发现了κ
-酪蛋白,
1965年
Delfour等
[2]发现用凝乳酶切断κ
-酪蛋白的特定位置,会生成不溶性的副κ
-酪蛋白和在三氯乙酸中可溶的 酪蛋白糖巨肽两部分。酪蛋白糖巨肽(
casein glycomacropeptide,
CGMP)是由κ
-酪蛋白第
106~
169位氨基酸(第
106位氨基酸为
Met,第
169位氨基酸为
Val)共
64个残基构成的高度糖基化、并且有磷酸化修饰的多肽,具有多种生理功能
[3]:抑制胃液分泌、抑制病原体(包括病毒和细菌等)黏附细胞、抑制霍乱弧菌等的毒素与受体结合等。另外,
CGMP还具有促进双歧杆菌增殖的作用:
Gy☒rzy等
[4]首先发现了在人初乳和常乳中存在双歧杆菌生长促进因子糖巨肽(
GMP),经研究发现两歧双歧杆菌宾夕法尼亚亚种的生长需要人类来源的初乳成分。李楠等
[5]研究了不同蛋白酶酶解糖巨肽包括商业化
CGMP在体外对乳双歧杆菌
BB12的促生长效果,发现蛋白质水解产生的多肽类物质能够在培养基中促进双歧杆菌的增殖。双歧杆菌作为恒温动物肠道中一种重要的益生菌群,具有抑制有害菌群生长、免疫调节、提供营养成分及影响机体代谢等多种生理功能
[6-8]。因此,准确定量分析动物肠道内双歧杆菌对营养保健及医疗卫生方面的研究具有重要意义。但由于双歧杆菌属于革兰氏阳性严格厌氧菌,对营养条件及培养环境要求苛刻,在动物体外很难生长,使得传统培养方法对双歧杆菌的定量存在一定局限性。本实验采用实时荧光定量聚合酶链式反应(
real-time polymerase chain reaction,
real-time PCR)分析比较不同剂量的乳源
CGMP对小鼠肠道中双歧杆菌的增殖水平的影响,为乳源
CGMP的进一步开发利用奠定实验基础。
1 材料与方法
1.1材料
1.1.1菌种与培养基
双歧杆菌菌株为两歧双歧杆菌(Bifidobacterium bifi dum)
CICC6071,来自中国微生物菌种保藏中心。
培养两歧双歧杆菌所用培养基为莫匹罗星锂盐改良的
MRS培养基。
1.1.2试剂
10×
PCR Buffer(
100 mmol/L Tris-HCl(
pH 8.3)、
500 mmol/L KCl)、
MgCl
2(
25 mmol/L)、
dNTPs(
2 mmol/L)、Taq
DNA聚合酶(
5 U/μL) 宝生物工程(大连)有限公司;
2×
Fast SYBR Green Master Mix美国
AB公司;细菌基因组
DNA提取试剂盒 天根生化科技(北京)有限公司;实验中使用的引物由生工生物工程(上海)股份有限公司合成。
1.1.3动物
SPF级
BALB/c健康雄性小鼠,体质量(
25±
2)
g,购自中国人民解放军军事医学科学院实验动物中心,适应性饲养
1周,期间小鼠被饲养在屏障系统中,
12 h光照
/12 h黑暗,室温(
20±
2) ℃,相对湿度(
50±
10)%,自由进食和饮水。
1.2方法
1.2.1乳源
CGMP溶液的配制
乳源
CGMP样品(
CGMP纯度
71%,唾液酸含量
5.6%),购自新西兰
Tatua合作乳品有限公司。用无菌生理盐水溶解
CGMP,配制成不同质量浓度的溶液,备用。
1.2.2动物的分组及处理
将
BALB/c雄性小鼠适应性饲养
1周后随机分为
5组:安慰组每天早上灌胃生理盐水
0.2 mL,乳源
CGMP低、中、高剂量组每天早上分别灌胃
0.2 mL不同质量浓度(
0.3、
0.5、
0.7 mg/mL)的乳源
CGMP,对照组既不灌胃生理盐水,也不灌胃乳源
CGMP。灌胃周期为
2周。所有小鼠在整个实验期间均饮用纯净水,定期更换垫料以保持环境清洁与干燥。
1.2.3样品的采集处理及细菌基因组
DNA的提取
分别于灌胃后第
0、
3、
5、
7、
9、
11、
13、
15天以及第
21天(即灌胃停止后
1周)的清晨,用逼迫法采集各组小鼠的新鲜粪便,放置于无菌的密封厌氧带袋,存于-
20 ℃冰箱中,24 h内对其进行处理。
取约
200 mg小鼠粪便样品置于
2 mL无菌离心管中,加入
1 mL pH 7.4的磷酸盐缓冲液(
phosphate buffered saline,
PBS),在漩涡仪上充分振荡混匀后,
1 800 r/min离心
6 min,用移液器轻取上清液,向沉淀中再加入
1 mL PBS(
pH 7.4),
1 800 r/min离心
6 min,取上清液。合并两次离心所得上清液,再次
2 300 r/min离心
6 min,收集上清液。
12 000 r/min继续离心
8 min,收集菌体,加入
PBS充分悬浮菌体并进行洗涤,离心收集沉淀,重复操作两次。再用无菌水重复操作两次。
用细菌基因组
DNA提取试剂盒进行基因组
DNA的抽提,最后用
TE缓冲液(
Tris和乙二胺四乙酸配制)进行溶解,-
20 ℃条件下保存备用。
1.2.4 PCR引物序列的选择
依据双歧杆菌
16S rRNA基因序列并参考文献
[9-13],合成以下
5对引物(表
1),通过实验最终确定其中的
1对作为检测小鼠肠道双歧杆菌的引物。
表1 双歧杆菌的PCR引物序列
Table1 PCR primers for Bifidobacterium genus

引物编号引物名称引物序列(5’→3’)长度/bp扩增产物片段长度/bp AB230-1 B230-2 GATTCTGGCTCAGGATGAACGC CTGATAGGACGCGACCCCAT 22 20230 BB350-1 B350-2 ACCCTGGTAGTCCACGCCGTAA GGCACAATCCGCTGGCAACA 22 20350 Clm26 Lm3r GATTCTGGCTCAGGATGAACG CGGGTGCTICCCACTTTCATG 21 211 350 DBif164-f Bif662-r GGGTGGTAATGCCGGATG CCACCGTTACACCGGGAA 18 18523 Eg-Bifid-F g-Bifid-R CTCCTGGAAACGGGTGG GGTGTTCTTCCCGATATCTACA 17 22549~563
1.2.5标准曲线的制作
取B. bifidum
CICC6071菌株,用细菌基因组
DNA提取试剂盒进行菌体
DNA的提取,换算为B. bifidum的拷贝数,
10倍梯度稀释为
10
7~
10
3
copies/μL,作为标准品。
Real-time PCR体系共
25μL:
2×
Fast SYBR Green Master Mix 12.5μL、双歧杆菌属上下游引物(
10μmol
/L)各1 μL、模板(B. bifidum
CICC6071菌株基因组
DNA)
2μL、
ddH
2
O 8.5μL。
Real-time PCR扩增条件:
94 ℃预变性3 min;
94 ℃变性40 s,
60 ℃退火30 s,
72 ℃延伸50 s,
79 ℃ 10 s,
40个循环;最后
72 ℃延伸3 min。
1.2.6样品的检测及数据处理
将待测样品
DNA按照与标准品相同的体系和条件进行
Real-time PCR和熔解曲线的制 作。
熔解条件:从
72 ℃ 以20℃
/s的速率升温至
94 ℃,保持15 s;再以
20℃
/s的速率降至
60 ℃,保持1 min;最终以
0.3 ℃/s(每升高
0.3 ℃收集1次荧光信号)的速率升温至
94 ℃,保持15 s。
1.3数据处理
将所有样品定量数据导入
SPSS 16.0统计软件进行显著性检验分析,以P<
0.05作为统计学差异的标准。
2 结果与分析
2.1小鼠肠道双歧杆菌引物检测效果的选择及分析
将所选择的
5对引物,以标准菌株(B. bifidum
CICC6071)及样品的基因组
DNA为模板进行
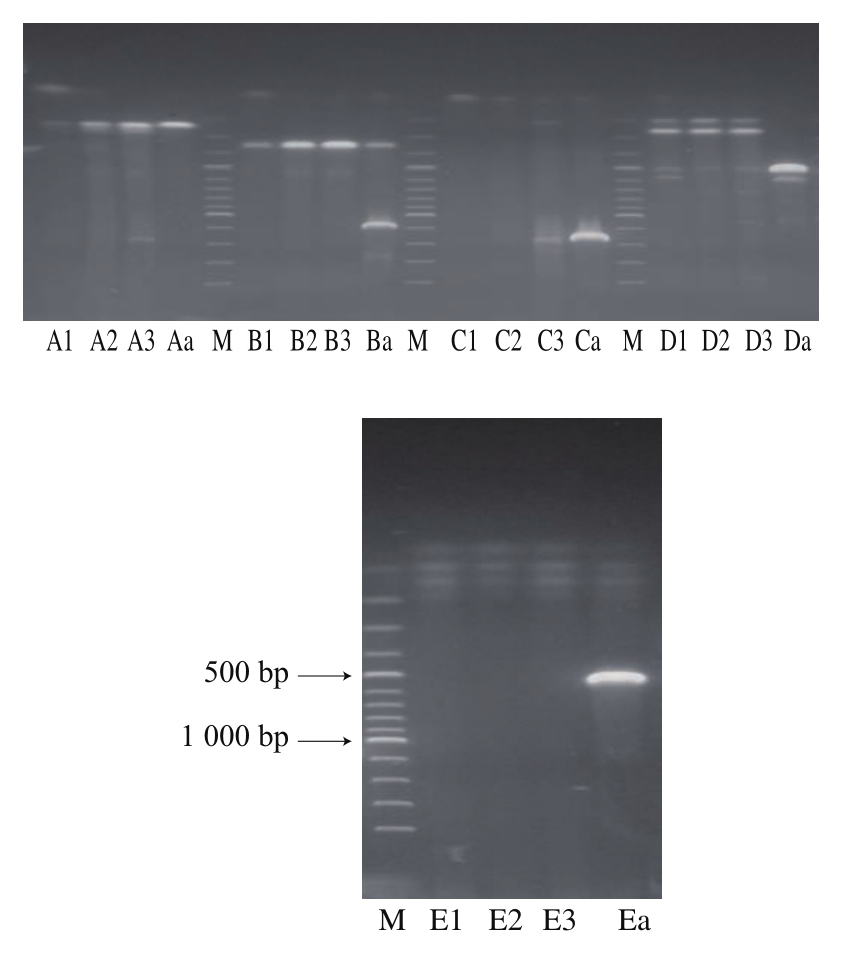
PCR扩增,将所得产物进行琼脂糖凝胶电泳,结果如图
1所示。

图1 双歧杆菌PCR扩增产物的琼脂糖凝胶电泳图
Fig.1 Agarose gel electrophoregrams of PCR-amplified products from bifidobacteria
如图
1所示,以B. bifidum
CICC6071基因组
DNA为模板时,引物
B(
B350-1/B350-2)出现非特异性扩增产物,大小约为
1 200 bp,直接被排除;而以小鼠粪便样品为模板时,引物
E(
g-Bifid-F/g-Bifid-R)无任何产物条带出现,也直接被排除;虽然以小鼠粪便基因组
DNA为模板时,引物
A(
B230-1/B230-2)、引物
D(
Bif164-f/ Bif662-r)及引物
C(
lm26/Lm3r)都会得到相应大小的目的产物片段,但是前两种引物在得到目的产物片段的同时也会得到与片段长度差异较小的非特异性产物片段,且通过改变
PCR条件不能将非特异性扩增产物消除。因此,最终选择只得到
1条目的产物条带的
lm26/Lm3r作为检测小鼠肠道双歧杆菌的引物。
2.2 Real-time PCR定量检测小鼠肠道中双歧杆菌有关条件的建立
2.2.1标准品的
PCR扩增曲线及反应灵敏度
标准品不同稀释度(不同模板量)体系的荧光信号随着循环数的增加也相应的增强,在经过一个指数扩增期后进入“平台期”。不同模板量的体系达到荧光阈值(即进入指数期)的初始循环数是不相同的,初始循环数与模板量之间的对应关系是双歧杆菌定量的基础。
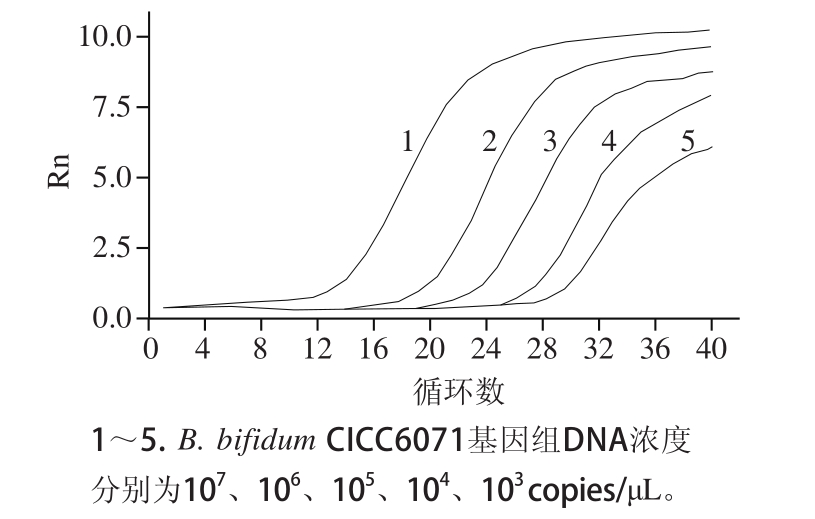
图2 梯度稀释标准品的PCR扩增曲线
Fig.2 Amplification curves of 10-fold serially diluted standards
如图
2所示,
PCR扩增曲线的横坐标代表
PCR反应的循环数,纵坐标代表
SYBR Green染料与双链
DNA小沟结合后产生的荧光强度(
Rn)。图中梯度稀释标准品的扩增曲线均呈“
S”型,且浓度最低的
10
3
copies/μL的标准品仍有特征性扩增曲线,说明该
Real-time PCR扩增过程具有较好的灵敏度。
2.2.2标准曲线的输出
以各个稀释度的菌落总数的对数值为纵坐标,相应的循环数为横坐标,得到的标准曲线方程为y=-
0.237 8x+
10.815(R
2=
0.971 3)。通过
Real-time PCR得到各个时间点采集的样品达到荧光阈值所需要的初始循环数,将其代入标准曲线方程,即可得到对应的菌落总数对数值,最终以每克粪便的菌落总数表示。
2.2.3样品熔解曲线

图3 样品的熔解曲线
Fig.3 Melting curves
由于实验中所用的
SYBR Green染料能与所有
DNA双链的小沟结合,不能将非特异性扩增产物片段与目的产物片段区别开来。若出现一个峰,说明只有一种产物生成,因为的片段大小不同或者碱基序列不同的双链产物,其解链温度是不一样的。依据
1.2.6节方法对
PCR扩增产物进行熔解,得到熔解曲线。如图
3所示,实验所得到的熔解曲线中只出现一个峰,说明引物的特异性很好,没有非特异性扩增产物出现。
2.3不同剂量乳源
CGMP对小鼠肠道双歧杆菌增殖水平的影响
基于上述分析过程所建立的
Real-time PCR检测相关条件,对不同剂量乳源
CGMP干预小鼠肠道双歧杆菌的增殖情况进行检测,结果见图
4。

图4 低、中、高剂量的乳源CGMP对小鼠肠道双歧杆菌增殖水平的影响
Fig.4 Effects of milk-derived CGMP at low, moderate and high doses on the number of mouse intestinal bifidobacteria
如图
4所示,对照组与安慰组小鼠肠道中双歧杆菌水平都未呈现出一定的变化趋势,只是在某一生理范围内(
3.39×
10
7~
1.41×
10
8
CFU/g)上下波动。
如图
4a所示,与对照组和安慰组相比,乳源
CGMP低剂量组小鼠肠道中双歧杆菌水平均无显著差异(P>
0.05),同样为在一个生理范围内波动(
3.80×
10
7~
2.00×
10
8
CFU/g)。
如图
4b所示,在灌胃第
0天时,与对照组和安慰组相比,乳源
CGMP中剂量组小鼠肠道中双歧杆菌水平无明显的差异,基本在同一水平。从灌胃第
3天开始,乳源
CGMP中剂量组小鼠肠道中双歧杆菌数量就有一定增加,在此之后一直处于上升趋势,直到灌胃第
11天,达到最大值(
3.09×
10
8
CFU/g),与对照组相比存在显著差异(P<
0.05)。在停止灌胃
1周后,小鼠肠道双歧杆菌数量有所降低(
7.76×
10
7
CFU/g),但仍比灌胃前(
3.80×
10
7
CFU/g)高约
0.4个数量级。
如图
4c所示,乳源
CGMP高剂量组小鼠肠道中双歧杆菌数量没有明显的变化趋势,只是在一定范围内上下波动(
5.13×
10
7~
1.78×
10
8
CFU/g),与对照组和安慰组相比都不存在显著差异(P>
0.05)。
综合分析,在不同剂量乳源
CGMP灌胃小鼠的第
0~
3天时,小鼠肠道中双歧杆菌数量都有增长的趋势,说明乳源
CGMP可以有效地促进双歧杆菌增殖,但随后乳源
CGMP低、高剂量组小鼠肠道中双歧杆菌数量开始出现波动,总体上促进小鼠肠道内双歧杆菌增殖的效果没有乳源
CGMP中剂量组的效果好,这说明乳源
CGMP促进小鼠肠道粪便双歧杆菌的增殖作用存在剂量选择性。
3 讨 论
随着微生物学的快速发展和人们健康意识的提高,人们逐渐认识到肠道微生物与宿主形成相互依赖制约的统一体的重要性。肠道微生物菌群数量庞大,会影响到宿主的消化、免疫和代谢能力,以及宿主的健康状况
[14]。许多分子生物学技术可用于肠道微生物多样性的研究
[15],其中宏基因组测序技术目前在肠道微生物菌群的研究中应用广泛。但是宏基因组测序技术能够确定样本中微生物的种类,却无法精确对其定量,而
Real-time PCR可发挥其优势,确定样本中某一菌种的具体数量
[16-18],同时可通过定量对比,分析某一因素是否影响肠道微生物菌群的增殖。因此,
Real-time PCR技术也因其敏感性高、复现性好、特异性强等优点,被广泛地应用于微生物菌群的定量检测中。
开展基于
Real-time PCR方法分析鉴定肠道双歧杆菌水平的研究,选择引物至关重要,因此本研究根据文献报道,对
5对引物的效果进行了分析评判。结果表明,以小鼠粪便样品为模板时,引物
g-Bifid-F/g-Bifid-R无任何条带出现,但是
Matsuki
[19]和张翼
[20]等却用此引物分别对人类和大鼠肠道中的双歧杆菌进行了定量,这就说明小鼠肠道中存在的优势双歧杆菌可能与人类和大鼠肠道中不一样。另外,
Lamendella等
[21]的研究结果也与本实验结果一致,他们在研究中选择了
g-Bifid-F/g-Bifid-R、
Bif164-f/Bif662r及
lm26/Lm3r这
3对引物对
32种
269个动物个体进行了粪便双歧v杆菌的检测,最终在
25种动物粪便中发现了双歧杆菌,在剩下
7种动物的粪便中没有检测到任何双歧杆菌。他们还证实了用引物
lm26/Lm3r可在奶牛、鸡等动物粪便中检测到双歧杆菌,且
lm26/Lm3r是唯一可以在猪及兔子粪便中扩增出现目的片段的引物。这说明本实验小鼠肠道中检测出的双歧杆菌可能与上述几种动物肠道中存在的双歧杆菌在菌群结构方面较为相似。综合分析,在没有明确小鼠肠道中双歧杆菌优势菌群的情况下,对引物进行充分选择是很有必要的。
研究发现
[22]双歧杆菌是最早定殖于婴儿肠道内的微生物菌群之一,在人的一生中,肠道内双歧杆菌的构成会随着年龄的变化而不断改变。
Centanni等
[23]采用了一种指纹图谱芯片技术与
Real-time PCR相结合的方法检测比较了
8位母乳喂养婴儿(
2~
6个月)和
5位年轻成年人粪便微生物的种类和数量。结果显示,婴儿的肠道菌群主要是双歧杆菌,其次为肠杆菌科;而成人肠道菌群占主导地位的是厚壁菌门和拟杆菌门。如今,越来越多的研究以双歧杆菌为切入点
[24],研究其与克罗恩病、哮喘、糖尿病和肠道疾病等多种疾病的关系。人们希望能采用一些物质来促进双歧杆菌的生长,比如王建等
[25]选取了番茄汁、肝浸汁、
VC、蜂蜜和新鲜乳清等对婴儿双歧杆菌进行培养,发现它们对双歧杆菌的生长都有促进作用。
本实验采用
Real-time PCR技术,分析不同剂量的乳源
CGMP对小鼠肠道双歧杆菌增殖水平的影响。对各组小鼠肠道中的双歧杆菌进行定量后,发现对照组与安慰组的双歧杆菌数量没有明显的变化趋势,乳源
CGMP低、高剂量组小鼠肠道双歧杆菌的数量也不呈现一定的变化规律。灌胃中剂量的乳源
CGMP时,小鼠肠道双歧杆菌数量呈现出了明显的变化趋势,从灌胃第
3天开始,双歧杆菌数量开始上升,在第
11天时达到最大值,之后双歧杆菌数量降低,但在灌胃结束后
1周内其数量级仍高于灌胃前的水平。此结果与任效东等
[26]用传统培养方法对小鼠肠道内双歧杆菌检测得到的结论是一致的,即灌胃适宜剂量(
0.5 mg/mL)的乳源
CGMP可显著(P<
0.05)促进小鼠肠道中双歧杆菌的增殖,而乳源
CGMP低、高剂量组与安慰组及对照组相比则不存在显著差异(P>
0.05),只是在某一生理范围内上下波动。低剂量的乳源
CGMP对小鼠肠道双歧杆菌没有明显的增殖作用,可能是因为灌胃剂量比较小,没有达到刺激双歧杆菌增殖的效果;高剂量的乳源
CGMP同样没有达到促双歧杆菌增殖的理想作用,这可能与高剂量的乳源
CGMP对小鼠肠道内其他有害菌群的作用有关系,或与小鼠肠道黏膜的耐受性相关。曹晋宜等
[27]研究发现高剂量的乳源
CGMP对小鼠盲肠中的肠杆菌等可疑致病菌不但没有起到抑制的作用,反而有明显的促进作用,这些肠道条件致病菌的大量增殖可能对双歧杆菌的生长产生了一定的影响,从而使得高剂量乳源
CGMP没能达到促双歧杆菌增殖的作用。这些研究也说明在各类具有某种生物活性的益生元、生物活性制剂或药剂中,存在最合适剂量活性或药性理论。
参考文献:
[1] WAUGH D F, von HIPPEL P H. κ-Casein and the stabilization of casein micelles[J]. Journal of the American Chemical Society, 1956, 78(18)∶ 4576-4582.
[2] DELFOUR A, JOLLES J, ALAIS C, et al. Caseino-glycopeptides∶characterization of a methionine residue and of the N-terminal sequence[J]. Biochemical and Biophysical Research Communications, 1965, 19(4)∶ 452-455.
[3] 陈庆森, 王金凤, 阎亚丽, 等. 酪蛋白糖巨肽对二甲肼干预的大鼠细胞因子网络变化的研究[J]. 食品科学, 2014, 35(13)∶ 192-198. doi∶10.7506/spkx1002-6630-201413037.
[4] GY☒RGY P, JEANLOZ R W, NICOLAI H, et al. Undialyzable growth factors for Lactobacillus bifidus var. pennsylvanicus[J]. European Journal of Biochemistry, 1974, 43(1)∶ 29-33.
[5] 李楠, 刘慧敏, 田茜, 等. 酪蛋白糖巨肽酶解产物对双歧杆菌的促生长效果[J]. 食品科技, 2013, 38(9)∶ 2-5.
[6] TOJO R, SU☒REZ A, CLEMENTE M G, et al. Intestinal microbiota in health and disease∶ role of bifidobacteria in gut homeostasis[J]. World Journal of Gastroenterology, 2014, 20(41)∶ 15163-15176. [7] SCHELL M A, KARMIRANTZOU M, SNEL B, et al. The genome sequence of Bifi dobacterium longum reflects its adaptation to the human gastrointestinal tract[J]. Proceedings of the National Academy of Sciences, 2002, 99(22)∶ 14422-14427.
[8] DONG Ping, YANG Yi, WANG Weiping. The role of intestinal bifidobacteria on immune system development in young rats[J]. Early Human Development, 2010, 86(1)∶ 51-58.
[9] 姜艳, 娄俊丽, 刘华, 等. 过敏性紫癜伴幽门螺杆菌感染患儿肠道菌群变化的研究[J]. 临床儿科杂志, 2009, 27(10)∶ 942-945.
[10] 张小贤, 钱香, 楼正青, 等. 16S rRNA实时荧光定量PCR检测肠道菌群的研究[J]. 中国高等医学教育, 2010(6)∶ 128-129.
[11] 陈津津, 蔡威. 应用real-time PCR测定幼兔肠道内双歧杆菌和乳杆菌的变化[J]. 世界华人消化杂志, 2007, 15(31)∶ 3278-3283.
[12] KOK R G, WAAL A D, SCHUT F, et al. Specific detection and analysis of a probiotic Bifi dobacterium strain in infant feces[J]. Applied and Environmental Microbiology, 1996, 62(10)∶ 3668-3672.
[13] MATSUKI T, WATANABE K, FUJIMOTO J, et al. Development of 16S rRNA-gene-targeted group-specific primers for the detection and identification of predominant bacteria in human feces[J]. Applied and Environmental Microbiology, 2002, 68(11)∶ 5445-5451.
[14] 郭慧玲, 邵玉宇, 孟和, 等. 肠道菌群与疾病关系的研究进展[J]. 微生物学通报, 2015, 42(2)∶ 400-410.
[15] 赵洁, 马晨, 席晓敏, 等. 实时荧光定量PCR技术在肠道微生物领域中的研究进展[J]. 生物技术通报, 2014(12)∶ 61-66.
[16] 张力文, 王宗润, 吴秀丽, 等. 实时荧光定量PCR法检测人粪便中双歧杆菌方法的建立及评价[J]. 吉林大学学报∶ 医学版, 2014(3)∶686-691.
[17] 蒋曼, 姚萍, 杨涛, 等. 实时荧光定量PCR法研究溃疡性结肠炎患者肠道双歧杆菌属, 柔嫩梭菌属及拟杆菌属量的变化[J]. 中国微生态学杂志, 2013, 25(11)∶ 1245-1249.
[18] 王宗润, 张力文, 王宗美, 等. 实时荧光定量PCR法检测人粪便中艰难梭状芽孢杆菌[J]. 中国卫生检验杂志, 2015(3)∶ 305-307.
[19] MATSUKI T, WATANABE K, FUJIMOTO J, et al. Use of 16S rRNA gene-targeted group-specific primers for real-time PCR analysis of predominant bacteria in human feces[J]. Applied and Environmental Microbiology, 2004, 70(12)∶ 7220-7228.
[20] 张翼. 膳食诱导肥胖大鼠的肠道菌群结构研究[D]. 上海∶ 上海交通大学, 2009.
[21] LAMENDELLA R, SANTO DOMINGO J W, KELTY C, et al. Bifidobacteria in feces and environmental waters[J]. Applied and Environmental Microbiology, 2008, 74(3)∶ 575-584.
[22] MASANTA W O, HEIMESAAT M M, BERESWILL S, et al. Modification of intestinal microbiota and its consequences for innate immune response in the pathogenesis of campylobacteriosis[J]. Clinical and Developmental Immunology, 2013. doi∶ 10.1155/2013/526860.
[23] CENTANNI M, TURRONI S, BIAGI E, et al. A novel combined approach based on HTF-Microbi. Array and qPCR for a reliable characterization of the Bifidobacterium-dominated gut microbiota of breast-fed infants[J]. FEMS Microbiology Letters, 2013, 343(2)∶121-126.
[24] 李俊洁, 陈庆森. 双歧杆菌调理和改善肠道相关疾病作用的研究进展[J]. 食品科学, 2011, 32(23)∶ 326-332.
[25] 王建, 李紫娟, 汪长钢, 等. 双歧杆菌促生长因子的筛选[J]. 中国酿造, 2012, 31(8)∶ 109-111.
[26] 任效东, 陈庆森, 李俊洁, 等. 酪蛋白糖巨肽和乳铁蛋白灌胃对小鼠肠道微生物定殖抗力的影响[J]. 食品科学, 2013, 34(9)∶ 282-286. doi∶ 10.7506/spkx1002-6630-201309057.
[27] 曹晋宜, 陈庆森, 梁晨曦, 等. 酪蛋白糖巨肽(CGMP)对小鼠盲肠中微生物区系的影响[J]. 食品科学, 2008, 29(10)∶ 582-585.
Real-Time PCR for Detecting the Growth-Promoting Effect of Casein Glycomacropeptide on Intestinal Bifidobacteria in Mice
JIANG Yan, CHEN Qingsen*
, LI Junjie, YAN Yali, ZHAO Pei
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Abstract:
Purpose∶ Toanalyze the growth-promoting effects of different doses of casein glycomacropeptide (CGMP) on intestinal bifi dobacteria in mice by
quantitativereal-time polymerase chain reaction PCR (qRT-PCR), which reveal whethe r or not CGMP derived from milk is able to proliferate the key intestinal probiotics. Methods: A total of 50 healthy
BALB/c mice were randomlydivided into fi ve groups: control group (daily diet), placebo group (0.2 mL of normal saline), low-, mode rate-, high-dose CGMP treatments (the same volume as normal saline at different concentrations).
The administration durati on was 2 weeks.We took the fresh feces of mice after 0, 3, 5, 7, 9, 11, 13 and 15 consecutive days of once-daily administration and at 6 days after the last administration for genomic DNA extraction. Five pairs of group-specifi c primers for bifi dobacteria were designed according to 16S rRNA sequence.
Bifi dobacterium bifi dum
CICC6071 was used to make the standard curve by gradient dilution to determine the response sensitivity. The melting curves of PCR products were used to evaluate the specificity. The results indicated that qRT-PCR could accurately quantify the number of mouse intestinal bifidobacteria. The moderate dose of CGMP could promote the growthof bifi dobacteria and the number of bifi dobacteria reached the maximum after 11 days of administration. This study demonstrates that CGMP from milk has the function of regulating the mouse intestinal bifi dobacteria in a dose-dependent manner.
Key words:
real-time polymerase chain reaction; casein glycomacropeptide (CGMP);
Bifi dobacterium
; mouse feces
中图分类号:
TS252.9
文献标志码:
A 文章编号:1002-6630(2015)17-0219-06
文章编号:1002-6630(2015)17-0219-06
doi:10.7506/spkx1002-6630-201517041
收稿日期:2015-04-17
基金项目:国家自然科学基金面上项目(31071522)
作者简介:江岩(1990—),女,硕士研究生,研究方向为发酵生物技术。E-mail:jiangyanjssh@126.com
*通信作者:陈庆森(1957—),男,教授,硕士,研究方向为发酵生物技术、蛋白资源开发与应用。E-mail:chqsen@tjcu.edu.cn