表1 正交试验因素与水平
Table1 Factors and levels used in orthogonal array experiments
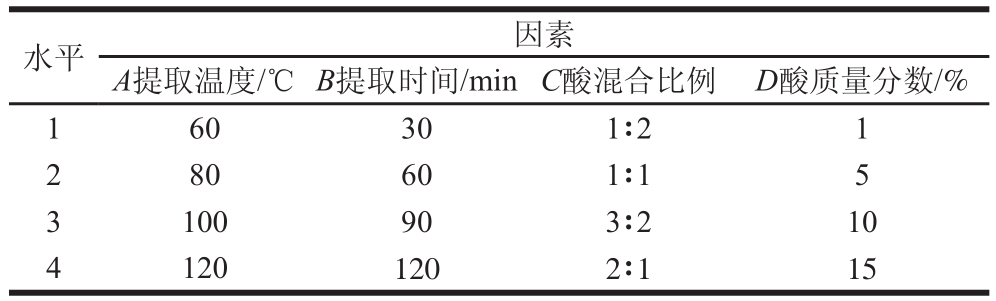
水平因素A提取温度/℃B提取时间/minC酸混合比例D酸质量分数/% 160301∶21 280601∶15 3100903∶210 41201202∶115
王珊珊 1,2,李八方 1,*,周德庆 2,侯 虎 1
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.中国水产科学研究院黄海水产研究所,山东 青岛 266071)
摘 要:目的:以水产加工下脚料鳕鱼骨为原料,探讨鳕鱼骨活性钙的最佳制备条件,并对其生物利用度进行研究。方法:对鱼骨进行基本组成分析与组织学观察;采用正交试验确定鱼骨活性钙的最佳提取条件;采用低钙饮食建立大鼠缺钙模型,检测大鼠血清生化指标、骨钙含量及钙代谢指标,对鱼骨活性钙的生物利用度进行探讨。结果:鳕鱼骨中钙与磷含量分别达到207.8 mg/g和100.9 mg/g,其比值接近2∶1。扫描电镜观察发现鳕鱼骨表面具有坚固致密的扁平板状羟基磷灰石结晶。活性钙最佳提取条件为提取温度100 ℃、提取时间120 min、酸混合比例(柠檬酸-苹果酸体积比)1∶2、酸质量分数15%,在此条件下提取率达到96.15%。与空白对照组相比,活性钙各剂量组能显著提高大鼠骨钙含量。钙代谢实验测定结果显示,活性钙高剂量组钙吸收率显著高于相同钙水平的碳酸钙对照组。结论:鳕鱼骨可作为一种优良的天然钙源,鱼骨活性钙能够作为一种有效的钙营养强化剂加以开发。
关键词:鳕鱼骨;活性钙;生物利用度;钙营养强化剂;高值化利用
钙是人体中含量最丰富的矿质元素之一,在人体生命维持与物质代谢方面发挥着重要作用 [1-2]。大量研究发现儿童与青少年时期摄入足量的钙有助于获得最佳的骨密度峰值 [3-6],绝经后的妇女及70 岁以上老年男性摄入足量的钙将会减缓骨量的流失速率,从而降低罹患骨质疏松症的风险 [7-10]。在我国城市地区钙的平均摄入量仅为439 mg/d [11],远未达到中国营养学会推荐的每日摄入剂量(800~1 000 mg/d) [12],因此通过钙营养强化剂合理补钙并促进人体对钙的吸收至关重要。使用柠檬酸和苹果酸所提取的复合钙盐果酸活性钙,是一种新型钙营养强化剂。目前国内外对果酸活性钙的开发和利用已有相关报道,但以鳕鱼骨为原料进行提取制备与生物学评价的研究还相对较少。
鳕鱼骨约占鱼体质量的15% [13],是鳕鱼加工业中的主要副产物。鱼骨钙大多是以羟基磷灰石结晶形式存在,导致钙的溶出量甚微。目前,国内已有对鱼骨钙进行开发利用的报道,例如霍健聪等 [14]制备鱼骨钙片并进行生物利用研究;王建中等 [15]以青鱼骨为钙源制备骨粉;吴燕燕等 [16]以罗非鱼骨为原料制取骨钙且探讨钙的生物利用;邵明栓等 [17]以斑点叉尾鮰鱼骨进行脱脂然后制备活性钙。为了提高钙的吸收利用率,使丰富的鳕鱼骨资源能够得到更好的利用,本实验将对鳕鱼骨活性钙的最佳制备工艺进行探讨,并研究其生物利用度,为鳕鱼骨资源的综合利用提供理论依据。
1.1 材料与试剂
冷冻状态下的鳕鱼(Gadus macrocephalus)鱼排青岛福生食品有限公司。
雄性Wistar大鼠45 只(体质量(110±10)g,清洁级,合格证号:0013862) 山东鲁抗医药质检中心实验动物中心。
柠檬酸、苹果酸、硝酸、高氯酸、无水乙醚等试剂均为国产分析纯;血清钙、血清磷及血清碱性磷酸酶等测定试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
JouanBR4i型冷冻离心机 法国Jouan公司;Sartorius1-14型高速离心机 德国Sigma公司;722S型分光光度计 上海精密仪器有限公司;AA-6800原子吸收分光光度计 岛津制作所仪器有限公司;680型酶标仪美国Bio-Rad公司。
1.3 方法
1.3.1 基本组成分析与组织结构观察
1.3.1.1 基本组成分析
水分含量的测定参照GB 5009.3—2010《食品中水分的测定》;蛋白质含量的测定参照GB 5009.5—2010《食品中蛋白质的测定》;灰分含量的测定参照GB 5009.4— 2010《食品中灰分的测定》;粗脂肪含量的测定参照GB/T 14772—2008《食品中粗脂肪的测定》。
1.3.1.2 矿物质元素组成分析
钙含量的测定参照GB/T 5009.92—2003《食品中钙的测定》;磷含量的测定参照GB/T 5009.87—2003《食品中磷的测定》;镁含量的测定参照GB/T 5009.90—2003《食品中铁、镁、锰的测定》;锌含量的测定参照GB/T 5009.14—2003《食品中锌的测定》;铜含量的测定参照GB/T 5009.13—2003《食品中铜的测定》;砷含量的测定参照GB/T 5009.11—2003《食品中总砷及无机砷的测定》;镉含量的测定参照GB/T 5009.15—2003《食品中镉的测定》。
1.3.1.3 微观结构的观察
将样品在液氮中粉碎,固定后真空喷金,将加速电压设为20 kV,使用JEOL JSM-840型扫描电镜对其显微结构进行观察。
1.3.2 活性钙的制备工艺优化
1.3.2.1 活性钙制备流程
鱼骨原料→酶解处理→NaOH处理→清洗→粉碎→混合酸活化处理→取上清液,冷冻干燥
1.3.2.2 预处理
将鱼排切成5 cm左右,取1 kg原料,加入5 g中性蛋白酶和1 000 mL水进行酶解(55 ℃,pH 7.5)2 h。酶解结束后洗去杂质,将鱼骨放入0.1 mol/L NaOH溶液(料液比1∶10(g/mL))搅拌24 h,以去除残留的盐溶性蛋白。将鱼骨洗至中性后105 ℃烘干,使用万能粉碎机粉碎后,再用混合酸提取(活化)。最后取上清液,冷冻干燥。
1.3.2.3 单因素试验
单因素试验基本条件为:提取温度100 ℃、酸质量分数10%、酸混合比例1∶1(柠檬酸-苹果酸,V/V)、提取时间60 min。改变其中一个条件,固定其余条件来分析提取温度、酸质量分数、酸混合比例和提取时间对钙提取率的影响。每个因素设4 个水平:提取温度(60、80、100、120 ℃)、酸质量分数(1%、5%、10%、15%)、酸比例(1∶2、1∶1、3∶2、2∶1)和提取时间(30、60、90、120 min)。
1.3.2.4 正交试验设计
根据单因素试验结果,以钙提取率为指标,对提取温度、酸质量分数、酸混合比例和提取时间4个因素设计正交试验L 16(4 5),如表1所示。
表1 正交试验因素与水平
Table1 Factors and levels used in orthogonal array experiments

水平因素A提取温度/℃B提取时间/minC酸混合比例D酸质量分数/% 160301∶21 280601∶15 3100903∶210 41201202∶115
1.3.2.5 钙提取率计算
1.3.3 钙剂量对大鼠钙代谢影响
1.3.3.1 动物饲养
大鼠在清洁级环境中喂养,室温保持(22±2) ℃,对室内定期进行紫外线消毒,大鼠自由饮水及摄食。低钙饲料按AIN-93配方配制(表2),钙含量调整为0.1%。
表2 饲料基本成分
Table2 The composition of low-calcium diet

组成成分含量/(g/kg)酪蛋白200玉米淀粉500蔗糖100玉米油100矿物质元素混合物35维生素混合物10酒石酸氢胆碱2纤维素50 DL-蛋氨酸3
1.3.3.2 动物分组
将45 只受试动物按体质量随机分为5 组,设活性钙样品低、中、高3 个剂量组,分别灌胃不同剂量水平样品(Ca 2+剂量水平分别为50、100、200 mg/kg);同时设立碳酸钙对照组(与活性钙高剂量组钙水平相同),空白对照组灌胃同体积生理盐水。所有大鼠均摄食低钙饲料,饮用去离子水。实验期间每周称量体质量,记录体质量变化及饲料摄入量,连续灌胃4 周。
1.3.3.3 钙代谢实验
生长实验结束后进行3 d钙代谢实验,将动物移入代谢笼,分别收集每只受试动物72 h的粪便与尿液,并准确记录每只受试动物的饲料摄食量;测定饲料、粪便与尿液中的钙含量。按式(2)~(6)计算钙的表观吸收率与储留率:

1.3.3.4 血清指标测定
腹主动脉取血后,血液室温静置30 min,4 000 r/min离心10 min,分离血清后于-35 ℃贮存。血钙、血磷和碱性磷酸酶含量均按照说明书,采用相应试剂盒进行测定。
1.3.3.5 股骨指标测定
剥离大鼠股骨,剔除肌肉和筋膜后称质量;测其长度和宽度,同时测定骨钙含量。
1.3.3.6 钙含量测定
饲料、粪便、尿液和股骨中钙含量的测定均采用GB/T 5009.92—2003《食品中钙的测定》方法。操作参数:混合酸消化液(硝酸-高氯酸混合体积比为4∶1),消化样品至无色透明后使用去离子水定容;波长设定为422.7 nm,光源为可见光,火焰为空气-乙炔;标准溶液系列质量浓度范围为0.25~2 μg/mL,稀释溶液20 g/L氧化镧溶液。
1.4 数据分析
所有数据以±
 表示,采用SPSS 11.0软件对数据进行单因素方差分析(ANOVA),同时进行多重比较检验。以P<0.05为有显著性差异。
表示,采用SPSS 11.0软件对数据进行单因素方差分析(ANOVA),同时进行多重比较检验。以P<0.05为有显著性差异。
2.1 基本组成含量分析与组织结构观察
2.1.1 基本组成含量分析如表3所示,鱼骨中水分含量较高,粗蛋白含量低于鱼肉。由于鱼骨的主要无机成分是羟基磷灰石,因此鱼骨中灰分的含量远高于鱼肉。Kittiphattanabawon等 [18]测得大眼鲷鱼骨中水分含量为62.3%,粗蛋白含量为13.3%,灰分含量为14.4%,与本实验对鳕鱼骨进行成分测定的结果较为接近。
表3 基本组成含量分析
Table3 Proximate analysis of fi sh bone and meat
g/100 g

原料水分含量粗蛋白含量脂肪含量灰分含量鱼骨60.1±1.814.5±0.51.2±0.419.8±0.3鱼肉71.8±0.419.3±0.61.8±0.64.7±0.6
2.1.2 矿物质元素组成含量分析
表4 样品矿物质元素组成含量分析
Table4 Mineral composition analysis of fish bone and meat

注:NT.未检出。
鱼骨中矿质元素含量Ca /(mg/g)207.8±18.3 P /(mg/g)100.9±2.4 Mg /(mg/g)6.1±1.8 Zn /(μg/g)105±9.7 Cu /(μg/g)2.3±0.4 As /(μg/g)NT Cd/ (μg/g)0.1±0.03
如表4所示,在鱼骨中钙与磷的含量较高,分别达到207.8 mg/g和100.9 mg/g。鱼骨中钙的含量高于猪腿骨(10.77%)、鸡架骨(4.33%)、鹅颈骨(7.96%)和鹅架骨(7.72%),这可能与物种间骨结构的差异及生活环境的不同有关 [19]。此外,鱼骨中的钙与磷含量的比值接近2∶1,与人体内的钙磷比接近。
2.1.3 扫描电镜观察

图1 扫描电镜观察图片
Fig.1 Scanning electron micrographs (SEM) of fi sh bone and meat
骨组织的主要无机成分为羟基磷灰石结晶和无定型磷酸钙,钙盐能够沉积在胶原原纤维上,形成坚硬的骨质。如图1A所示,可见到坚固致密的羟基磷灰石结晶,如图1B所示,可观察到结晶呈扁平的板层状,与马的骨组织扫描电镜观察结果较为相似;不同物种的骨组织显微结构有所不同,例如犬骨矿质结晶形态呈棒状 [20]。
2.2 活性钙制备工艺优化
2.2.1 单因素试验结果
2.2.1.1 提取温度对提取率的影响

图2 提取温度对提取率的影响
Fig.2 Effect of temperature on the extraction effi ciency of active calcium
如图2所示,随着提取温度的升高,活性钙的提取率亦随之提高。当提取温度为80 ℃时,提取率达到84.29%,显著高于60 ℃时所得提取率(P<0.05)。这是由于温度升高时,反应体系中溶液离子与骨粉微粒的运动加速,加快了整个反应的进程。当温度继续升高时,钙提取率会继续提高,但其增幅小于60~80 ℃的提取率变化,因此提取温度设置在80~100 ℃内较为合适。
2.2.1.2 酸质量分数对提取率的影响
如图3所示,在酸质量分数为1%时,提取率仅为28.73%,当质量分数上升至5%时,提取率迅速增至79.16%。随着酸质量分数的继续提高,活性钙的溶出率仍有升高。这说明在合适的范围内,酸质量分数的增大有利于骨粉微粒的溶解和钙的溶出。

图3 酸质量分数对提取率的影响
Fig.3 Effect of acid concentration on the extraction effi ciency of active calcium
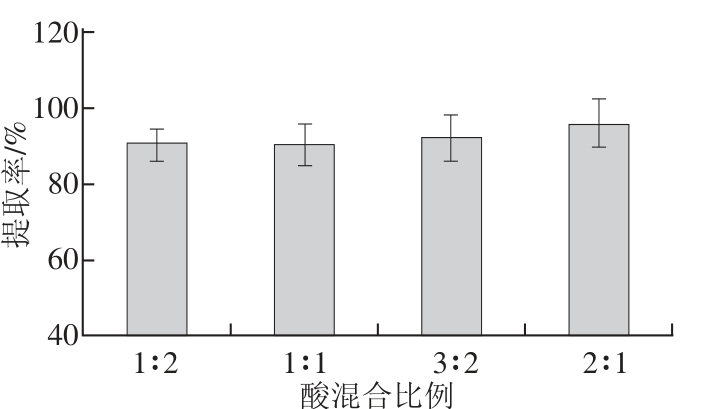
图4 酸混合比例对提取率的影响
Fig.4 Effect of acid mixing ratio on the extraction effi ciency of active calcium
2.2.1.3 酸混合比例对提取率的影响酸的混合比例对提取率的影响如图4所示,柠檬酸与苹果酸的体积比在1∶2~2∶1范围内,混合比例对钙提取率的影响并不显著(P>0.05)。
2.2.1.4 提取时间对提取率的影响
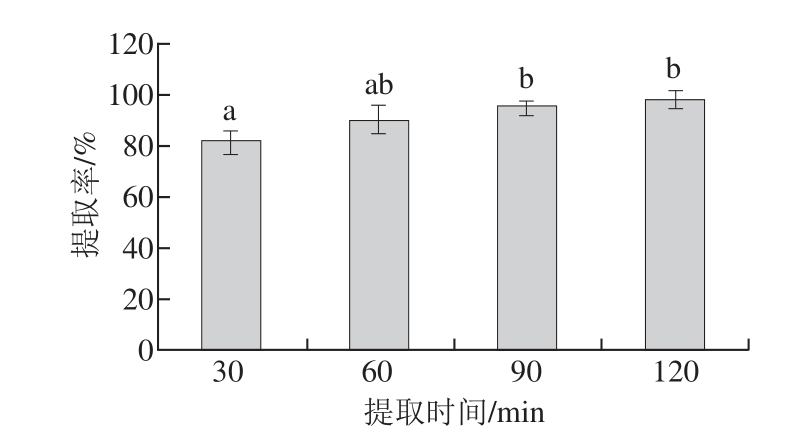
图5 提取时间对提取率的影响
Fig.5 Effect of extraction time on the extraction effi ciency of active calcium
如图5所示,随着提取时间的延长,钙的提取率随之增加,在90 min时提取率为95.01%,显著高于30 min时的提取率81.44%(P<0.05),但90 min与100 min时的钙提取率(分别为95.01%、98.11%)相差不大(P>0.05)。这可能是因为酸的质量分数较高(10%),能够在较短的时间内溶出骨粉中的钙质。
2.2.2 正交试验结果
如表5所示,各因素对鳕鱼骨中活性钙提取率的影响大小为酸质量分数>提取温度>提取时间>酸混合比例,鳕鱼骨中活性钙提取的最佳分析组合为A 3B 4C 1D 4,即提取温度100℃、提取时间120min、酸混合比例1∶2、酸质量分数15%,在此条件下钙提取率达到96.15%。
表5 正交试验设计与结果
Table5 Orthogonal experimental design and results

试验号A提取温度/℃B提取时间/min C酸混合比例D酸质量分数/%提取率/% 1 119.36±2.05 2 1 2 2 243.32±4.45 1 1 1 3 377.52±7.48 4 1 4 4 484.81±5.97 1 3 3 5 384.91±1.07 6 2 2 1 489.06±2.46 2 1 2 7 125.23±0.06 8 2 4 3 294.62±3.34 2 3 4 496.17±2.19 10324394.43±3.54 11331291.95±1.39 12342135.69±0.43 13414269.01±0.65 14423128.85±2.16 15432496.58±4.55 16441397.05±7.81 k 156.2567.3674.3627.28 k 273.4663.9265.1374.73 k 379.5672.8274.2988.48 k 472.8778.0468.3791.66 R23.3114.129.2364.38 9 3 1 3
2.3 钙剂量对大鼠体征指标影响
2.3.1 钙剂量对大鼠体质量和脏器指数的影响

图6 钙剂量对大鼠体质量(A)和脏器系数(B)的影响
Fig.6 Effects of calcium concentration on body weight and viscera indexes of rats
体质量是生物体健康的表观指标之一,体质量的异常增加与减少均说明大鼠健康情况可能出现异常。在实验期内大鼠的饮食、排便与活动情况均正常。如图6A所示,各组大鼠的体质量相差均不显著(P>0.05)。在连续灌胃28 d后,各组大鼠的脏器指数差异并不显著(P>0.05)(图6B);在解剖过程中观察各脏器均未见明显异常,初步说明活性钙对大鼠没有明显的副作用,具有较好的安全性。
2.3.2 钙剂量对大鼠股骨指标的影响
表6 钙剂量对股骨指标的影响
Table6 Effects of calcium concentration on femur physical parameters and calcium content of rats

注:*. P<0.05,与同列空白对照组差异显著;**. P<0.01,与同列空白对照组差异极显著。表7同。
组别骨质量/g长度/mm横径/mm骨钙含量/(mg/g)空白对照组0.698 2±0.078 634.742 5±0.910 74.16±0.2583.07±8.19低剂量组0.696 9±0.037 734.152 9±1.105 24.08±0.1094.97±7.04*中剂量组0.744 5±0.042 534.461 3±0.943 54.23±0.30103.57±7.50**高剂量组0.759 8±0.084 534.073 8±0.680 44.23±0.20109.11±11.17**碳酸钙对照组0.728 4±0.066 134.123 8±0.680 94.33±0.23108.49±6.86**
如表6所示,测定结果表明各组大鼠股骨的质量有提高的趋势,但并无显著性差异(P>0.05)。股骨长度、直径等指标亦无显著性差异。与空白对照组相比,样品低剂量组大鼠骨钙含量明显增加(P<0.05),中剂量、高剂量与碳酸钙对照组的骨钙含量增加极为显著(P<0.01),显示钙摄入量的提高与股骨钙含量的增加呈剂量依赖性关系。
2.4 活性钙生物利用度
2.4.1 钙剂量对大鼠血清生化指标的影响
表7 钙剂量对大鼠血清生化指标的影响Table7 Effects of calcium concentration on biochemical parameters in serum of raattss
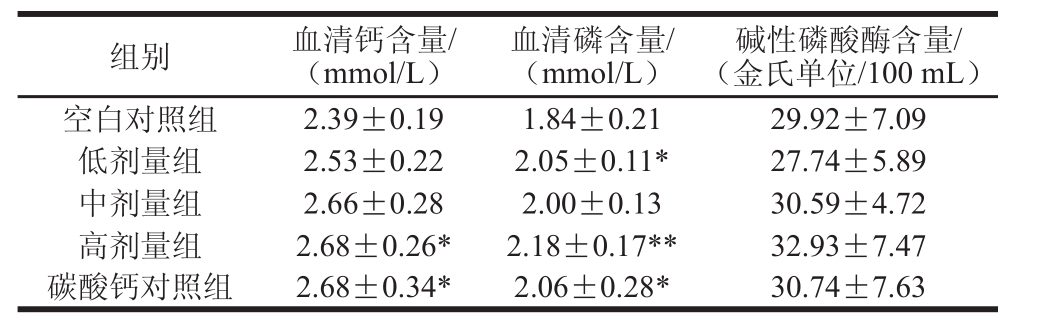
碱性磷酸酶含量/(金氏单位/100 mL)空白对照组2.39±0.191.84±0.2129.92±7.09低剂量组2.53±0.222.05±0.11*27.74±5.89中剂量组2.66±0.282.00±0.1330.59±4.72高剂量组2.68±0.26*2.18±0.17**32.93±7.47碳酸钙对照组2.68±0.34*2.06±0.28*30.74±7.63组别血清钙含量/(mmol/L)血清磷含量/(mmol/L)
如表7所示,与空白对照组相比,样品高剂量组与碳酸钙对照组血清钙含量显著增加(P<0.05);样品低剂量组与碳酸钙对照组血清磷结果与空白对照组有显著差异(P<0.05),样品高剂量组有极显著性差异(P<0.01)。与空白对照组相比,各样品组血清碱性磷酸酶含量的变化并不显著(P>0.05)。
2.4.2 钙剂量对大鼠钙代谢的影响
表8 大鼠钙代谢指标
Table8 Effects of calcium concentration on calcium absorption and retention of raattss
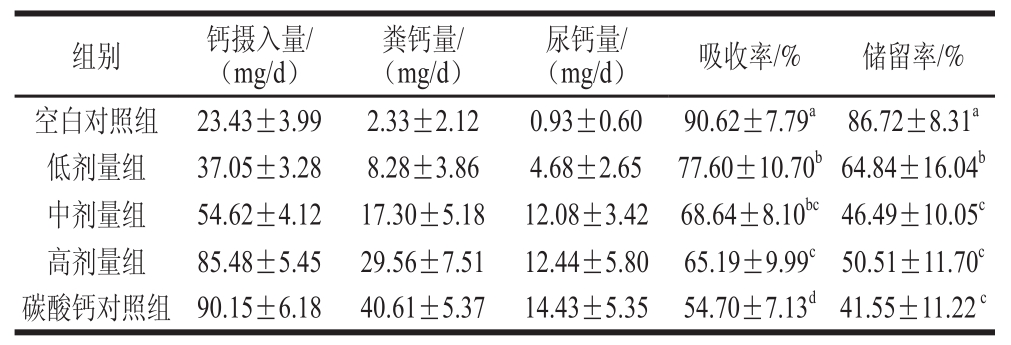
注:同列不同字母表示差异显著(P<0.05)。
组别钙摄入量/(mg/d)粪钙量/(mg/d)尿钙量/(mg/d)吸收率/%储留率/%空白对照组23.43±3.992.33±2.120.93±0.6090.62±7.79 a86.72±8.31 a低剂量组37.05±3.288.28±3.864.68±2.6577.60±10.70 b64.84±16.04 b中剂量组54.62±4.1217.30±5.1812.08±3.4268.64±8.10 bc46.49±10.05 c高剂量组85.48±5.4529.56±7.5112.44±5.8065.19±9.99 c50.51±11.70 c碳酸钙对照组90.15±6.1840.61±5.3714.43±5.3554.70±7.13 d41.55±11.22 c
钙的吸收率与储留率反映了钙在胃肠道的吸收情况,以及被吸收的钙被机体储备和用于维持正常生理功能的程度 [21]。钙在生物体中的吸收利用通常包括摄入、吸收和排泄3 个过程 [22]。如表8所示,由于空白对照组的钙摄入高度缺乏,处于“钙饥饿”状态 [23-24],因此其钙吸收率与储留率显著高于其余样品组(P<0.05)。而随着钙摄入量的逐渐提高,样品低、中、高剂量组钙的吸收率和储留率逐渐降低。与碳酸钙对照组相比,样品高剂量组的钙吸收率明显提高(P<0.05),储留率无显著差异(P>0.05)。
按照现有的保健食品评价原则和方法,对含钙产品评判标准:骨钙含量或骨密度值显著高于钙低剂量组,而且不低于相应剂量的碳酸钙对照组,同时钙的吸收率不低于碳酸钙对照组,即可判断该受试样品具有提高骨密度的作用 [25]。与空白对照组相比,鱼骨活性钙低剂量组大鼠骨钙含量明显增加(P<0.05),中、高剂量组与碳酸钙对照组骨钙含量增加极显著(P<0.01),且样品高剂量组大鼠的骨钙含量与相同钙水平的碳酸钙对照组无明显差异(P>0.05)(表6)。钙吸收率测定结果显示活性钙高剂量组的钙吸收率显著高于相同钙水平的碳酸钙对照组(P<0.05)(表8)。因此判断鱼骨活性钙可作为一种有效的钙营养强化剂。
综上所述,鳕鱼骨可作为一种优良的天然钙源。使用鳕鱼骨活性钙样品对大鼠进行钙吸收功效研究,结果表明鱼骨活性钙具有较好的安全性;与空白对照组相比,活性钙低剂量组大鼠骨钙含量明显增加(P<0.05),中剂量、高剂量骨钙含量增加极显著(P<0.01)。钙代谢实验测定结果显示鱼骨活性钙高剂量组钙吸收率显著高于相同钙水平的碳酸钙对照组(P<0.05)。
参考文献:
[1] TEEGARDEN D. Calcium intake and reduction in weight or fat mass[J]. The Journal of Nutrition, 2003, 133(Suppl 1): 249-251.
[2] LIU S, SONG Y, FORD E S, et al. Dietary calcium, vitamin D, and the prevalence of metabolic syndrome in middle-aged and older US women[J]. Diabetes Care, 2005, 28(12): 2926-2932.
[3] CADOGAN J, EASTELL R, JONES N, et al. Milk intake and bone mineral acquisition in adolescent girls: randomised, controlled intervention trial[J]. BMJ-British Medical Journal, 1997, 315(7118): 1255-1260.
[4] Jr JOHNSTON C C, MILLER J Z, SLEMENDA C W, et al. Calcium supplementation and increases in bone mineral density in children[J]. New England Journal of Medicine, 1992, 327(2): 82-87.
[5] ITO S, ISHIDA H, UENISHI K, et al. The relationship between habitual dietary phosphorus and calcium intake, and bone mineral density in young Japanese women: a cross-sectional study[J]. Asia Pacifi c Journal of Clinical Nutrition, 2011, 20(3): 411.
[6] 孙晓红, 詹国瑛. 补钙对大鼠峰值骨量形成和预防骨质疏松的作用[J].营养学报, 2001, 23(1): 40-43.
[7] CHEVALLEY T, RIZZOLI R, NYDEGGER V, et al. Effects of calcium supplements on femoral bone mineral density and vertebral fracture rate in vitamin-D-replete elderly patients[J]. Osteoporosis International, 1994, 4(5): 245-252.
[8] PRINCE R, DEVINE A, DICK I, et al. The effects of calcium supplementation (milk powder or tablets) and exercise on bone density in postmenopausal women[J]. Journal of Bone and Mineral Research, 1995, 10(7): 1068-1075.
[9] RIGGS B L, O’FALLON W M, MUHS J, et al. Long-term effects of calcium supplementation on serum parathyroid hormone level, bone turnover, and bone loss in elderly women[J]. Journal of Bone and Mineral Research, 1998, 13(2): 168-174.
[10] SHEA B, WELLS G, CRANNEY A, et al. Meta-analysis of calcium supplementation for the prevention of postmenopausal osteoporosis[J]. Endocrine Reviews, 2002, 23(4): 552-559.
[11] 中国居民营养与健康状况调查报告之三: 2002居民体质与营养状况[M]. 北京: 人民卫生出版社, 2006.
[12] 中国营养学会. 中国居民膳食营养素参考摄入量[M]. 北京: 中国轻工业出版社, 2001.
[13] GILDBERG A, ARNESEN J A, CARLEHÖG M. Utilisation of cod backbone by biochemical fractionation[J]. Process Biochemistry, 2002, 38(4): 475-480.
[14] 霍健聪, 邓尚贵, 童国忠. 鳕鱼骨钙片的制备及其生物利用[J]. 水产学报, 2010, 3(4): 382-388.
[15] 王建中, 邓仁芳, 朱瑞龙. 淡水鱼鱼头与鱼骨的利用[J]. 食品科学, 1994, 15(2): 47-50.
[16] 吴燕燕, 李来好, 林洪. 罗非鱼骨制备CMC 活性钙的工艺及生物利用的研究[J]. 食品科学, 2005, 26(2): 114-117.
[17] 邵明栓, 陶敏, 向蔚, 等. 斑点叉尾鮰鱼骨脱脂及其制备CMC活性钙的工艺优化[J]. 食品科学, 2010, 31(20): 111-115.
[18] KITTIPHATTANABAWON P, BENJAKUL S, VISESSANGUAN W, et al. Characterisation of acid-soluble collagen from skin and bone of bigeye snapper (Priacanthus tayenus)[J]. Food Chemistry, 2005, 89(3): 363-372.
[19] 薛长湖, 李兆杰. 由鳕鱼排制备活性钙[J]. 青岛海洋大学学报: 自然科学版, 1995, 25(2): 173-179.
[20] OLSZTA M J, CHENG X, JEE S S, et al. Bone structure and formation: a new perspective[J]. Materials Science and Engineering: R: Reports, 2007, 58(3): 77-116.
[21] JACKSON M J. The assessment of bioavailability of micronutrients: introduction[J]. European Journal of Clinical Nutrition, 1997, 51(1): 1-2.
[22] GUÉGUEN L, POINTILLART A. The bioavailability of dietary calcium[J]. Journal of the American College of Nutrition, 2000, 19(Suppl 2): 119-136.
[23] 何丽, 薛安娜, 付萍. 多种钙剂不同钙含量对大鼠钙吸收及骨密度的影响[J]. 卫生研究, 2002, 31(4): 258-260.
[24] 吕莹. 大豆肽结合钙的机制及其促进机体钙吸收和增强骨质量的生物学效应[D]. 北京: 中国农业大学, 2010.
[25] 卫生部. 卫法监发[2003]42号 保健食品检验与评价技术规范[S]. 2003版.
Optimization of Preparation Process for Active Calcium from Cod Bone by Orthogonal Array Experiments and Its Oral Bioavailability in Vivo
WANG Shanshan
1,2, LI Bafang
1,*, ZHOU Deqing
2, HOU Hu
1
(1. College of Food Science and Technology, Ocean University of China, Qingdao 266003, China; 2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China)
Abstract:Objective: To determine the optimum conditions for the preparation of active calcium from cod bone through orthogonal array experiments and to investigate its bioavailability. Methods: Compositional analyses and histological observation of cod bone were performed. The optimum parameters for preparng active calcium from cod bone were obtained by orthogonal array experiments. The calcium defi ciency model in rats induced by low-calcium diet was used to investigate the calcium bioavailability by detecting the contents of serum calcium and bone calcium and the indicators of calcium metabolism. Results: The contents of calcium and phosphorous in cod bone were 207.8 mg/g and 100.9 mg/g, respectively, indicating a ratio of approximately 2:1 between the two elements. Tightly and firmly combined hydroxyapatite crystals characterized by the fl at tabular shape were found under scanning electron microscopy (SEM) observation. The optimum acid extraction conditions for active calcium from cod bone were determined as follows: extraction temperature, 100 ℃; extraction time, 120 min; ratio of citric to malic acid, 1:2; and acid concentration, 15% leading to a calcium yield of 96.15%. Compared with the blank control group, the active calcium at all doses investigated exhibited signifi cantly higher contents of femur calcium. The results of calcium metabolism experiments suggested that the calcium absorption of high dose group was signifi cantly higher than that of calcium carbonate group. Conclusions: These results demonstrate that cod bone is a good calcium resource and the active calcium extracted from cod bone possesses excellent bioavailability and could be used as a natural calcium supplement.
Key words:cod bone; active calcium; biological availability; calcium supplement; high-value utilization
中图分类号:R336
文献标志码:A
文章编号:1002-6630(2015)20-0013-06
doi:10.7506/spkx1002-6630-201520003
收稿日期:2015-01-21
基金项目:国家高技术研究发展计划(863计划)项目(2014AA093508);国家自然科学基金面上项目(31471606);青岛市博士后研究人员应用研究项目(ZQ51201415031)
作者简介:王珊珊(1984—),女,博士,研究方向为海洋生物活性物质。E-mail:wsstougao@126.com
*通信作者:李八方(1953—),男,教授,博士,研究方向为海洋生物活性物质、功能食品与制品。E-mail:bfl i@ouc.edu.cn