
刘蓄瑾,胡志和*,刘军军,邸红艳,张 莉,孙 源,朱丽萍
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
摘 要:以青蛤为研究对象,以水产品常见污染的致病菌副溶血弧菌(Vibrio parahaemolyticus)CGMCC1.1997及溶藻弧菌(Vibrio alginolyticus)CGMC1.1833为目标菌,优化超高压杀菌条件。研究选用CGMCC1.1997和CGMC1.1833两种弧菌菌株,在离体和在体状态下,采用不同压力、保压温度及时间进行处理,确定杀灭条件。结果表明,在离体状态下,300 MPa、20 ℃处理5 min或不小于300 MPa、30 ℃ 处理3 min以上,可以彻底杀灭10 8CFU/mL的弧菌;但在体状态下,即使青蛤污染的弧菌量级为10 4CFU/g,该条件仍不能彻底杀灭所污染的弧菌,说明青蛤的肌肉组织对弧菌的杀灭有保护作用。经过优化得到超高压杀灭青蛤中弧菌(污染菌的量级为10 4CFU/g)的条件为500 MPa、30 min、30 ℃或400 MPa、30 min、40 ℃或600 MPa、20 min、40 ℃,这些条件下,同样可杀灭青蛤体内污染更高数量级(10 7CFU/g)弧菌,说明青蛤肌肉组织对高压杀灭弧菌的保护作用是有限度的。因此,超高压处理可以杀灭青蛤污染的弧菌;在一定压力条件下,青蛤的肌肉组织对弧菌的杀灭有保护作用,但其保护作用是有限度的。
关键词:青蛤;副溶血弧菌;溶藻弧菌;超高压
青蛤(Cylcina sinensis)俗称蛤蜊,在我国各沿海地区均有分布。青蛤中丰富的氨基酸及多不饱和脂肪酸使其具有预防疾病及保健作用 [1-3],潜海生存的习性使其具有咸、寒的药性,是滋阴清热的良药 [4-5]。青蛤中优质蛋白质含量高 [6-7],新鲜青蛤有“天下第二鲜的美誉”。贝类因滤食的摄食方式,极易受到水环境中致病菌及病毒的侵害并在体内蓄积,食用加工不当的贝类易造成安全性问题。国家食源性疾病监测网数据表明,副溶血弧菌引发的食物中毒规模出现明显上升,危害仅次于沙门氏菌、大肠杆菌、葡萄球菌和肉毒梭菌 [8-9]。
近年来,为了“鲜上加鲜”的味觉享受及柔嫩的口感,以及对原汁味、高营养的诉求,更多人选择生食,这为寄生虫及致病菌对人类的感染埋下隐患。超高压处理作为一种冷加工技术,既可以起到杀菌的效果,又能很好地保持食品固有的色泽、口感、营养、新鲜程度等,对食品的风味、维生素等营养物质没有破坏作用 [10]。本实验针对青蛤容易污染的两种嗜盐性致病 菌:副溶血弧菌(Vibrio parahaemolyticus)和溶藻弧菌(Vibrio alginolyt icus),利用超高压处理,研究不同压力、时间和温度对两种弧菌的杀灭条件,比较两种弧菌在离体状态与在贝类体内(在体状态)对压力耐受性的差异,为研究高压处理青蛤的食用安全性提供数据支持。
1.1 材料、菌种与试剂
青蛤(Cylcina sinensis) 天津韩家墅水产品市场。
CGMCC1.1997 Vibrio parahaemolyticus、CGMC1.1833 Vibrio alginolyticus 中国微生物菌种保藏管理中心。
3%氯化钠胰蛋白胨大豆琼脂(tryptic soy agar,TSA)、平板计数琼脂、3%氯化钠碱性蛋白胨水(3% NaCl alkaline peptone water,3% N-APW)、硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基(thiosulfate citrate bile salts sucrose agar culture medium,TCBS) 北京陆桥技术有限责任公司。
氯化钠、丙三醇 天津市风船化学试剂科技有限公司。
1.2 仪器与设备
HPP.L3-800/2.5超高压设备 华泰森淼生物工程技术有限公司;DC-2030节能型智能恒温槽(控制超高压处理的温度) 宁波新芝生物科技股份有限公司;HWS-24电热恒温水浴槽 上海一恒科学仪器有限公司;FA25-18G实验室高切分散乳化机 上海弗鲁克流体机械制造有限公司;HS-50立式压力蒸汽灭菌器 江阴滨江医疗设备有限公司;HFsafe-900生物安全柜 上海力申科学仪器有限公司;SW-GT-1F超净工作台 上海博迅医疗设备有限公司;CLIN-250生化培养箱 天津华北实验仪器有限公司;TCC-240A紫外分光光度计 日本Shimadzu公司;20菌落计数器 意大利Astor Tecnica公司。
1.3 方法
1.3.1 菌种活化及保存
菌种活化:无菌操作吸取0.5 mL 3% N-APW,滴入安瓿管内,轻轻振荡,使冻干菌体溶解呈均匀地悬浮状。将全部菌液移入5 mL 3% N-APW中,(36±1) ℃培养24~48 h,观察菌液是否混浊,若无混浊增加一倍培养时间。至菌液混浊,无菌操作用接种环挑取菌液进行斜面接种,37℃培养18~24 h,根据长势进行二次接种。将斜面培养基4 ℃保存备用。
甘油管冻存:待菌种复壮,无菌操作用接种环挑取菌液接种至5 mL 3% N-APW中增菌培养至对数期,移取适量菌液于EP管中,加灭菌甘油调节终浓度至20%~30%,4 ℃预冷后于-80 ℃冻存。
1.3.2 生长曲线
取活化后的菌液接入3% N-APW增菌液中,用紫外分光光度计测定初始菌液600 nm波长处光密度值(3% N-APW做空白对照),后置于37℃摇床160 r/min培养24 h,每隔1 h测定菌液吸光度(每组3 个平行),绘制生长曲线。
致死率和存活率计算见公式(1)和(2)。

1.3.3 超高压处理
1.3.3.1 超高压处理对弧菌的影响
取活化后菌种增菌培养至对数期,用3% N-APW调整菌浓至10 8、10 7、10 6、10 5、10 4CFU/mL分装于10 mL无菌袋中真空密封包装后,于不同压力(100~350 MPa)、保压温度(20~50 ℃)、保压时间(1~5 min)进行处理,研究压力、温度和保压时间对两种弧菌存活的影响,每组样品重复3 次。
依据单因素试验结果,进行三因素三水平正交试验,优化超高压杀灭副溶血弧菌/溶藻弧菌的条件。
1.3.3.2 超高压处理对青蛤中弧菌及菌落总数的影响
将新鲜青蛤用无菌水清洗表面,挑选大小均匀的8 个为一组,分装于无菌袋中,加无菌水浸没后真空密封包装后,再不同压力(300~700 MPa)、保压温度(20~50 ℃)、保压时间(5~40 min)条件下进行处理,研究对青蛤中弧菌的影响,每组样品重复3 次。
依据单因素试验结果,进行三因素三水平正交试验,优化超高压杀灭青蛤中微生物的条件。
1.3.4 微生物的测定
根据GB 4789.7—2013《食品微生物学检验:副溶血弧菌检验》 [11]检测超高压后的菌液/贝肉匀浆液中弧菌。10 倍梯度稀释,取1 mL样液于培养皿中;3%氯化钠-胰蛋白胨大豆琼脂倾倒平板,每组样品2 个平行;置于37 ℃培养24 h;平板菌落计数,取平均值。
根据GB 4789.2—2010《食品微生物学检验:菌落总数测定》 [12]检测菌落总数。
1.4 数据处理
将每组菌落计数得到的平均值转化为对数值,用SPSS 16.0进行多重比较分析及显著性分析,比较不同处理条件对弧菌存活量的影响及离体与在体状态下弧菌对超高压耐受性的差异;图表制作利用Origin 8软件。
2.1 菌落数与OD值关系曲线
无菌操作取活化后菌液,调整菌浓约10 8CFU/mL作为初始菌液,用3% N-APW分别稀释1.5、2、2.5、3、4、5 倍后迅速测定600 nm波长处OD值,并根据GB 4789.7—2013平板菌落计数。得到菌落数取对数值,与OD值对应,拟合出菌浓与OD值关系曲线(图1),y=0.738 2x+7.755 9。实验用3% N-APW 为空白对照。
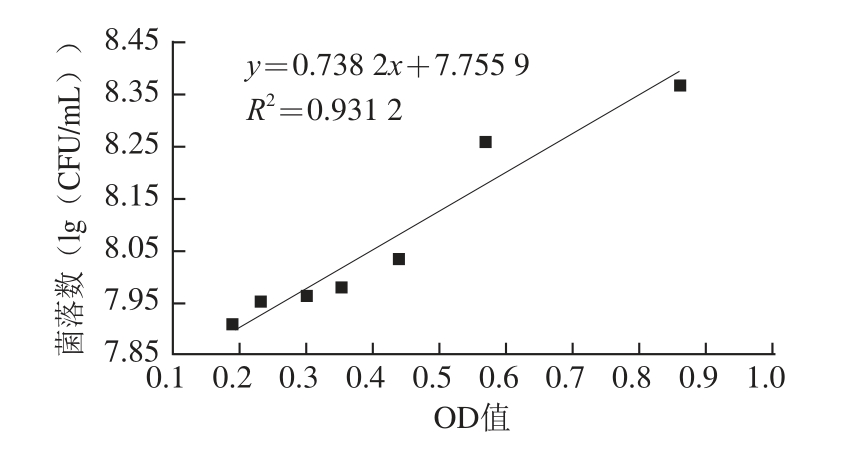
图1 菌落数与OD值关系曲线
Fig.1 Relationship curve between number of colonies and OD value
2.2 生长曲线

图2 弧菌生长曲线
Fig.2 Growth curves of Vibrio
由图2可知,两种弧菌在4~10 h内呈现指数生长状态,10~16 h为相对稳定期,18 h之后逐渐衰亡。指数生长期的细胞群体增长活跃且代谢旺盛,能较好地反映细胞性能。超高压处理中选取对数生长期后期的菌液,用3% N-APW调整菌浓至10 8CFU/mL并梯度稀释得到10 7、 10 6、10 5、10 4CFU/mL,研究超高压对不同浓度的副溶血弧菌及溶藻弧菌的影响。
2.3 超高压处理对弧菌的影响
2.3.1 时间对不同浓度弧菌的影响
不同浓度的菌液在20 ℃、200 MPa压力下处理不同时间,结果如图3所示。
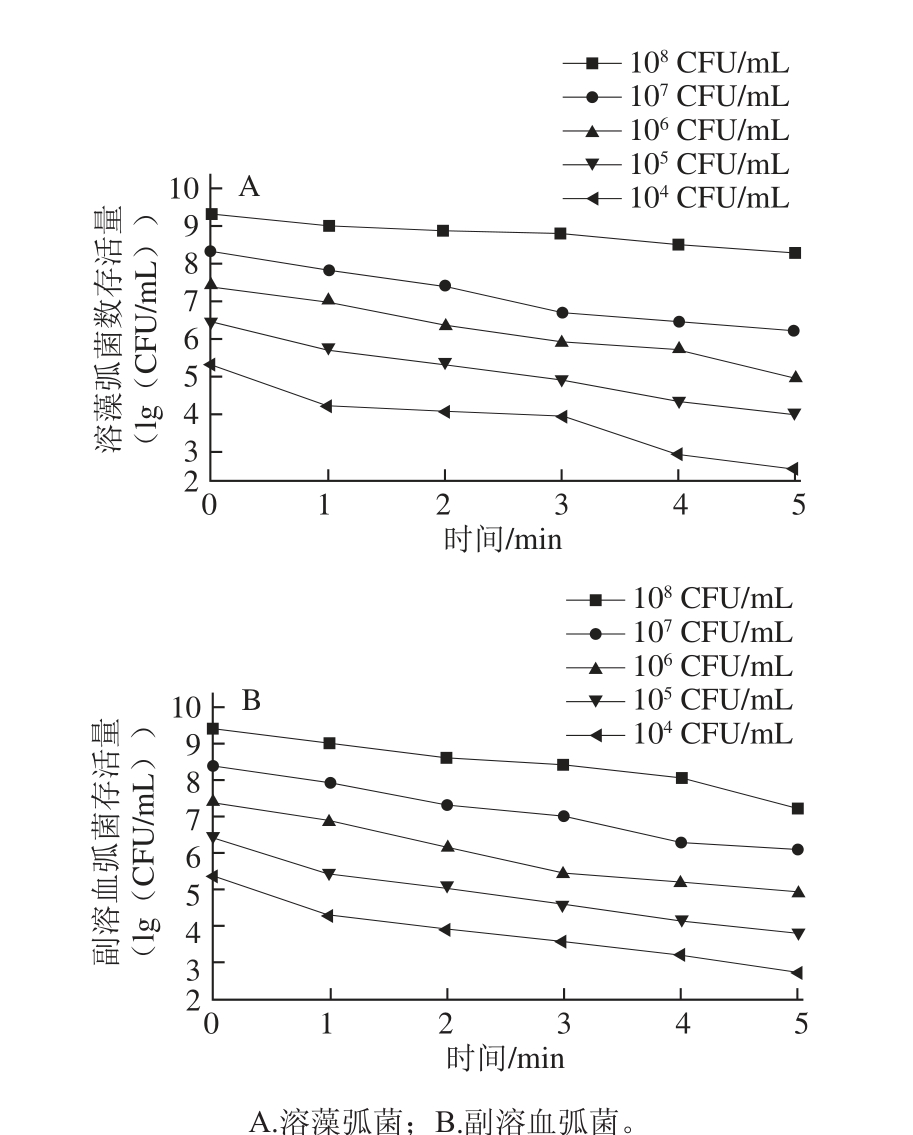
图3 200 MPa、20 ℃条件下不同时间处理对弧菌存活量的影响
Fig.3 Effect of UHP at 200 MPa and 20 ℃ on Vibrio survival
由图3可知,随着保压时间由1 min延长到5 min,溶藻弧菌和副溶血弧菌存活量均有所降低。初始菌浓为10 8~10 4CFU/mL的溶藻弧菌,在200 MPa、20℃处理1min后存活率分别为53.28%、33.82%、39.69%、17.7%、7.38%,而5 min处理后分别降至9.43%、0.74%、0.18%、0.31%、0.16%。菌浓为10 8CFU/mL的副溶血弧菌处理5 min存活率时仅为0.65%。超高压处理随时间延长对弧菌存活量削减效果明显。
由图3中弧菌存活量变化趋势来看,两种弧菌存活率的下降趋势均较平稳,在5 min时存活量达到较低水平,但与3、4 min处相比均差异显著,因此选取3、4、5 min进行正交试验。
2.3.2 压力对不同浓度弧菌的影响
不同浓度的菌液在20 ℃不同压力下处理3 min,结果如图4所示。随压力增大,溶藻弧菌和副溶血弧菌存活量都明显减少。150 MPa时,菌浓为10 8~10 4CFU/mL的溶藻弧菌存活率分别为72.69%、51.96%、36.92%、34.36%、35.11%;250 MPa时,菌浓为10 8CFU/mL的溶藻弧菌存活率仅为1.77%,10 7~10 4CFU/mL的溶藻弧菌存活率均在0.01%以下;300 MPa时,菌浓为10 7~10 4CFU/mL的溶藻弧菌存活率均为0,而10 8CFU/mL的溶藻弧菌无法彻底杀灭;压力达到350 MPa时,10 8~10 4CFU/mL的溶藻弧菌均可被彻底杀灭。300 MPa时10 8和10 7CFU/mL的副溶血弧菌无法彻底杀灭,此时10 6~10 4CFU/mL的副溶血弧菌存活率均为0;当压力为350 MPa时,10 8~10 4CFU/mL的副溶血弧菌均可被彻底杀灭。
200 MPa以上压力处理对弧菌起到很好的削减效果,压力为300 MPa时菌浓低于10 6CFU/mL的弧菌可被杀灭,达到350 MPa时10 8CFU/mL的弧菌均可被杀死。因此,选取200、250、300 MPa进行正交试验。
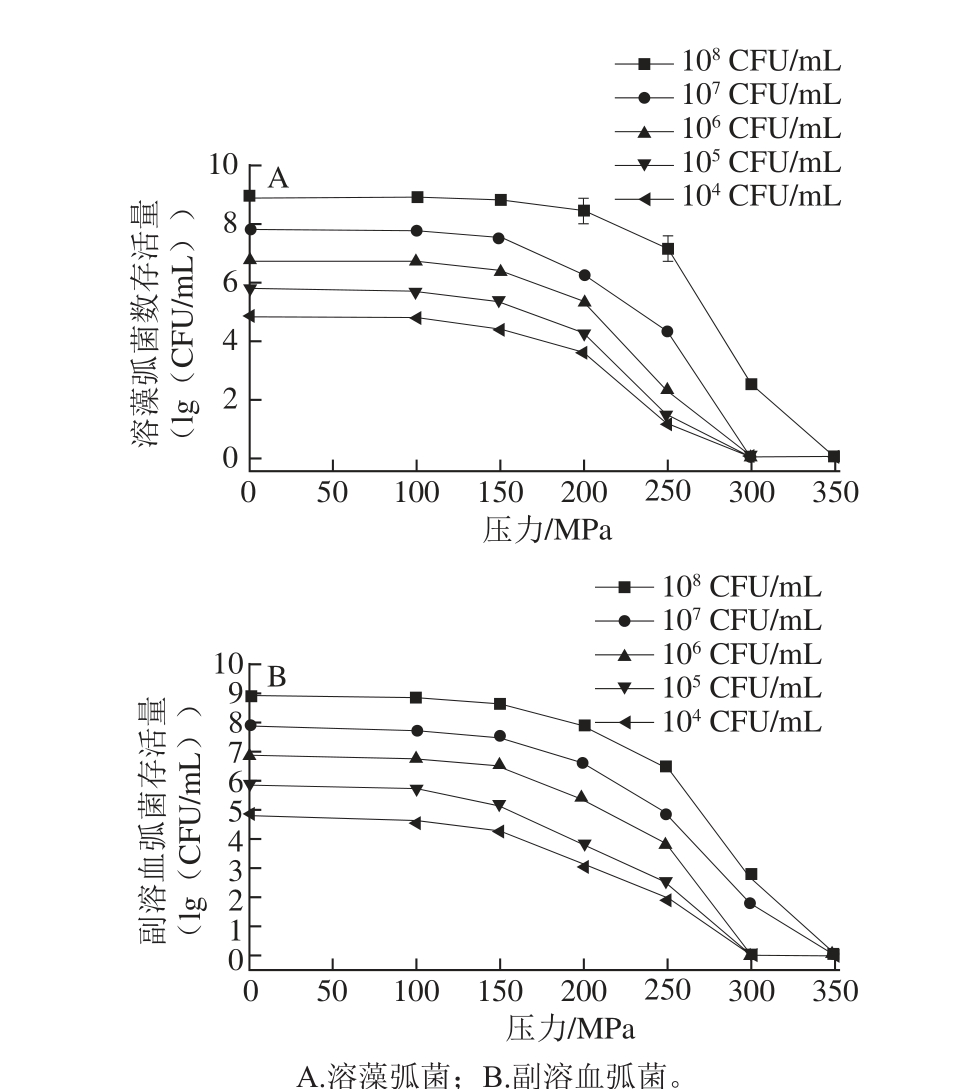
图4 20 ℃、3 min条件下不同压力处理对弧菌存活量的影响
Fig.4 Effect of UHP at 20 ℃ and different pressures for 3 min on Vibrio survival
2.3.3 温度对不同浓度弧菌的影响
不同浓度的菌液在不同温度条件下,300 MPa压力处理3 min,结果如图5所示。随着温度的升高,弧菌存活量逐渐减少。20 ℃时10 8~10 4CFU/mL的溶藻弧菌存活率分别为29.02%、2.67%、2.44%、2.58%、2.26%;当温度达到40 ℃时,不同菌浓溶藻弧菌和副溶血弧菌存活率均已不足0.1%,当温度达到50 ℃时,菌浓在10 7CFU/mL以下的溶藻弧菌存活量为0,此时菌浓在10 6CFU/mL以下的副溶血弧菌均可被彻底杀灭。
由此看出弧菌温度耐受性较差。有研究 [13]指出,副溶血弧菌在55 ℃、10 min即可杀灭。
为验证弧菌在50 ℃是耐受性,将活化后菌液调整菌浓为10 8CFU/mL,取10 mL于无菌袋中真空密封分装16 份,置于50 ℃水浴锅中水浴,在0、3、5、 7、9、11、13、15 min时分别取出2 份(平行),平板菌落计数,结果如图6所示。由图6可以看出,弧菌在50 ℃环境中随着时间的延长,存活量逐渐降低,13 min时两种菌都无法检出。综上,选取20、30、40 ℃进行正交试验。
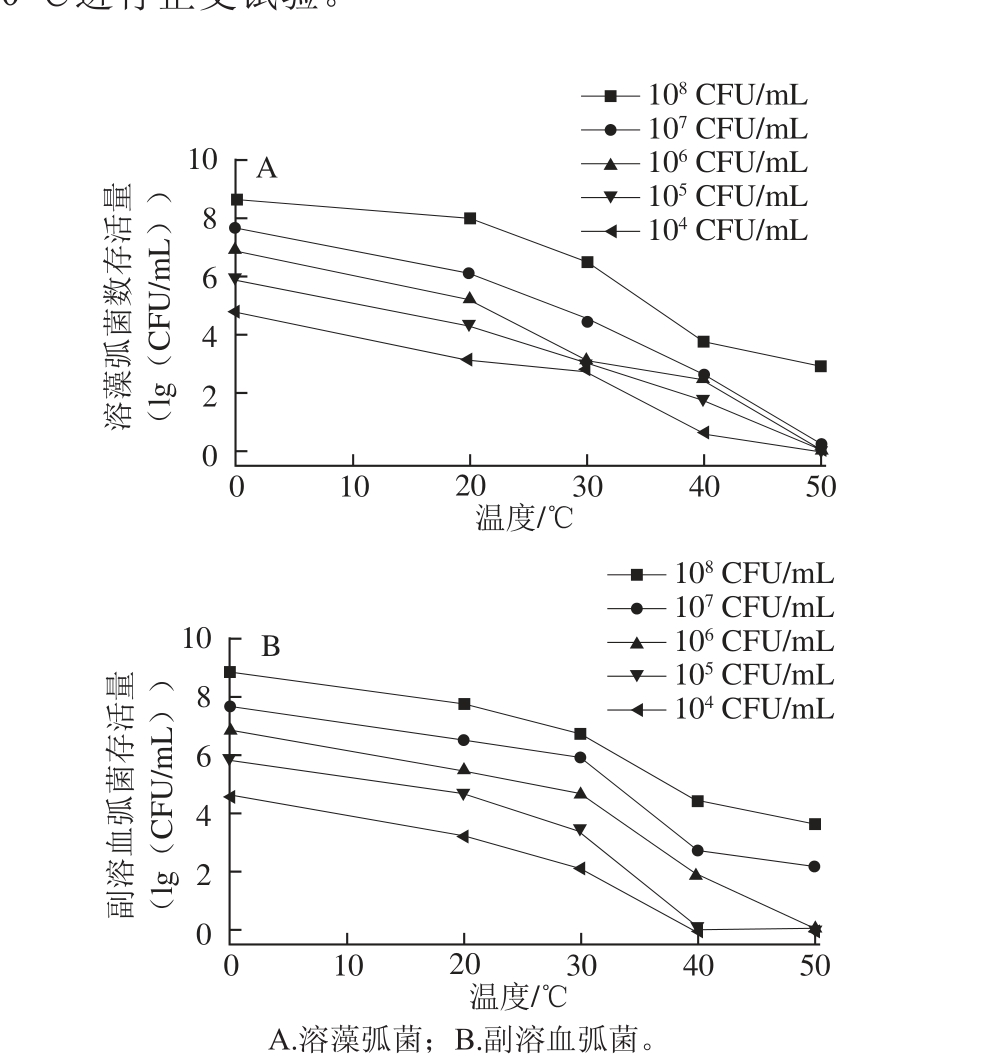
图5 200 MPa、3 min条件下不同温度处理对弧菌存活量的影响
Fig.5 Effect of UHP at 200 MPa and different temperatures for 3 min on Vibrio survival
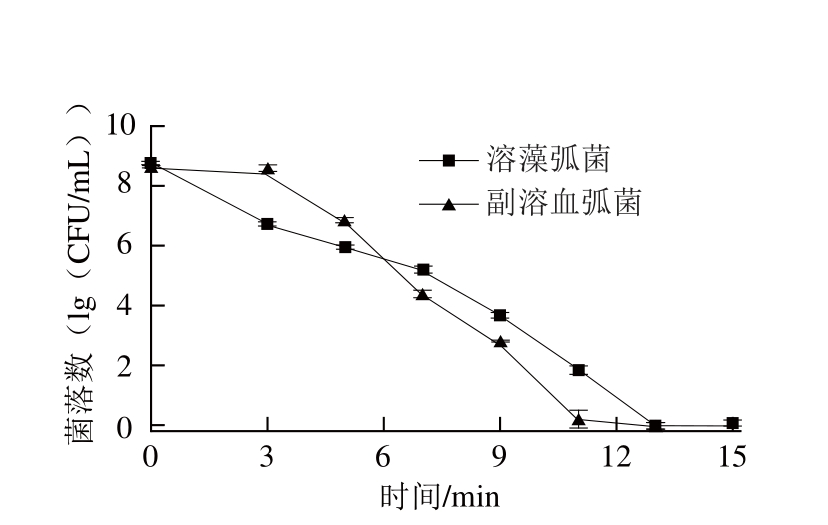
图6 弧菌50 ℃耐受性
Fig.6 Survival rates of Vibrio at 50 ℃
2.3.4 超高压杀灭弧菌条件的优化
由单因素试验结果选取出压力(200、250、 300 MPa)、温度(20、30、40 ℃)、时间(3、4、5 min)进行三因素三水平正交试验,优化杀灭弧菌的条件,选取菌液浓度为10 8CFU/mL的副溶血弧菌和溶藻弧菌。
由表1分析k值得到溶藻弧菌最优组合为A 3B 3C 3(300 MPa、40 ℃、5 min),经验证,该条件下溶藻弧菌致死率为100%;分析副溶血弧菌的k’值可知A 1<A 2<A 3,而B 1<B 2=B 3,C 1<C 2=C 3,经验证当压力为A 3水平时,A 3B 2C 2(300 MPa、30 ℃、4 min)、A 3B 2C 3(300 MPa、30 ℃、5 min)、A 3B 3C 2(300 MPa、 40 ℃、4 min)和A 3B 3C 3(300 MPa、40 ℃、5 min)均可将副溶血弧菌彻底杀死。
表1 弧菌杀灭条件优化结果L
9(3
4)
Table1 Orthogonal array design L
9((3
4) with experimental results of Vibrio mortality

溶血弧菌致死率/% 99.57 99.98 99.99 99.99 99.99 99.99 100.00 8 3 2 1100.00100.00 9 3 3 2100.00100.00溶藻弧菌k 196.2894.7996.32 k 298.4699.9698.42 k 3100.0099.9999.93 R3.725.203.61副溶血弧菌k 1 ’99.8599.8599.85 k 2’99.9099.9999.99 k 3’100.0099.9999.99 R’0.150.140.14
由副溶血弧菌和溶藻弧菌致死率的相关数据,在条件A 3B 1C 3(300 MPa、20 ℃、5 min)、A 3B 2C 1(300 MPa、30 ℃、3 min)和A 3B 3C 2(300 MPa、40 ℃、4 min)时,副溶血弧菌和溶藻弧菌致死率均可达到100%。
综上,压力为300 MPa时,20 ℃处理5 min或保压温度不小于30 ℃,保压时间不小于3 min均可以彻底杀灭副溶血弧菌和溶藻弧菌,说明超高压结合温度处理可以彻底杀灭溶藻弧菌和副溶血弧菌。
2.4 在体状态下青蛤污染弧菌的杀灭条件确定
2.4.1 彻底杀灭离体状态下弧菌条件作用于青蛤的实验
将2.3.4节优化的杀菌条件,用于青蛤中弧菌的杀灭,其结果见表2。实验中购买的市售青蛤弧菌数约10 4CFU/mL(经TCBS培养基划线培养,生长状态与弧菌纯菌种相同,镜检形态一致),将筛选出的离体弧菌杀菌条件作用于青蛤,验证是否可以同样杀灭青蛤中的弧菌。
表2 离体状态下杀灭弧菌条件作用于青蛤的结果
Table2 Comparison of in vitro sterilization effifi ciencies of Vibrio from Cylcina sinensis by different UHP treatments %
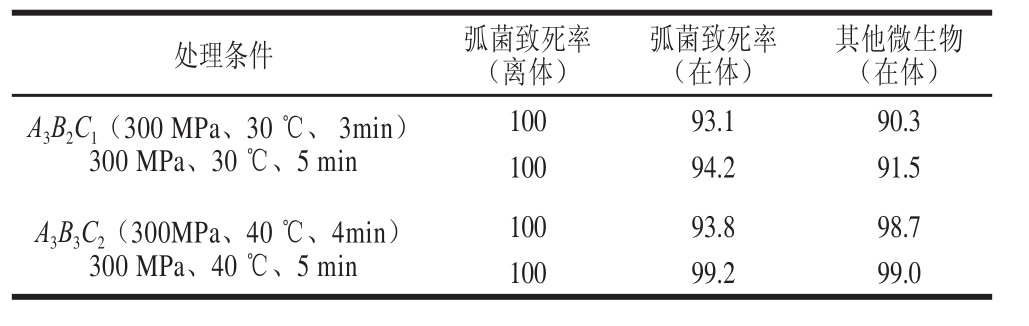
其他微生物(在体)A 3B 2C 1(300 MPa、30 ℃、 3min)300 MPa、30 ℃、5 min处理条件弧菌致死率(离体)弧菌致死率(在体)10093.190.3 10094.291.5 A 3B 3C 2(300MPa、40 ℃、4min)300 MPa、40 ℃、5 min 10093.898.7 10099.299.0
由表2结果可以看出,在离体状态下,菌液浓度为10 8CFU/mL的菌液彻底杀灭弧菌的条件,用于青蛤的杀菌,即使污染菌液浓度只有10 4CFU/g,也不能彻底杀灭所污染的弧菌。将处理时间延长至5 min仍无法彻底杀灭所污染的弧菌。因此说明,在体状态下,采用超高压杀菌时,青蛤的肌肉组织对污染的微生物有保护作用。
另外,研究 [14]表明,副溶血弧菌代时较短约8~10 min,若条件适宜,残留在青蛤体内的弧菌可能快速增殖至中度剂量,诱发食物中毒。为了食用安全,必须将青蛤中的微生物全部杀灭。
2.4.2 时间对青蛤中微生物的影响

图7 300 MPa、20 ℃条件下不同时间处理对青蛤中微生物存活量的影响
Fig.7 Effect of UHP at 300 MPa and 20 ℃ for different periods of time on Vibrio survival in Cylcina sinensis
如图7所示,300 MPa压力处理5 min青蛤中弧菌及其他微生物的致死率均为98.61%,30 min时弧菌及其他微生物的致死率分别为99.45%和99.73%,当处理时间延长至40 min时弧菌及其他微生物的致死率率分别为99.76%和99.90%。因此,选择10、20、30 min进行正交试验。
2.4.3 压力对青蛤中微生物的影响
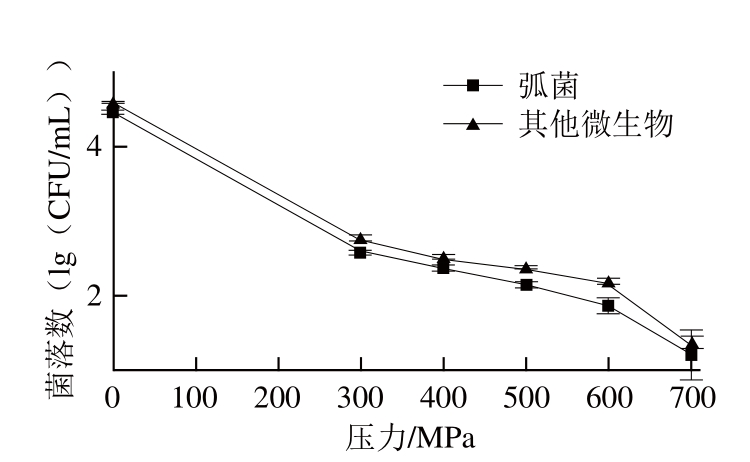
图8 20 ℃条件下不同压力处理5 min对青蛤中微生物存活量的影响
Fig.8 Effect of UHP pressure at 20 ℃ for 5 min on Vibrio survival in Cylcina sinensis
20 ℃不同压力处理5 min对青蛤中微生物的影响,结果如图8所示。随压力变化,青蛤中微生物表现出对压力敏感性,300 MPa压力处理5 min时弧菌致死率可达98.61%,其他微生物致死率98.59%,随着压力增大,致死率显著升高,700 MPa时,弧菌及其他微生物致死率可达99.93%及99.94%,仅有微量存活。同时考虑到处理后青蛤的口感,选择400、500、600 MPa进行正交试验。
2.4.4 温度对青蛤中微生物的影响

图9 300 MPa、5 min条件下不同温度处理对青蛤中微生物存活量的影响
Fig.9 Effect of UHP treatment time at 200 MPa for 5 min on Vibrio survival in Cylcina sinensis
不同温度条件下300 MPa处理5 min对青蛤中微生物的影响,结果如图9所示。随着温度的升高,弧菌及其他微生物存活量逐渐减少,各温度对青蛤中弧菌及其他微生物影响均显著,20 ℃时致死率已达90%以上;40 ℃时弧菌及其他微生物致死率分别达到99.45%和99.16%;50℃时可达到99.71%和99.49%。因此,选取20、30、40 ℃进行正交试验。
2.4.5 超高压杀灭青蛤中微生物条件的优化
表3 青蛤中微生物杀菌条件优化结果L
9(3
4)
Table3 Orthogonal array design L
9(3
4) with experimental results of Cylcina sinensis sterilization
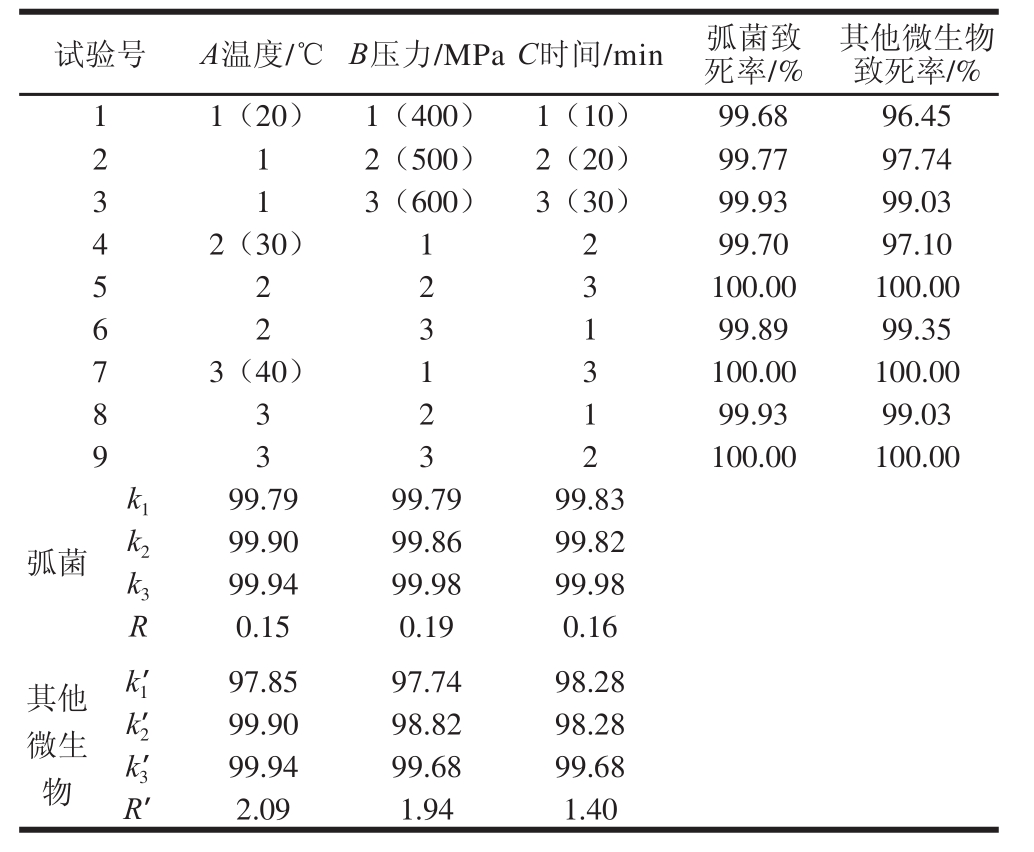
试验号A温度/℃B压力/MPaC时间/min弧菌致死率/%其他微生物致死率/% 11(20)1(400)1(10)99.6896.45 2 12(500)2(20)99.7797.74 3 13(600)3(30)99.9399.03 42(30) 1299.7097.10 5 2 2 3100.00100.00 6 2 3 199.8999.35 73(40)13100.00100.00 8 3 2 199.9399.03 9 3 3 2100.00100.00弧菌k 199.7999.7999.83 k 299.9099.8699.82 k 399.9499.9899.98 R0.150.190.16其他微生物k 1’97.8597.7498.28 k 2’99.9098.8298.28 k 3’99.9499.6899.68 R’2.091.941.40
由表3 可知,k值和k’值分析弧菌及其他微生物致死率的最优组合为A 3B 3C 3(40 ℃、600 MPa、30 min),经验证,在该条件下青蛤中的弧菌及其他微生物均可被彻底杀灭;由表3中弧菌及其他微生物致死率结果可知,在A 2B 2C 3(30 ℃、500 MPa、30 min)、A 3B 1C 3(40 ℃、400 MPa、30 min)、A 3B 3C 2(40 ℃、600 MPa、20 min)条件下,弧菌和其他微生物的致死率为100%。
综上,正交试验优化得到彻底杀灭青蛤中弧菌及其他微生物的条件为500 MPa、30 ℃、30 min, 400 MPa、 40 ℃、30 min和600 MPa、40 ℃、20 min。
2.4.6 青蛤活体接种弧菌验证杀菌条件
由表3已确定出青蛤彻底杀菌的条件,实验所用青蛤携带弧菌数约10 4CFU/g。重度污染的水域贝类最高携带弧菌可达10 6CFU/g,为确保食用安全,实验中采取对活体青蛤人工接种副溶血弧菌和溶藻弧菌,接种方法参照赵峰等 [15]。将菌种活化后于3% N-APW中,37 ℃摇床(140 r/min)培养,调整菌浓至10 8CFU/mL,按1∶100的比例接种到灭菌海水中(每升海水接种10 个青蛤),平板菌落计数测定接种后海水及接种前青蛤体内弧菌含量,置于24 ℃恒温环境中培养24 h,24 h后分别测定海水中及青蛤体内弧菌含量;并对青蛤进行超高压处理,验证上述杀菌条件能否杀灭青蛤中更大浓度的弧菌。实验中副溶血弧菌和溶藻弧菌两种菌分别接种,培养后青蛤内污染的菌液浓度见表4。
表4 青蛤活体接种弧菌
Table4 Growth of Vibrio inoculated to living Cylcina sinensis

接种前与接种24 h后青蛤/(CFU/g)弧菌4.9×10 6/7.1×10 68.2×10 4/1.1×10 71.2×10 6/2.8×10 68×10 4/3.3×10 6其他微生物5.4×10 3/5.1×10 35.4×10 3/3.6×10 3微生物副溶血弧菌溶藻弧菌菌浓与接种24 h后水/(CFU/mL)接种 前与接种24 h后青蛤/(CFU/g)菌浓与接种24 h后水/(CFU/mL)
接种量及培养24 h后海水中弧菌含量均为10 6CFU/mL但数量有所增加,接种副溶血弧菌的青蛤中弧菌含量由10 4CFU/g 增加到10 7CFU/g;接种溶藻弧菌的青蛤中弧菌含量由10 4CFU/g 增加到10 6CFU/g,说明弧菌在海水和青蛤体内菌发生增殖,并在青蛤体内富集。将2.4.5节所确定的在体状态下杀菌条件,用于更高污染菌的环境中的青蛤杀菌,结果见表5。经验证发现,即使青蛤体内弧菌含量高达10 7CFU/g,筛选出的杀菌条件仍然能够将污染的弧菌和其他微生物彻底杀灭。说明在高压条件下进行杀菌,青蛤组织成分对污染的微生物有保护作用,但是这种保护作用是有限度的。
表5 活体接种青蛤验证杀菌条件
Table5 Verififi cation of sterilization conditions for living Cylcina sinensis inoculated with Vibrio
%

杀菌条件青蛤弧菌致死率载体其他微生物30 ℃、500 MPa、30 min100100 40 ℃、400 MPa、30 min100100 40 ℃、600 MPa、20 min100100
自20世纪以来,食品的安全性问题日益凸现,各国逐步完善食品质量安全市场准入制度的同时,消费者对原生态食品的需求增加,过度追求原汁原味而食用加工不彻底的贝类,导致副溶血弧菌等引发食物中毒,各个年龄阶段均有发病可能,在微生物性食物中毒病例中已经高居首位 [16-19];简单的净化处理很难将贝类体内的副溶血弧菌清除 [20];传统的加热蒸煮等方式,虽然起到良好的杀菌效果,但是伴随着水分的流失、蛋白质变性及质构特性的改变,失去了鲜嫩多汁的口感,同时造成营养成分的损失。食品超高压技术是逐步引起各国重视的一项热点,更是食品工业领域具 有革命性的高新技术 [21]。经过超高压处理,蛋白质、糖、维生素、脂类和色素的共价键对超高压相对稳定 [22],可以更好地保持食品风味;食物中的蛋白质、淀粉类物质超高压处理后还可获得新特性,延长食品的保藏时间 [23]。
超高压对微生物的作用主要表现为对其细胞形态的损伤,从而影响生化反应的进行 [24],也会影响DNA的转录与复制 [25-26]。Ma等 [27]按照10 4~10 5CFU/g的比例对牡蛎接种副溶血弧菌,并将接种后的牡蛎在(8±1)℃、293 MPa压力下处理2 min,结果表明副溶血弧菌减少3.52(lg(CFU/g)),经过该条件处理的牡蛎在冰中可储存16~18 d,货架期大大延长。Phuvasate等 [28]将副溶血弧菌接种到牡蛎组织匀浆中,施以250 MPa压力5 min来比较几种耐压型菌株和压力敏感性菌株在低温环境下对压力的耐受性,结果表明,5 ℃时不同株型检出率约降低大于6~7(lg(CFU/g)),而1.5 ℃则降低到无法检测的程度。本实验结果表明,超高压结合温度处理可以彻底杀灭贝中微生物,确保食用安全。
近年来,风味水产品研究日益增多,超高压处理即食贝类将以其方便性、安全性及良好的口感广泛被消费者接受。超高压杀菌用于水产品加工在国外已然进入商业市场,近年我国自主研制的连续式超高压设备最高处理压力700 MPa,容量可达100 L以上,初步实现了设备工业化 [29],但由于我国对于超高压食品产品质量认证评价体系的空白,距离商业化生产仍有一定距离 [30]。
通过研究优化了离体和在体状态下超高压杀灭弧菌的条件,并进行相互验证实验,发现超高压可以彻底杀灭青蛤中所污染的弧菌和其他微生物,达到安全食用的目的。另外,在超高压杀灭弧菌时,在一定条件下青蛤的肌肉组织成分对弧菌有保护作用,但这种保护作用是有限度的。
参考文献:
[1] 关美君, 丁源. 我国海洋药物主要成分研究概况Ⅰ[J]. 中国海洋药物, 1999, 18(1): 32.
[2] 李晓英, 董志国, 薛洋, 等. 温度骤升和窒息条件对青蛤酸性磷酸酶和溶菌酶的影响[J]. 水产科学, 2009, 28(6): 321-324.
[3] 范成成, 张剑, 康劲翮, 等. 文蛤多肽的体外抗癌活性研究[J]. 台湾海峡, 2009, 28(4): 472-476.
[4] 于业绍, 顾润润, 杨星星. 青蛤的保活与营养[J]. 海洋科学, 2005, 29(8): 10-14.
[5] 王风康. 民间秘方入宫廷: 青蛤散[J]. 家庭医学, 2001(9): 79.
[6] 顾润润, 周琳, 于业绍, 等. 青蛤的营养分析[J]. 苏盐科技, 1999, 3(1): 24-26.
[7] 李晓英, 董志国, 阎斌伦, 等. 青蛤与文蛤的营养成分分析与评价[J].食品科学, 2010, 31(23): 366-370.
[8] 赵峰, 周德庆, 于维森, 等. 东部沿海城市贝类中副溶血弧菌的分布特征[J]. 食品与生物技术学报, 2011, 30(5): 711-715.
[9] 马光刚, 郭福生, 王娟, 等. 海产品中副溶血弧菌的分离与鉴定[J].中国动物检疫, 2002, 19(9): 25-27.
[10] ASHIE IN A, SIMPSON B K. Application ofhigh pressure to control enzyme related fresh seafood texture deterioration[J]. Food Research International, 1996, 29: 569-575.
[11] 国家卫生和计划生育委员会. GB 4789.7—2013食品微生物学检验:副溶血弧菌检验[S]. 北京: 中国标准出版社, 2013.
[12] 卫生部. GB 47892—2010 食品微生物学检验: 菌落总数测定[S]. 北京: 中国标准出版社, 2010.
[13] 刘琦. 水产品种副溶血弧菌几种检测方法的研究[D]. 上海: 上海海洋大学, 2008.
[14] MAKINO K, OSHIMA K, KUROKAWA K, et al. Genome sequence of Vbrio parahaemolyticus: a pathogenic mechanism distinct from that of V. cholerae[J]. The Lancet, 2003, 361: 743-749.
[15] 赵峰, 李毅财. 周德庆, 等. 超高压处理对牡蛎中副溶血弧菌的消减作用研究[J]. 食品工业科技, 2012, 24(33): 161-164.
[16] 刘秀梅, 陈艳. 王晓英, 等. 1992—2001年食源性疾病暴发资料分析:国家食源性疾病监测网[J]. 卫生研究, 2004, 33(6): 725-727.
[17] 斯国静, 吴奇志, 韦东芳, 等. 2001—2003年杭州市细菌性食物中毒病原菌检测和分析[J]. 中国卫生检验杂志, 2004, 14(3): 320.
[18] 李晓春. 浙南部沿海地区细菌性食物中毒病源检测研究分析[J]. 中国预防医学杂志, 2004, 5(5): 370-373.
[19] 刘弘, 王科家, 杨召萍. 上海市集体性食物中毒分析[J]. 上海预防医学杂志, 2003, 15(11): 454-456.
[20] 陶晶, 杨瑞金, 张文斌, 等. 牡蛎净化工艺的研究[J]. 食品开发与机械, 2008(7): 108-112.
[21] 李双, 王成忠, 唐晓璇. 超高压技术在食品工业中的应用研究进展[J].山东食品发酵, 2014(4): 11-14.
[22] HUGO M P, AURORA V F, CAROLE T S, et al. High-pressure processing technologies for the pasteurization and sterilization of foods[J]. Food Bioprocess Technology, 2011, 4(6): 969-985.
[23] 薄纯智. 超高压食品处理效果的实验与模拟研究[D]. 大连: 大连理工大学, 2007.
[24] 生庆海, 程建军, 王辉兰. 一种新的食品加工技术-超高压技术[J]. 中国乳品工业, 2000, 28(5): 23-25.
[25] ADAPA S, SCHMIDT K A, TOLEDO R. Functional properties of skim milk processed with continuous high pressure throttling[J]. Journal of Dairy Science, 1997, 80(9): 1941-1948.
[26] CHEFTEL J C. Review: high-pressure, microbial inactivation and food preservation[J]. Food Science and Technology International, 1995, 1: 75-90.
[27] MA L, SU Yicheng. Validation of high pressure processing for inactivating Vibrio parahaemolyticus in Pacifi c oysters (Crassostrea gigas)[J]. International Journal of Food Microbiology, 2011, 144: 469-474.
[28] PHUVASATE S, SU Yicheng. Efficacy of low-temperature high hydrostatic pressure processing in inactivating Vibrio parahaemolyticus in culture suspension and oyster homogenate[J]. International Journal of Food Microbiology, 2015, 196: 11-15.
[29] 赵伟, 杨瑞金, 张文斌, 等. 超高压处理牡蛎超微结构、组分及蛋白质变性的影响[J]. 食品与发酵工业, 2011, 37(5): 7-11.
[30] 朱松明, 苏光明, 王春芳, 等. 水产品超高压加工技术研究与应用[J].农业机械学报, 2014, 45(1): 168-177.
Optimization of Sterilization Conditions for Vibrio in Cyclina sinensis Using Ultra-High Hydrostatic Pressure
LIU Xujin, HU Zhihe*, LIU Junjun, DI Hongyan, ZHANG Li, SUN Yuan, ZHU Liping
(Tianjin Key Laboratory of Food and Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Abstract:The objective of this study was to optimize the conditions for killing Vibrio parahaemolyticus (Vp) CGMCC1.1997 and Vibrio alginolyticus (Va) CGMC1.1833 in Cyclina sinensis using ultra-high pressure (UHP). Both Vibrio species were treated in vitro and in vivo under different ultra-high pressure conditions including pressure, holding temperature and holding time. Results showed that under the in vitro condition, the two strains at an initial concentration of 10 8CFU/mL were completely killed by UHP treatment at 300 MPa and at 20 ℃ for 5 min or more than 3 min at 30 ℃. But the sterilization of Cyclina sinensis containing 10 8CFU/mL of Vibrio was incomplete suggesting the muscle tissue of Cyclina sinensis can protect against the inactivation of Vibrio by UHP treatment. The optimized UHP conditions for killing 10 8CFU/mL of Vibrio present in Cyclina sinensis were determined as follows: 500 MPa and 30 ℃ for 30 min, 400 MPa and 40 ℃ for 30 min, or 600 MPa and 40 ℃ for 20 min. Under these conditions, the quantity of Vibrio in Cyclina sinensis at a higher order of magnitude (10 7CFU/g) was inactivated consistently demonstrating that the muscle tissue of Cyclina sinensis can only provide limited protection on Vibrio. Therefore, Vibrio in contaminated Cyclina sinensis can be killed using ultrahigh pressure treatment, although its muscle tissue has only limited protective effects the bacteria.
Key words:Cylcina sinensis; Vibrio parahaemolyticus; Vibrio alginolyticus; ultra-high pressure
中图分类号:TS254.4
文献标志码:A
文章编号:1002-6630(2015)20-0019-07
doi:10.7506/spkx1002-6630-201520004
收稿日期:2015-06-01
基金项目:国家级大学生创新创业训练计划项目(201410069002);天津市高等学校创新团队项目(TD12-5049)
作者简介:刘蓄瑾(1991 —),女,硕士研究生,研究方向为食品生物技术。E-mail:liuliuxujin@163.com
*通信作者:胡志和(1962—),男,教授,硕士,研究方向为专用功能食品。E-mail:hzhihe@tjcu.edu.cn