薛楚然 1,刘树文 1,严 俊 1,杨世玲 1,徐向文 2
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.广东为多生物科技有限公司,广东 茂名 525000)
摘 要:为抑制荔枝酒褐变,在酒精发酵完成后,以褐变抑制率为指标,在单因素试验的基础上,采用L 8(2 7)正交试验表进行六因素二水平正交试验,采用极差分析法选出对荔枝酒褐变抑制率影响最大的4 种褐变抑制剂:L-半胱氨酸、谷胱甘肽、乙二胺四乙酸二钠(ethylene diamine tetraacetic acid disodium,EDTA-Na 2)和柠檬酸,利用Design-Expert 8.0软件进行响应面优化。结果表明:荔枝酒褐变抑制剂的最佳配方为L-半胱氨酸8.46 mmol/L、谷胱甘肽1.16 mmol/L、EDTA-Na 21.87 mmol/L、柠檬酸1.89 mmol/L,在此条件下预测褐变抑制率为47.89%,实际值为50.18%,实际值与预测值吻合率达95.44%。
关键词:荔枝酒;褐变抑制剂;褐变抑制率;正交试验设计;响应面法
荔枝(Litchi chinensis Sonn.)是无患子科(Sapindaceae)荔枝属(Litchi)植物,为我国亚热带地区的特有水果,因其具有丰富的营养价值和独特而优雅的风味受到广大消费者的喜爱。荔枝可止烦消渴,治头重心燥,也可通神、益智、健气、美容等 [1-2]。以荔枝为原料酿造的果酒,传承了其优雅的香气和纯正的果香,得到了许多消费者的认可。但是由于在发酵及贮藏荔枝酒期间存在技术、储备不够完善等问题,加之荔枝果实易氧化褐变,许多产品在灌装后仍然存在氧化褐变、失光等问题 [3],使得荔枝酒的品质严重降低。
研究 [4]表明,导致荔枝酒褐变的主要原因是荔枝中相关氧化酶引起的酶促反应。因此,控制荔枝酒酶促褐变成为保持其良好色泽和感官品质的首选方法。本研究所选取的6 种常用果蔬褐变抑制剂——谷胱甘肽、L-半胱氨酸、抗坏血酸、氯化钙、柠檬酸和乙二胺四乙酸二钠(ethylene diamine tetraacetic acid disodium,EDTA-Na 2),均为食用安全的食品添加剂,其抑制褐变机理在于直接或间接抑制酶促褐变反应。其中,谷胱甘肽、L-半胱氨酸、抗坏血酸和氯化钙对荔枝果肉中多酚氧化酶(polyphenol oxidase,PPO)和过氧化物酶(peroxidase,POD)具有明显的活性抑制作用 [5-6];柠檬酸不仅可以作为酸味剂降低体系pH值,而且还可以作为络合剂,降低酚酶的活性 [7];EDTA-Na 2是一种金属螯合剂,可以通过螯合促进褐变反应的金属离子进一步抑制褐变反应 [8]。由于单一褐变抑制剂的应用存在使用浓度高、不能长期保持果蔬色泽稳定等缺陷 [9],近年来许多研究者采用复合抑制剂控制果蔬褐变,目前已在苹果、鸭梨、马铃薯和生菜等果蔬中取得了良好的褐变控制效果 [10-13]。但目前鲜见复合抑制剂对于荔枝酒的褐变抑制效果研究。本研究选取以上6 种物质,以褐变抑制率为参照指标,通过单因素试验确定抑制褐变的较优浓度,通过正交试验确定单一抑制剂对荔枝酒褐变抑制率影响的主次顺序,并通过响应面法优化出适于添加至荔枝酒中的最佳褐变抑制剂配方,为荔枝酒产品的褐变控制提供一定的理论依据。
1.1 材料与试剂
以广东省茂名市2014年6月采摘的新鲜荔枝“黑叶”作为实验原材料。该原料成熟度适中,果实饱满且无病害。原料总糖含量155 g/L,总酸含量3.8 g/L(以柠檬酸计)。
谷胱甘肽、L-半胱氨酸、抗坏血酸、氯化钙、EDTA-Na 2、柠檬酸等均为国产食品级添加剂。
1.2 仪器与设备
AUY220电子分析天平、UV-2450紫外分光光度计日本Shimadzu公司;Sorvall RC5C Plus冷冻高速离心机美国Thermo Scientifi c公司。
1.3 方法
1.3.1 荔枝酒酿造
参照李华等 [14]酿造干白葡萄酒的工艺进行荔枝酒发酵,略作修改。新鲜荔枝去皮、去核、破碎、压榨、过滤,取澄清汁进行发酵。将总糖含量调整为180 g/L,添加酿酒酵母0.2 g/L。荔枝酒发酵期间控制温度在18~20 ℃内,发酵至干(含糖量低于4 g/L)。
1.3.2 褐变度及褐变抑制率的测定
荔枝酒发酵结束后,根据不同实验目的添加不同浓度和组合褐变抑制剂,于常温条件下放置48 h后测定其褐变度:根据Lopez-Toledano等 [15]的方法,略有改动,取待测荔枝酒样5 mL,以5 000 r/min离心10 min,以去除酒中沉淀物。利用分光光度计,在420 nm波长处测定离心后的荔枝酒的吸光度,以蒸馏水为空白,以吸光度来表示荔枝酒褐变度。荔枝酒褐变抑制率按照下式进行计算:
式中:R为褐变抑制率;A 0为空白实验所测褐变度;A m为褐变抑制剂处理后所测褐变度。
1.3.3 单因素试验
一定体积的荔枝酒中,分别添加不同浓度的单一褐变抑制剂:谷胱甘肽(0.4、0.8、1.2、1.6、2.0、 2.4 mmol/L)、L-半胱氨酸(2.0、4.0、6.0、8.0、10.0、12.0 mmol/L)、抗坏血酸(5、10、15、20、25、30 mmol/L)、氯化钙(2.0、4.0、6.0、8.0、10.0、12.0 mmol/L)、EDTA-Na 2(0.5、1.0、1.5、2.0、2.5、3.0 mmol/L)、柠檬酸(0.5、1.0、1.5、2.0、2.5、3.0 mmol/L)。以常温条件下放置48 h后荔枝酒褐变抑制率为指标,探究各单一抑制剂的褐变抑制效果。
1.3.4 正交试验
以褐变抑制率为指标,采用L 8(2 7)正交试验表进行六因素二水平正交试验,对结果进行极差分析,判断不同单一护色剂对荔枝酒褐变抑制率影响的主次顺序,正交试验因素水平见表1。
表1 正交试验设计因素水平表
Table1 Variables and their levels used in orthogonal experimental design mmol/L

水平F柠檬酸浓度11.26.015.06.01.51.0 21.68.020.08.02.01.5因素A谷胱甘肽浓度B L-半胱氨酸浓度C抗坏血酸浓度D氯化钙浓度E EDTA-Na 2浓度
1.3.5 响应面试验设计
在正交试验基础上,选择出对荔枝酒褐变抑制率影响最大的4 个单一褐变抑制剂:L-半胱氨酸、谷胱甘肽、EDTA-Na 2和柠檬酸,进行四因素三水平的中心组合试验设计,因素水平见表2,以褐变抑制率为指标,利用Design-Expert 8.0软件进行分析,确定荔枝酒褐变抑制剂最佳配方。
表2 响应面试验设计因素水平表
Table2 Variables and their levels used in response surface design mmol/L

D柠檬酸浓度1 101.62.52.0 0 8 1.22.01.5-160.81.51.0水平因素A L-半胱氨酸浓度B谷胱甘肽浓度C EDTA-Na 2浓度
1.4 数据处理
单因素试验结果利用SPSS 19.0进行数据分析,并利用Origin 8.5作图软件进行作图;正交试验结果利用正交设计助手3.1进行数据处理;响应面试验的设计与数据分析利用Design-Expert 8.0进行处理。
2.1 单因素试验结果
2.1.1 谷胱甘肽浓度对荔枝酒褐变抑制率的影响
谷胱甘肽是重要的抗氧化物质,有研究 [16-17]表明,植物在逆境条件下可以谷胱甘肽和抗坏血酸为底物,通过提高抗坏血酸-谷胱甘肽循环中谷胱甘肽还原酶和抗坏血酸POD的活性,加强体系中活性氧的清除能力,从而降低氧化胁迫。莫亿伟等 [18]研究了谷胱甘肽对荔枝保鲜效果的影响,结果表明,在低温条件下,谷胱甘肽结合柠檬酸处理降低了荔枝果皮的PPO活性,显著提高了荔枝保鲜效果。本研究中,随着外源谷胱甘肽浓度的增高,荔枝酒褐变抑制率随之上升,并在谷胱甘肽浓度达到1.2 mmol/L时达到最大值(28.52%),当浓度继续升高时,荔枝酒褐变抑制率缓慢下降(图1)。

图1 谷胱甘肽的褐变抑制效果
Fig.1 Effect of glutathione on browning inhibition
2.1.2 L-半胱氨酸浓度对荔枝酒褐变抑制率的影响

图2 2 L-半胱氨酸的褐变抑制效果
Fig.2 Effect of L-cysteine on browning inhibition
如图2所示,随着荔枝酒中L-半胱氨酸浓度升高,其褐变抑制率增大,当L-半胱氨酸浓度达到8 mmol/L时,具有最大褐变抑制率(45.11%),此后则基本保持不变。半胱氨酸抑制褐变的主要机理在于其本身含有氨基、羧基和巯基。巯基是活泼性很强的基团,具有还原性,并且能够作为醌类物质的螯合剂,与醌作用生成稳定的无色化合物。此外,半胱氨酸还能防止反应物的氧化作用于褐变中间体α-β-不饱和烯醇基性化合物,使其处于非活化状态,从而阻止黑色素的生成,减少褐变 [19]。作为亚硫酸盐替代物,L-半胱氨酸不仅无毒无害,并且是一种可溶性氨基酸,具有一定的营养价值。
2.1.3 抗坏血酸浓度对荔枝酒褐变抑制率的影响
如2.1.1节所述,抗坏血酸可以通过抗坏血酸-谷胱甘肽循环,以自身为底物消耗体系中活性氧,从而减少氧化褐变。也有研究 [20-21]认为,在缺乏PPO底物时,抗坏血酸可以通过与PPO活性位点结合,使其不可逆失活。但是,如果体系内含氧量过高或添加的抗坏血酸过少,会使抗坏血酸完全氧化并与氨基酸反应导致非酶褐变 [22]。因此在本研究中,当荔枝酒中抗坏血酸浓度低于15 mmol/L时,其褐变抑制率较低,而20 mmol/L是抗坏血酸抑制褐变的最佳浓度(图3)。

图3 3 抗坏血酸的褐变抑制效果
Fig.3 Effect of ascorbic acid on browning inhibition
2.1.4 氯化钙浓度对荔枝酒褐变抑制率的影响
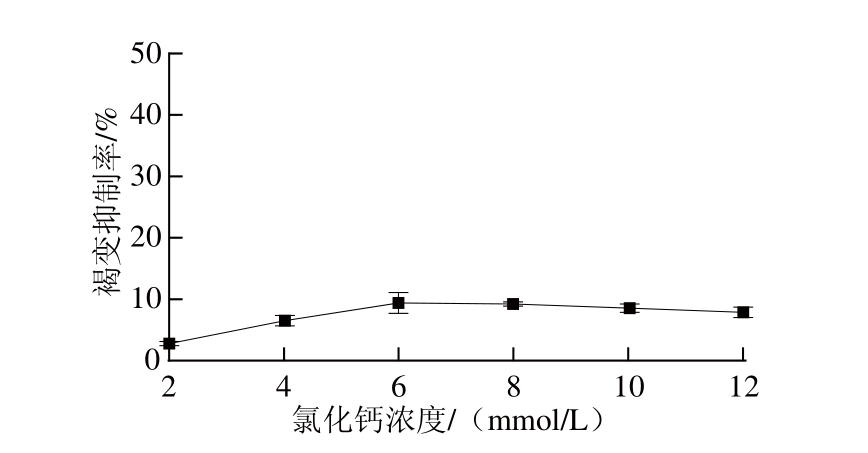
图4 氯化钙的褐变抑制效果
Fig.4 Effect of CaCl
2on browning inhibition
如图4所示,单一使用氯化钙作为荔枝酒褐变抑制剂时,其褐变抑制率普遍较低(低于10%)。氯化钙的褐变抑制机理有两种解释,分别为钙离子与氨基酸结合为不溶性化合物,以及钙离子与PPO中的铜离子构成竞争 [23]。在本研究中,氯化钙的褐变抑制效果并不明显,在浓度为6 mmol/L时褐变抑制率达到最大值(9.40%)。
2.1.5 EDTA-Na 2浓度对荔枝酒褐变抑制率的影响
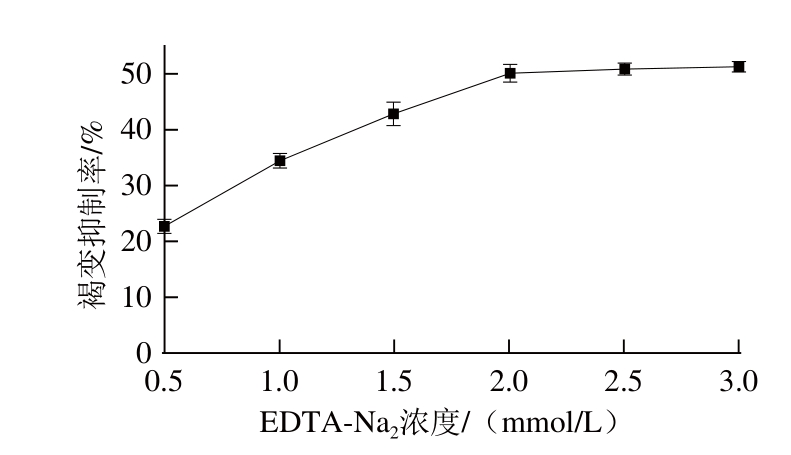
图5 EDTA--Na
2的褐变抑制效果
Fig.5 Effect of EDTA-Na
2on browning inhibition
如图5所示,随着荔枝酒中EDTA-Na 2浓度的升高,其褐变抑制率随之上升,并在高于2.0 mmol/L时处于稳定值(51%左右)。EDTA-Na 2是一种金属离子螯合剂,通过螯合体系中对褐变反应具有促进作用的金属离子,达到抑制褐变的效果。在本研究中,EDTA-Na 2具有明显的褐变抑制效果,但当其浓度增加到一定值后(2.0 mmol/L)褐变抑制率便不再增大。
2.1.6 柠檬酸浓度对荔枝酒褐变抑制率的影响

图6 柠檬酸的褐变抑制效果
Fig.6 Effect of citric acid on browning inhibition
柠檬酸在抑制酶促褐变方面具有双重作用:一方面可以作为酸味剂降低体系pH值;另一方面还可以作为络合剂,与从PPO上解离下来的铜离子作用,形成络合物,降低酚酶的活性。研究 [24-25]表明,柠檬酸与抗坏血酸、谷胱甘肽复合使用时,通常对果蔬的酶促褐变抑制效果最佳。本研究中,荔枝酒中柠檬酸浓度达到1.5 mmol/L时,褐变抑制率达到最大值(15.62%),高于或低于该浓度时,荔枝酒褐变抑制率均处于下降状态(图6)。
2.2 正交试验结果
表3 正交试验设计与结果
Table3 Orthogonal array design with experimental results of browning inhibition

褐变抑制率/% 111111152.56 211122254.28 312211250.19 412222141.28 521212148.96 621221245.63 722112234.69 822121149.72 k 149.57850.35847.81346.60049.52548.130 k 244.75043.97046.51547.72744.80346.197 R4.8286.3881.2981.1274.7221.933主次因素B>A>E>F>C>D试验号A谷胱甘肽浓度B L-半胱氨酸浓度C抗坏血酸浓度D氯化钙浓度E EDTANa 2浓度F柠檬酸浓度
在单因素试验的基础上,分别选取6 种抑制剂的两个较优水平,利用L 8(2 7)正交表进行正交试验,结果见表3。由极差分析得出影响荔枝酒褐变率的主次顺序如下:B>A>E>F>C>D,即L-半胱氨酸浓度>谷胱甘肽浓度>EDTA-Na 2浓度>柠檬酸浓度>抗坏血酸浓度>氯化钙浓度。
2.3 响应面试验结果
2.3.1 回归模型的建立与分析
表4 响应面试验设计及结果
Table4 Experimental design and results for response surface design

试验号褐变抑制率/% 1-101038.93 2000047.72 3011040.95 400-1-141.29 510-1033.34 601-1036.98 7-110028.46 8000049.65 9-1-10039.94 10101026.75 11-10-1028.28 121-10025.48 13010145.29 14110038.82 15000045.93 16001141.20 17100135.46 180-1-1043.33 19-100135.11 200-10-139.47 21001-144.03 22100-126.85 23000048.31 24010-140.52 250-11041.73 26000047.66 270-10148.78 28-100-133.09 2900-1144.77 A L-半胱氨酸浓度B谷胱甘肽浓度C EDTA-Na 2浓度D柠檬酸浓度
表5 回归系数显著性
Table5 Signifi cance test of regression coeffi cients
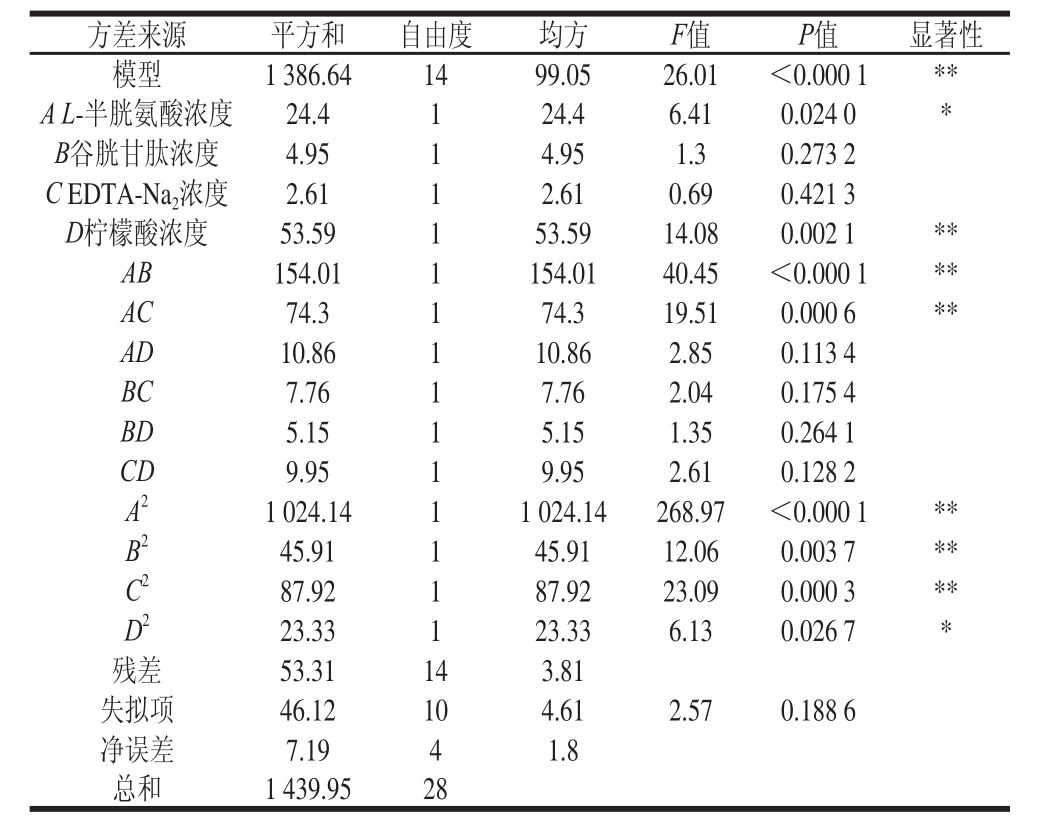
注:*. P<0.05,差异显著;**. P<0.01,差异极显著。
方差来源平方和自由度均方F值P值显著性模型1 386.641499.0526.01<0.000 1** A L-半胱氨酸浓度24.4124.46.410.024 0* B谷胱甘肽浓度4.9514.951.30.273 2 C EDTA-Na 2浓度2.6112.610.690.421 3 D柠檬酸浓度53.59153.5914.080.002 1** AB154.011154.0140.45<0.000 1** AC74.3174.319.510.000 6** AD10.86110.862.850.113 4 BC7.7617.762.040.175 4 BD5.1515.151.350.264 1 CD9.9519.952.610.128 2 A 21 024.1411 024.14268.97<0.000 1** B 245.91145.9112.060.003 7** C 287.92187.9223.090.000 3** D 223.33123.336.130.026 7*残差53.31143.81失拟项46.12104.612.570.188 6净误差7.1941.8总和1 439.9528
根据正交试验结果,选择4 种对荔枝酒褐变抑制率影响较大的单一抑制剂浓度:L-半胱氨酸、谷胱甘肽、EDTA-Na
2、柠檬酸,各选择3 个较优水平,以褐变抑制率为响应值,进行多元回归拟合分析,响应面试验结果见表4。通过Design-Expert 8.0分析,建立二次多项式模型:Y=-240.85+46.39A-29.16B+95.43C+33.24D+7.76AB-4.31AC+1.65AD+6.96BC-5.68BD-6.31CD-3.14A
2-16.63B
2-14.73C
2-7.59D
2(R
2=0.963 0,
![]()
由表5可知,回归模型极显著(P<0.000 1),失拟项不显著(P=0.188 6>0.05),预测值与试验值具有高度相关性(R 2=0.963 0)。拟合程度高,说明模型能够反映响应值的变化,可以利用该模型预测荔枝酒的褐变抑制剂配方。因素D、AB、AC、A 2、B 2、C 2对荔枝酒褐变抑制率有极显著影响(P<0.01),因素A、D 2对荔枝酒褐变抑制率有显著影响(P<0.05)。
2.3.2 响应面和等高线分析
响应面等高线图可以直观地反映各因素对响应值的影响,以便找出最佳工艺参数以及各参数之间的相互作用,等高线中最小椭圆的中心点即是响应面的最高点。此外,等高线的形状可反映出交互效应的强弱,椭圆形表示两因素交互作用显著,而圆形则与之相反。如图7所示,除EDTA-Na 2浓度和谷胱甘肽浓度的交互作用不明显外,其余因素的交互作用均显著。因素AB、AC、AD的响应面等高线均呈椭圆状(图7a、b、c),说明它们之间具有非常显著的交互作用,也反映了这几个因素对于荔枝酒褐变抑制率的影响程度较高。因素BD、CD的响应面图表明,当谷胱甘肽或EDTA-Na 2浓度范围一定时,荔枝酒的褐变抑制率随着柠檬酸浓度的增大而上升。
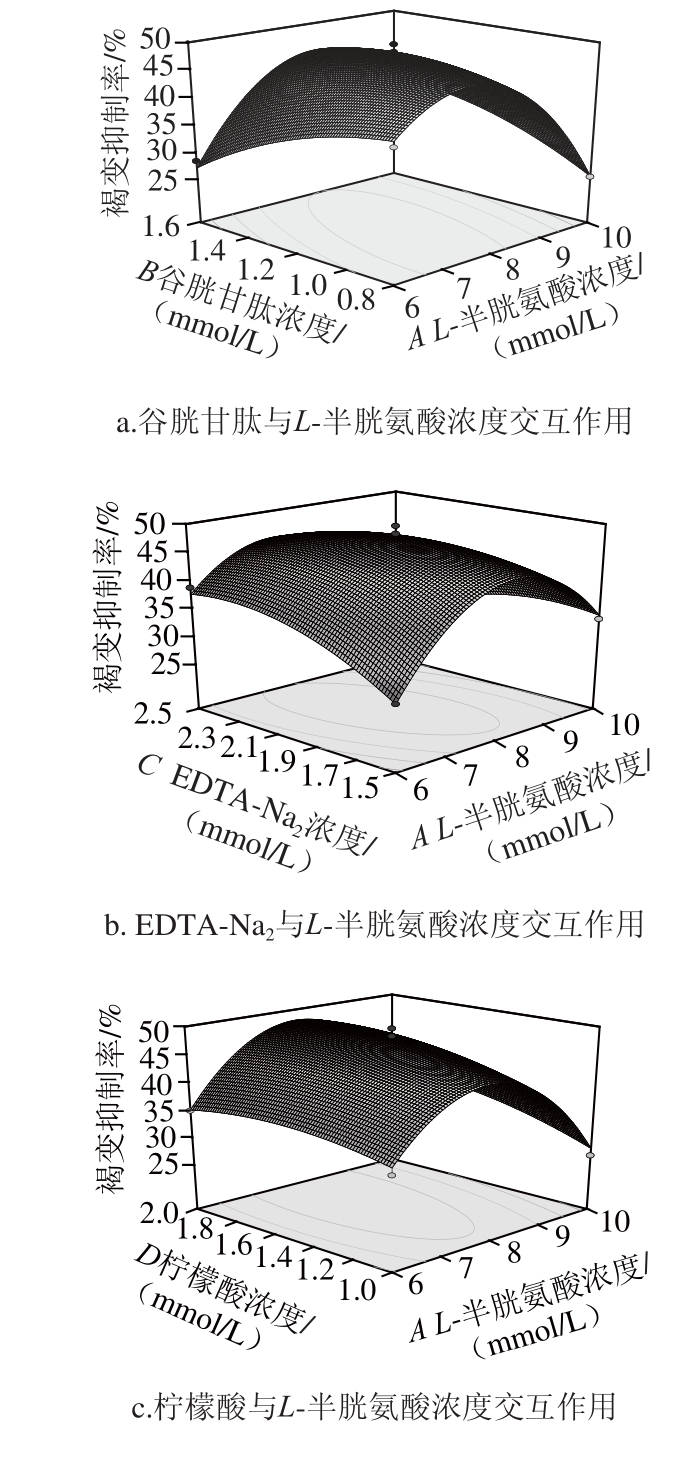
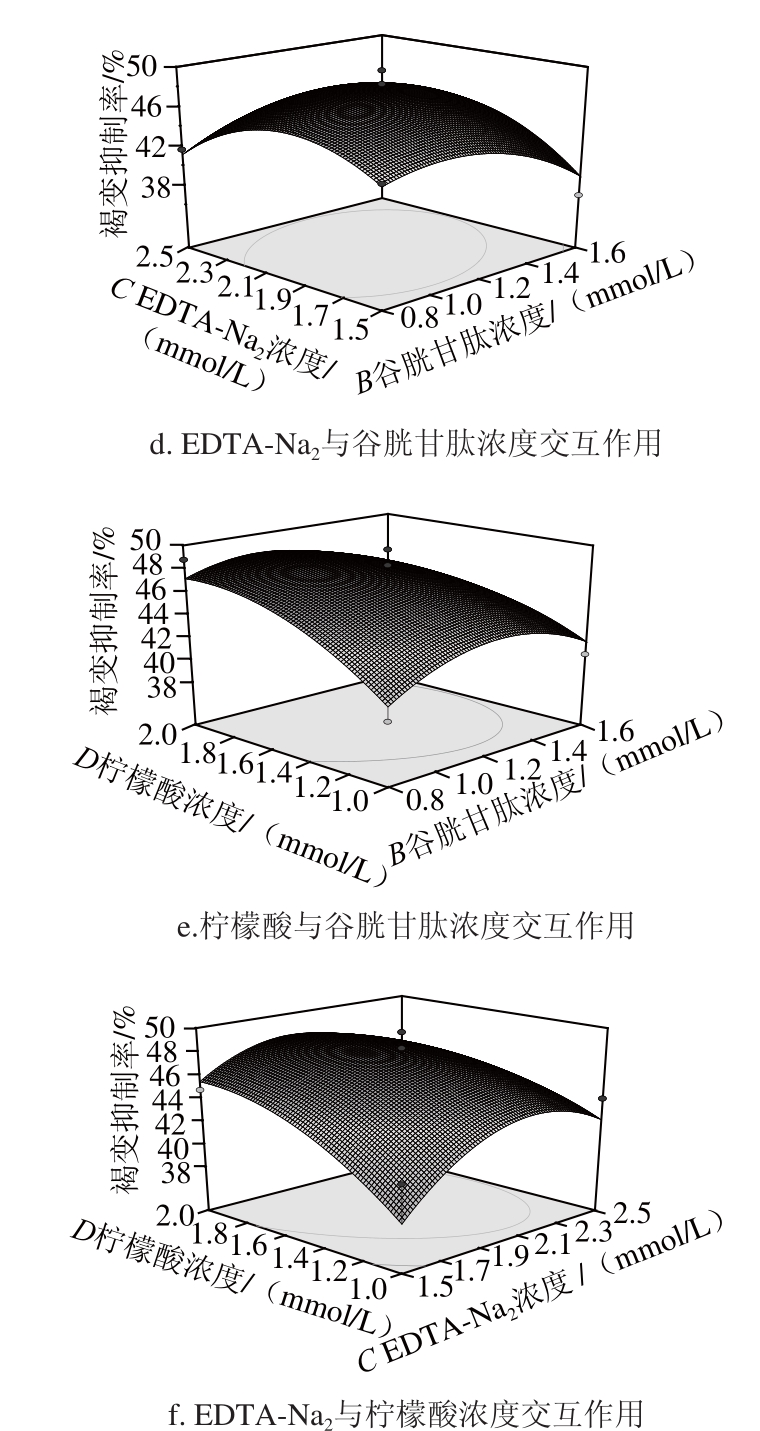
图7 7 L-半胱氨酸、谷胱甘肽、EDTA-NaTA-Na
2、柠檬酸浓度交互作用对荔枝酒褐变抑制率影响的等高线和响应面图
Fig.7 Response surface and contour plots for the interactive effects of L-cysteine, GSH, EDTA-Na
2and citric acid on browning inhibition rate of litchi wine
2.3.3 验证实验结果
根据响应面试验所得结果,通过Design-Expert 8.0处理分析,得出荔枝酒褐变抑制剂的最佳配方为L-半胱氨酸8.46 mmol/L、谷胱甘肽1.16 mmol/L、EDTA-Na 21.87 mmol/L、柠檬酸1.89 mmol/L,在此条件下所预测的褐变抑制率为47.89%。为验证该预测模型的可行性,按照上述最佳配方在荔枝酒中进行验证实验,得到褐变抑制率50.18%,与预测值吻合率达到95.44%。说明通过响应面试验所建立的回归模型预测性良好,褐变抑制剂最佳配方准确可靠,具有实际参考价值。
荔枝原料经过破碎、压榨等程序,组织受到破坏,细胞间区域打破,导致酚类物质与PPO及氧气充分接触,因此荔枝酒在发酵和贮藏过程中极易褐变。本研究所选取的6 种褐变抑制剂,不仅是食用安全的常用食品添加剂,更能通过直接或间接控制氧化反应抑制褐变。单因素试验表明,6 种褐变抑制剂的作用效果差异明显,其中L-半胱氨酸和EDTA-Na 2的褐变抑制效果最佳。但单一抑制剂在使用时易存在使用浓度高、稳定性差等缺陷,且在本研究中单一抑制剂的作用效果均低于复合抑制剂,因此探究荔枝酒褐变抑制的最佳工艺参数十分必要。
六因素二水平正交试验和极差分析结果表明,本研究中对荔枝酒褐变抑制贡献最大的4 种抑制剂分别为L-半胱氨酸、谷胱甘肽、EDTA-Na 2和柠檬酸。尽管抗坏血酸在单因素试验中表现出良好的褐变抑制效果,但在复合抑制剂中贡献较小,原因可能为各抑制剂间存在一定的互作关系,因此还需要进一步探索其抑制褐变的机理。柠檬酸与抗坏血酸、谷胱甘肽复合使用时,对果蔬的酶促褐变具有较强的抑制作用,这一点通过正交试验可以得到证实,但三者的互作机理仍需进一步研究。
通过响应面法优化,得到最佳褐变抑制剂配方:L-半胱氨酸8.46 mmol/L、谷胱甘肽1.16 mmol/L、EDTA-Na 21.87 mmol/L、柠檬酸1.89 mmol/L。在此条件下所预测的褐变抑制率为47.89%,实际值为50.18%,与预测值吻合率达到95.44%。说明实验结果与模型拟合性较好,优化后的复合抑制剂合理可行。L-半胱氨酸和谷胱甘肽为亚硫酸盐替代品,但作为天然食品添加剂,相比亚硫酸盐更具有食用安全性。在本研究中,这两种抑制剂表现出了良好的褐变抑制效果,并且在与EDTA-Na 2和柠檬酸复合使用时,具有褐变抑制效果更强、使用量低于单一抑制剂等优势,证明其对荔枝酒产品的褐变控制有很好的实用性。本研究所得到的荔枝酒褐变抑制工艺条件,能够为改善荔枝酒易于褐变等问题提供良好的指导,但荔枝酒产品的褐变抑制率仍然有提升空间,进一步研究可以从改善贮藏条件、加强非酶褐变控制等方面进行。
参考文献:
[1] 董周永, 池建伟, 杨公明, 等. 荔枝的保健作用及开发利用前景[J].食品研究与开发, 2005, 26(5): 148-151.
[2] 李时珍. 本草纲目[M]. 北京: 人民卫生出版社, 1998.
[3] 康增军, 杨亚娟, 米生喜. 荔枝酒非生物稳定性的影响因素[J]. 中外葡萄与葡萄酒, 2007(2): 46-47.
[4] 冯卫华, 林丽棉, 秦艳, 等. 荔枝与荔枝酒褐变控制[J]. 食品科学, 2011, 32(4): 246-250.
[5] 刘春丽, 杨跃寰, 陈欲云. 荔枝果肉多酚氧化酶酶学性质研究[J]. 安徽农业科学, 2011, 39(2): 646-648.
[6] 刘春丽. 荔枝果肉过氧化物酶酶学性质研究[J]. 西南农业学报, 2012, 25(2): 424-428.
[7] ZEMEL G P, SIMS C A, MARSHALL M R, et al. Low pH inactivation of polyphenoloxidase in apple juice[J]. Journal of Food Science, 1990, 55(2): 502-505.
[8] 舒念辉. 果汁褐变及控制研究[J]. 食品与发酵科技, 2011, 47(5): 59-61.
[9] ÖZOGLU H, BAYLNDLRLL A. Inhibition of enzymatic browning in cloudy apple juice with selected antibrowning agents[J]. Food Control, 2002, 13(4/5): 213-221.
[10] 张少颖, 王向东, 于有伟, 等. 微波预处理原料对苹果汁褐变的影响[J].农业工程学报, 2010, 26(5): 347-351.
[11] 王领, 张子德, 刘彩莉. 鸭梨汁加工过程中褐变的控制及澄清方法研究[J]. 中国食品学报, 2002, 2(4): 61-64.
[12] 丁捷, 刘书香, 张雪军. 鲜切马铃薯复合褐变抑制剂组合的筛选[J].食品科学, 2011, 32(6): 288-292.
[13] ARZU A, VURAL G. Effect of various inhibitors on enzymatic browning antioxidant activity and total phenol content of fresh lettuce Lactuca sativa[J]. Food Chemistry, 2008, 107: 1173-1179.
[14] 李华, 王华, 袁春龙, 等. 葡萄酒工艺学[M]. 北京: 科学出版社, 2007.
[15] LOPEZ-TOLEDANO A, MAYEN M, MERIDA J, et al. Yeastinduced inhibition of (+)-catechin and (-)-epicatechin degradation in model solution[J]. Journal of Agricultural and Food Chemistry, 2002, 50(6): 1631-1635.
[16] ASADA K. The water-water cycle as alternative photon and electron sinks[J]. Philosophical Transactions of the Royal Society of London, Series B: Biology Science, 2000, 355: 1419-1431.
[17] NOCTER G, FOYER C H. Ascorbate and glutathione: keeping active oxygen under control[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1998, 49(1): 249-279.
[18] 莫亿伟, 郑吉祥, 李伟才, 等. 外源抗坏血酸和谷胱甘肽对荔枝保鲜效果的影响[J]. 农业工程学报, 2010, 26(3): 363-368.
[19] LEE C Y, KAGAN V. Enzymatic browning in relation to phenolic compounds and PPO activity among various peach cultivars[J]. Journal of Agricultural and Food Chemistry, 1990(38): 99-101.
[20] ARIAS E, GONZALEZ J, ORIA R, et al. Ascorbic acid and 4-hexylresorcinol effects on pear PPO and PPO catalyzed browning reaction[J]. Journal of Food Science, 2007, 72(8): 422-429.
[21] ARIAS E, GONZALEZ J, PEIRO J M, et al. Browning prevention by ascorbic acid and 4-hexylresorcinol: different mechanisms of action on polyphenol oxidase in the presence and in the absence of substrates[J]. Journal of Food Science, 2007, 72(9): 464-470.
[22] 李任强, 江凤仪, 方玲, 等. 维生素C与氨基酸褐变反应的研究[J]. 食品工业科技, 2002(11): 32-34.
[23] 曾朝珍, 张永茂, 康三江, 等. 果蔬褐变抑制机理研究进展[J]. 北方园艺, 2013(5): 186-190.
[24] BENJAWAN C, CHUICHUDE P. Control of skin color and polyphenol oxidase activity in santol fruit by dipping in organic acid solution[J]. Pakistan Journal of Biological Sciences, 2009, 12(11): 852-858.
[25] JIANG Y M, FU J R, ZAUBERMAN G, et al. Purification of polyphenol oxidase and the browning control of litchi fruit by glutathione and citric acid[J]. Journal of the Science of Food and Agriculture, 1999, 79(7): 950-954.
Optimization of Browning Inhibition Conditions of Litchi Wine by Response Surface Methodology
XUE Churan
1, LIU Shuwen
1, YAN Jun
1, YANG Shiling
1, XU Xiangwen
2
(1. College of Enology, Northwest A&F University, Yangling 712100, China; 2. Guangdong Weiduo Biotechnology Co. Ltd., Maoming 525000, China)
Abstract:Single factor experiments were carried out to confirm the optimal concentrations of six browning inhibitors added to litchi wine. Based on the results, orthogonal array experiments involving six factors at two levels were designed to determine the effectiveness of inhibitors in terms of inhibition rate using an L 8(2 7) orthogonal array design. The four inhibitors with the greatest effects on browning inhibition were L-cysteine, glutathione (GSH), ethylene diamine tetraacetic acid disodium (EDTA-Na 2) and citric acid. The experimental data were analyzed by response surface regression using Design-Expert 8.0. The results showed that the best browning inhibitor for litchi wine was obtained by the combined use of 8.46 mmol/L L-cysteine, 1.16 mmol/L GSH, 1.87 mmol/L EDTA-Na 2, and 1.89 mmol/L citric acid. The predicted value of browning inhibition rate using the optimized combination of browning inhibitors was 47.89%, and the actual value was 50.18%, representing a coincidence rate of 95.44%.
Key words:litchi wine; browning inhibitor; browning inhibition rate; orthogonal experimental design; response surface methodology
中图分类号:TS262.7
文献标志码:A
文章编号:1002-6630(2015)20-0043-06
doi:10.7506/spkx1002-6630-201520008
收稿日期:2015-03-18
基金项目:广东省教育部产学研结合项目(2011A01003);茂名市重大科技专项(2009B090300133)
作者简介:薛楚然(1989—),女,硕士研究生,研究方向为荔枝与荔枝酒褐变机理及其控制。E-mail:xuechuran@hotmail.com
*通信作者:刘树文(1965—),男,教授,博士,研究方向为葡萄酒酿造工艺、葡萄酿酒微生物。E-mail:liushuwen@nwsuaf.edu.cn