表1 梯度洗脱程序
Table1 Gradient elution program
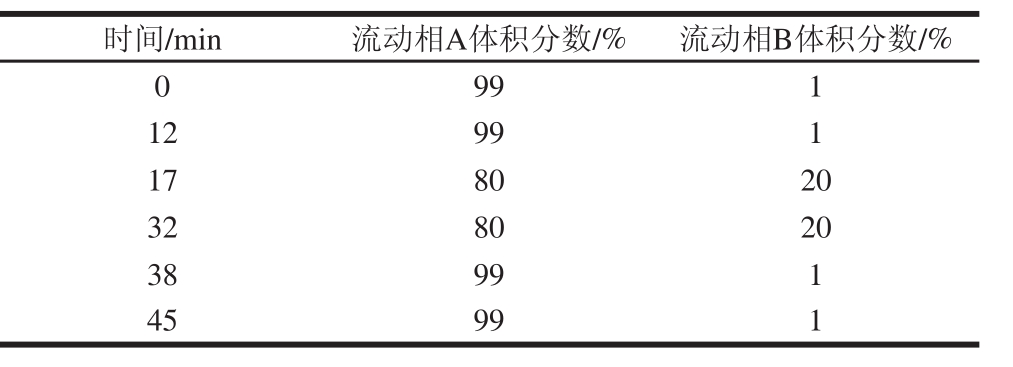
时间/min流动相A体积分数/%流动相B体积分数/% 0 991 12991 178020 328020 38991 45991
聂启兴 1,冯 蕾 1,张媛媛 2,聂少平 1,*,熊 涛 1,谢明勇 1
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.石家庄学院化工学院,河北 石家庄 050035)
摘 要:建立高效液相色谱-串联紫外-荧光检测器同时测定发酵前后果蔬中4 种水溶性B族维生素(硫胺素(VB 1)、核黄素(VB 2)、烟酸(VB 3)和吡哆醇(VB 6))的分析新方法。在已优化的实验条件下,4 种待测物的分离效果较好,仪器检出限在0.23~54 μg/L之间,线性相关系数在0.998 2~0.999 9之间,线性关系良好。枸杞果浆在3 个添加水平的平均回收率在86.99%~110.23%之间,相对标准偏差在1.25%~6.88%之间。该方法简便、快捷、准确、选择性好,可用于发酵前后果浆中4 种水溶性维生素的同时测定。
关键词:水溶性维生素;发酵;高效液相色谱
水溶性维生素是维持人体生命健康必不可少的一类有机化合物,主要包括B族维生素与VC [1]。水溶性维生素缺乏可导致癫痫 [2]、口角炎 [3]、心功能障碍 [4]、神经系统紊乱等多种疾病。发酵是指通过微生物的生长繁殖和代谢活动,产生和积累人们所需产品的生物反应过程 [5]。发酵食品具有调节肠道菌群,提高免疫力和抗癌等作用 [6-10]。然而,发酵过程会导致食品中维生素含量发生变化 [11-13],因此,研究建立发酵前后果浆中水溶性维生素分析方法,对于监测果蔬发酵过程中水溶性维生素的含量变化,进一步优化发酵果蔬生产工艺有着重要的现实意义。
由于水溶性维生素的结构差异较大,且发酵前后果蔬样品基质复杂,因此,较难实现样品中水溶性维生素的同时测定。目前,对于水溶性维生素的分析测定主要采用高效液相色谱(high-performance liquid chromatography,HPLC)法 [14-17]。其中,质谱分析法 [15]的设备昂贵难于普及,从而限制了其在水溶性维生素研究中的应用;紫外分析法 [14,18]的灵敏度较低,仅适用于样品中丰度较高的维生素的分析测定;荧光分析法 [19]具有较高的灵敏度和选择性,但无法用于自体荧光响应较差的维生素的分析。因此,单独的紫外检测法或荧光检测法无法满足发酵前后果蔬样品中水溶性维生素的同时测定。基于此,本实验应用HPLC-串联紫外-荧光检测(HPLC-ultraviolet-fluorescence detector,HPLC-UV-FLD)法,建立同时分析发酵前后果蔬中4 种水溶性B族维生素(硫胺素(VB 1)、核黄素(VB 2)、烟酸(VB 3)和吡哆醇(VB 6))的新方法,取得了较为满意的结果。
1.1 材料、试剂与仪器
新鲜枸杞浆、胡萝卜浆、雪梨汁、柚子汁,发酵枸杞浆、胡萝卜浆、雪梨汁、柚子汁均由本实验室自制。
标准品(VB 1、VB 2、VB 3、VB 6,纯度均大于98.5%) Aladdin-阿拉丁试剂(上海)有限公司;实验用水为屈臣氏蒸馏水 广州屈臣氏食品饮料有限公司;甲酸、乙腈均为色谱纯。
1260 HPLC仪(配备G1311C四元泵、G1313A自动进样器、G1316C柱温箱、G4121A DAD二极管阵列检测器、G1321A FLD、ChemStation B.04.02色谱工作站)美国Agilent科技有限公司;高速冷冻离心机 德国Thermo Electron LED GmbH公司;超声波清洗器 昆山市超声仪器有限公司;XS-105电子分析天平 瑞士梅特勒-托利多集团。
1.2 方法
1.2.1 标准溶液配制
准确称取上述4 种维生素标准品,用体积分数1%甲酸溶液配制成质量浓度为200 mg/L的标准溶液,置于4 ℃保存。使用时用体积分数0.08%甲酸溶液逐级稀释,配制混合标准工作液,以上操作均在避光条件下进行。
1.2.2 样品处理
枸杞浆、胡萝卜浆:称取样品2.5 g(精确至0.000 1 g)于50 mL离心管中(锡箔纸包裹避光),加入10 mL体积分数0.08%甲酸溶液超声水浴中室温条件下提取10 min,然后置于高速冷冻离心机中10 000 r/min离心10 min,离心温度16 ℃,移取上清液。重复提取1 次,合并上清液,定容至25 mL容量瓶,样品经0.22 μm微孔滤膜过滤后进样分析。
柚子汁、雪梨汁:称取样品10 g(精确至0.000 1 g),加入10 mL体积分数0.08%甲酸溶液超声水浴中室温提取10 min,离心后定容于25 mL容量瓶,样品经0.22 μm微孔滤膜过滤后进样分析。
1.2.3 色谱条件
色谱柱:Diamonsil C 18(4.6 mm×250 mm, 5 μm);柱温35 ℃;进样量10 μL;流量0.5 mL/min。实验采用梯度洗脱,流动相A为体积分数0.08%甲酸溶液,流动相B为乙腈,洗脱程序如表1所示。紫外检测VB 1、VB 3含量,检测波长为275 nm;荧光检测VB 2、VB 6含量,激发/发射波长分别为VB 2(374 nm/524 nm)、VB 6(293 nm/396 nm)。
表1 梯度洗脱程序
Table1 Gradient elution program

时间/min流动相A体积分数/%流动相B体积分数/% 0 991 12991 178020 328020 38991 45991
2.1 色谱条件的选择
由于VB 1、VB 3和VB 6的极性较强,在C 18柱上的保留能力比较弱,而VB 2的极性相对较弱,在C 18柱上的保留能力比较强。因此,实验采用梯度洗脱 [20-21]。
实验分别考察了流动相中缓冲溶液(磷酸二氢钾-氢氧化钠缓冲溶液(50 mmol/L,pH 5.5~6.5)和甲酸溶液(0.05%~2%))、有机相比例以及流速对4 种水溶性B族维生素色谱行为的影响。结果发现,使用磷酸二氢钾-氢氧化钠缓冲溶液作为流动相时,基线不稳定,梯度洗脱时出现大量溶剂峰;而使用甲酸溶液作为流动相时,基线波动较小,且当甲酸溶液体积分数为0.08%时,4 种待测物能够获得较好的峰形和分离度,且检测灵敏度较高。因此,实验选择体积分数0.08%甲酸溶液缓冲体系,混合维生素标准溶液见图1。在已优化的色谱条件下,4 种水溶性B族维生素的分离效果较好。
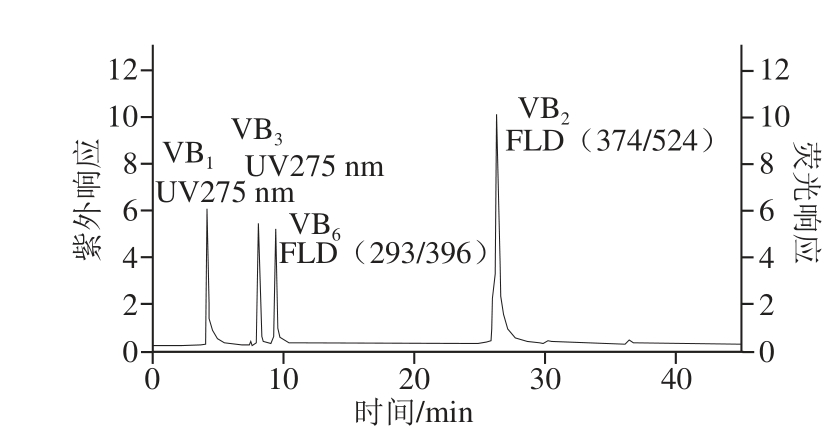
图1 4 种水溶性维生素混合标准溶液色谱图
Fig.1 HPLC chromatograms of mixed standards of four water-soluble vitamins
2.2 线性关系与检出限
取少量维生素标准溶液混合配制成维生素标准混合液,VB 1、VB 3、VB 6、VB 2的质量浓度依次为50、50、2.5、10 mg/L,用体积分数0.08%甲酸溶液逐级稀释成一系列不同质量浓度的混合标准液(n=8)。按1.2.3节色谱条件进行HPLC分析(紫外法检测VB 1、VB 3,荧光法检测VB 2、VB 6),以吸收峰面积(Y)对质量浓度(X)进行线性拟合,以3 倍信噪比为仪器检出限,同时分别称取2.5 g新鲜胡萝卜和10 g黄冠梨,按1.2.2节方法提取得到水溶性维生素提取液,提取液再经过稀释后上机测定,以3 倍信噪比得出4 种水溶性维生素的方法检出限。由表2可知,4 种组分在线性范围内,峰面积与质量浓度呈良好的线性关系(r 2均大于0.998),仪器检出限在0.23~54 μg/L之间,以胡萝卜为基质的方法检出限在2.30~345 μg/kg之间,以黄冠梨为基质的方法检出限在14.5~135 μg/kg之间。
表2 4 种水溶性维生素的线性范围、线性方程、相关系数及检出限
Table2 Linear equations with correlation coeffi cients, limits of detection (LODs) and limits of quantifi cation (LOQs) for four water soluble vitamins
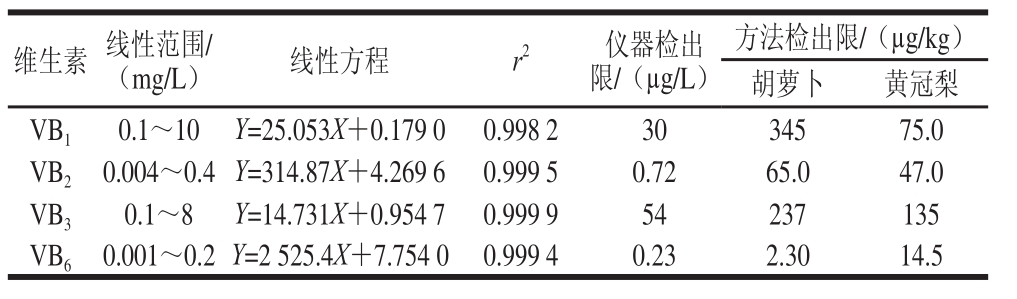
维生素线性范围/(mg/L)线性方程r 2仪器检出限/(μg/L)方法检出限/(μg/kg)胡萝卜黄冠梨VB 10.1~10Y=25.053X+0.179 00.998 23034575.0 VB 20.004~0.4Y=314.87X+4.269 60.999 50.7265.047.0 VB 30.1~8Y=14.731X+0.954 70.999 954237135 VB 60.001~0.2Y=2 525.4X+7.754 00.999 40.232.3014.5
2.3 方法精密度与回收率
表3 添加回收率及RSD结果
Table3 Result of spiked recoveries and relative standard deviations
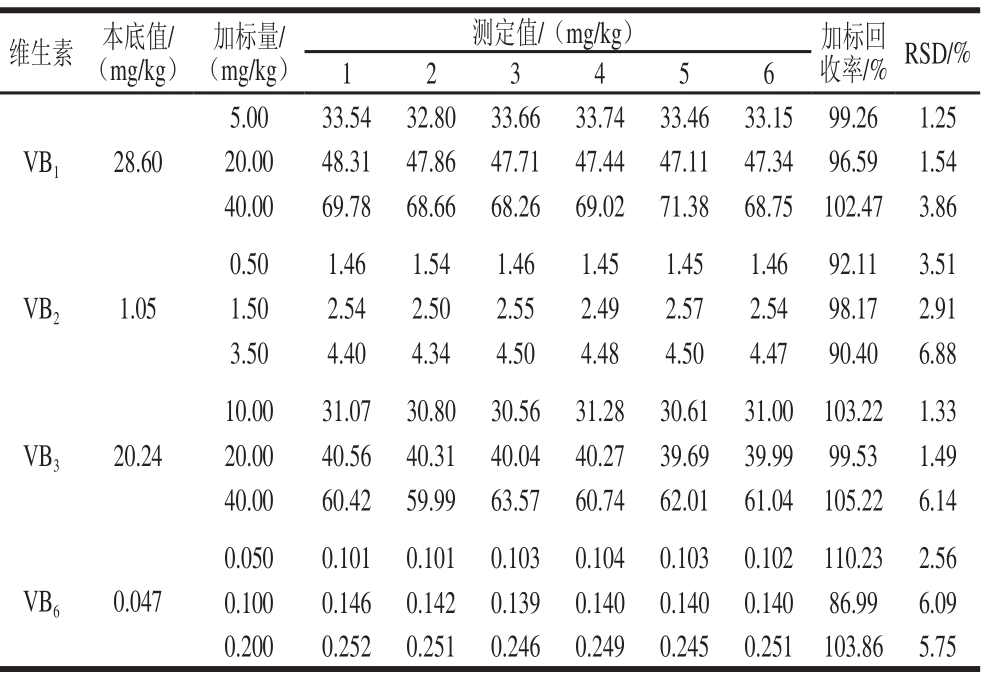
维生素本底值/(mg/kg)加标量/(mg/kg)测定值/(mg/kg)加标回收率/%RSD/%123456 VB 128.60 5.0033.5432.8033.6633.7433.4633.1599.261.25 20.0048.3147.8647.7147.4447.1147.3496.591.54 40.0069.7868.6668.2669.0271.3868.75102.473.86 VB 21.05 0.501.461.541.461.451.451.4692.113.51 1.502.542.502.552.492.572.5498.172.91 3.504.404.344.504.484.504.4790.406.88 VB 320.24 10.0031.0730.8030.5631.2830.6131.00103.221.33 20.0040.5640.3140.0440.2739.6939.9999.531.49 40.0060.4259.9963.5760.7462.0161.04105.226.14 VB 60.047 0.0500.1010.1010.1030.1040.1030.102110.232.56 0.1000.1460.1420.1390.1400.1400.14086.996.09 0.2000.2520.2510.2460.2490.2450.251103.865.75
取未发酵枸杞果浆为原料,分别添加3 个不同质量浓度的混合标准溶液进行回收率和精密度实验。未加标枸杞果浆和加标枸杞果浆按1.2.2节方法进行样品处理后,按1.2.3节色谱条件进行分析,每个水平重复测定6 次,测定结果见表3,枸杞果浆样品及样品加标色谱如图2所示。结果显示,4 种待测物的加标回收率在86.99%~110.23%之间,相对标准偏差(relative standard deviation,RSD)在1.25%~6.88%之间。以上结果表明,该方法准确可靠,可用于实际样品的测定。
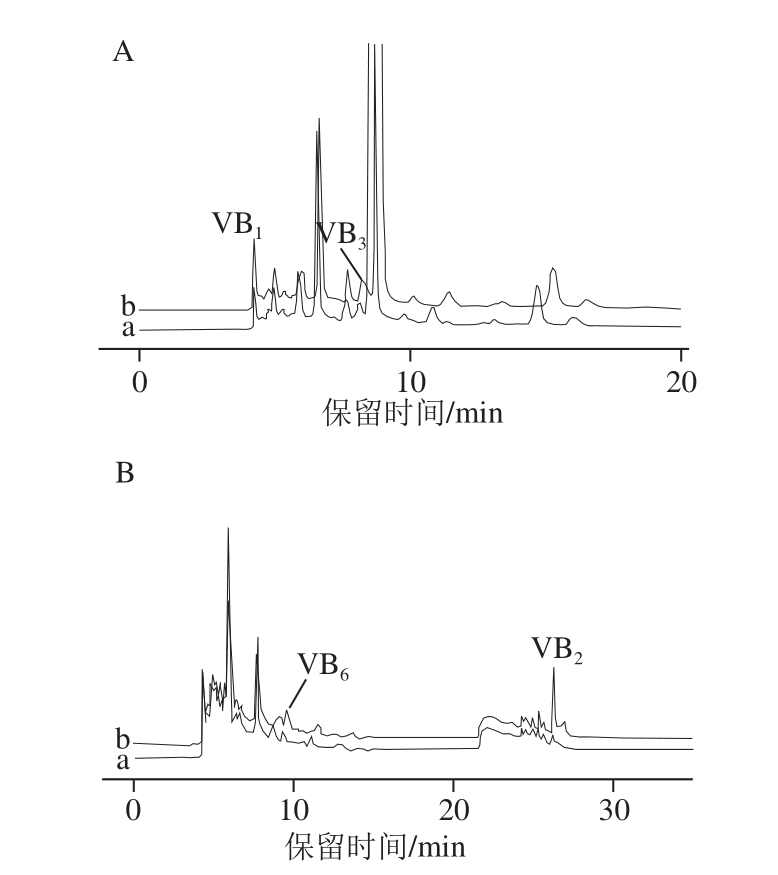
图2 枸杞及枸杞加标色谱图
Fig.2 Chromatograms of unspiked and spiked wolfberries with UV detector (A) and fl uorescence detector (B)
A.紫外检测;B.荧光检测;a.枸杞果浆样品;b.枸杞果浆样品加标。
2.4 实际样品检测结果
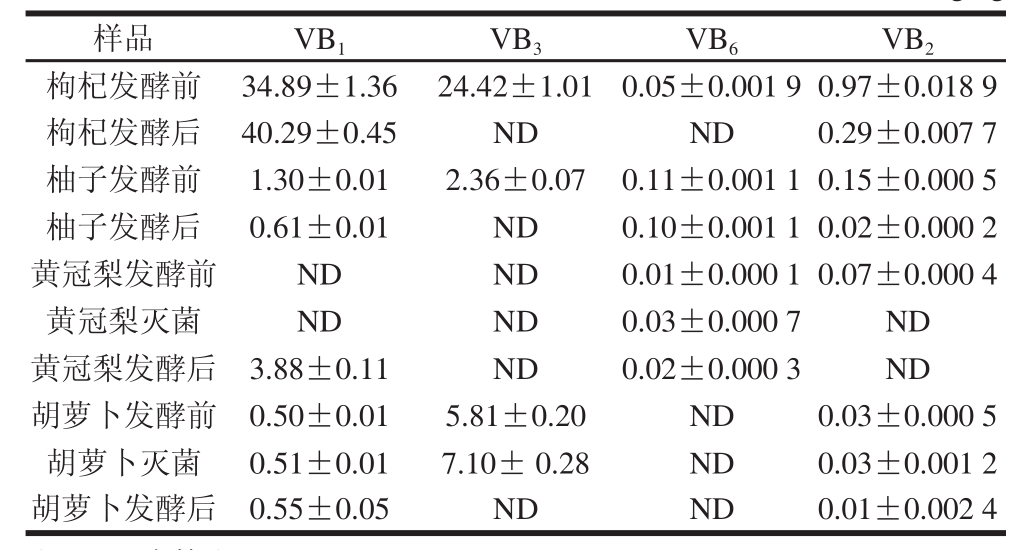
表4 发酵前后样品测定结果(n=3)
Table4 Water soluble vitamin contents of fermented and unfermented wolfberries (n= 3) mg/kg
注:ND.未检出。
样品VB 1VB 3VB 6VB 2枸杞发酵前34.89±1.3624.42±1.010.05±0.001 90.97±0.018 9枸杞发酵后40.29±0.45NDND0.29±0.007 7柚子发酵前1.30±0.012.36±0.070.11±0.001 10.15±0.000 5柚子发酵后0.61±0.01ND0.10±0.001 10.02±0.000 2黄冠梨发酵前NDND0.01±0.000 10.07±0.000 4黄冠梨灭菌NDND0.03±0.000 7ND黄冠梨发酵后3.88±0.11ND0.02±0.000 3ND胡萝卜发酵前0.50±0.015.81±0.20ND0.03±0.000 5胡萝卜灭菌0.51±0.017.10± 0.28ND0.03±0.001 2胡萝卜发酵后0.55±0.05NDND0.01±0.002 4
取发酵前后枸杞浆、胡萝卜浆、柚子汁、黄冠梨汁以及灭菌胡萝卜浆、黄冠梨汁进行4 种水溶性维生素测定。以保留时间定性,色谱峰面积定量,外标法测定维生素含量,每个样品平行测定3 次(n=3),结果见表4。对于VB 1,枸杞、黄冠梨和胡萝卜中发酵后含量提高,其中黄冠梨发酵前未检出,发酵后检出,而柚子中发酵后含量减少;VB 2及VB 3经发酵后含量均减少;VB 6除黄冠梨含量有轻微上升,其余均减少。由黄冠梨和胡萝卜中发酵前样品以及发酵前灭菌样品的对比可知,灭菌会减少黄冠梨VB 2含量而不影响胡萝卜VB 2含量,对其余3 种维生素则有略微增加。Beitane等 [22]报道通过增加牛奶中不同浓度的乳果糖和菊粉后由双歧杆菌发酵均可提高VB 1的含量,但对于VB 6,则与添加浓度有很大的关系;Champagne等 [23]报道通过瑞士乳杆菌单独发酵或者与嗜热链球菌和双歧杆菌混合发酵大豆饮品会提高VB 1的含量,但结果不显著,同时,对VB 6含量没有影响;Hou等 [11]报道双歧杆菌发酵豆浆后减少了VB 3的含量。所以对于样品柚子汁中VB 1含量的减少可能是因为柚子中糖类含量较少,缺乏益生菌发酵的底物,从而导致含量的降低,而其他维生素含量的变化可能是发酵过程中一些其他变量变化导致的结果。也有其他的一些报道 [24-25]得出一些食品发酵前后维生素含量的变化,但结果各异。本实验所用发酵菌种为干酪乳杆菌、鼠李糖乳杆菌以及植物乳杆菌混合而成的混合发酵剂,因此发酵前后维生素含量可能因为原料、菌种、发酵条件等的差异而呈现不同的结果。
本实验建立一种HPLC-UV-FLD法同时检测发酵前后果蔬中4 种水溶性维生素的方法,采用甲酸溶液与乙腈溶液为流动相,方便快捷、回收率稳定、线性良好,为发酵食品的营养价值评价以及优化发酵工艺条件提供一定参考依据,而发酵过程中引起维生素含量变化的原因,则需要进行进一步实验探讨。
参考文献:
[1] 谢明勇. 食品化学[M]. 北京: 化学工业出版社, 2011: 137.
[2] İNCECIK F, HERGÜNER M Ö, ALTUNBAŞAK Ş. Vitamin B 12defi ciency and epilepsy in children[J]. Balkan Medical Journal, 2010, 27(4): 351-353.
[3] 郭长江, 顾景范. 核黄素[J]. 营养学报, 2013, 35(2): 119-121.
[4] PORTER S G, COATS D, FISCHER P R, et al. Thiamine defi ciency and cardiac dysfunction in Cambodian infants[J]. The Journal of Pediatrics, 2014, 164(6): 1456-1461.
[5] 余龙江. 发酵工程原理与技术应用[M]. 北京: 化学工业出版社, 2006: 1.
[6] 杜鹏, 霍贵成. 传统发酵食品及其营养保健功能[J]. 中国酿造, 2004, 23(3): 6-8.
[7] 刁治民, 于学军. 发酵乳的营养价值及保健作用[J]. 中国乳品工业, 1998, 26(5): 11-14.
[8] PARVEZ S, MALIK K A, AHKANG S, et al. Probiotics and their fermented food products are beneficial for health[J]. Journal of Applied Microbiology, 2006, 100(6): 1171-1185.
[9] STANTON C, ROSS R P, FITZGERALD G F, et al. Fermented functional foods based on probiotics and their biogenic metabolites[J]. Current Opinion in Biotechnology, 2005, 16(2): 198-203.
[10] GIBBS B F, ZOUGMAN A, MASSE R, et al. Production and characterization of bioactive peptides from soy hydrolysate and soyfermented food[J]. Food Research International, 2004, 37(2): 123-131.
[11] HOU J, YU R, CHOU C. Changes in some components of soymilk during fermentation with bifidobacteria[J]. Food Research International, 2000, 33(5): 393-397.
[12] LEBLANC J G, LAIÑO J E, del VALLE M J, et al. B-Group vitamin production by lactic acid bacteria-current knowledge and potential applications[J]. Journal of Applied Microbiology, 2011, 111(6): 1297-1309.
[13] LIEM I T, STEINKRAUS K H, CRONK T C. Production of vitamin B-12 in tempeh, a fermented soybean food[J]. Applied and Environmental Microbiology, 1977, 34(6): 773-776.
[14] 张凤枰, 赵艳, 刘耀敏, 等. 青藏高原白刺、枸杞和沙棘果粉中水溶性维生素含量比较分析[J]. 食品科学, 2010, 31(2): 179-182.
[15] 夏静, 俞婧, 孙磊, 等. 功能性饮料中9 种水溶性维生素的HPLC-MSMS同步检测技术[J]. 食品科学, 2014, 35(12): 196-199. doi: 10.7506/ spkx1002-6630-201412040.
[16] HEUDI O, KILINÇ T, FONTANNAZ P. Separation of water-soluble vitamins by reversed-phase high performance liquid chromatography with ultra-violet detection: application to polyvitaminated premixes[J]. Journal of Chromatography A, 2005, 1070(1/2): 49-56.
[17] SANTOS J, MENDIOLA J A, OLIVEIRA M B P P, et al. Sequential determination of fat- and water-soluble vitamins in green leafy vegetables during storage[J]. Journal of Chromatography A, 2012, 1261: 179-188.
[18] 张志清, 白琦, 湛珺雯, 等. RP-HPLC法测定功能性饮料水溶性维生素含量[J]. 食品科学, 2010, 31(14): 212-215.
[19] 宓晓黎, 丁贵平, 李利东. 荧光液相色谱法测定强化面粉中维生素B 1、B 2和B 11[J]. 现代食品科技, 2005, 21(2): 150-152.
[20] 蒲明清, 戴舒春, 张连龙, 等. 超高效液相色谱法测定保健食品中的多种水溶性维生素[J]. 现代食品科技, 2012, 28(7): 886-889.
[21] ASLAM J, KHAN S H, KHAN S A. Quantifi cation of water soluble vitamins in six date palm (Phoenix dactylifera L.) cultivar’s fruits growing in Dubai, United Arab Emirates, through high performance liquid chromatography[J]. Journal of Saudi Chemical Society, 2013, 17(1): 9-16.
[22] BEITANE I, CIPROVICA I. The study of added prebiotics on B group vitamins concentration during milk fermentation[J]. AC Romanian Biotechnology Letters, 2011, 16(6): 92-96.
[23] CHAMPAGNE C P, TOMPKINS T A, BUCKLEY N D, et al. Effect of fermentation by pure and mixed cultures of Streptococcus thermophilus and Lactobacillus helveticus on isofl avone and B-vitamin content of a fermented soy beverage[J]. Food Microbiology, 2010, 27(7): 968-972.
[24] ALM L. Effect of fermentation on B-vitamin content of milk in Sweden[J]. Journal of Dairy Science, 1982, 65(3): 353-359.
[25] EKINCI R. The effect of fermentation and drying on the water-soluble vitamin content of tarhana, a traditional Turkish cereal food[J]. Food Chemistry, 2005, 90(1/2): 127-132.
Simultaneous Determination of Four Water-Soluble Vitamins in Fresh and Fermented Vegetables and Fruits by High-Performance Liquid Chromatography
NIE Qixing
1, FENG Lei
1, ZHANG Yuanyuan
2, NIE Shaoping
1,*, XIONG Tao
1, XIE Mingyong
1
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China; 2. School of Chemical Engineering, Shijiazhuang University, Shijiazhuang 050035, China)
Abstract:A simple, sensitive and selective method was developed for simultaneous determination of four water-soluble B vitamins including thiamine (VB 1), ribofl avin (VB 2), nicotinic acid (VB 3) and pyridoxal (VB 6), in fresh and fermented vegetables and fruits by high-performance liquid chromatography (HPLC) coupled with UV and fluorescence detector. Under the optimized conditions, all four compounds were well separated. The instrumental limits of detection and limits of quantifi cation for the four B vitamins ranged from 0.23 to 54 μg/L, respectively, and good linear correlation was observed with R 2of 0.998 2 to 0.999 9. Recoveries of the four B vitamins in goji berries (Lycium barbarum) were in the range of 86.99%-110.23% at three spiked levels, with relative standard deviations (RSD S) of 1.25%-6.88%. This method is simple, rapid, accurate and selective, and can be successfully applied to the simultaneous determination of four water-soluble vitamins in fresh and fermented fruits and vegetables.
Key words:water-soluble vitamins; fermentation; high-performance liquid chromatography
中图分类号:Q563
文献标志码:A
文章编号:1002-6630(2015)20-0101-04
doi:10.7506/spkx1002-6630-201520018
收稿日期:2015-03-17
基金项目:国家高技术研究发展计划(863计划)项目(2011AA100904)
作者简介:聂启兴(1993—),男,硕士研究生,研究方向为食品化学与营养学。E-mail:18770045074@163.com
*通信作者:聂少平(1978—),男,教授,博士,研究方向为食品化学与分析、食品营养与安全、食品复杂碳水化合物。
E-mail:spnie@ncu.edu.cn