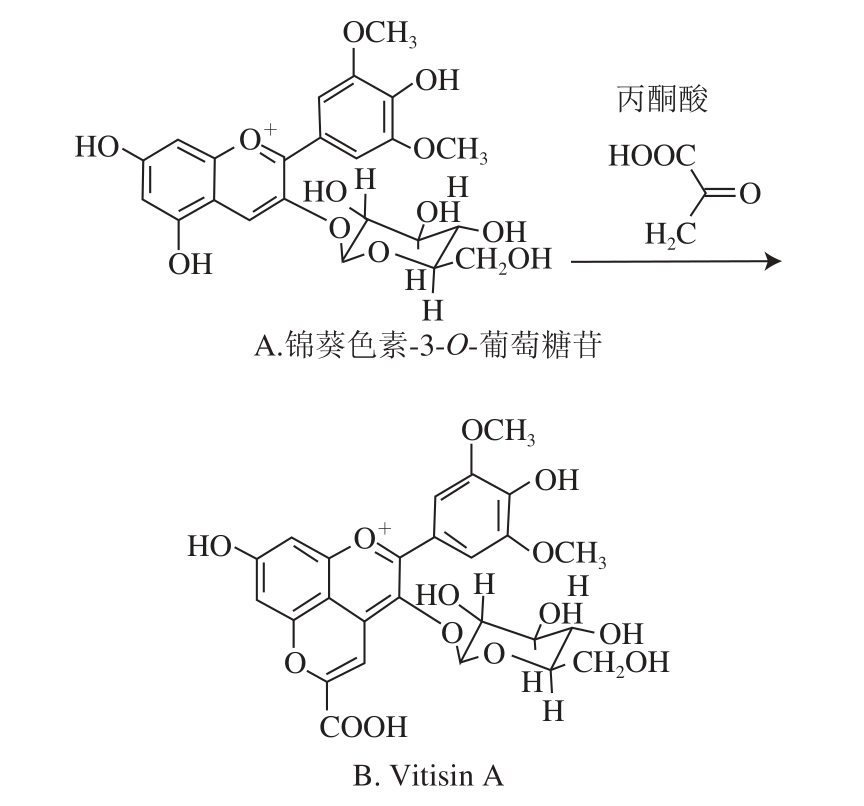
图1 锦葵色素及Vitisin A结构及转变[
12]
Fig.1 Structure and conversion of malvidin to vitisin A
闫 衡 1,韩舜愈 1,王 波 2,周小平 2,*
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.甘肃出入境检验检疫局综合技术中心,甘肃 兰州 730000)
摘 要:使用锦葵色素-丙酮酸混合溶液作为反应液合成锦葵色素衍生花色苷——Vitisin A,研究Vitisin A的高效液相色谱检测方法,并优化检测条件。初步研究了Vitisin A合成过程中量的变化情况。结果表明,利用反相高效液相色谱法,采用CAPCELL PAK C 18ACR色谱柱,乙腈-水(磷酸调pH值为1.5)溶液作为流动相,使用紫外检测器在波长为507 nm条件下对Vitisin A进行检测。使用质谱法对Vitisin A进行定性分析,将结果与谱库信息进行对比。该方法同样适用于检测葡萄酒中的Vitisin A。
关键词:Vitisin A;锦葵色素;葡萄酒;高效液相色谱-串联质谱
葡萄酒是目前世界上产量最大、普及最广的单糖酿造酒,其质量指标可分为感官指标和理化指标两大类。其中,色泽是葡萄酒重要感官指标之一。花色苷是葡萄酒中主要的显色物质 [1-2]。近年来研究表明,葡萄酒中的单体花色苷主要包括矢车菊色素、飞燕草色素、芍药色素、牵牛花色素和锦葵色素 [3]。葡萄酒陈酿过程中可以促进酒中杂醇类物质的分解,不仅可以减少葡萄酒的青涩味,提升葡萄酒的口感,还有益于人体健康。但是,陈酿时间较长会导致葡萄酒中花色苷的分解。在对陈酿葡萄酒中花色苷的检测的相关实验中,仅检测到锦葵色素衍生花色苷Vitisin A的存在 [4]。
锦葵色素-3-O-葡萄糖苷又称二甲花翠素-3-O-葡萄糖苷,是大多数葡萄酒的第一特征花色苷 [5-6]。其结构如图1A所示,与其他花色苷相比较,因其无邻二羟基而抗氧化性最强 [7]。故在葡萄酒环境下,锦葵色素的稳定性强于其他单体花色素 [8]。随着酒体发酵的进行,单体锦葵色素葡萄糖苷会与葡萄糖发酵代谢的中间产物及其他物质发生环化、加成、聚合等多种反应,形成更为稳定的呈色物质(花色苷衍生物),从而造成酒体颜色产生变化 [9]。吡喃花色苷是葡萄酒中主要呈色物质之一 [10],包括Vitisins型、甲基吡喃花色苷、酚基吡喃花色苷等 [11]。
Vitisin A是Vitisins类物质的主要成分,结构如图1B所示,是在红葡萄酒发酵及后熟过程中锦葵色素与烯醇化的丙酮酸反应所产生的一类羧基吡喃环花色苷,反应变化如图1所示 [12]。结构的改变使在一定pH值范围内Vitisin A更稳定,且更耐受二氧化硫的漂白作用 [13-14]。其色泽主要呈现橙红色,因此使得酒体色泽呈现砖红色 [15]。在葡萄酒酿造及陈酿过程的环境条件下,Vitisin A要比其他花色苷表现出更深的颜色 [16]。此外,与锦葵花色苷相比,Vitisin A对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除能力更优,有较强的抗氧化能力 [17-19];在对肿瘤坏死因子的抑制作用研究中还发现,Vitisin A在一定程度上能抑制肿瘤 [20]。因此,研究锦葵色素及Vitisin A的分离检测与合成变化对提高葡萄酒感官品质及营养价值具有非常重要的意义。

图1 锦葵色素及Vitisin A结构及转变[
12]
Fig.1 Structure and conversion of malvidin to vitisin A
目前,国外对Vitisin A的研究较多,主要集中在对葡萄酒中花色苷种类的定性及Vitisin A合成所需的反应物质及其稳定性方面的研究。确定了Vitisin A的结构,并使用液相色谱-质谱法及核磁共振法对Vitisin A进行定性分析 [14],明确了Vitisin A是锦葵色素与丙酮酸反应的生成物,且生成量受反应物含量制约 [12]。部分研究涉及到了Vitisin A功能活性的研究,但研究并不全面 [17-20]。而国内针对Vitisin A的学术报道鲜少出现。
国内外对于花色苷的检测标准并未有明确规定。实验研究中常用方法主要有纸层析与薄层板层析 [21-22]、紫外-可见光谱法 [23]、高效液相色谱法 [24-25]、花色苷水解法等 [26]。其中,高效液相色谱法最为常见,可用于花色苷的定性和定量测定,但由于目前商业上可提供的花色苷标准物质有限,所以高效液相色谱多与质谱联用进行花色苷的定性分析 [3]。
本实验使用锦葵色素纯溶液,针对Vitisin A合成过程中的变化进行研究,采用CAPCELL PAK C 18ACR色谱柱、二极管阵列检测器、反相色谱条件的高效液相色谱分析技术,对Vitisin A分离检测方法进行研究,在不同红葡萄酒中同时分离锦葵色素-3-O-葡萄糖苷及Vitisin A。并通过检测锦葵色素-3-O-葡萄糖苷与丙酮酸反应生成Vitisin A含量以研究Vitisin A的变化规律。建立了检测葡萄酒中Vitisin A含量的方法,并讨论了Vitisin A合成过程中的变化趋势,为葡萄酒中花色苷的进一步研究提供参考依据。
1.1 材料、试剂与仪器
样品酒来源于甘肃农业大学,由甘肃农业大学自种葡萄采用传统酿造工艺酿成,酿成后4 ℃保藏。葡萄品种及酿造时间如表1所示。
表1 葡萄酒样品信息
Table1 Information about the sample grape wines used in this study

赤霞珠20142013201220112010陈酿时间/a1112345品种及酿制年份黑比诺(2014)蛇龙珠(2014)
锦葵色素-3-O-葡萄糖苷标准品(纯度98%) 美国Chromadex公司;蒸馏水 广州屈臣氏食品饮料有限公司;甲醇、乙腈(均为色谱纯) 德国Merck公司。
Ultimate 3000型双三元二维液相色谱仪 美国Dionex公司;1290-6460超高效液相色谱仪-串联四极杆质谱联用仪 美国Agilent公司;CP224S型分析天平 德国Sartorius公司;100~1 000 μL移液器、20~200 μL移液器德国Witeg公司;0.45 μm有机相滤膜 上海安谱科学仪器有限公司。
1.2 方法
1.2.1 溶液配制与样品处理
标准贮备液配制:准确称量10.0 mg锦葵色素-3-O-葡萄糖苷标准品转移至10 mL容量瓶中,用V(甲醇)∶V(水)=1∶1(磷酸调pH 1.5)溶液溶解并定容,充分摇匀,配制成1 000 mg/L锦葵色素-3-O-葡萄糖苷标准储备液,4 ℃冷藏保存。
标准工作液配制:将1 000 mg/L锦葵色素-3-O-葡萄糖苷标准贮备液准确量取1.5 mL,用V(甲醇)∶V(水)= 1∶1(磷酸调pH 1.5)溶液定容至10 mL容量瓶中,配制成150 mg/L锦葵色素-3-O-葡萄糖苷标准工作液,4 ℃条件下冷藏待用。
Vitisin A合成反应液配制:准确量取150 mg/L锦葵色素标准工作液5 mL,添加20 μL丙酮酸,使用V(甲醇)∶V(水)=1∶1(磷酸调pH 2.0)溶液定容至10 mL,于室温条件下避光放置反应。
样品处理:葡萄酒样品经0.45 μm膜过滤后直接进样分析。
1.2.2 实验条件
液相色谱条件:色谱柱:CAPCELL PAK C 18ACR(4.6 mm×150 mm,5 μm);流动相:A为乙腈-水(60∶40,V/V);B为乙腈-水(5∶95,V/V)(均使用磷酸调pH 1.5);进样体积:10 μL;流速:1.0 mL/min;柱温:35 ℃;检测波长:507 nm;梯度洗脱程序见表2。
表2 梯度洗脱程序
Table2 Gradient elution program
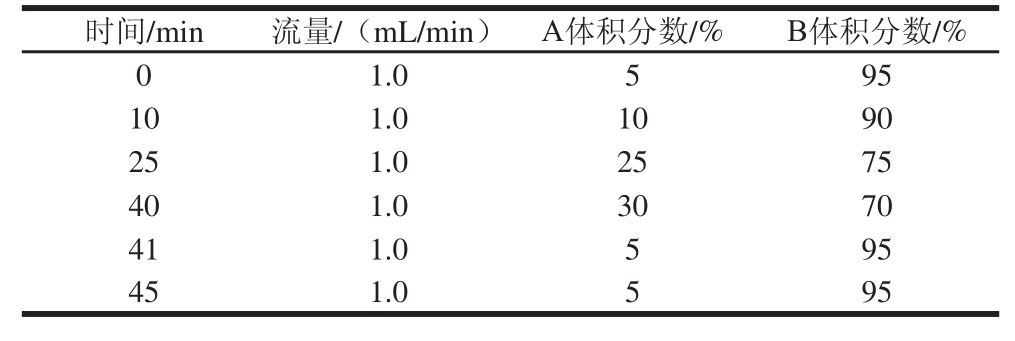
时间/min流量/(mL/min)A体积分数/%B体积分数/% 0 1.0595 101.01090 251.02575 401.03070 411.0595 451.0595
使用该条件定期对反应液进行检测,当单体系反应液色谱图中出现第2物质峰时表明有新物质生成,采用液相色谱-质谱联用技术对反应溶液进行定性分析,将结果同葡萄与葡萄酒中花色苷高效液相色谱-串联质谱的分子离子与碎片离子峰谱库信息 [9]进行比对,确定反应生成物性质。
质谱条件:正离子扫描(m/z 100~600),毛细管电压:3.50 kV;裂解电压:125 V;鞘气温度:350 ℃;鞘气流量:11 L/min;脱溶剂气温度:300 ℃;脱溶剂气流量:7 L/min。
1.3 数据处理
花色苷含量采用峰面积表示法,以色谱图中花色苷响应峰面积值表征花色苷含量,进行同种花色苷含量的比较。
2.1 Vitisin A的合成及定性
由锦葵色素溶液与丙酮酸溶液组成反应体系合成Vitisin A,反应液在0、7、14、21、28、35、42、49、56、63、75、86、176 d后分别进行检测,其检测结果显示,反应14 d后出现新物质峰,其相应面积随时间延长而增加,反应176 d后检测得最大值。图2为反应液反应初期与实验结束时检测所得色谱图。可以明显看出,新物质出峰时间晚于锦葵色素,约为21.3 min;锦葵色素含量显著减少,其响应峰面积由最初的38.48 mAU·min降至11.65 mAU·min。由于该反应体系初期仅存在锦葵色素与反应前体丙酮酸,故该新物质很有可能为锦葵色素衍生花色苷Vitisin A。
对反应液进行质谱分析,图2中峰2的质谱图如图3所示。该物质分子离子[M+H] +为m/z 561.1,碎片离子为m/z 398.9,是由分子离子失去了一个质量数为m/z 162.2的碎片(脱水六碳糖基)而得,在本系统中,很有可能为葡萄糖基。检测结果同葡萄与葡萄酒中花色苷高效液相色谱-质谱的分子离子与碎片离子峰谱库信息相符,故判定,生成物为Vitisin A。
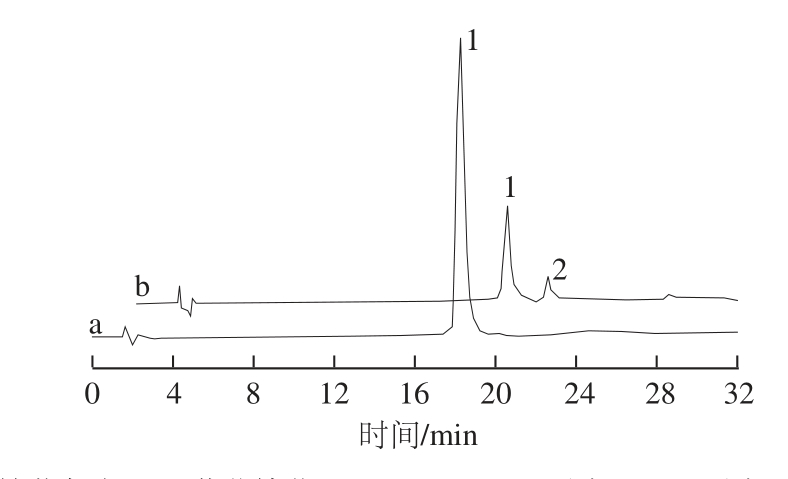
图2 反应液色谱图
Fig.2 Chromatogram of the reaction solution
1.锦葵色素-3-O-葡萄糖苷;2. Vitisin A;a.反应0 d;b.反应176 d。
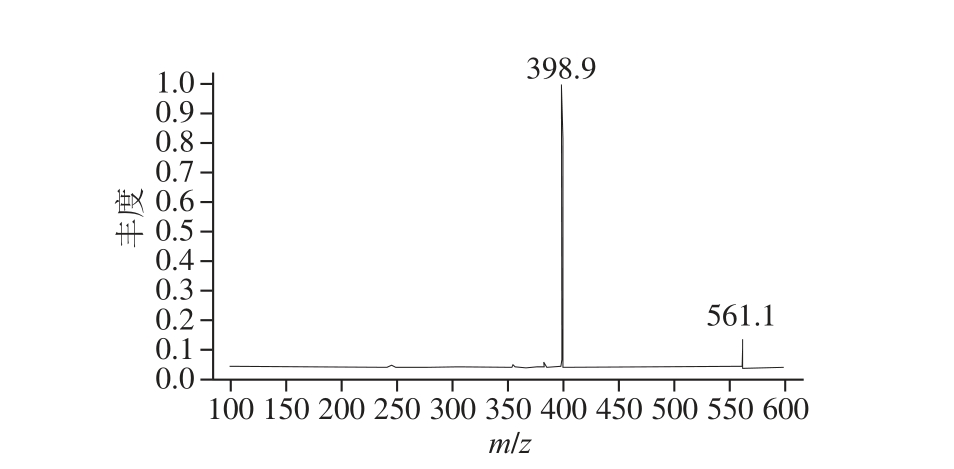
图3 Vitisin A ESI
+-MSS图及结构
Fig.3 ESI
+-MS spectrum and structure of vitisin A
根据质谱信息推测,质量数为m/z 162.2的碎片离子可能为葡萄糖基,Vitisin A断裂过程中与葡萄糖基相连的键更易断裂,裂解为一碎片离子与一葡萄糖基,裂解图如图4所示。
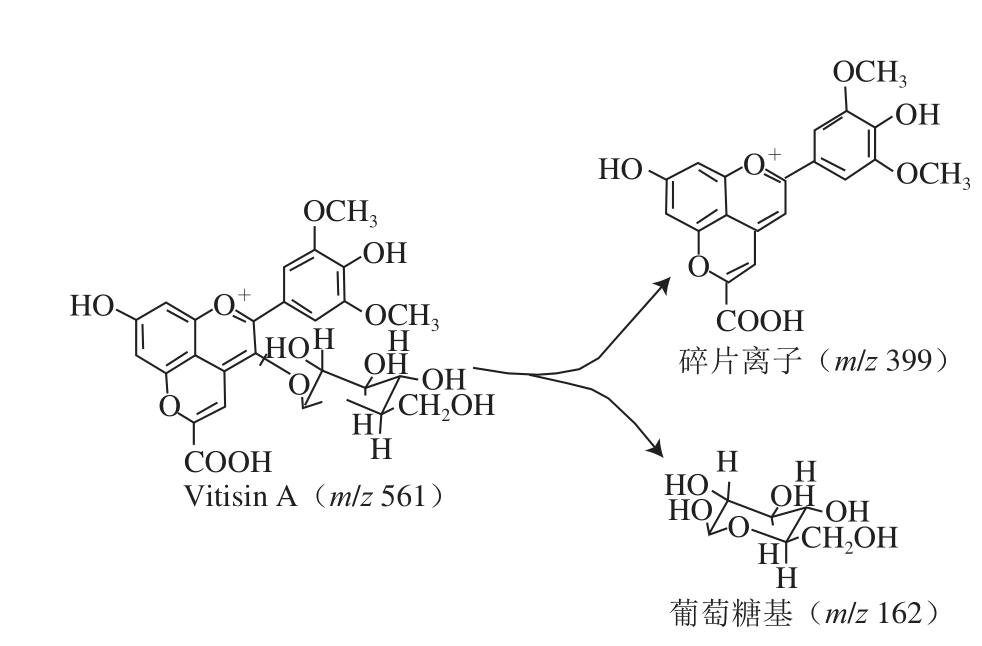
图4 Vitisin A裂解图
Fig.4 Cleavage map of vitisin A
2.2 高效液相色谱条件选择
花色苷为极性化合物,溶于极性溶剂,在低pH值条件下保持相对稳定。本实验选用CAPCELL PAK C 18ACR色谱柱,乙腈、水混合液作为流动相可对花色苷进行较好分离,且重复性较好。因此,本实验在上述色谱条件基础上,对流动相pH值及检测波长进行进一步优化。
2.2.1 流动相pH值的选择
在pH值较高时(pH>2.5),花色苷中常有非花色烊阳离子形式存在的干扰,而在pH为1.5时,约96%的花色苷呈红色花色烊阳离子结构。本实验对比了流动相pH 1.5与pH 2.5时2014年赤霞珠酿造酒中各花色苷出峰情况,色谱图及相邻峰分离度如图5、表3所示。
分离度和拖尾因子计算如公式(1)、(2)所示:
式(1)中:R s为分离度;t R1、t R2分别为相邻峰1、峰2的保留时间;W 1、W 2分别为峰1、峰2的基线宽度。
式(2)中:T为拖尾因子;h为峰高;W 0.05h为0.05峰高处的峰宽:d 1为峰顶点至峰前沿之间的宽度。
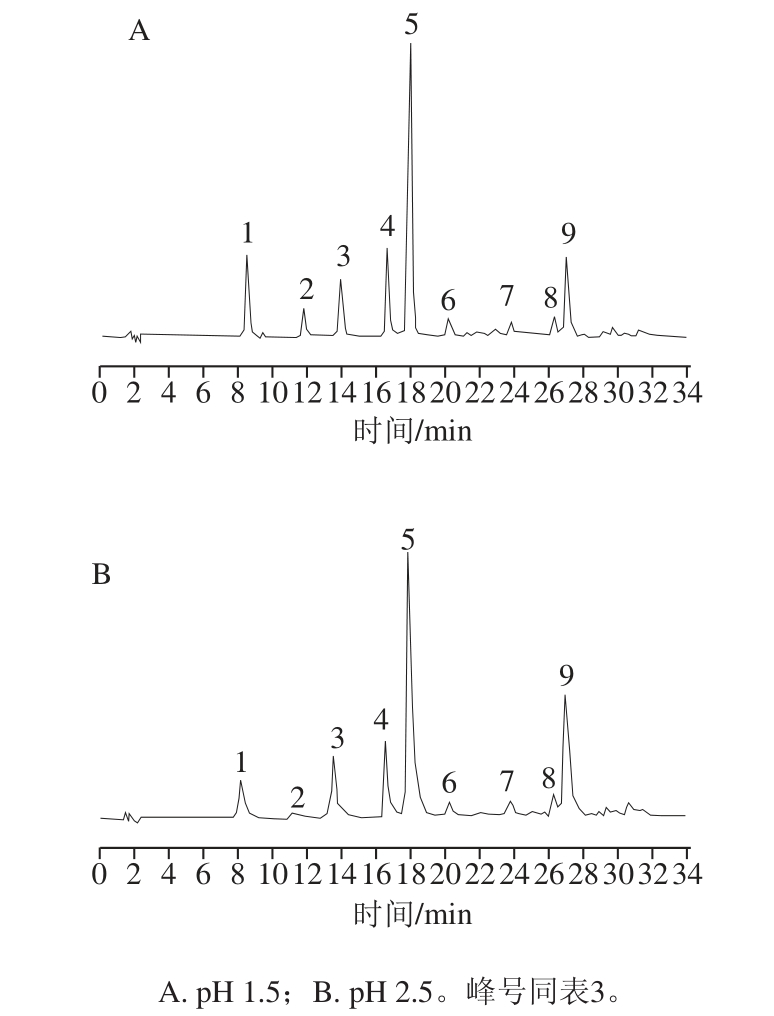
图5 不同pH值条件下葡萄酒色谱图
Fig.5 Chromatograms of grape wine at different pH values
表3 不同pH值条件下相邻峰分离度及拖尾因子
Table3 The resolution and tailing factor of adjacent peaks at different pH values
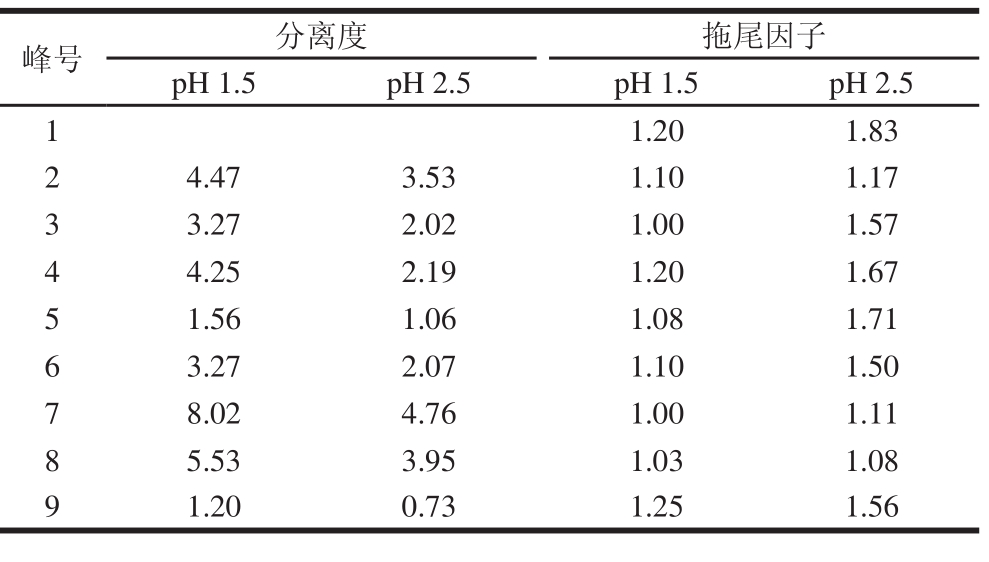
峰号分离度拖尾因子pH 1.5pH 2.5pH 1.5pH 2.5 1 1.201.83 24.473.531.101.17 33.272.021.001.57 44.252.191.201.67 51.561.061.081.71 63.272.071.101.50 78.024.761.001.11 85.533.951.031.08 91.200.731.251.56
由图5和表3可见,当流动相pH 1.5时赤霞珠葡萄酒中所有色谱峰峰宽均小于流动相pH 2.5条件下的色谱峰,分离度较高。同时,流动相pH 1.5时,色谱峰峰形更优,拖尾因子较小。因此本实验选择在流动相pH 1.5条件下对花色苷进行分离。
2.2.2 Vitisin A检测波长优化
使用DIONEX Ultimate TM3000二维液相色谱对反应液进行全波段扫描,光电二极管阵列检测器扫描范围为200~700 nm,得时间(X轴),检测波长(Y轴)Vitisin A光谱吸收等高图如图6所示。由图6可以看出,Vitisin A有4 个最大吸收峰,分别为204、235、300 nm。最高吸收峰出现在检测波长204 nm处,但该区域低紫外检测区域,检测过程中基线不稳,次高峰出现在检测波长为235 nm时,易受到干扰物质影响且噪音大,故选择第3高峰对应检验波长507 nm。
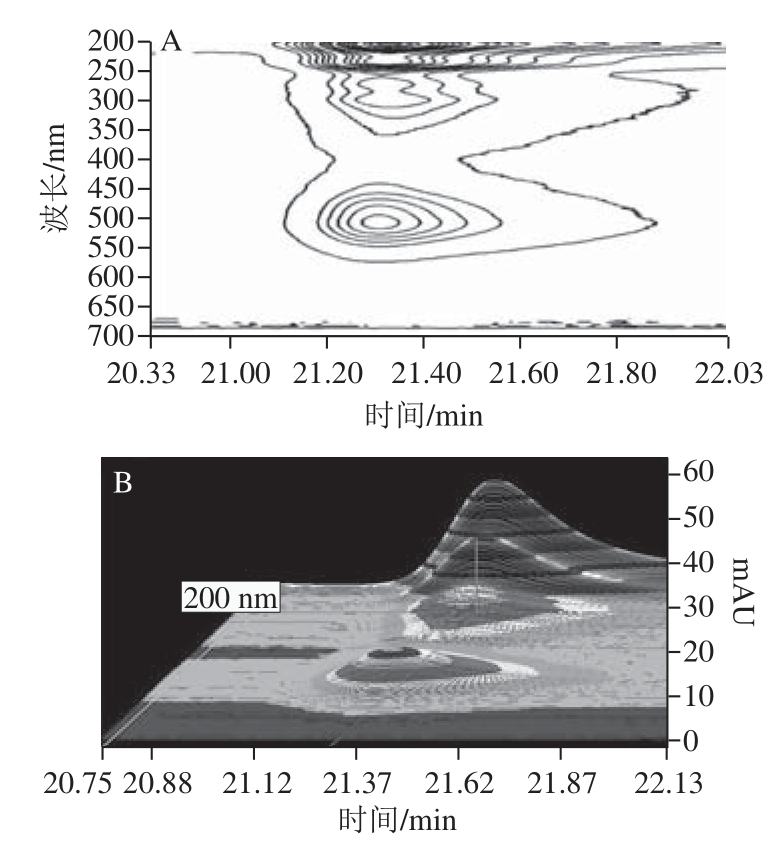
图6 Vitisin A紫外-可见吸收图谱
Fig.6 UV-Vis spectra of vitisin A
A.可见光谱吸收等高图;B.可见光谱吸收三维立体图。
2.3 样品中Vitisin A的检测
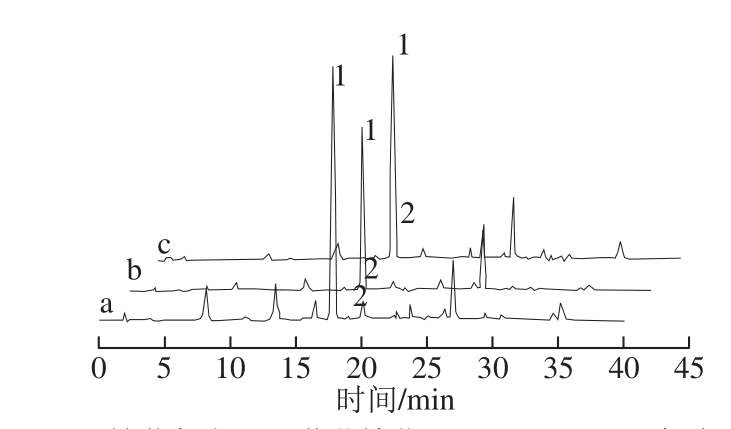
图7 3 种葡萄酒样品色谱图
Fig.7 Chromatograms of three kinds of grape wine
1.锦葵色素-3-O-葡萄糖苷;2. Vitisin A;a.赤霞珠葡萄酒;b.蛇龙珠葡萄酒;c.黑比诺葡萄酒。
用上述方法对3 种供试葡萄酒样进行了检测,如图7所示。结果显示,葡萄酒中均检测出Vitisin A,且与其他花色苷基本分离,且重复性良好。表明此方法可以用于对葡萄酒中的Vitisin A进行直接检测。3 种葡萄酒中锦葵色素及Vitisin A响应面积值如表4所示,其中,赤霞珠葡萄酒中锦葵色素及Vitisin A含量均为最高,黑比诺葡萄酒与蛇龙珠葡萄酒中较少。由此推断,Vitisin A的含量可能是与葡萄酒中锦葵色素含量多少有关。
表4 3 种葡萄酒中锦葵色素及Vitisin A响应面积值
Table4 Response area values of malvidin and vitisin A in three kinds of grape wine mAU·min
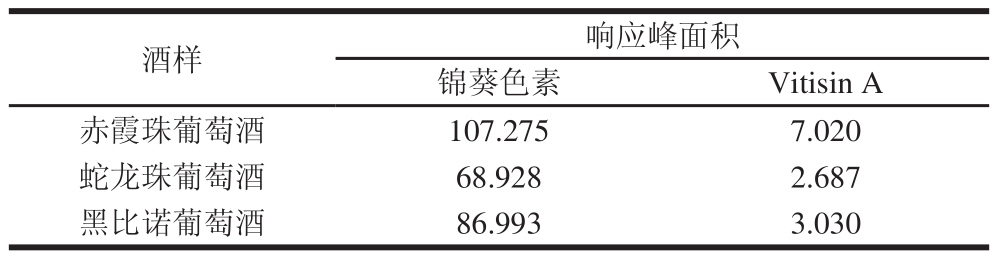
酒样响应峰面积锦葵色素Vitisin A赤霞珠葡萄酒107.2757.020蛇龙珠葡萄酒68.9282.687黑比诺葡萄酒86.9933.030
2.4 Vitisin A合成过程中的变化规律
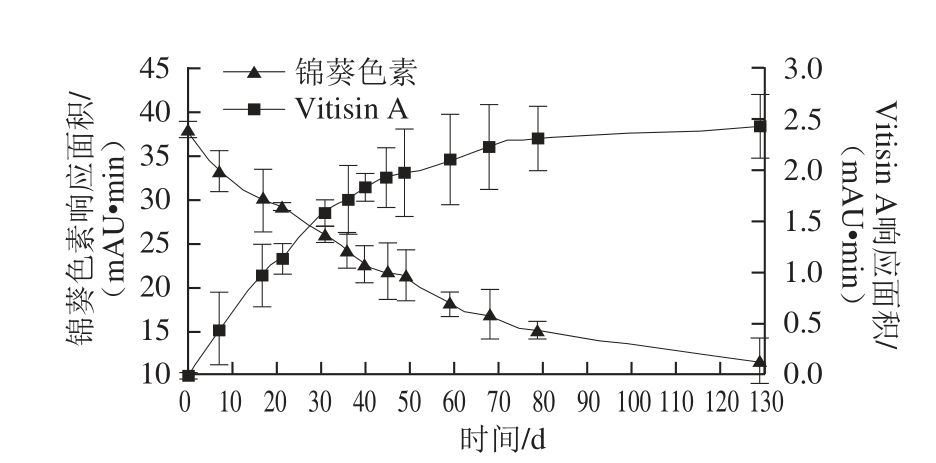
图8 花色苷含量变化趋势图
Fig.8 Time course of anthocyanin formation/depletion during the synthesis of vitisin A
自反应液配制起定期对反应液中锦葵色素与Vitisin A进行检测,两种花色苷检测结果及含量变化趋势如图8所示。伴随着反应物锦葵色素含量的大量减少,生成物Vitisin A的含量显著升高,实验结束时Vitisin A生成量响应面积为2.45 mAU·min。反应物锦葵色素含量显著减少,由38.48 mAU·min降至11.78 mAU·min。
从变化趋势来看,2 种花色苷趋势相同,方向相反。两种花色苷含量变化前期较快,Vitisin A大量合成,与此同时,锦葵色素迅速减少;随着时间推移,含量变化速率不断减小,Vitisin A生成速度及锦葵色素减少速度均降低,可能是由于反应液中锦葵色素及丙酮酸的浓度降低,制约了Vitisin A的合成;第10周后,Vitisin A含量变化极小,合成速率接近为0。与此同时,锦葵色素的含量仍然不断减小,是因为锦葵色素在该环境体系下稳定性差,不断分解为其他物质。从总变化量上来看,共消耗锦葵色素26.70 mAU·min,Vitisin A总生成量为2.45 mAU·min,比值约为0.1,以峰面积增减趋势可以看出,每生成1 mAU·min Vitisin A需消耗约10 mAU·min锦葵色素。
2.5 不同年份赤霞珠葡萄酒中锦葵色素及Vitisin A含量的检测
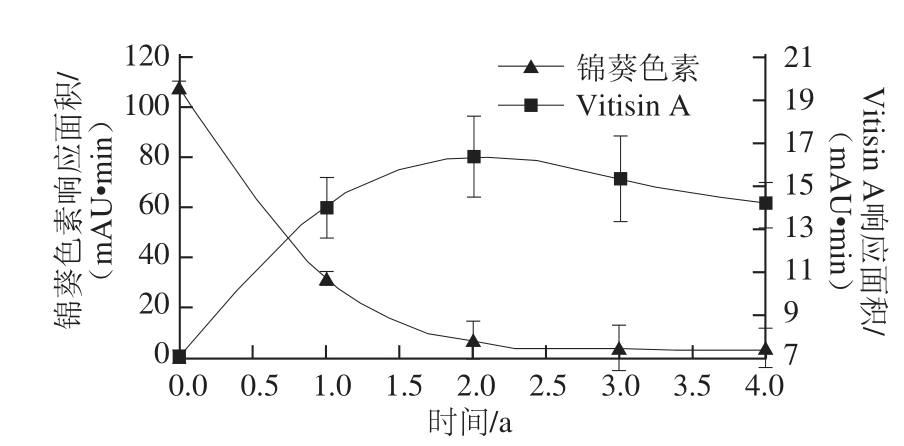
图9 花色苷响应面积值随陈酿时间的变化趋势图
Fig.9 Time course of anthocyanins formation/depletion during the aging of red wine
对酒中锦葵色素及Vitisin A进行检测,锦葵色素与Vitisin A的响应面积值随陈酿时间的变化趋势如图9所示。锦葵色素在陈酿初期含量大量减少,在陈酿2a的葡萄酒中含量几乎为0。而Vitisin A含量则呈现先增长后降低的趋势,在陈酿2a的葡萄酒中检测到Vitisin A含量达最大值。在酒体中几乎不存在锦葵色素时仍能检测到Vitisin A的存在,表明Vitisin A的稳定性强于锦葵色素。
本实验使用由锦葵色素-3-O-葡萄糖苷标准工作液与丙酮酸溶液配制而成的混合反应液,合成锦葵色素衍生花色苷Vitisin A。并在使用高效液相色谱仪,采用CAPCELL PAK C 18ACR色谱柱,乙腈-水(磷酸调pH值为1.5)溶液作为流动相,使用紫外检测器在检测波长为507 nm条件下对反应液及葡萄与葡萄酒中Vitisin A与其他花色苷进行检测,使用液相色谱-质谱联用技术对Vitisin A进行定性,初步建立了高效液相色谱检测葡萄酒中Vitisin A的方法,并在实际样品中得以验证。通过对合成过程中锦葵色素及Vitisin A的检测,分析了Vitisin A合成过程中的变化趋势,以峰面积变化趋势可以判定,Vitisin A的生成量及生成速率受锦葵色素及丙酮酸含量制约,其生成量与锦葵色素消耗量响应峰面积之比约为1∶10。在对陈酿时间不同的葡萄酒中锦葵色素与Vitisin A的检测实验中发现,Vitisin A含量在酒体中先增加后减少,其稳定性强于锦葵色素。
本实针对葡萄酒中锦葵色素及Vitisin A的研究,为检测葡萄酒中单体花色苷及其衍生色素的检测分析提供了有力的证据,为今后研究葡萄酒中花色苷的进一步研究做出贡献。
参考文献:
[1] 王锋, 邓洁红, 谭兴和, 等. 花色苷及其共色作用研究进展[J]. 食品科学, 2008, 29(2): 472-476.
[2] 陈曦, 周小平, 韩舜愈, 等. HPLC测定葡萄和葡萄酒中花色苷[J]. 光谱实验室, 2013, 30(4): 1704-1709.
[3] 卢钰, 董现义, 杜景乎, 等. 花色苷研究进展[J]. 山东农北大学学报:自然科学版, 2004, 35(2): 315-320.
[4] ROMERO C, BAKKER J. Effect of storage temperature, pyruvate on kinetics of anthocyanin degradation, Vitisin A de. rivative formation and color characteristics of modei solutions[J]. Journal of Agricultural and Food Chemistry, 2000, 48: 2135-2141.
[5] 徐琳. 单宁对红葡萄酒颜色和花色苷的影响[D]. 北京: 中国农业大学, 2007.
[6] 梁振昌. 葡萄果皮花色苷构成特点、遗传规律及其在果实成熟过程中的变化[D]. 北京: 中国科学院, 2008.
[7] 刘一健, 孙剑锋, 王颉. 葡萄酒酚类物质的研究进展[J]. 中国酿造, 2009, 28(8): 5-9.
[8] ROMERO C, BAKKER J. Anthocyanin and colour evolution during maturation of four port wines: effect of pyruvic acid addition[J]. Journal of the Science of Food and Agriculture, 2000, 81: 252-260.
[9] GARCIA-PUENTE E R, ALCALDE-EON C, SANTOS-BUELGA C, et al. Behaviour and characterization of the colour during red wine making and maturation[J]. Analytica Chimica Acta, 2006, 563(1/2): 215-222.
[10] RENTZSCH M, SEHWARZ M, WINTERHALTER P. Pyranoanthocyanins-an overview on structures, occurrence, and pathways of formation[J]. Trends in Food Science and Technology, 2007, 18: 526-534.
[11] OLIVEIRA J, AZEVEDO J, SILVA A M S, et al. Pyranoanthocyanin dimers: a new family of turquoise blue anthocyanin-derived pigments found in port wine[J]. Journal of Agricultural and Food Chemistry, 2010, 58(8): 5154-5159.
[12] MORATAA A, CALDERONA E, GONZALEZA M C. Formation of the highly stable pyranoanthocyanins (vitisins A and B) in red wines by the addition of pyruvic acid and acetaldehyde[J]. Food Chemistry, 2007, 100: 1144-1152.
[13] HE J, CARVALHO A, MATEUS N, et al. Spectral features and stability of oligomeric pyranoanthocyanin-fl avanol pigments isolated from red wines[J]. Journal of Agricultural and Food Chemistry, 2010, 58(16): 9249-9258.
[14] BAKKER J, TIMBERLAKE C F. Isolation, identi fication and characterization of new color-stable anthocyanins occurring in some red wines[J]. Journal of Agricultural and Food Chemistry, 1997, 45(1): 35-43.
[15] CARVALHO A, OLIVEIRA J, de FREITAS V, et al. A theoretical interpretation of the color of two classes of pyranoanthocyanins[J]. Journal of Molecular Structure: THEOCHEM, 2010, 948(1/2/3): 61-64.
[16] ROMERO C, BAKKERJ. Effect of storage temperature, pyruvate on kinetics of anthocyanin degradation, vitisin A de. rivative formation and color characteristics of modei solutions[J]. Journal of Agricultural and Food Chemistry, 2000, 48: 2135-2141.
[17] GOUPY P, BAUTISTA-ORTIN A B, FULCRAND H, et al. Antioxidant activity of wine pigments derived from anthocyanins: hydrogen transfer reactions to the DPPH radical and inhibition of the heme-induced peroxidation of linoleic acid[J]. Journal of Agricultural and Food Chemistry, 2009, 57(13): 5762-5770.
[18] MUSELIK J, GARCIA-ALONSO M, MARTIN-LOPEZ M P, et al. Measurement of antioxidant activity of wine catechins, procyanidins, anthocyanins and pyranoanthocyanins[J]. International Journal of Molecular Sciences, 2007, 8(8): 797-809.
[19] JORDHEIM M, AABY K, FOSSEN T, et al. Molar absorptivities and reducing capacity of pyranoanthocyanins and other anthocyanins[J]. Journal of Agricultural and Food Chemistry, 2007, 55(26): 10591-10598.
[20] GARCIA-ALONSO M, RIMBACH G, RIVAS-GONZALO J C, et al. Antioxidant and cellular activities of anthocyanins and their corresponding vitisins A-studies in platelets, monocytes, and human endothelial cells[J]. Journal of Agricultural and Food Chemistry, 2004, 52(11): 3378-3384.
[21] 余华. 玫瑰茄红色素主要呈色物质分离提纯的研究[J]. 食品科学, 2005, 26(2): 79-82.
[22] 朱永红, 赵博, 吴彦蕾. 食品中合成测速快速检测方法研究进展[J].食品科学与营养, 2014(3): 34-41.
[23] 杨华锋, 杨勇, 董勤, 等. 紫外-可见光谱技术在葡萄酒品质评价中的应用[J]. 酿酒科技, 2012(11): 58-64.
[24] 林丽, 李进, 丁成丽. 高效液相色谱法测定黑果枸杞果实中花色苷的含量[J]. 食品科学, 2013, 34(6): 164-166.
[25] 王卫东, 李超, 许时婴. 高效液相色谱-串联质谱法分离鉴定黑莓花色苷[J]. 食品科学, 2009, 30(14): 230-234.
[26] 张秀丽, 李劲涛, 杨军. 植物花色苷定性定量研究方法[J]. 西华师范大学学报: 自然科学版, 2006, 27(3): 300-303.
Synthesis and Detection of Vitisin A in Red Grape Wine
YAN Heng
1, HAN Shunyu
1, WANG Bo
2, ZHOU Xiaoping
2,*
(1. College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China; 2. Central Laboratory of Technical Center, Gansu Entry-Exit Inspection and Quarantine Bureau, Lanzhou 730000, China)
Abstract:This study aimed to develop an HPLC method for detecting vitisin A in red grape wine under optimized testing conditions. Malvidin-pyruvate mixed solution was used as the reaction liquid to synthesize vitisin A derived from malvidin. The preliminary study demonstrated the quantitative changes of vitisin A during the synthesis process. The optimal chromatographic conditions for vitisin A separation were determined by using a CAPCELL PAK C 18ACR acidproof column with acetonitrile-water (adjusted to pH 1.5 with phosphoric acid) as the mobile phase, and the UV detector wavelength was set at 507 nm. Mass spectrometry was used to conduct the qualitative analysis of vitisin A, and the results were compared with those from the mass spectral library. The method is suitable for detecting both synthetic and natural vitisin A in red grape wine.
Key words:vitisin A; malvidin; grape wine; high performance liquid chromatography-mass spectrometry-mass spectrometry (HPLC-MS-MS)
中图分类号:TS262.6
文献标志码:A
文章编号:1002-6630(2015)20-0139-06
doi:10.7506/spkx1002-6630-201520026
收稿日期:2014-12-05
基金项目:质检行业公益性科研专项(201310071)
作者简介:闫衡(1989—),女,硕士研究生,研究方向为葡萄酒色素。E-mail:yanheng89@126.com
*通信作者:周小平(1965—),男,高级工程师,硕士,研究方向为食品药品中有毒有害物质检验检测。E-mail:zhxp1123@163.com