许 龙 1,章 英 2,朱立鑫 1,范 艳 1,赖 肖 2,孟 玮 1,胡 娜 1,刘仁荣 1,*
(1.江西科技师范大学生命科学学 院,江西 南昌 330013;2.南昌市疾病预防控制中心,江西 南昌 330038)
摘 要:采用活泼酯法将 双酚A的结构类似物双酚酸与载体蛋 白偶联制备人工抗原,用制备的人工抗原免疫BALB/c小鼠,采用聚乙二醇法进行细胞融合制备双酚A单克隆抗体,成功获得一株分泌抗 双酚A单克隆抗体的细胞株3H1,经鉴定抗体属于IgG1亚型,轻链为κ,并建立了间接竞争酶联免疫分析法。线性范围为1~50 ng/mL, 最低检测限为0.43 ng/mL,半数抑制浓度为6.56 ng/mL。回收率为82.83%~101.94%,变异系数为2.94%~12.95%。该方法具有较高的灵敏度和特异性,具有良好的应用前景。
关键词:双酚A;单克隆抗体;酶联免疫分析法
近年来,许多工业化学物质被释放到环境中,其中一些化学物质具有类似体内激素的作用,影响和干扰了生物体内分泌统的正常功能,导致人和动物的生殖系统发育不良,生育能力下降,并引起各种生理异常,这类物质通常称为“环境激素” [1]。双酚A(bisphenol A,BPA)学名为2,2-二(4-羟基苯基)丙烷,属于一种酚类雌激素。BPA是一种重要的化工原料,主要用于生产聚碳酸酯和环氧树脂等高分子材料 [2-3]。聚碳酸酯广泛用于水瓶、婴儿奶瓶、罐头瓶等食品和饮料容器。环氧树脂常用作一些金属食品容器的内壁涂层,防止食品腐蚀金属容器内壁 [4]。这些食品包装材料中微量的BPA可以迁移到食品和周围环境中,通过食物链或生物链进入生物体内,对人和动物的健康造成威胁 [5]。近几年研究表明,BPA可以影响生精细胞周期,干扰精子的正常产生,影响生殖功能。BPA也可以诱导淋巴细胞的增殖,具有潜在的免疫毒性。BPA还能诱发乳腺癌、前列腺癌、子宫内膜异位等疾病 [6-7]。因此,加强BPA的残留检测,对保护人类健康和生存环境具有重要意义。
目前,国内外关于BPA残留的检测方法主要有:紫外分光光度法 [8]、电化学法 [9-10]、高效液相色谱-紫外法 [11]、高效液相色谱-荧光法 [12-14]、气相色谱法-质谱法 [15-16]等。高效液相色谱-荧光法检测食品中BPA残留的检测限可达到0.1~2ng/mL。这些传统的仪器分析方法具有检测结果准确、稳定、可靠等优点,但其需要昂贵的仪器、复杂的操作和复杂的样品前处理,不适用于大量样品的快速检测。而酶联免疫分析(enzyme linked immunosorbent assay,ELISA)法 [17-19]具有简便、快速、灵敏、特异性好等优点,这对BPA的残留检测具有重要的意义。
本实验成功地合成了BPA人工抗原,制备了BPA的单克隆抗体,并初步建立了间接竞争ELISA法,检测BPA的残留。
1.1 材料与试剂
BPA标准品、卵清蛋白(ovalbumin,OVA)和羊抗小鼠酶标二抗 美国Sigma公司;N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS) 美国Aladdin公司;双酚酸(valeric acid,BVA) 日本Tokyo Kasei公司;四甲基联苯胺(tetramethylbenzidine,TMB)、1-乙基-3-(3-二甲基胺丙基)碳化二亚胺盐酸盐(1-ethyl-3-(3-dimethyllaminopropyl) carbodiimide hydrochloride,EDAC) 中国生工生物公司;抗BPA单克隆抗体3H1由本实验室自制。
包被缓冲液:0.01 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS,pH 7.4);封闭液:取5 g脱脂奶粉溶于100 mL 50 ℃的蒸馏水;洗涤液:PBS T缓冲液即含0.05%吐温-20的PBS;标准品稀释液:超纯水。其他试剂均为国产分析纯。
1.2 仪器与设备
UV-2600紫外分光光度计 上海尤尼柯公司;Multiskan MK3酶标仪、WELLWASH VERSA洗板机美国Thermo公司;Milli-Q超纯水系统 美国Millipore公司;Centrifuge 5804R型离心机 德国Eppendorf公司;酶标板 美国Costar公司。
1.3 方法
1.3.1 BPA人工抗原的合成
参照文献[20]加以改进,以BVA作为BPA的半抗原引入羧基,称取BVA 0.45 mg,NHS 1.49 mg和EDAC 2.28 mg溶于150 μL二甲基甲酰胺,17 ℃,130 r/min避光反应16 h。反应后所得溶液为A液。称取5.8 mg OVA 溶于2 mL 0.13 mol/L NaHCO 3溶液中,得到OVA溶液。将A液逐滴加入OVA溶液中,边加边搅拌,17 ℃,130 r/min避光反应12 h。然后将反应后的混合液转入透析袋中,在4 ℃,0.01 mol/L pH 7.4的PBS中透析2 d,期间换液2 次,以去除未反应的BVA等小分子物质。透析后的偶联物进行紫外扫描。免疫抗原BVA-血蓝蛋白(keyhole limpet hemocyanin,KLH)以相同的方法制备。
1.3.2 BPA单克隆抗体的制备与纯化
第3次免疫后21 d对免疫效价较好的小鼠尾静脉注射人工抗原加强免疫,3 d后,取脾细胞与SP2/0骨髓瘤细胞在融合剂聚乙二醇作用下进行细胞融合。在HAT完全培养基中培养7 d,换HT完全培养基,观察杂交瘤细胞生长情况,取培养上清液,用间接竞争ELISA方法筛选分泌抗BPA单克隆抗体的杂交瘤细胞。阳性细胞经有限稀释法亚克隆3次的抗体阳性率均为100%后,建立细胞株并用液氮冻存。取8~10 周龄BALB/c小鼠注射液体石蜡,0.6 mL/只,一周后每只注入1 mL BPA杂交瘤细胞3H1,7~10 d后采集腹水用辛酸-硫酸铵法 [21]纯化,纯化后的抗体用紫外扫描测定其蛋白含量。最后用单克隆抗体分型试剂盒进行亚型鉴定。
1.3.3 间接竞争ELISA法的建立
1.3.3.1 检测抗原包被质量浓度和抗体最佳稀释比例的确定
用PBS将BVA-OVA分别稀释至0.5、1、2、4、6 μg/mL,4 ℃包被过夜,PBST洗板4 次,每 孔加入320 μL 5 mg/mL脱脂奶37 ℃温育2 h。洗板机洗板4 次,加入PBS稀释的抗BPA单克隆抗体3H1,按照1∶8 000、1∶16 000、1∶32 000、1∶64 000、1∶1 28 000、1∶256 000、1∶512 000的比例倍比稀释,进行方阵滴定确定抗原的包被质量浓度和抗体的最佳稀释比例。
1.3.3.2 有机溶剂对抗原抗体结合的影响
用pH 7.4的 0.01 mol/L的PBS缓冲液稀释包被抗原至最佳质量浓度包被到酶标板上,分别用含不同体积分数甲醇溶液稀释BPA标准品至系列质量浓度,然后按间接竞争ELISA法进行测定,比较最大光密度值和IC 50值,考察有机溶剂对抗原抗体结合的影响,确立标准品最佳的稀释缓冲液。
1.3.3.3 抗体稀释缓冲液pH值的优化
用不同pH值(6.4、7.4、8.4、9.4)的PBS稀释的抗体和最佳稀释缓冲液稀释的BPA标准品,按照间接竞争ELISA法反应,比较最大光密度值和IC 50值的变化。
1.3.3.4 ELISA标准工作曲线的建立
根据确定的抗原最佳包被质量浓度和抗体的最佳稀释比例,建立BPA间接竞争ELISA的标准曲线。用PBS将BVA-OVA稀释至最佳质量浓度包被酶标板,120 μL/孔,4 ℃包被过夜,用5 mg/mL的脱脂牛奶封闭。PBST洗板4 次,加入系列超纯水稀释的BPA(0、0.25、0.5、1、2.5、5、10、25、50、100、200 ng/mL)和最佳稀释比例的抗体各50 μL,混匀,37 ℃温育40 min;洗板4 次后每孔加1∶2 500的酶标二抗100 μL,37 ℃温育40 min;洗板4 次,每孔加100 μL TMB显色液37 ℃显色8min;取出每孔加50 μL 2 mol/L H 2SO 4终止反应,酶标仪测定OD 450 nm值。按式(1)计算各质量浓度的结合率,并绘制标准曲线。
式中:B 0为未加BPA的OD 450 nm值;B为加BPA的OD 450 nm值。
1.3.3.5 交叉反应率的测定
用超纯水溶解不同质量浓度的双酚S、BVA、对苯二酚、邻羟基苯甲酸标准品,取50 μL进行竞争ELISA测定,按式(2)计算交叉反应率:
1.3.3.6 加标回收率的测定
以某品牌塑料瓶装的矿泉水为样品。用矿泉水配制质量浓度为100 ng/mL的BPA加标溶液。分别吸取BPA加标溶液(100 ng/mL)1.25、2.5、12.5、50 mL于50 mL容量瓶中定容,混合摇匀,得到一系列不同质量浓度的BPA加标溶液,以矿泉水为对照样品,分别按照间接ELISA法进行测定,每个质量浓度平行测定5次,计算加标回收率。
2.1 BPA人工抗原的紫外扫描结果
采用活泼酯法将BVA与OVA偶联,合成了人工抗原BVA-OVA。紫外分光光度计对BVA、OVA和BVA-OVA进行扫描,结果见图1。对比3条曲线可以看出,同质量浓度的OVA和BVA-OVA偶联物在280 nm左右均有特征吸收峰,而偶联物在280 nm的峰高相对较高,且发生了一定的位移。这说明BVA和OVA的特征吸收峰发生了叠加,因此可以判断BVA与载体蛋白OVA偶联成功。同理,由图2可以判断BVA与载体蛋白KLH偶联成功。
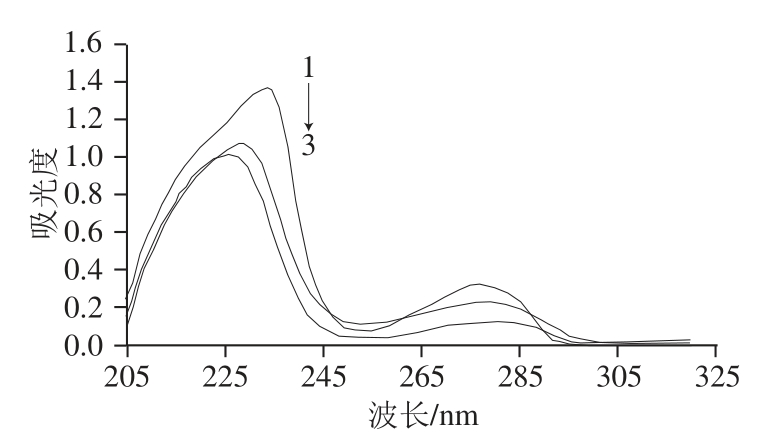
图1 BVA、OVA和其偶联物的紫外扫描图
Fig.1 UV spectra of BVA, OVA and BVA-OVA
1. BVA质量浓度为0.025 mg/mL;2. BVA-OVA质量浓度为0.27 mg/mL;3. OVA质量浓度为0.27 mg/mL。
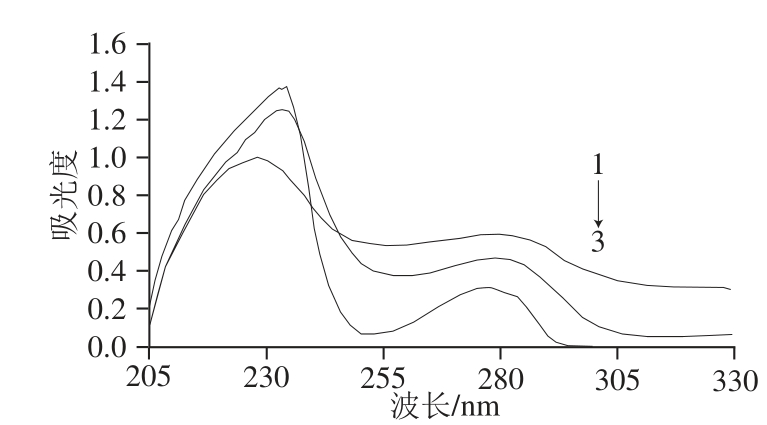
图2 BVA、KLH和其偶联物的紫外扫描图
Fig.2 UV spectra of BVA, KLH and BVA-KLH
1. BVA-KLH质量浓度为0.32 mg/mL;2. KLH质量浓度为0.32 mg/mL;3. BVA质量浓度为0.025 mg/mL。
2.2 BPA单克隆抗体的制备
经细胞融合,筛选得到一株分泌抗BPA单克隆抗体的细胞株,命名为3H1。分泌的单克隆抗体经测定属于IgG1亚型,轻链为κ链。注射杂交瘤细胞的小鼠,7 d左右小鼠腹部明显膨胀,行动迟缓。观察小鼠状况,采集腹水,辛酸-硫酸铵法纯化腹水。腹水纯化后,采用紫外分光光度计法计算抗体蛋白含量。根据公式 [22]C/(mg/mL)=(1.45A 280 nm-0.74A 260 nm)×稀释倍数,计算得到抗体蛋白质量浓度为7.56 mg/mL。
2.3 包被抗原质量浓度和抗体最佳稀释比例的确定
采用方阵滴定法进行间接ELISA测定,选择光密度值为1.0左右时包被抗原的质量浓度和抗体稀释比作为最佳条件。在抗体稀释度为1∶512 000时,包被抗原质量浓度达到1 μg/mL后,对应的光密度值随抗原质量浓度的增大变化不明显,且光密度值达到1.0,因此选择1 μg/mL为抗原的包被质量浓度。
2.4 标准品稀释缓冲液的优化

图3 BPA稀释液甲醇体积分数对ELISA检测的影响
Fig.3 Effect of methanol concentration of BPA diluent on ELISA
从图3可以看出,随着甲醇体积分数的增大,ELISA最大光密度值无明显变化,但ELISA方法IC 50值逐渐增大,表明高体积分数的甲醇对BPA抗体竞争抑制效率有明显影响,因此选用超纯水作为标准品稀释缓冲液。
2.5 抗体稀释缓冲液pH值的优化
从图4可以看出,随着pH值的增大,最大光密度值逐渐降低,IC 50值也逐渐减小,可能是由于较高的pH值会对抗原抗体的结合具有干扰作用,虽然pH值为6.4时,光密度值最大,但IC 50值最大,结合标准曲线的相关系数,pH值为7.4时相关系数最大,所以选择缓冲液pH值为7.4比较合适。
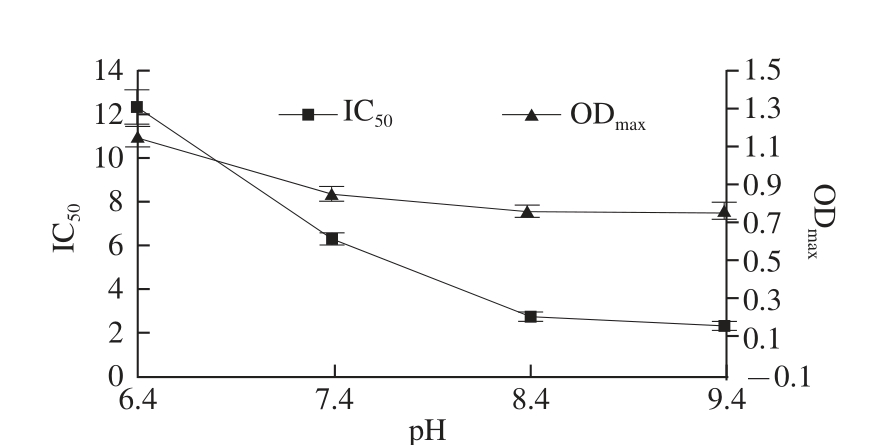
图4 缓冲液pH值对ELISA检测的影响
Fig.4 Infl uence of buffer pH on ELISA
2.6 ELISA标准曲线的建立
BVA-OVA包被质量浓度为1 μg/mL,抗体最终稀释比例为1∶512 000,酶标二抗浓度为1∶2 500时,建立BPA间接竞争抑制曲线。抗体在1~50 ng/mL之间具有良好的 线性,线性方程为y=-0.339x+1.116,相关系数R 2=0.995,抑制率为50%时,BPA的质量浓度为6.56 ng/mL。一般选择抑制率为10%对应的质量浓度为最低检测限,该方法的最低检测限,即IC 10为0.43 ng/mL。
2.7 交叉反应率的测定
将单抗分别与双酚S、BVA、对苯二酚和邻羟基苯甲酸进行间接竞争ELISA,测定IC 50值,并计算交叉反应率,结果见表1。双酚S交叉反应率为0.29%,BVA交叉反应率为0.25%,对苯二酚和邻羟基苯甲酸的交叉反应率均小于0.066%。4种物质的交叉反应率均小于1%,对BPA的检测几乎无干扰。实验结果表明,本实验室制备的3H1单克隆抗体对BPA具有较好的特异性。
表1 交叉反应率的测定
Table1 Cross-reactivity of the assay

反应标准品IC 50/(ng/mL)交叉反应率/% BPA6.56100双酚S2 2620.29 BVA2 6240.25对苯二酚>10 000<0.066邻羟基苯甲酸>10 000<0.066
2.8 加标回收率测定结果
表2 BPA加标回收率
Table2 Recovery rates of BPA in water

加标质量浓度/(ng/mL)检出值/(ng/mL)回收率/%变异系数/% 2.52.05882.8312.95 5 4.19483.882.94 2525.486101.943.80 10097.7997.798.97
采用间接竞争ELISA方法检测矿泉水中BPA含量,以未检出BPA的矿泉水进行BPA加标实验。结果见表2,显示BPA回收率为82.83%~101.94%,变异系数为2.94%~12.95%。
BPA作为重要的化工原料,广泛应用于生活中。因其具有多种毒性作用,对人类的健康造成严重的危害。世界各国针对BPA的残留制定了相应的残留标准并建立了各种分析方法,进行严格监管。目前,ELISA方法已被广泛应用于BPA的快速检测,而建立高灵敏的ELISA法的关键在于特异性抗体的制备。如果要制备高亲和性和特异性的抗体,选用的半抗原分子的反应基团应远离其特征结构,如羧基、氨基、羟基、苯环和杂环等,使半抗原特征结构充分暴露。BPA分子上具有两个羟基基团,在半抗原分子的两个苯环上,不适合用作反应基团与载体大分子偶联制备人工抗原。
本研究选用了BPA的结构类似物BVA作为半抗原引入了羧基,采用活泼酯法制备了人工抗原,使BPA分子中的特征结构充分暴露。用抗原免疫BALB/c小鼠,对免疫抗原的剂量和免疫程序进行了优化,首次免疫抗原剂量为80 μg/只,隔3周进行加强免疫,免疫剂量为55μg/只,共免疫3 次。第3次免疫后筛选出血清效价和特异性较高的小鼠。采用聚乙二醇法进行细胞融合,经过3次筛选,成功获得一株分泌抗BPA单克隆抗体的细胞株3H1,并应用制备的单克隆抗体初步建立了BPA的间接竞争ELISA方法,线性范围为1~50 ng/mL,最低检测限为0.43 ng/mL,IC 50为6.56 ng/mL。回收率为82.83%~101.94%,变异系数为2.94%~12.95%。本方法简便、灵敏、快速,可用于检测水体中的BPA污染情况,具有较好的应用前景。
参考文献:
[1] KURUTO-NIWA R, TATEOKA Y, USUKI Y, et al. Measurement of bisphenol A concentrations in human colostrums[J]. Chemosphere, 2007, 66(6): 1160-1164.
[2] XU Liangcao. A review recent development on analytical methods for determination of bisphenol A in food and biological samples[J]. Journal of Liquid Chromatography and Related Technologies, 2012, 35: 2795-2829.
[3] 周剑青. 以多聚赖氨酸为载体的双酚A包被抗原制备及其免疫分析研究[D]. 广州: 广东工业大学, 2013.
[4] 鲍洋. 食品金属罐内涂层中6 种双酚类物质的检测及迁移规律的研究[D]. 无锡: 江南大学, 2012.
[5] 朱建如, 宋毅. 环境激素及对人体的危害[J]. 公共卫生与预防医学, 2006, 17(6): 38-40.
[6] 郑刚. 环境雌激素对机体的影响[J]. 国外医学, 2001, 28(4): 197-200.
[7] ZHENG Jie, ZHAO Suqing, ZHANG Kun, et al. Detection of bisphenol A in water samples using ELISA determination method[J]. Water Science and Technology: Water Supply, 2011, 11(1): 55-60.
[8] 郑劼. 双酚A人工抗原合成及酶联免疫分析方法研究[D]. 广州: 广东工业大学, 2008.
[9] INOUE K, KATO K, YOSHIMURA Y, et al. Determination of bisphenol A in human serum by high-performance liquid chromatography with multi-electrode electrochemical detection[J]. Journal of Chromatography B, 2000, 749: 17-23.
[10] SAJIKI J, TAKAHASHI K, YONEKUBO J. Sensitive method for the determination of bisphenol-A in serum using two systems of highperformance liquid chromatography[J]. Journal of Chromatography B, 1999, 736: 255-261.
[11] 国家标准化管理委员会. GB/T 29609—2013 橡胶[S]. 北京: 中国标准出版社, 2013.
[12] GOMEZ A B, RUBIO S, BENDITO D P. Analytical methods for the determination of bisphenol A in food[J]. Journal of Chromatography A, 2009, 1216(3): 449-469.
[13] SUN Yen, IRIE M, KISHIKAWA N, et al. Determination of bisphenol A in human breast milk by HPLC with column-switching and fl uorescence detection[J]. Biomedical Chromatography, 2004, 18(8): 501-507.
[14] COBELLIS L, COLACURCI N, TRABUCCO E, et al. Measurement of bisphenol A and bisphenol B levels in human blood sera from healthy and endometriotic women[J]. Biomedical Chromatography, 2009, 23(11): 1186-1190.
[15] 王玉飞, 陈衡平, 陈晖. 桶装饮用水中双酚A的溶出及GC-MS分析[J].中国卫生检测杂志, 2003, 13(5): 581-582.
[16] 杜会芳, 闫慧芳, 李晔, 等. 蔬菜中内分泌干扰物4-壬基酚和双酚A的GC-MS检测方法研究[J]. 卫生研究, 2007, 36(3): 369-371.
[17] ZHAO Meiping, LI Yuanzong, GUO Zhenquan, et al. A new competitive enzyme-linked immunosorbent assay (ELISA) for determination of estrogenic bisphenols[J]. Talanta, 2002, 57: 1205-1210.
[18] MEULENAER B D, BAERT K, LANCKRIET H, et al. Development of an enzyme-linked immunosorbent Assay for bisphenol A using chicken immunoglobulins[J]. Journal of Agricultural and Food Chemistry, 2002, 50: 5273-5282.
[19] OHKUMA H, ABE K, ITO M, et al. Development of a highly sensitive enzyme-linked immunosorbent assay for bisphenol A in serum[J]. The Analyst, 2002, 17(1): 93-97.
[20] 郝贵增, 龙淼. 环丙沙星人工抗原的合成与鉴定[J]. 现代食品科技, 2008, 24(7): 658-660
[21] 朱立鑫. 建立免疫亲和柱联合高效液相色谱法检测苏丹红Ⅰ[D]. 南昌: 南昌大学, 2011.
[22] 王忠斌. 食品中恩诺沙星残留免疫学检测方法的研究[D]. 天津: 天津科技大学, 2007.
Preparation of Monoclonal Antibody for the Detection of Bisphenol A by Enzyme-Linked Immunoassay
XU Long
1, ZHANG Ying
2, ZHU Lixin
1, FAN Yan
1, LAI Xiao
2, M ENG Wei
1, HU Na
1, LIU Renrong
1,*
(1. College of Life Science, Jiangxi Science and Technology Normal University, Nanchang 330013, China; 2. Nanchang Center for Disease Control and Prevention, Nanchang 330038, China)
Abstract:4,4-Bis (4-hydroxyphenyl) valeric acid (BVA), a derivative of bisphenol A (BPA), was chosen as the hapten to prepare the artifi cial antigen. An active ester method was used for coupling BPA hapten with keyhole limpet hemocyanin (KLH) and ovalbumin (OVA), respectively. BALB/c mice were immunized with the immune antigen to produce antibo dy. After cell fusion with PEG method, the hybridoma cell lines generating anti-BPA monoclonal antibodies were obtained. The monoclonal antibody was identifi ed as IgG1 subtype with κ light chain. An indirect competitive enzyme-linked immunoassay (ELISA) was set up using the monoclonal antibody. The linear range of the inhibition curve was between 1 and 50 ng/mL. The limit of detection was 0.43 ng/mL, and the IC 50value was 6.56 ng/mL. The recovery rates of BPA in water ranged from 82.83% to 101.94% with variation coeffi cients of 2.94%-12.95%.The propose d immunoassay offer s a great potential for sensitive and specifi c detection of BPA in food safety monitoring.
Key words:bisphenol A; monoclonal antibody; enzyme-linked immunoassay
中图分类号:TQ323.5
文献标志码:A
文章编号:1002-6630(2015)20-0202-05
doi:10.7506/spkx1002-6630-201520039
收稿日期:2014-12-04
基金项目:国家自然科学基金地区科学基金项目(81360429);江西省高等学校科技落地计划项目(GJJ13573/13574);
南昌市科技计划项目(洪财企[2012],37号-23)
作者简介:许龙(1990—),男,硕士研究生,研究方向为食品安全检测。E-mail:xu_lon@163.com
*通信作者:刘仁荣(1969—),男,教授,博士,研究方向为食品安全检测。E-mail:lilirenrong@hotmail.com