吴雪莹 1,邓丽莉 1,2,王宝刚 3,曾凯芳 1,2,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715;3.北京市农林科学院林业果树研究所,北京 100093)
摘 要:探讨采后5 μL/L的1-甲基环丙烯(1-methylcyclopropene,1-MCP)处理对采后麦李、青脆李和歪嘴李果实贮藏期间采后生理的影响,同时,通过测定采后贮藏期间3 种李果实抗氧化酶活性的变化,揭示1-MCP处理调节麦李、青脆李和歪嘴李果实生理活动的机制。结果表明,5 μL/L的1-MCP处理能推迟麦李、青脆李和歪嘴李3 种李果实贮藏期间呼吸高峰的来临时间,降低其呼吸强度;同时抑制李果实相对电导率的增加和丙二醛的生成;结果还显示,5 μL/L的1-MCP处理能够有效地维持3 种李果实采后贮藏过程中超氧化物歧化酶、过氧化物酶和过氧化氢酶的活性。说明5 μL/L的1-MCP处理能有效减少呼吸作用对李果实带来的影响,维持果实细胞膜的完整性,并且在一定程度上维持活性氧代谢系统的正常运行,对延缓李果实的衰老、减轻李果实营养价值的降低有积极作用。
关键词:1-甲基环丙烯;李果实;采后生理
李果实主要的成熟采摘时期为5、6月份,为夏季高温季节,期间病原微生物生长繁殖迅速,果实容易受到侵染最后导致腐烂,因此其贮藏性能较差 [1]。并且李果实属于呼吸跃变型果实,采后贮藏期间后熟启动,一系列与成熟相关的代谢活动加强,促进果实成熟,同时伴随水解酶活性的增加,导致果实软化,最后缩短李果实贮藏时间和货架期 [2]。李果实采后贮藏过程中由于环境改变或者处理不当极易造成果实软化腐烂及生理失调,其中果实生理失调将导致果实营养散失、品质劣变,最后导致严重的经济损失。呼吸作用作为果实采后主要的生理活动之一,不仅能为其他的生理活动提供所需能量,还严重影响着果实的成熟衰老 [3]。李果实后熟过程中呼吸作用增强,导致果实膜脂过氧化加剧,细胞内电解质向外渗漏。而丙二醛(malonaldehyde,MDA)作为果实采后成熟衰老过程中膜脂过氧化最重要的产物之一,它的积累会进一步加速果实的成熟衰老过程 [4]。李果实采后贮藏过程中细胞代谢会产生活性氧(O 2 -·),果实贮藏初期细胞正常生长、代谢,因此细胞内O 2 -·的产生和清除保持动态平衡。但当果实贮藏到一定时期,O 2 -·的生成加剧,O 2 -·清除系统失衡,就会导致氧化胁迫,最后细胞死亡。超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和过氧化物酶(peroxidase,POD)作为细胞内重要的3 种抗氧化酶,在清除活性氧系统中发挥着重要的作用 [5]。在O 2 -·清除系统中,SOD是第一个参与反应的物质,它能催化O 2 -·的中间产物,通过歧化反应生成O 2和H 2O 2,然后经CAT和POD进一步催化分解,达到清除O 2 -·的目的 [6]。
1-甲基环丙烯(1-methylcyclopropene,1-MCP)作为一种安全有效的生物保鲜剂,已广泛用于番茄 [7]、苹果 [8]、芒果 [9]、桃 [10]、梨 [11]、香蕉 [12]等多种果蔬的贮藏保鲜技术上。研究 [13-18]发现,1-MCP能有效抑制苹果、香梨、冬枣、猕猴桃、磨盘柿和桃果实贮藏过程中的呼吸强度,推迟呼吸高峰的来临。公谱 [19]发现经过1-MCP处理的晚香蕉李果实贮藏过程中相对电导率一直明显低于对照组果实,说明1-MCP处理对贮藏过程中晚香蕉李的成熟衰老和细胞膜透性的改变有抑制作用。Lee等 [20]采用剂量为1 μL/L的1-MCP处理“Empire”苹果,然后分别置于0.5 ℃和3.3 ℃环境下贮藏40 d发现,置于0.5 ℃环境下的“Empire”苹果从贮藏第5天开始,对照组和1-MCP处理组的MDA含量之间有显著性差异,并且对照组MDA含量始终高于1-MCP处理组,而置于3.3 ℃环境下的“Empire”苹果对照组和1-MCP处理组之间MDA含量并无显著性差异。采用0.5 μL/L的1-MCP处理“Laiyang”梨果实发现,贮藏中后期经过1-MCP处理的梨果实的SOD、CAT和POD活性都显著高于对照组梨果实,说明1-MCP对梨果实贮藏过程中SOD、CAT和POD活性的下降有抑制作用,能有效延缓梨果实的成熟衰老 [21]。Cao Shifeng等 [22]用剂量为1.0 μL/L的1-MCP处理青椒并置于20 ℃条件下贮藏,发现贮藏中后期1-MCP处理组青椒的SOD活性高于对照组,而整个贮藏过程中1-MCP处理组青椒的CAT和POD活性都显著高于对照组。同时,1-MCP对芒果 [23]、“Conference”梨 [24]和苦瓜 [25]等果蔬贮藏期间SOD、CAT和POD活性的下降均有抑制作用,能有效地延缓芒果、“Conference”梨和苦瓜成熟衰老,提高其抗氧化能力。1-MCP对多种果蔬采后生理生化反应具有调节作用,能有效地改善果蔬的生理失调,延长贮藏时间,然而,有关1-MCP处理对 不同品种李果实采后贮藏期间生理变化的影响研究却相对较少。本实验通过测定1-MCP处理后李果实贮藏期间呼吸强度、相对电导率、MDA含量、SOD活性、CAT活性和POD活性的变化,探讨1-MCP处理对采后不同品种李果实生理活动的影响,从而为李果实采后贮藏品质的保持提供可靠的理论依据和技术支持。
1.1 材料与试剂
1.1.1 李果实
实验所用麦李果实于2014年5月采摘自重庆市璧山县;实验所用歪嘴李果实于2014年7月采摘自重庆市渝北区统景县;实验所用青脆李果实于2014年6月采摘自重庆市北碚区缙云山。采后剔除病果、伤果、畸果,挑选饱满、色泽光亮、无病虫斑、大小均一、成熟度一致的新鲜成熟果实,用2%次氯酸钠溶液浸泡2 min,然后用自来水冲洗干净,在室温(20~25 ℃)条件下晾干后备用。
1.1.2 试剂
1-MCP(有效成分0.14%) 深圳绿农保鲜公司;三氯乙酸、氯化硝基四氮唑蓝、乙二胺四乙酸二钠、核黄素 成都市科龙化工试剂厂;硫代巴比妥酸 上海科丰实业有限公司;蛋氨酸 天津市大茂化学试剂厂;愈创木酚 上海市佘山化工厂;其他试剂为实验室常用试剂。
1.2 仪器与设备
WD-9405B水平摇床 沃德生物医学仪器公司;电导率测定仪 上海仪电科学仪器股份有限公司;高速冷冻离心机 湖南赫西仪器装备有限公司;紫外分光光度计上海天美科学仪器有限公司;超低温冷冻储存箱 中科美菱低温科技有限公司;恒温贮藏箱 日本三洋公司。
1.3 方法
1.3.1 1-MCP溶液的制备
实验李果实置于密封的泡沫箱中进行1-MCP熏蒸处理,通过1-MCP制剂的剂量和泡沫箱体积计算出实验所需处理剂量为5 μL/L的1-MCP用量,采用蒸馏水溶解。1-MCP为强挥发性生物制剂,使用时必须快速有效地防止其挥发。
1.3.2 处理方法
麦李果实、青脆李果实和歪嘴李果实清洗晾干后分别随机分成2 组置于泡沫箱中,然后采用剂量为0 μL/L(对照)、5 μL/L的1-MCP室温(20~25 ℃)条件下密封熏蒸处理6 h。处理完成后,取出李果实并包装,贮藏于0 ℃、85%~90% 相对湿度的环境下,定期取样进行相关指标的测定。每个处理共300 个果实,重复3 次。
1.3.3 果实呼吸强度的测定
李果实呼吸强度的测定参照曹建康等 [26]的方法。采用静置法,李果实呼吸强度测定结果以每小时每千克果蔬释放的CO 2的质量表示。每个处理每次测定500 g李果实,重复3 次。
1.3.4 相对电导率的测定
参照曹建康 [26]、王国泽 [27]等测定方法并作一定修改。取厚薄均匀大小一致的组织圆片,精确称取2.0 g,放入盛有20 mL去离子水的烧杯振荡10 min后将水倒去,再用去离子水按上述方法清洗3 次,并用滤纸片吸干组织圆片上的水分。把组织圆片放入大试管中,准确加入20 mL去离子水,再放入振荡器中振动1 h,在20~25 ℃恒温条件下,用电导率测定仪测定溶液电导率(L 1)。再将试管煮沸10 min,加热杀死组织圆片,冷却至室温再测定经煮沸后提取液的电导度(L 0)。每个样品重复3 次测定。细胞膜渗透率按以下公式计算:
1.3.5 MDA含量的测定
MDA含量测定参考Hodges等 [28]方法并修改。
提取液制备:准确称取1.0 g李果实新鲜样品,与5 mL经4 ℃预冷的10 g/100 mL三氯乙酸(trichloroacetic acid,TCA)溶液混合研磨至匀浆,移至离心管并在10 000×g,4 ℃条件下离心20 min,吸取上清液为MDA提取液。
测定步骤:吸取2 mL提取液+2 mL 10%的2-硫代巴比妥酸(2-thiobarbituric acid,TBA)溶液于试管中,充分混合后,沸水浴加热15 min,立刻冷却后离心。用2 mL 10 g/100 mL TCA+2 mL 10% TBA溶液作为空白调零。分别测定反应液在波长450、532 nm和600 nm的吸光度,计算出反应混合物中MDA的质量浓度,再计算样品中MDA的含量。重复3 次实验测定。
1.3.6 SOD活性的测定
SOD活性的测定参考Liu Wenqin等 [29]方法并修改,采用氯化硝基四氮唑蓝法。
粗酶液提取:准确称取2.5 g李果实新鲜样品,加入5 mL 0.05 mol/L(pH 7.8,含1%聚乙烯吡咯烷酮)的磷酸缓冲液,冰浴研磨至匀浆,移至离心管并在4 ℃、8 500×g条件下离心20 min,吸取上清液为SOD粗酶液。
SOD活性测定:准备2 支对照管和2 支测定管,然后分别加入0.05 mol/L(pH 7.8)的磷酸缓冲液、0.13 mol/L的蛋氨酸、750 μmol/L的氯化硝基四氮唑蓝、100 μmol/L的乙二胺四乙酸二钠、20 μmol/L的核黄素各0.3 mL和0.5 mL蒸馏水,之后测定管中加入1 mL粗酶液,对照管中以1 mL的0.05 mol/L(pH 7.8)的磷酸缓冲液代替粗酶液,混匀后将1 支对照管置于暗处,其他各管正常光照下反应25 min,至反应结束后,以置于暗处的对照管做空白调零,分别测定其他各管在560 nm波长处的光密度值,以1 min内ΔOD 560 nm减少0.1 个单位为一个酶活单位(U)。每个处理每次测定10 个果实,重复3 次。
1.3.7 CAT活性的测定
CAT活性的测定参照胡花丽等 [30]的方法。采用分光光度法,以煮死的酶液作为对照,以1 min内A 240 nm减少0.1个单位为一个酶活单位(U)。每个处理每次测定10 个果实,重复3 次。
1.3.8 POD活性的测定
POD活性的测定参照胡花丽等 [30]的方法。采用分光光度法,以每分钟内ΔOD 470 nm变化0.01为一个酶活单位(U)。每个处理每次测定10 个果实,重复3 次。
1.4 数据分析
Excel 2003统计分析数据,计算标准误并制图;应用SPSS 19.0对数据进行方差分析(ANOVA),利用独立样品T检验进行差异显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2.1 1-MCP处理对李果实贮藏期间呼吸强度的影响
图1显示,麦李、青脆李和歪嘴李贮藏过程中果实呼吸强度呈现先增加后降低的趋势,与对照相比,1-MCP处理延缓了李果实贮藏期间呼吸高峰的出现时间,并且明显降低了峰值。如图1A所示,对照组麦李果实在第20天时出现呼吸高峰,而经过5 μL/L的1-MCP处理的麦李果实的呼吸高峰则在第40 天时出现,对照组麦李果实贮藏过程中呼吸峰值是处理组的1.27 倍(P<0.05)。贮藏后期对照组果实呼吸强度下降速度和幅度都高于处理组果实,贮藏末期对照组麦李果实呼吸强度是处理组的0.60 倍(P<0.01)。如图1B所示,对照组青脆李果实在第40 天时出现呼吸高峰,而经过5 μL/L的1-MCP处理的青脆李果实的呼吸高峰则在第70天时出现,对照组青脆李果实贮藏过程中呼吸峰值是处理组的1.18 倍(P <0.05),贮藏后期对照组果实呼吸强度下降速度和幅度都高于处理组果实,贮藏末期对照组青脆果实呼吸强度是处理组的0.68 倍(P<0.05)。如图1C所示,对照组歪嘴李果实在第30天时出现呼吸高峰,而经过5 μL/L的1-MCP处理的歪嘴李果实的呼吸高峰则在第40天时出现,贮藏后期对照组果实呼吸强度下降速度和幅度都高于处理组果实,贮藏末期对照组歪嘴李果实呼吸强度是处理组的0.58 倍(P<0.05)。结果表明,5 μL/L的1-MCP处理能有效地推迟麦李、青脆李和歪嘴李果实采后贮藏期间呼吸高峰的来临,对呼吸强度的变化有控制作用,有效地保持呼吸作用的稳定。并且1-MCP处理对麦李和青脆李果实呼吸强度的影响效果优于歪嘴李。

图1 采后1-MCP处理对李果实呼吸强度的影响
Fig.1 Effects of postharvest 1-MCP treatment on respiration intensity of plum fruits
2.2 1-MCP处理对李果实贮藏期间相对电导率的影响


图2 采后1-MCP处理对李果实相对电导率的影响
Fig.2 Effects of postharvest 1-MCP treatment on relative conductivity of plum fruits
图2 显示,麦李、青脆李和歪嘴李果实贮藏过程中相对电导率逐渐上升,且经过5 μL/L的1-MCP处理的李果实相对电导率明显小于对照组李果实(P<0.05)。贮藏80 d时处理组麦李果实和贮藏100 d时歪嘴李果实相对电导率是对照组果实的0.75 倍,贮藏130 d时处理组青脆李果实相对电导率是对照组果实的0.74 倍。结果显示,与对照相比1-MCP处理能显著抑制李果实贮藏期间相对电导率的增加。
2.3 1-MCP处理对李果实贮藏期间MDA含量的影响
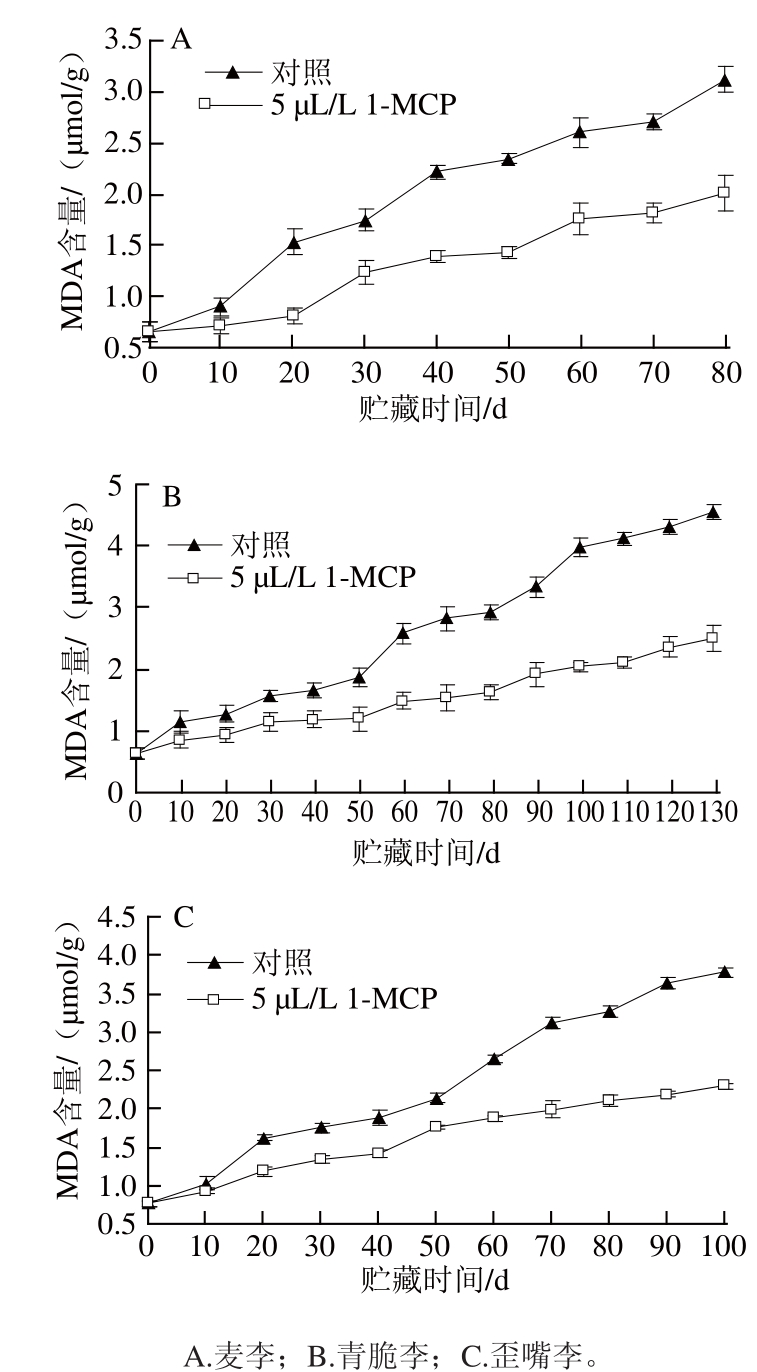
图3 采后1-MCP处理对李果实MDA含量的影响
Fig.3 Effects of postharvest 1-MCP treatment on malonaldehyde content of plum fruits
图3显示,麦李、青脆李和歪嘴李果实贮藏过程中MDA含量逐渐上升,但对照组李果实MDA含量的增加幅度在整个贮藏过程中都明显高于经过5 μL/L的1-MCP处理的李果实(P<0.05)。贮藏80 d时对照组麦李果实MDA含量是处理组果实的1.55 倍(P<0.05),贮藏130 d时对照组青脆李果实MDA含量是处理组果实的1.82 倍(P<0.01),贮藏100 d时对照组歪嘴李果实MDA含量是处理组果实的1.65 倍(P<0.05)。与对照相比,1-MCP处理对贮藏期间麦李、青脆李和歪嘴李果实MDA含量的增加有控制作用。
2.4 1-MCP处理对李果实贮藏期间SOD活性的影响
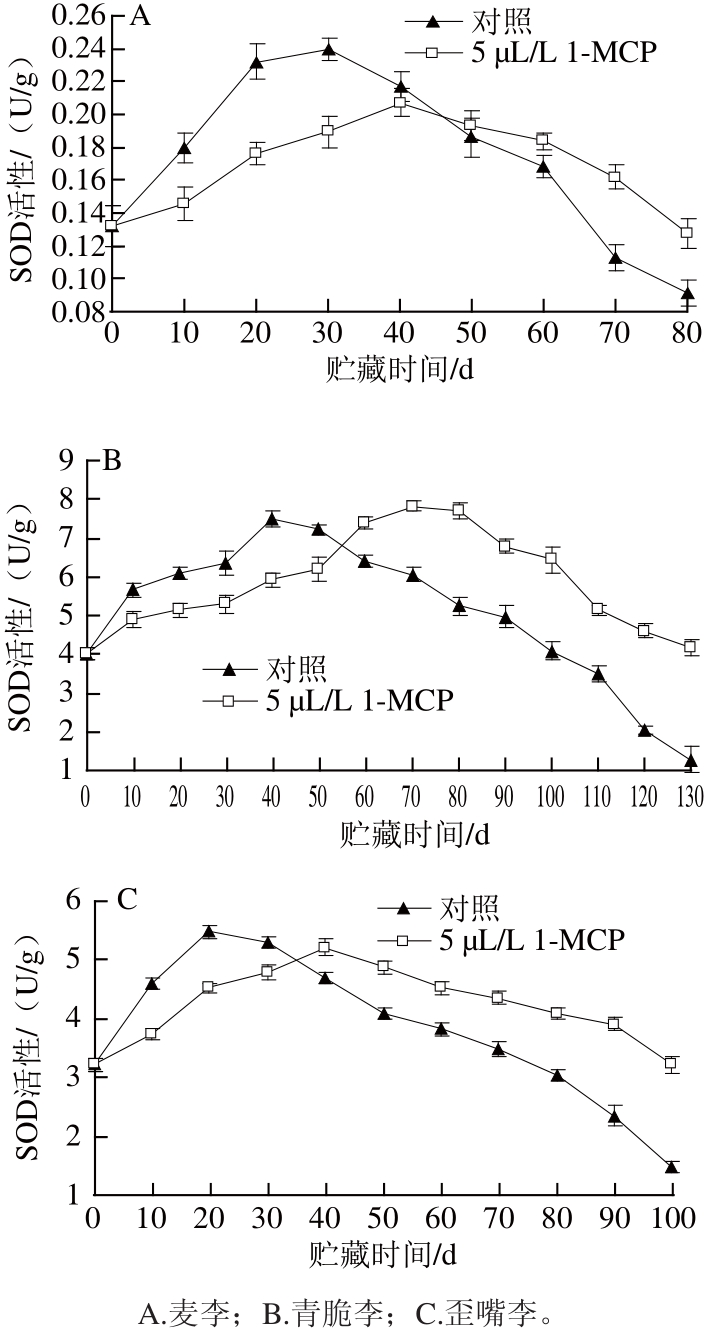
图4 采后1-MCP处理对李果实SOD活性的 影响
Fig.4 Effects of postharvest 1-MCP treatment on SOD activity of plum fruits
贮藏过程中SOD水平的高低可以从一定程度上反映果实耐氧化本领的强弱。图4显示,麦李、青脆李和歪嘴李贮藏过程中果实SOD活性呈现先增加后降低的趋势,且贮藏中后期经过5 μL/L的1-MCP处理的李果实SOD活性的下降显著低于对照组李果实(P<0.05)。与对照相比,1-MCP处理对李果实贮藏期间SOD活性的下降有明显抑制作用。如图4A所示,对照组麦李果实在第30天时SOD活性出现高峰,而经过5 μL/L的1-MCP处理的麦李果实的SOD活性高峰则在第40天时出现,贮藏后期对照组果实SOD活性下降速度和幅度都高于处理组果实。贮藏80 d时处理组麦李果实SOD活性与对照组之间差异最大,是对照组的1.41 倍(P<0.05)。如图4B所示,对照组青脆李果实在第40天时出现SOD活性高峰,而经过5 μL/L的1-MCP处理的青脆李果实的SOD活性高峰则在第70天时出现,贮藏后期对照组果实SOD活性下降速度和幅度都高于处理组果实,贮藏130 d时,处理组青脆李果实SOD活性与对照组之间差异最大,是对照组的3.26 倍(P<0.01)。如图4C所示,对照组歪嘴李果实在第20 天时出现SOD活性高峰,而经过5 μL/L的1-MCP处理的歪嘴李果实SOD活性高峰则在第40天时出现,贮藏后期对照组果实SOD活性下降速度和幅度都高于处理组果实,贮藏100 d时,处理组歪嘴李果实SOD活性与对照组之间差异最大,是对照组的2.18 倍(P<0.01)。实验表明,5 μL/L的1-MCP处理可以推迟麦李、青脆李和歪嘴李果实SOD活性高峰的到来,并降低了麦李果实SOD活性峰值的大小。1-MCP处理能有效抑制3 个品种李果实贮藏中后期SOD活性的下降,延缓其氧化衰老。1-MCP处理对青脆李和歪嘴李果实贮藏期间SOD活性下降的抑制效果优于麦李。
2.5 1-MCP处理对李果实贮藏期间POD活性的影响

图5 采后1-MCP处理对李果实POD活性的影响
Fig.5 Effects of postharvest 1-MCP treatment on POD activity of plum fruits
图5显示,麦李、青脆李和歪嘴李贮藏过程中果实POD活性呈现先增加后降低的趋势,贮藏中后期对照组李果实POD活性显著低于经过5 μL/L的1-MCP处理的处理组果实(P<0.05)。图5A所示麦李果实贮藏过程中POD活性的变化,对照组麦李果实在第20天时POD活性出现高峰,而经过5 μL/L的1-MCP处理的麦李果实的POD活性高峰则在第40天时出现,贮藏中后期对照组果实POD活性下降速度和幅度都高于处理组果实,贮藏末期对照组果实POD活性与处理组之间无明显差异。图5B所示,青脆李贮藏过程中POD活性的变化,对照组青脆李果实在第40天时出现POD活性高峰,而经过5 μL/L的1-MCP处理的青脆李果实的POD活性高峰则在第70天时出现,贮藏中后期处理组果实POD活性始终高于对照组。贮藏130 d时,对照组青脆李果实POD活性是处理组的0.79 倍(P<0.05)。图5C所示,歪嘴李贮藏过程中POD活性的变化,对照组歪嘴李果实在第30天时出现POD活性高峰,而经过5 μL/L的1-MCP处理的歪嘴李果实的POD活性高峰则在第50天时出现,贮藏中后期对照组歪嘴李果实POD活性一直低于处理组。贮藏100 d时,对照组歪嘴李果实POD活性是处理组的0.81 倍(P<0.05)。实验表明,5 μL/L的1-MCP处理能有效地推迟麦李、青脆李和歪嘴李果实采后贮藏期间POD活性高峰的来临,对POD活性的变化有控制作用,有效地保持POD活性的稳定。1-MCP处理对青脆李果实POD活性变化的影响最佳。
2.6 1-MCP处理对李果实贮藏期间CAT活性的影响
图6显示,麦李贮藏过程中果实CAT活性呈现逐渐下降的趋势,青脆李和歪嘴李贮藏过程中果实CAT活性呈现先增加后降低的趋势,贮藏中后期经过5 μL/L的1-MCP处理的3 种李果实CAT活性均高于对照组(P<0.05)。与对照相比,1-MCP处理对李果实贮藏期间CAT活性的下降有明显抑制作用。图6A所示,麦李贮藏过程中CAT活性的变化,麦李贮藏期间CAT活性逐渐下降,处理组果实CAT活性下降速度和幅度都显著小于对照组果实,贮藏80 d时,处理组果实CAT活性是对照组的1.32 倍(P<0.05)。图6B所示,青脆李贮藏过程中CAT活性的变化,对照组青脆李果实在第50天时出现CAT活性高峰,而经过5 μL/L的1-MCP处理的青脆李果实的CAT活性高峰则在第80天时出现,贮藏中后期对照组果实CAT活性始终低于处理组。贮藏130 d时,处理组果实CAT活性是对照组的1.18 倍。图6C所示。歪嘴李贮藏过程中CAT活性的变化,对照组歪嘴李果实在第10天时出现CAT活性高峰,而经过5 μL/L的1-MCP处理的歪嘴李果实的CAT活性高峰则在第20 天时出现,贮藏中后期处理组果实CAT活性高于对照组。贮藏100 d时,处理组歪嘴李果实CAT活性是对照组的1.43 倍(P<0.05)。实验结果表明,5 μL/L的1-MCP处理能有效地推迟青脆李和歪嘴李采后贮藏期间CAT活性高峰的来临,对3 个品种李果实贮藏过程中CAT活性的变化有控制作用,有效地保持CAT活性的稳定。1-MCP处理对麦李果实贮藏期间CAT活性下降的抑制效果最佳,歪嘴李次之。
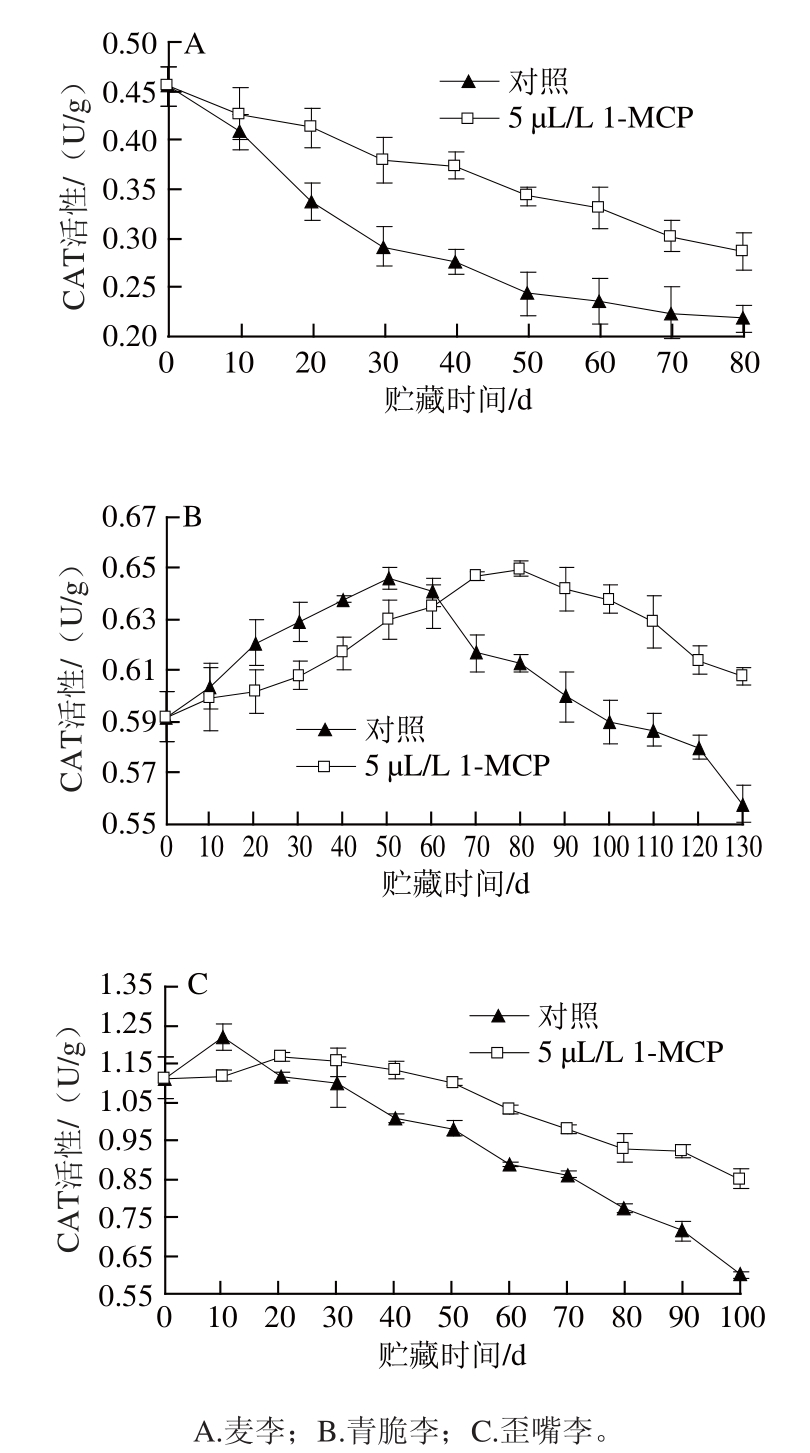
图6 采后1-MCP处理对李果实CAT活性的影响
Fig.6 Effects of postharvest 1-MCP treatment on CAT activity of plum fruits
本实验采用5 μL/L的1-MCP处理麦李、青脆李和歪嘴李3 个品种李果实,结果显示1-MCP能有效地调节李果实贮藏期间后熟生理变化,对控制李果实的成熟衰老具有一定的积极意义。结果还发现,1-MCP处理推迟了李果实贮藏期间呼吸高峰的来临、降低了呼吸峰值,控制了李果实贮藏过程中相对电导率的增加以及MDA的生成。同时,1-MCP处理还能控制李果实贮藏过程中SOD、POD和CAT活性的降低,保证了果实清除活性氧系统的正常运行,减轻氧化胁迫对李果实造成的伤害。
呼吸作用在李果实采后各项生命活动中起到主导作用,为影响李果实贮藏时间的主要因素之一,它能通过部分代谢途径将细胞内有机质分解,引起营养物质的变化 [31]。本实验结果发现1-MCP处理能够显著推迟麦李、青脆李和歪嘴李3 个品种果实贮藏期间呼吸高峰的来临,并且降低了呼吸峰值,有效地减少了呼吸作用对李果实带来的影响。已有研究 [19, 32-33]表明1-MCP处理能推迟香蕉李、杏李、“Qingnan”李果实采后呼吸高峰的来临并且抑制其呼吸强度。李果实在成熟衰老过程中,膜透性不断变大,因此细胞中电解质大量渗出,最后导致相对电导率不断增大;同时李果实组织细胞发生膜脂过氧化作用引起果实衰老变质,MDA即为膜质过氧化作用的主要产物之一。本实验中采用5 μL/L的1-MCP处理麦李、青脆李和歪嘴李3 个品种李果实发现,处理组李果实相对电导率和MDA含量都明显低于对照组,说明1-MCP对李果实贮藏期间组织细胞的膜脂过氧化作用有控制作用,同时能够维持果实细胞膜的完整性。李果实细胞内存在活性氧清除酶系统,能够维持适度的活性氧水平,减少对果实的伤害,而SOD、POD和CAT即作为细胞内活性氧清除酶系统中的主要角色。本实验研究发现,5 μL/L的1-MCP处理能够有效地抑制麦李、青脆李和歪嘴李3 个品种李果实采后贮藏过程中SOD、POD和CAT活性的降低,在一定程度上达到清除果实细胞内活性氧的目的,对延缓李果实的衰老、减轻李果实营养价值的降低有积极作用。此研究结果与1-MCP处理在黑琥珀李、大石早生李、“Larry Ann”李和黑宝石李上研究结果类似 [34-38]。
参考文献:
[1] 成协设. 几个品种李的贮藏保鲜与果肉褐变的研究[D]. 武汉: 华中农业大学, 2004.
[2] 张广燕. 李果实减压及浸钙贮藏保鲜机理研究[D]. 保定: 河北农业大学, 2005.
[3] 孔祥佳, 郑俊峰, 林河通, 等. 热处理对果蔬贮藏品质和采后生理的影响及其应用[C]//国际农业工程大会论文集. 2010: 149-159.
[4] 刘砚璞. MA包装与1-MCP处理对“藤牧一号”苹果贮藏效应的研究[D].杨凌: 西北农林科技大学, 2009.
[5] MUHAMMAD J T, NADEEM A A, ISHFAQ A H. Postharvest application of salicylic acid enhanced antioxidant enzyme activity and maintained quality of peach cv. ‘Flordaking’ fruit during storage[J]. Scientia Horticulturae, 2012, 142: 221-228.
[6] 汪本勤. 植物SOD的研究进展[J]. 河北农业科学, 2008, 12(3): 6-9.
[7] GUILLEN F, CASTILLO S, ZAPATA P J, et al. Effi cacy of 1-MCP treatment in tomato fruit[J]. Postharvest Biology and Technology, 2007, 43: 23-27.
[8] YANG Xiaotang, SONG Jun, CAMPBELL P L, et al. Effect of ethylene and 1-MCP on expression of genes involved in ethylene biosynthesis and perception during ripening of apple fruit[J]. Postharvest Biology and Technology, 2013, 78: 55-66.
[9] SINGH R, DWIVEDI U N. Effect of ethrel and 1-methylcyclopropene (1-MCP) on antioxidants in mango (Mangifera indica var. Dashehari) during fruit ripening[J]. Food Chemistry, 2008, 111: 951-956.
[10] ORTIZ A, GRAELL J, LOPEZ M L, et al. Volatile ester-synthesising capacity in ‘Tardibelle’ peach fruit in response to controlled atmosphere and 1-MCP treatment[J]. Food Chemistry, 2010, 123: 698-704.
[11] VILLALOBOS-ACUNA M G, BIASI W B, FLORES S, et al. Effect of maturity and cold storage on ethylene biosynthesis and ripening in ‘Bartlett’ pears treated after harvest with 1-MCP[J]. Postharvest Biology and Technology, 2011, 59: 1-9.
[12] KETSA S, WISUTIAMONKUL A, DOORN W G. Apparent synergism between the positive effects of 1-MCP and modified atmosphere on storage life of banana fruit[J]. Postharvest Biology and Technology, 2013, 85: 173-178.
[13] 吕天星, 姜孝军, 伊凯, 等. 1-MCP处理对“岳帅”苹果贮藏性能的影响[J]. 北方果树, 2008(1): 7-9.
[14] 张辉, 庄莹莹. 1-MCP在库尔勒香梨贮藏过程中应用及其效果的研究[J]. 中国农学通报, 2007, 23(2): 117-120.
[15] 陈延, 饶景萍, 左俊, 等. 1-MCP处理对冬枣冷藏中生理变化及保鲜效果的研究[J]. 西北农业学报, 2006, 15(3): 157-161.
[16] 陈金印, 付永琦, 刘康. 1-MCP处理对美味猕猴桃果实采后生理生化变化的影响[J]. 江西农业大学学报, 2007, 29(12): 940-947.
[17] 刘成红, 李江阔, 张平, 等. 1-MCP对磨盘柿冷藏期间生理生化及贮藏效果的影响[J]. 保鲜与加工, 2008, 45(2): 23-26.
[18] 杨虎清, 王允祥, 庞林江, 等. 1-MCP对不同成熟度白凤桃冷害发生的影响[J]. 果蔬学报, 2008, 25(1): 111-114.
[19] 公谱. 采收成熟度和1-MCP处理对冷藏晚香蕉李果实品质和褐变的影响[D]. 沈阳: 沈阳农业大学, 2010.
[20] LEE J W, CHENG L L, RUDELL D R, et al. Antioxidant metabolism of 1-methylcyclopropene (1-MCP) treated ‘Empire’ apples during controlled atmosphere storage[J]. Postharvest Biology and Technology, 2012, 65: 79-91.
[21] LI Fujun, ZHANG Xinhua, SONG Baicheng, et al. Combined effects of 1-MCP and MAP on the fruit quality of pear (Pyrus bretschneideri Reld cv. Laiyang) during cold storage[J]. Scientia Horticulturae, 2013, 164: 544-551.
[22] CAO Shifeng, YANG Zhenfeng, ZHENG Yonghua. Effect of 1-methylcyclopene on senescence and quality maintenance of green bell pepper fruit during storage at 20 ℃[J]. Postharvest Biology and Technology, 2012, 70: 1-6.
[23] SINGH R, DWIVEDI U N. Effect of Ethrel and 1-methylcyclopropene (1-MCP) on antioxidants in mango (Mangifera indica var. Dashehari) during fruit ripening[J]. Food Chemistry, 2008, 111: 951-956.
[24] CHIRIBOGA M, BORDONABA J W, SCHOTSMANS W C, et al. Antioxidant potential of ‘Conference’ pears during cold storage and shelf life in response to 1-methylcyclopropene[J]. LWT-Food Science and Technology, 2013, 51: 170-176.
[25] HAN Cong, ZUO Jinhua, WANG Qing, et al. Effects of 1-MCP on postharvest physiology and quality of bitter melon (Momordica charantia L.)[J]. Scientia Horticulturae, 2015, 182: 86-91.
[26] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 48-49; 68-70.
[27] 王国泽. 磷脂酶D感应和接受低温胁迫的功能及在黄瓜冷害中的作用[D]. 杭州: 浙江大学, 2006.
[28] HODGES D M, DELONG J M, FORNEY C F. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plnat tissues containing anthocyanin and other interfering compounds[J]. Planta, 1999, 207(4): 604-611.
[29] LIU Weiqin, KANG Lang, WANG Liangju. Effects on strawberry photosynthesis and relations to anti-oxidant enzymes of A LA[J]. Acta Botanica Boreali-Occidentalia Sinica, 2006, 26(1): 57-62.
[30] 胡花丽, 李鹏霞, 王毓宁. O 2和CO 2配比对低温贮藏李品质及生理变化的影响[J]. 西北植物学报, 2011, 31(10): 2035-2044.
[31] 张明明. 多黄花精提取物对果蔬采后生理和品质的影响[D]. 合肥:安徽农业大学, 2013.
[32] 刘新社, 李静, 潘自舒. 1-MCP对美国杏李采后生理及贮藏品质的影响[J]. 北方园艺, 2010(2): 205-208.
[33] LUO Zisheng, XIE Jing, XU Tingqiao, et al. Delay ripening of ‘Qingnai’plum (Prunus salicina Lindl.) with 1-methylcyclopropene[J]. Plant Science, 2009, 177: 705-709.
[34] 孟坤. 1-MCP间歇处理和壳聚糖涂膜对采后大石早生李成熟衰老调控的研究[D]. 保定: 河北农业大学, 2010.
[35] 胡玲. 黑琥珀李果实采后品质变化的代谢组学研究[D]. 北京: 北京工商大学, 2010.
[36] 顾玉红, 赵志磊, 孟坤, 等. 1-MCP对大石早生李采后生理及品质的影响[J]. 林业科学, 2009, 45(11): 167-170.
[37] LARRIGAUDIERE C, CANDAN A P, UBACH D, et al. Physiological response of ‘Larry Ann’ plums to cold storage and 1-MCP treatment[J]. Postharvest Biology and Technology, 2009, 51: 56-61.
[38] 张利珍. 钙、1-MCP处理对黑宝石李贮藏保鲜的影响及生理生化指标的测定[D]. 北京: 中国农业大学, 2006.
Effects of 1-MCP Treatment on Postharvest Physiology of Plum Fruits
WU Xueying
1, DENG Lili
1,2, WANG Baogang
3, ZENG Kaifang
1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Chongqing Special Food Programme and Technology Research Center, Chongqing 400715, China; 3. Institute of Forestry and Pomology, Beijing Academy of Agriculture and Forestry Sciences, Beijing 100093, China)
Abstract:The effects of 5 μL/L 1-methylcyclopropene (1-MCP) treatment on postharvest physiology of “Mai”, “Green Crisp” and “Waizui” plum fruits were investigated. At the same time, according to the measured changes in antioxidase activities in the three plum fruits during postharvest storage, the mechanism underlying the regulation of physiological activity by 1-MCP treatment were revealed. The results showed that 5 μL/L 1-MCP treatment postponed the peak of respiration in the three plum varieties during postharvest storage, and reduced the intensity of respiration. Meanwhile, this treatment inhibited the increase in relative conductivity in plum fruits and the formation of malondialdehyde. It was also shown that the 1-MCP treatment effectively maintained the activities of superoxide dismutase, peroxidase and catalase in plum fruits during storage. In conclusion, 5 μL/L 1-MCP treatment can effectively reduce the impact of respiration on plum fruits, and maintain the integrity of cell membranes of plum fruits and the normal operation of reactive oxygen species metabolism system to certain degree, which has a positive effect on delaying senescence of plum fruits and reducing loss of the nutritional value in plum fruit.
Key words:1-MCP; plum fruits; postharvest physiology
中图分类号:S609.3;S667.7
文献标志码:A
文章编号:1002-6630(2015)20-0270-07
doi:10.7506/spkx1002-6630-201520052
收稿日期:2015-04-29
基金项目:公益性行业(农业)科研专项(201303075);“十二五”国家科技支撑计划项目(2015BAD16B07)
作者简介:吴雪莹(1989—),女,硕士研究生,研究方向为农产品贮藏工程。E-mail:wuxueyingtvb@163.com
*通信作者:曾凯芳(1972—),女,教授,博士,研究方向为农产品贮藏工程。E-mail:zengkaifang@163.com