
王之珺,张柳婧,钟莹霞,阚丽娇,谢建华 *,谢明勇
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
摘 要:以青钱柳多糖为原料,使用乙酸酐法制备得到乙酰化青钱柳多糖样品。以乙酰化多糖取代度为评价指标,采用正交试验考察乙酸酐-多糖比例、反应时间、反应温度对乙酰化修饰的影响。在此基础上,选择取代度为0.681的乙酰化多糖样品进行1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除实验。结果表明,青钱柳多糖乙酰化最优反应条件为:m(多糖)∶V(乙酸酐)=1∶60、反应时间2 h、反应温度40 ℃,同时,乙酰化修饰可以显著提高青钱柳多糖的DPPH自由基清除活性,乙酰化修饰可作为青钱柳多糖改性的方法之一,为青钱柳资源的进一步开发利用提供新的方向。
关键词:青钱柳;多糖;乙酰化修饰;抗氧化
青钱柳(Cyclocarya paliurus(Batal.)Iljinskaja)是我国特有的胡桃科青钱柳属植物,又被称为青钱李、摇钱树。青钱柳的活性成分主要包括:多糖、黄酮、氨基酸和三萜类化合物等 [1]。青钱柳多糖是提取自青钱柳叶片中的一种杂多糖,主要由葡萄糖、阿拉伯糖、木糖、甘露糖、鼠李糖等单糖组成 [2],并具有抗氧化 [3]、降血糖 [4]、免疫调节以及抗肿瘤 [5]等多种生物活性。由于其出色的保健效果,目前青钱柳已被开发成多种功能性茶饮料。
多糖是一类由10 个以上单糖聚合而成的大分子物质,又被称作多聚糖 [6]。近年来,随着乙酰基与活性多糖构效关系的研究不断深入,乙酰化修饰逐渐成为一种对多糖进行结构修饰的有效方法。许多研究表明经乙酰化修饰后的多糖,其抗氧化 [7]和免疫调节活性 [8]可以得到显著提高。本实验以江西修水青钱柳为原料,利用水提醇沉法提取、Sevag法脱蛋白以得到精制多糖,使用乙酸酐法对多糖进行乙酰化修饰,采用正交试验优化青钱柳多糖乙酰化的最优条件,并利用有机自由基(1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH))体系评价乙酰化修饰对多糖体外抗氧化活性的影响。
1.1 材料与试剂
青钱柳,由江西神茶实业有限公司提供。
DPPH 美国Sigma公司;抗坏血酸 美国Aladdin试剂有限公司;无水乙醇、乙酸酐 国药集团化学试剂有限公司;正丁醇、三氯甲烷、氢氧化钠、浓盐酸等均为国产分析纯。
1.2 仪器与设备
HH-4数显恒温水浴锅 常州国华电器有限公司;ALPHA1-2冷冻干燥机 德国Martin Christ公司;SHZ-82A恒温水浴摇床 常州恒隆仪器有限公司;EYELA N-1001旋转蒸发仪 东京理化器械株式会社;TGL-5-A离心机 上海飞鸽系列离心机厂;TU-1900双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司;PB-10 pH计 德国Sartorius 公司;Milli-Q超纯水仪 美国Millipore公司;AL-104 型电子天平 上海梅特勒-托利多仪器公司。
1.3 方法
1.3.1 青钱柳精制多糖的制备
采用热水浸提法提取青钱柳多糖 [9]。称取800 g干燥的青钱柳叶片粉末,按照1∶10(m/V)加入8 000 mL体积分数为95%的乙醇,浸泡过夜,除去脂质、单糖、色素等小分子物质。过滤后,挥干乙醇,收集残渣,在料液比1∶8(m/V)的条件下,将青钱柳置于80 ℃水浴浸提120 min。浸提后过滤,收集滤液,滤渣继续水浴浸提。反复对滤渣进行两次浸提后合并所有滤液,置于旋转蒸发仪中真空浓缩后保存备用。采用Sevag法进行脱蛋白,按照V(正丁醇)∶V(三氯甲烷)=1∶5的比例配制Sevag试剂,以浓缩液体积的1/5加入Sevag试剂,并持续振荡10 min使浓缩液与Sevag试剂充分接触,再将混合液放入离心机中离心10 min,反复多次至无蛋白沉淀。合并上清液,真空旋蒸以除去有机溶剂,然后将其转入截留分子质量8 000~14 000 u透析袋中,依次使用自来水透析48 h,蒸馏水透析24 h,超纯水透析24 h。透析后,经浓缩、醇沉、冷冻干燥,即得到精制的青钱柳多糖样品(CP),干燥保存备用。
1.3.2 优化条件的选择
本课题组前期研究结果表明,m(多糖)∶V(乙酸酐)、反应时间和反应温度是3 个影响乙酰化多糖取代度的主要因素 [10]。为进一步研究乙酰化修饰青钱柳多糖的最佳工艺条件,根据前期实验的结果,以及Han Fei [11]、梁少茹 [12]和宋逍 [13]等多糖乙酰化工艺优化的结果,选取反应时间、反应温度以及m(多糖)∶V(乙酸酐)进行三因素三水平正交试验,其中试验号1~9分别对应乙酰化青钱柳多糖样品Ac-CP 1~Ac-CP 9。
1.3.3 乙酰化青钱柳多糖的制备
采用乙酸酐法 [10,14]制备乙酰化青钱柳多糖,并使用正交试验法 [11]考察m(多糖)∶V(乙酸酐)、反应时间和反应温度对乙酰化多糖取代度的影响。称取一定质量的青钱柳多糖分别用10 mL超纯水溶于20 mL的试管中,用NaOH溶液调节pH值至9.0,分两次加入2 mL的乙酸酐后,磁力搅拌15 min,调节pH值到8.0。之后将配制好的反应液放入恒温水浴摇床中分别反应1、2、3 h。在40、60、80℃水浴下分别制得乙酰化青钱柳多糖(Ac-CP)。
反应结束后,离心,收集上清液,转入8 000~14 000 u透析袋中,依次使用自来水、蒸馏水、超纯水均分别透析24 h。透析后,将反应液进行浓缩,以V(反应液)∶V(无水乙醇)=1∶4的比例对所有反应液进行醇沉。4 ℃醇沉过夜后,离心,沉淀加水复溶。除去乙醇后,经冷冻干燥即得乙酰化青钱柳多糖,分别命名为:Ac-CP 1~Ac-CP 9。
1.3.4 乙酰基取代度(degree of substitution,DS)的测定
采用中和滴定法测定DS [11]。取9 支20 mL的试管,分别称取10 mg乙酰化青钱柳多糖加入试管中。再加入10 mL 0.01 mol/L的NaOH溶液溶解乙酰化青钱柳多糖,将试管放入水浴恒温振荡器中,在50 ℃条件下剧烈振荡2 h。待反应结束之后,用0.012 mol/L的HCl溶液反滴定至pH值为7.0。取代度计算公式如下。

式中:A为乙酰基含量/%;V 0为加入NaOH溶液的体积/mL;c 0为NaOH溶液的浓度/(mol/L);V 1为反滴定时消耗HCl溶液的体积/mL;c 1为HCl溶液的浓度/(mol/L);m为样品的质量/g。
1.3.5 乙酰化青钱柳多糖的自由基清除活性的测定
根据正交试验的结果,选用乙酰化多糖Ac-CP 4(DS=0.681)参照文献[15]方法,测定乙酰化修饰对青钱柳多糖抗氧化活性的影响。准确称取25 mg乙酰化多糖样品及未修饰的青钱柳多糖分别定容至25 mL,配制成1 mg/mL溶液,分别稀释至31.25、62.5、125、250、500 μg/mL。将实验分为样品组、对照组和空白组,以抗坏血酸为阳性对照。2 mL 1 mmol/L的DPPH溶液加入10 mL具塞试管中,再加入0.5 mL样品溶液,然后再加入1.5 mL水充分混匀,静置30 min后在517 nm波长处测定吸光度。
式中:A 2为2 mL DPPH溶液+0.5 mL多糖样品溶液+ 0.5 mL水的吸光度;A 1为2 mL乙醇+0.5 mL多糖样品溶液+0.5 mL水的吸光度;A 0为2 mL DPPH溶液+2 mL水的吸光度。
1.4 数据分析
以上实验均平行3 次,数据表示为
![]() 。所得数据经过SPSS 19.0软件处理,使用Duncan’s检验分析了显著性,P<0.05表示差异显著。
。所得数据经过SPSS 19.0软件处理,使用Duncan’s检验分析了显著性,P<0.05表示差异显著。
2.1 正交试验优化乙酰化青钱柳多糖的制备
表1 乙酰化青钱柳多糖制备的正交试验优化方案及结果
Table 1 Orthogonal array design with experimental results for optimal preparation of acetylated C. paliurus polysaccharides
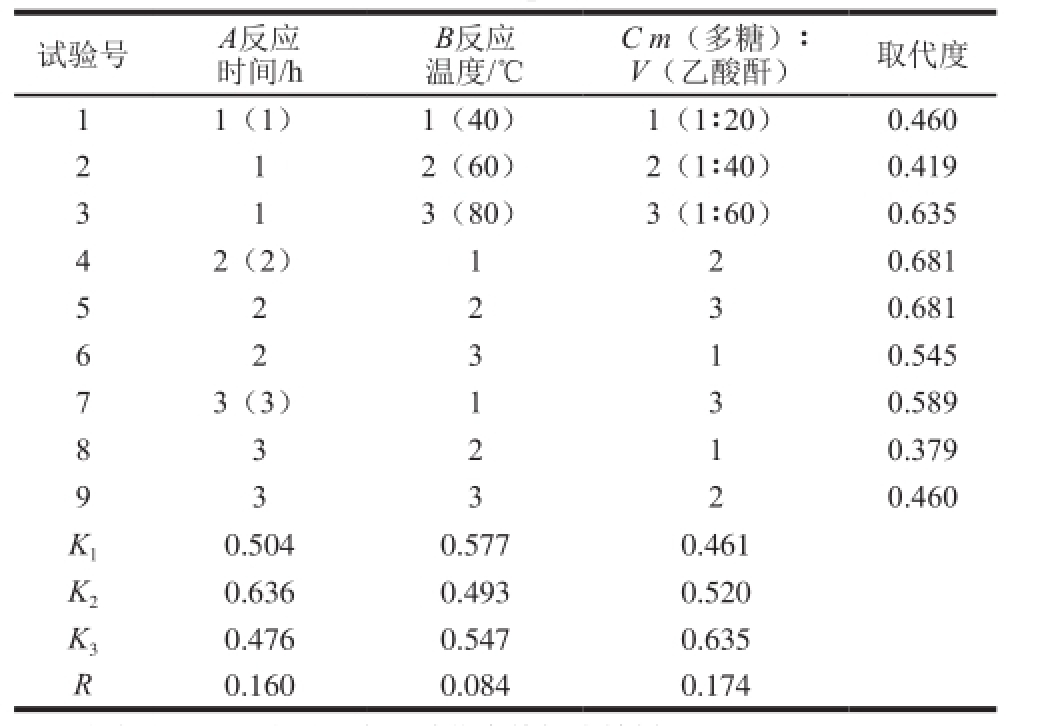
注:试验号1~9分别对应乙酰化青钱柳多糖样品Ac-CP 1~Ac-CP 9。
试验号A反应时间/h B反应温度/℃C m(多糖)∶V(乙酸酐)取代度11(1)1(40)1(1∶20)0.460 2 1 2(60)2(1∶40)0.419 3 3(80)3(1∶60)0.635 42(2)120.681 5 2 2 3 0.681 1 6 0.545 73(3)130.589 8 3 2 1 0.379 2 3 1 0.460 K 10.504 0.577 0.461 K 20.636 0.493 0.520 K 30.476 0.547 0.635 R0.160 0.084 0.174 9 3 3 2
由表1可知,取代度最高的是Ac-CP 4和Ac-CP 5,其取代度为0.681;取代度最低的是Ac-CP 8,其取代度为0.379,两者之间多糖取代度相差0.302。反应时间过长或过短时,多糖取代度都呈现出下降趋势,最佳反应时间为2 h;反应温度为40 ℃或80 ℃时的多糖取代度比较相近,均高于60 ℃,在本实验中,最佳反应温度为40 ℃;m(多糖)∶V(乙酸酐)越高时,多糖取代度越高。根据K值直观分析,最佳乙酰化工艺条件是:A 2B 1C 3,即反应时间为2 h、反应温度为40 ℃、m(多糖):V(乙酸酐)为1∶60。在上述优化条件下进行平行验证实验,测得乙酰化多糖平均取代度与理论预测值比较误差小于3%,结果较为理想。
表2 正交试验结果方差分析
Table 2 Analysis of variance of the experimental results of orthogonal array design
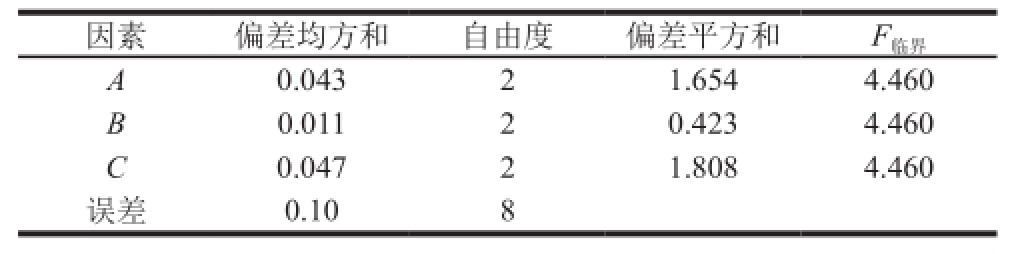
因素偏差均方和自由度偏差平方和F 临界A 0.04321.6544.460 B 0.01120.4234.460 C 0.04721.8084.460误差0.108
以取代度为指标,根据取代度结果进行方差分析,由表2可知,影响青钱柳多糖乙酰化的主要因素是m(多糖)∶V(乙酸酐)和反应时间,反应温度对多糖乙酰化的影响相对较小,各因素对取代度影响程度依次为C>A>B,即依次是m(多糖)∶V(乙酸酐)、反应时间、反应温度。
2.2 乙酰化修饰对青钱柳多糖体外抗氧化活性的影响
机体在新陈代谢过程中会产生包括有机自由基、超氧阴离子自由基、羟自由基等多种自由基 [16],当自由基在体内积累到一定浓度时,便会对机体细胞正常的生命活动造成侵害 [17]。现代社会,诸如糖尿病、心血管疾病、高血压等许多困扰人们身心健康的疾病都与自由基的活动有关 [18-19]。许多研究用DPPH自由基清除能力作为天然活性成分抗氧化活性的评价指标 [20-21]。
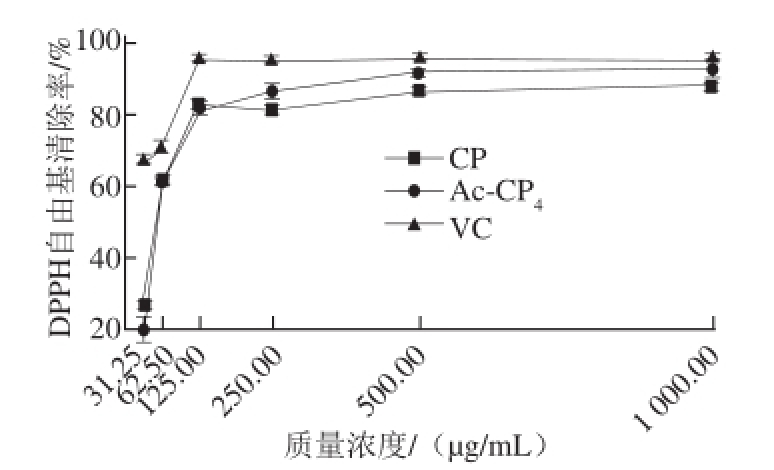
图1 乙酰化青钱柳多糖Ac-CP
4对DPPH自由基的清除作用
Fig.1 DPPH radical scavenging activity of acetylated polysaccharide Ac-CP
4
由图1可知,修饰后与未修饰的青钱柳多糖DPPH自由基清除率均随质量浓度的增加而增加,呈一定的剂量依赖关系,在500 μg/mL时其清除率达到最高,接近85%,之后增幅趋于平缓。有研究证实,较高的取代度可赋予修饰后多糖更强的生物活性 [14],因此根据正交试验结果,选择取代度最高的Ac-CP 4样品进行DPPH自由基清除实验。随着样品质量浓度的增加,可以观察到Ac-CP 4清除率与样品质量浓度成显著的正相关,并且在较高质量浓度如500 μg/mL和1 000 μg/mL时,乙酰化多糖DPPH自由基清除率分别增加至(91.69±0.51)% 和(93.07±1.28)%,明显高于未经修饰的同质量浓度青钱柳多糖的清除率(84.42±1.03)%及(86.15±1.73)%(P<0.05),说明乙酰化修饰可起到增强青钱柳多糖清除DPPH自由基能力的作用。另外,VC作为阳性对照组,显示出较强的抗氧化性,证明DPPH自由基体系建立成功,可以借助其清除率评价抗氧化物质的活性强弱。
随着结构修饰逐渐成为多糖构效关系的研究热点,已经有越来越多的证据表明,合理的结构修饰可以增强包括抗氧化、免疫活性、抗凝血在内的多种生物活性 [22-23]。经乙酰化修饰后的南瓜多糖,其DPPH自由基、羟自由基、超氧阴离子自由基清除率均可得到显著增强,并且与乙酰基取代度成正相关 [14]。另外,本实验结果也与Zhang Zhongshan等 [24]对乙酰化紫菜聚糖的研究结果类似。多糖构效关系研究表明,多糖的抗氧化活性可能来自于其糖环上的游离羟基、酚类物质和交联蛋白的共同作用 [25],这也进一步说明多糖的抗氧化机理比较复杂,可能与其结合组分种类、高级结构有关,多糖经乙酰化修饰后,其空间构象发生变化,使其更易于提供羟基,从而有利于捕捉自由基,提高抗氧化活性。
本实验采用乙酸酐法对青钱柳多糖进行乙酰化修饰,并使用正交试验得到了最优的乙酰化条件,即反应时间2 h、反应温度40 ℃、m(多糖)∶V(乙酸酐)为1∶60。进一步在体外进行的DPPH自由基清除实验表明,经乙酰化修饰后的青钱柳多糖,其对DPPH自由基的清除能力得到显著提高,乙酰化修饰可以提高多糖的抗氧化活性。本研究表明乙酰化修饰可用于青钱柳多糖的结构改性,为其构效关系研究提供新的方向。
参考文献:
[1] 谢明勇, 李磊. 青钱柳化学成分和生物活性研究概况[J]. 中草药, 2001, 32(4): 365-366.
[2] XIE Jianhua, SHEN Mingyue, NIE Shaoping, et al. Analysis of monosaccharide composition of Cyclocarya paliurus polysaccharide with anion exchange chromatography[J]. Carbohydrate Polymers, 2013, 98(1): 976-981.
[3] XIE Jianhua, SHEN Mingyue, XIE Mingyong, et al. Ultrasonicassisted extraction, antimicrobial and antioxidant activities of Cyclocarya paliurus (Batal.) Iljinskaja polysaccharides[J]. Carbohydrate Polymers, 2012, 89(1): 177-184.
[4] WANG Qingqing, JIANG Cuihua, FANG Shengzuo, et al. Antihyperglycemic, antihyperlipidemic and antioxidant effects of ethanol and aqueous extracts of Cyclocarya paliurus leaves in type 2 diabetic rats[J]. Journal of Ethnopharmacology, 2013, 150(3): 1119-1127.
[5] XIE Jianhua, LIU Xin, SHEN Mingyue, et al. Purification, physicochemical characterisation and anticancer activity of a polysaccharide from Cyclocarya paliurus leaves[J]. Food Chemistry, 2013, 136(3/4): 1453-1460.
[6] PERSIN Z, STANA-KLEINSCHEK K, FOSTER T J, et al. Challenges and opportunities in polysaccharides research and technology: the epnoe views for the next decade in the areas of materials, food and health care[J]. Carbohydrate Polymers, 2011, 84(1): 22-32.
[7] ZHANG Zhongshan, WANG Xiaomei, YU Shuchi, et al. Synthesized oversulfated and acetylated derivatives of polysaccharide extracted from Enteromorpha linza and their potential antioxidant activity[J]. International Journal of Biological Macromolecules, 2011, 49(5): 1012-1015.
[8] CHEN Yi, ZHANG Hui, WANG Yuanxing, et al. Acetylation and carboxymethylation of the polysaccharide from Ganoderma atrum and their antioxidant and immunomodulating activities[J]. Food Chemistry, 2014, 156: 279-288.
[9] XIE Jianhua, XIE Mingyong, NIE Shaoping, et al. Isolation, chemical composition and antioxidant activities of a water-soluble polysaccharide from Cyclocarya paliurus (Batal.) Iljinskaja[J]. Food Chemistry, 2010, 119(4): 1626-1632.
[10] 黄丹菲, 聂少平, 江乐明, 等. 乙酰化大粒车前子多糖的制备及其活性研究 [J]. 食品科学, 2013, 34(22): 1-4. doi:10.7506/spkx1002-6630-201322001.
[11] HAN Fei, GAO Chunmei, LIU Mingzhu, et al. Synthesis, optimization and characterization of acetylated corn starch with the high degree of substitution[J]. International Journal of Biological Macromolecules, 2013, 59: 372-376.
[12] 梁少茹, 肖霄, 肖斌. 绿茶多糖的乙酰化修饰及其清除自由基、
 活性的研究[J]. 食品工业科技, 2015, 36(11): 84-87; 99.
活性的研究[J]. 食品工业科技, 2015, 36(11): 84-87; 99.
[13] 宋逍, 张丽华, 赵鹏, 等. 响应面法优选款冬花多糖的乙酰化工艺研究[J]. 中成药, 2013, 35(9): 2030-2033.
[14] SONG Yi, YANG Yang, ZHANG Yuyu, et al. Effect of acetylation on antioxidant and cytoprotective activity of polysaccharides isolated from pumpkin (Cucurbita pepo, lady godiva)[J]. Carbohydrate Polymers, 2013, 98(1): 686-691.
[15] YANG Bao, ZHAO Mouming, SHI J, et al. Effect of ultrasonic treatment on the recovery and DPPH radical scavenging activity of polysaccharides from longan fruit pericarp[J]. Food Chemistry, 2008, 106(2): 685-690.
[16] LUSHCHAK V I. Free radicals, reactive oxygen species, oxidative stress and its classification[J]. Chemico-Biological Interactions, 2014, 224: 164-175.
[17] FORMAN H J, TORRES M. Reactive oxygen species and cell signaling: respiratory burst in macrophage signaling[J]. American Journal of Respiratory and Critical Care Medicine, 2002, 166(12 Pt2): S4-S8.
[18] CAO Hui, XIE Yixi, CHEN Xiaoqing. Type 2 diabetes diminishes the benefits of dietary antioxidants: evidence from the different free radical scavenging potential[J]. Food Chemistry, 2015, 186: 106-112.
[19] SU Qing, QIN Danian, WANG Fuxin, et al. Inhibition of reactive oxygen species in hypothalamic paraventricular nucleus attenuates the renin-angiotensin system and proinflammatory cytokines in hypertension[J]. Toxicology and Applied Pharmacology, 2014, 276(2): 115-120.
[20] HUA Dehong, ZHANG Dezhi, HUANG Bing, et al. Structural characterization and DPPH radical scavenging activity of a polysaccharide from Guara fruits[J]. Carbohydrate Polymers, 2014, 103: 143-147.
[21] SHENG Jiwen, SUN Yanlong. Antioxidant properties of different molecular weight polysaccharides from Athyrium multidentatum (Doll.) Ching[J]. Carbohydrate Polymers, 2014, 108: 41-45.
[22] MA Lishuai, CHEN Haixia, ZHANG Yu, et al. Chemical modification and antioxidant activities of polysaccharide from mushroom Inonotus obliquus[J]. Carbohydrate Polymers, 2012, 89(2): 371-378.
[23] DU Xiuju, ZHANG Jingsong, LÜ Zhiwei, et al. Chemical modification of an acidic polysaccharide (TAPA1) from Tremella aurantialba and potential biological activities[J]. Food Chemistry, 2014, 143: 336-340.
[24] ZHANG Zhongshan, ZHANG Quanbin, WANG Jing, et al. Chemical modification and influence of function groups on the in vitroantioxidant activities of porphyran from Porphyra haitanensis[J]. Carbohydrate Polymers, 2010, 79(2): 290-295.
[25] SIU K C, CHEN Xia, WU Jianyong. Constituents actually responsible for the antioxidant activities of crude polysaccharides isolated from mushrooms[J]. Journal of Functional Foods, 2014, 11: 548-556.
Acetylated Modification and Antioxidant Activity of Polysaccharides from Cyclocarya paliurus
WANG Zhijun, ZHANG Liujing, ZHONG Yingxia, KAN Lijiao, XIE Jianhua*, XIE Mingyong
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
Abstract:Acetylated polysaccharides from Cyclocarya paliurus were prepared by using acetic anhydride method. An orthogonal array design was used to investigate the effects of ratio between acetic anhydride and polysaccharids, reaction temperature and reaction time on the efficiency of acetylated modification as evaluated by degree of substitution (DS). The antioxidant activity of acetylated polysaccharide (DS = 0.681) was investigated by DPPH radical scavenging capacity. The optimal conditions for acetylated modification were determined as 1:60, 2 h and 40 ℃ for ratio between acetic anhydride and polysaccharids, reaction time and reaction temperature, respectively. The results indicated that acetylated modification could enhance the antioxidant activity of Cyclocarya paliurus polysaccharides significantly. In conclusion, acetylation could be considered as an efficient method for the modification of Cyclocarya paliurus polysaccharides which provides a new direction for the development and utilization of Cyclocarya paliurus.
Key words:Cyclocarya paliurus (Batal.) Iljinskaja; polysaccharides; acetylation; antioxidation
中图分类号:TQ281
文献标志码:A
文章编号:1002-6630(2015)21-0006-04
doi:10.7506/spkx1002-6630-201521002
收稿日期:2015-06-25
基金项目:国家自然科学基金面上项目(31471702);国家自然科学基金青年科学基金项目(31201297)
作者简介:王之珺(1991—),男,硕士研究生,研究方向为食品化学与分析。E-mail:zjwang0916@163.com
*通信作者:谢建华(1982—),男,副研究员,博士,研究方向为食品碳水化合物结构与功能。E-mail:jhxie@ncu.edu.cn