焦亚硫酸钠对酵母细胞的毒性作用
乔瑞芳
1,仪 民
2,*,仪慧兰
1,*
(1.山西大学生命科学学院,山西 太原 030006;2.密苏里大学哥伦比亚分校统计系,哥伦比亚 MO 65211,美国)
摘 要:为探讨焦亚硫酸钠的保鲜防腐机制,采用毒理学方法研究保鲜剂对酵母细胞的毒性效应。结果表明:在100~1 000 μmol/L浓度范围内,焦亚硫酸钠可抑制酵母细胞生长分裂,诱发细胞死亡;随着焦亚硫酸钠浓度升高和作用时间延长,其对酵母细胞的毒性效应也逐渐增强。经100 μmol/L焦亚硫酸钠作用2 h后,酵母细胞生长曲线与对照组产生差异;300 μmol/L焦亚硫酸钠处理6 h后,酵母细胞死亡率显著高于对照组,用抗坏血酸或LaCl
3预处理可阻止焦亚硫酸钠诱发的酵母细胞死亡,表明焦亚硫酸钠通过诱导酵母细胞内活性氧和Ca
2+水平升高来引发细胞死亡。研究还发现,相同浓度的焦亚硫酸钠作用后,pH 4.0组酵母细胞的死亡率明显高于pH 7.0组,即酸性环境能增强焦亚硫酸钠对酵母细胞的毒性作用,有助于保鲜剂的抑菌防腐。
关键词:焦亚硫酸钠;保鲜剂;酵母细胞;生长抑制;细胞死亡
葡萄(Vitis vinifera L.)是世界上第四大水果,在我国销量很大,但由于鲜食葡萄在贮藏和运输期间易腐烂,需要采取一定的保鲜措施。二氧化硫(SO
2,由焦亚硫酸钠释放)是传统的葡萄保鲜剂,也是目前为止葡萄果实贮藏期间最为有效的防腐保鲜剂
[1-2],SO
2能抑制病原菌生长、延缓果实衰老,但SO
2贮藏会影响果实品质,导致果实中SO
2残留量增加,对果实的食用安全性造成影响
[3-4]。为了寻求更为安全的保鲜措施,研究人员采用物理手段(紫外线辐照或气调方式)、化学药物(H
2O
2、氯化钙等)或生物材料(植物油、几丁质酶、壳聚糖等)对葡萄果实保鲜,取得了一定效果,但保鲜作用均不如SO
2
[1,5-7]。因此,研究控制SO
2适宜的浓度成为葡萄保鲜领域的难题
[8]。
SO
2易溶于水生成
 和
和
 (SO
2水合物)
[9-10],因此,在葡萄贮藏箱内焦亚硫酸钠(Na
2S
2O
5)释放SO
2,箱内的高湿度(相对湿度约95%)环境使SO
2溶于水分子中形成SO
2水合物,SO
2水合物作用于果穗及其携带的酵母菌、病原菌等,从而发挥防腐保鲜作用。SO
2水合物滞留在果穗表面或进入果实中,果穗表面的SO
2水合物能直接作用于微生物,进入果实内部的
(SO
2水合物)
[9-10],因此,在葡萄贮藏箱内焦亚硫酸钠(Na
2S
2O
5)释放SO
2,箱内的高湿度(相对湿度约95%)环境使SO
2溶于水分子中形成SO
2水合物,SO
2水合物作用于果穗及其携带的酵母菌、病原菌等,从而发挥防腐保鲜作用。SO
2水合物滞留在果穗表面或进入果实中,果穗表面的SO
2水合物能直接作用于微生物,进入果实内部的
 和
和
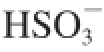 在植物细胞内的代谢转化可能激活细胞氧化应激防御系统
[1,9],提高自身防御能力。但目前为止,SO
2的防腐保鲜机制尚不清楚,其通过何种机制影响葡萄果实衰老和病原菌致病性还有待研究。
在植物细胞内的代谢转化可能激活细胞氧化应激防御系统
[1,9],提高自身防御能力。但目前为止,SO
2的防腐保鲜机制尚不清楚,其通过何种机制影响葡萄果实衰老和病原菌致病性还有待研究。
葡萄果实表面携带有大量酵母菌,对酵母细胞具有抑制效应的化合物具有对葡萄果实保鲜的作用
[11]。而酵母细胞具有生长周期短、易培养的特点,已成为研究真核生物细胞学机制的模式生物,环境理化因素如紫外线、有害金属离子As
3+和Al
3+等均可诱导酵母细胞死亡
[12-14]。因此,本实验以酵母菌为材料,研究特定条件下SO
2对酵母细胞的毒性效应,以揭示SO
2保鲜防腐的作用机制。
1 材料与方法
1.1 菌种与试剂
酿酒酵母(Saccharomyces cerevisiae),实验室自行保存,挑取单菌落用YPD培养基活化。
焦亚硫酸钠 美国Sigma公司。
1.2 方法
1.2.1 酵母菌生长速率测定
取活化酵母菌液,接入新培养基(葡萄糖10 g、硫酸铵3 g、磷酸二氢钾3 g、酵母提取物1 g、硫酸镁25 mg、无水氯化钙20 mg,用柠檬酸-柠檬酸钠缓冲溶液调pH值至4.0)中,250 r/min、30 ℃培养,待酵母细胞浓度达到4×10
6个/mL时加入一定量的焦亚硫酸钠继续振荡培养,间隔一定时间取发酵液,用分光光度计在600 nm波长处检测光密度(OD
600
nm)值,绘制酵母菌生长曲线。
1.2.2 酵母细胞活性检测
以pH 4.0或pH 7.0的柠檬酸-柠檬酸钠缓冲液配制特定浓度的焦亚硫酸钠溶液。取活化酵母细胞接入YPD培养基中培养,收集对数生长期细胞,用pH 7.0磷酸盐缓冲液洗涤后加入一定浓度的焦亚硫酸钠溶液制备细胞悬液使酵母细胞浓度为10
6个/mL,于30 ℃、200 r/min孵育6 h。干预组采用抗坏血酸(ascorbic acid,AsA)或LaCl
3预处理10 min后,再与焦亚硫酸钠同时作用6 h。检测时间效应时,在药物作用期间,每间隔一定时间取细胞检测细胞活性。
药物作用结束后,采用美蓝染色法检测细胞活性,利用活细胞新陈代谢旺盛,能将进入细胞内的美蓝还原为无色,而死细胞或衰老细胞因不能将美蓝有效还原而呈现蓝色的特点,鉴定细胞活力。药物处理后,取适量酵母细胞用美蓝染液染色,于光学显微镜下观察并统计着色细胞和总细胞数目,按照下式计算细胞死亡率。每个处理至少重复3 次,每次重复至少观察1 000 个细胞。
1.3 数据分析
用SPSS v16.0对所得结果进行方差分析,采用Duncan’s多重比较法比较分析不同处理组之间的差异显著性。
2 结果与分析
2.1 焦亚硫酸钠对酵母细胞生长的影响
检测葡萄常规贮藏过程中(0 ℃低温与SO
2保鲜剂结合)贮藏箱内葡萄果粒表面液滴的pH值发现,果实表面pH值在3.0~4.2之间,虽然不同葡萄品种间pH值存在一定差异,但使用SO
2保鲜剂的实验组果实表面pH值均低于无SO
2的对照组,贮藏40 d时,SO
2处理组玫瑰香葡萄果粒表面pH值约为3.5,对照组pH值为4.0。以此为据,本实验采用pH 4.0的培养基培养酵母细胞,发现添加焦亚硫酸钠的4 组培养液中酵母菌OD
600
nm值均低于同期无焦亚硫酸钠处理的对照组(图1),焦亚硫酸钠浓度越高,其与对照组间的差异越大;随着培养时间的延长,各焦亚硫酸钠处理组与对照组OD
600
nm值的差异增大。1 000 μmol/L焦亚硫酸钠处理组的酵母细胞生长缓慢,在接种8 h后OD
600
nm提高了0.041 0,而同期对照组OD
600
nm提高了0.903 0。由此可见,一定浓度的焦亚硫酸钠能够抑制酵母细胞的生长分裂,且抑制效应具有浓度和时间依赖性。

图1 焦亚硫酸钠对酵母细胞生长的影响
Fig.1 Effect of sodium metabisulfite on yeast cell growth
2.2 焦亚硫酸钠对酵母细胞活性的影响
为证实焦亚硫酸钠对酵母细胞的毒性作用,采用美蓝染色法对细胞活性进行观测,结果如图2所示。在pH 4.0时,4 个不同浓度焦亚硫酸钠作用6 h后,酵母细胞存活率均低于对照组,部分酵母细胞死亡,随着焦亚硫酸钠浓度的升高,酵母细胞相对存活率降低,相应地,细胞死亡率增大,焦亚硫酸钠对酵母细胞的毒性效应表现一定的剂量依赖性。焦亚硫酸钠低浓度长期作用或高浓度短期作用均表现出明显的细胞毒性,可致酵母细胞死亡。
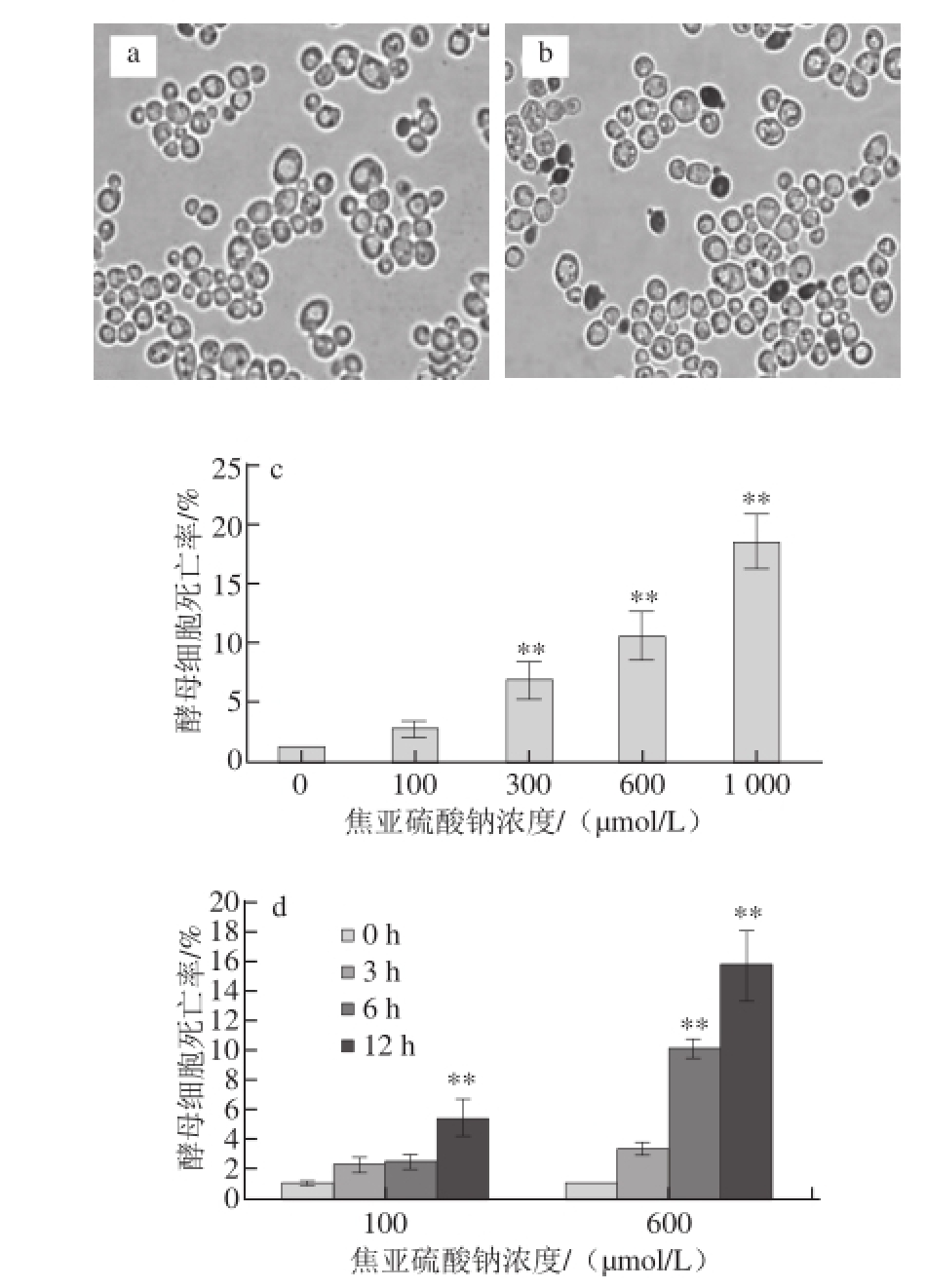
图2 焦亚硫酸钠对酵母细胞的致死效应
Fig.2 Lethal effect of sodium metabisulfite on yeast cells
a. 对照组酵母细胞;b. 1 000 μmol/L焦亚硫酸钠处理酵母细胞6 h;c. 剂量依赖性图;d. 时间依赖性图。**.与对照组(0 μmol/L处理组或0 h处理组)相比,差异极显著(P<0.01)。
不同pH值条件下酵母细胞活性检测结果如图3所示,当介质pH值由中性变为酸性时,焦亚硫酸钠的细胞毒性效应明显增强:浓度300 μmol/L的焦亚硫酸钠在酸性(pH 4.0)条件下对酵母细胞具有致死效应,而中性(pH 7.0)条件下对酵母细胞不具有明显致死效应;在pH 7.0条件下,焦亚硫酸钠浓度达到600 μmol/L以上时,才对酵母菌产生细胞毒性。由此可见,酸性条件有助于焦亚硫酸钠发挥对酵母细胞的毒性作用。
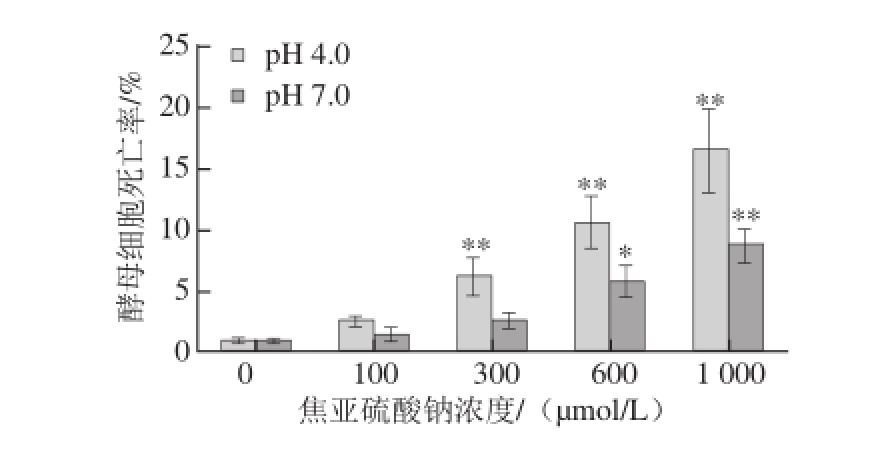
图3 pH值影响焦亚硫酸钠对酵母细胞的毒性
Fig.3 Effect of pH on the toxicity of sodium metabisulfite to yeast cells
*.相同pH值条件下与对照组(0 μmol/L处理组)相比,差异显著(P<0.05);**. 相同pH值条件下与对照组相比,差异极显著(P<0.01)。
2.3 AsA和LaCl
3对焦亚硫酸钠毒性的缓解作用
用外源抗氧化剂AsA或质膜Ca
2+通道特异性抑制剂LaCl
3与600 μmol/L焦亚硫酸钠同时作用酵母细胞6 h后,细胞存活率明显升高(图4),即用AsA降低胞内活性氧(reactive oxygen species,ROS)水平后可缓解焦亚硫酸钠对酵母细胞的毒性作用,而LaCl
3阻止胞外Ca
2+内流,同样可以抑制焦亚硫酸钠的细胞毒性,该结果说明保鲜剂SO
2对酵母细胞的毒性与其诱导细胞内ROS和Ca
2+水平升高有关。

图4 外源AsA和LaCl
3对焦亚硫酸钠处理酵母细胞毒性的影响
Fig.4 Effect of ascorbic acid and LaCl
3on the toxicity of sodium metabisulfite to yeast cells
3 讨 论
焦亚硫酸钠(贮藏过程中释放出SO
2)是常用的保鲜防腐剂,在水果贮藏保鲜、果脯加工、红酒酿制等过程中被广泛使用。研究表明,较高浓度的SO
2对多种植物细胞具有毒性,可引发遗传损伤、细胞死亡等
[15-16]。本实验采用葡萄果实贮藏保鲜剂焦亚硫酸钠释放SO
2的原理,研究了浓度100~1 000 μmol/L的焦亚硫酸钠对酵母细胞的毒性效应,发现一定浓度的焦亚硫酸钠可抑制酵母细胞生长分裂,还能引起细胞死亡,说明SO
2对微生物细胞具有毒性;随着暴露时间的延长,酵母细胞相对存活率下降,死亡细胞数目增加,表现出了一定的时间依赖性。为了证实保鲜过程中焦亚硫酸钠对果实表面微生物的毒性作用,实验同时采用菌落平板计数法检测了焦亚硫酸钠处理后酵母细胞的活性,取得了一致的结果;在前期对购自中国科学院标注为“模式生物”的酿酒酵母菌株的测试中发现,50 μmol/L焦亚硫酸钠作用12 h后该酵母菌株的细胞死亡率达到85%,死亡率高于本实验所用酵母菌株,说明不同酵母菌株对焦亚硫酸钠的敏感性存在差异。因此,在贮藏期间焦亚硫酸钠可能对葡萄果实表面的不同酵母菌株表现出不同程度的毒性,并对其他病原菌产生毒性,从而发挥其保鲜防腐作用。
培养介质中加入焦亚硫酸钠后,酵母菌的OD
600
nm值出现差异的原因可能有两方面:一是焦亚硫酸钠抑制酵母细胞生长和分裂,部分细胞可能因胞内DNA合成受到抑制而脱离细胞增殖周期转入休眠状态,在显微镜下也观察到了焦亚硫酸钠处理组的酵母细胞出芽生殖被抑制(图2b);二是焦亚硫酸钠长期作用导致部分酵母细胞活性降低或死亡,使具有增殖能力的酵母细胞数量减少,子细胞产生速率下降。上述两者共同导致焦亚硫酸钠处理组酵母细胞生长缓慢,细胞总数量减少,相应的OD
600
nm值降低。
用H
2O
2、紫外辐照处理虽然也能诱发葡萄果实细胞抗氧化防御应答,但其保鲜效果不及SO
2
[1],原因可能还与SO
2水合过程及
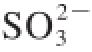 在植物细胞内的代谢和转化过程有关。进入果实内部的
在植物细胞内的代谢和转化过程有关。进入果实内部的
 和
和
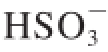 可经过植物细胞内的硫代谢途径得以转化,其中氧化途径可将
可经过植物细胞内的硫代谢途径得以转化,其中氧化途径可将
 转化为
转化为
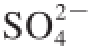 ,还原途径生成半胱氨酸,半胱氨酸是细胞内其他含硫氨基酸、肽和蛋白质的前体,SO
2处理后植物细胞内硫代谢途径增强,细胞内
,还原途径生成半胱氨酸,半胱氨酸是细胞内其他含硫氨基酸、肽和蛋白质的前体,SO
2处理后植物细胞内硫代谢途径增强,细胞内
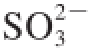 、
、
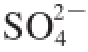 及还原性含硫产物水平提高
[1,10,17]。细胞内含硫产物如半胱氨酸、谷胱甘肽、蛋白质巯基及谷胱甘肽硫转移酶等参与细胞防御应答和代谢解毒过程,在生物和非生物胁迫中发挥作用
[18-19],因此,SO
2处理后植物细胞内含硫抗氧化物水平的升高可能在果实保鲜过程中参与调控了细胞对环境的适应性,并增强了其抗逆性。但细胞代谢
及还原性含硫产物水平提高
[1,10,17]。细胞内含硫产物如半胱氨酸、谷胱甘肽、蛋白质巯基及谷胱甘肽硫转移酶等参与细胞防御应答和代谢解毒过程,在生物和非生物胁迫中发挥作用
[18-19],因此,SO
2处理后植物细胞内含硫抗氧化物水平的升高可能在果实保鲜过程中参与调控了细胞对环境的适应性,并增强了其抗逆性。但细胞代谢
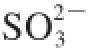 的同时产生ROS,如超氧阴离子自由基(
的同时产生ROS,如超氧阴离子自由基(
 ·)、过氧化氢(H
2O
2)、羟自由基(·OH)等
[1,9-10],使胞内ROS水平升高。胁迫引发细胞内ROS水平升高具有双重作用,一是作为毒性分子攻击生物大分子引发细胞损伤,二是作为信号分子参与多种细胞生理过程
[20-22];SO
2胁迫组拟南芥和蚕豆叶细胞中ROS水平升高同样具有氧化损伤和信号分子双重功效,其效应与SO
2浓度及ROS水平相关
[23-24]。因此,SO
2处理组葡萄果实内部高水平的ROS不仅能激活细胞抗氧化防御应答,发挥保鲜作用
[1],还可能对周围的酵母菌和其他微生物细胞产生氧化损伤,导致微生物生长抑制和细胞死亡,其效应取决于SO
2浓度和果实组织中ROS的水平。本实验加入外源ROS清除剂AsA,降低酵母细胞内ROS水平后,细胞死亡率显著下降,说明SO
2处理诱导酵母细胞ROS水平升高是酵母细胞死亡的一个诱因,该结果也为葡萄果实内ROS水平升高可能参与抑菌作用提供了间接证据。
·)、过氧化氢(H
2O
2)、羟自由基(·OH)等
[1,9-10],使胞内ROS水平升高。胁迫引发细胞内ROS水平升高具有双重作用,一是作为毒性分子攻击生物大分子引发细胞损伤,二是作为信号分子参与多种细胞生理过程
[20-22];SO
2胁迫组拟南芥和蚕豆叶细胞中ROS水平升高同样具有氧化损伤和信号分子双重功效,其效应与SO
2浓度及ROS水平相关
[23-24]。因此,SO
2处理组葡萄果实内部高水平的ROS不仅能激活细胞抗氧化防御应答,发挥保鲜作用
[1],还可能对周围的酵母菌和其他微生物细胞产生氧化损伤,导致微生物生长抑制和细胞死亡,其效应取决于SO
2浓度和果实组织中ROS的水平。本实验加入外源ROS清除剂AsA,降低酵母细胞内ROS水平后,细胞死亡率显著下降,说明SO
2处理诱导酵母细胞ROS水平升高是酵母细胞死亡的一个诱因,该结果也为葡萄果实内ROS水平升高可能参与抑菌作用提供了间接证据。
本课题组前期研究发现,SO
2可诱导蚕豆、拟南芥细胞凋亡,并伴随着细胞内Ca
2+浓度的升高,高水平的Ca
2+可介导细胞死亡,其中细胞外Ca
2+内流是细胞内Ca
2+水平升高的一个诱因
[16]。本研究发现,在SO
2处理过程中加入质膜Ca
2+通道特异性抑制剂LaCl
3后,酵母细胞死亡率降低,表明SO
2处理组酵母细胞死亡与细胞内Ca
2+水平升高有关。有研究发现,ROS可以激活质膜Ca
2+通道,介导植物细胞外Ca
2+内流
[25];在酵母细胞中可能也存在类似的机制,SO
2胁迫引发的ROS合成增加可能会影响质膜Ca
2+通道的通透性,引发细胞外Ca
2+内流,促使细胞内Ca
2+水平升高,继而介导细胞死亡。此外,SO
2处理组酵母细胞内高水平的ROS也可能直接攻击生物大分子DNA、蛋白质、膜脂等,造成细胞氧化损伤,引发细胞死亡。
4 结 论
葡萄保鲜剂焦亚硫酸钠可抑制酵母细胞生长分裂,高剂量短期作用或低剂量长期作用均能诱导酵母细胞死亡,因此贮藏初期采用较高浓度SO
2抑制微生物生长繁殖,之后以低浓度SO
2长期作用抑制微生物活性,可有效控制果实外部微生物,发挥防腐保鲜作用。焦亚硫酸钠的保鲜作用与其降低果实表面pH值有关,酸性pH值条件下SO
2对酵母细胞的毒性作用明显增强。
参考文献:
[1] GIRAUD E, IVANOVA A, GORDON C S, et al. Sulphur dioxide evokes a large scale reprogramming of the grape berry transcriptome associated with oxidative signalling and biotic defence responses[J]. Plant Cell and Environment, 2011, 35: 405-417.
[2] KOKKALOS T I. Posthavest decay control of grapes by using sodium metabisulfite in cartons enclosed in plastic bags[J]. American Journal of Enology and Viticulture, 1986, 37: 149-151.
[3] 武建明, 钟梅, 吴斌, 等. 新疆鲜食葡萄保鲜过程中SO
2残留行为的研究[J]. 食品科学, 2008, 29(3): 486-489.
[4] 李志文, 张平, 黄艳凤, 等. 贮藏保鲜中SO
2伤害对红提葡萄香气组分的影响[J]. 西北植物学报, 2011, 31(2): 385-392.
[5] D’HALLEWIN G, LADU G, PANI G, et al. Postharvest physiopathological disorders in table grapes as affected by UV-C light[J]. Communications in Agricultural and Applied Biological Sciences, 2012, 77(4): 515-525.
[6] PETIT A N, BAILLIEUL F, VAILLANT-GAVEAU N, et al. Low responsiveness of grapevine flowers and berries at fruit set to UV-C irradiation[J]. Journal of Experimental Botany, 2009, 60(4): 1155-1162.
[7] SHIN M H, KIM J H, CHOI H W, et al. Effect of thymol and linalool fumigation on postharvest diseases of table grapes[J]. Mycobiology, 2014, 42(3): 262-268.
[8] 赵猛, 王春生, 李建华, 等. SO
2两段释放处理对红提葡萄贮藏品质的影响[J]. 果树学报, 2011, 28(4): 685-688.
[9] LI Lihong, YI Huilan. Differential expression of Arabidopsis defenserelated genes in response to sulfur dioxide[J]. Chemosphere, 2012, 87: 718-724.
[10] KOPRIVA S. Regulation of sulfate assimilation in Arabidopsis and beyond[J]. Annals of Botany, 2006, 97(4): 479-495.
[11] CRISTINA C, ANNALISA L, AMALIA C, et al. In vitro and in vivo application of active compounds with anti-yeast activity to improve the shelf life of ready-to-eat table grape[J]. World Journal of Microbiology and Biotechnology, 2013, 29(6): 1075-1084.
[12] WU Lihua, YI Huilan, ZHANG Hufang. Reactive oxygen species and Ca
2+are involved in sodium arsenite-induced cell killing in yeast cells[J]. FEMS Microbiology Letter, 2013, 343: 57-63.
[13] del CARRATORE R, DELLA CROCE C, SIMILI M, et al. Cell cycle and morphological alterations as indicative of apoptosis promoted by UV irradiation in S. cerevisiae[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2002, 513: 183-191.
[14] ZHENG Ke, PAN Jianwei, YE Lan, et al. Programmed cell deathinvolved aluminum toxicity in yeast alleviated by antiapoptotic members with decreased calcium signals[J]. Plant Physiology, 2007, 143: 38-49.
[15] 仪慧兰, 姜林. SO
2水合物诱发蚕豆(Vicia faba)根尖细胞染色体畸变效应[J]. 生态学报, 2007, 27(6): 2318-2324.
[16] YI Huilan, YIN Jingjing, LIU Xin, et al. Sulfur dioxide induced programmed cell death in Vicia guard cells[J]. Ecotoxicology and Environment Safety, 2012, 78: 281-286.
[17] 李利红, 仪慧兰, 武冬梅. 二氧化硫胁迫诱发拟南芥植株含硫抗氧化物水平提高[J]. 应用与环境生物学报, 2010, 16(5): 613-616.
[18] NOCTOR G, MHAMDI A, CHAOUCH S, et al. Glutathione in plants: an integrated overview[J]. Plant Cell and Environment, 2012, 35: 454-484.
[19] HÖLLER K, KIRÁLY L, KÜNSTLER A, et al. Enhanced glutathione metabolism is correlated with sulfur-induced resistance in tobacco mosaic virus: infected genetically susceptible Nicotiana tabacum plants[J]. Molecular Plant-Microbe Interactions, 2010, 23(11): 1448-1459.
[20] BREUSEGEM F V, DAT J F. Reactive oxygen species in plant cell death[J]. Plant Physiology, 2006, 141: 384-390.
[21] FOYER C, NOCTOR G. Oxidant and antioxidant signalling in plants: a re-evaluation of the concept of oxidative stress in a physiological context[J]. Plant, Cell and Environment, 2005, 28: 1056-1071.
[22] SUZUKI N, KOUSSEVITZKY S, MITTLER R, et al. ROS and redox signalling in the response of plants to abiotic stress[J]. Plant, Cell and Environment, 2012, 35: 259-270.
[23] YI Huilan, LIU Xin, YI Min. Dual role of hydrogen peroxide in Arabidopsis guard cells in response to sulfur dioxide[J/OL]. Advances in Toxicology, 2014. http://dx.doi.org/10.1155/2014/407368.
[24] ZHAO Jun, YI Huilan. Genome-wide transcriptome analysis of Arabidopsis response to sulfur dioxide fumigation[J]. Molecular Genetics and Genomics, 2014, 289: 989-999.
[25] PEI Ziming, MURATA Y, BENNING G, et al. Calcium channels activated by hydrogen peroxide mediate abscisic acid signaling in guard cells[J]. Nature, 2000, 406: 731-734.
Toxicity of Sodium Metabisulfite on Yeast Saccharomyces cerevisiae
QIAO Ruifang
1, YI Min
2,*, YI Huilan
1,*
(1. College of Life Science, Shanxi University, Taiyuan 030006, China; 2. Department of Statistics, University of Missouri-Columbia, Columbia MO 65211, USA)
Abstract:Sodium metabisulfite is commonly used as a food preservative and antioxidant for dried foods, fruit concentrate juices and fresh fruits. It is the most efficiently preservative for table grape since table grapes are subject to serious water loss and decay while making the long trip from the vine to tables around the world. Herein, the effects of sodium metabisulfite on cell viability were explored in the model eukaryote Saccharomyces cerevisiae. The growth curve of yeast cells was measured by optical density, and cell viability was examined based on methylene blue staining method. Randomly selected views on the tested yeast cells were monitored under a microscope to determine the number of dead cells and the total number of scored cells. The results indicated that sodium metabisulfite could inhibit yeast cell growth and division, and even cause cell death. The toxicity of sodium metabisulfite was increased with increasing concentration and prolonged duration. Either high concentration for a shorter-term exposure or low concentration for a long-term exposure showed significant toxic effects on yeast cells. Exposure to 100 to 1 000 μmol/L sodium metabisulfite for 6 h could cause significant cell death, and both antioxidant ascorbic acid and plasma membrane Ca
2+channel inhibitor LaCl
3blocked sodium metabisulfite-induced cell death. These results indicated that sodium metabisulfite could cause yeast cell death via reactive oxygen species (ROS) production and Ca
2+influx. However, the death rate increased in acidic environment. The cell death rate in pH 4.0 treatment group was higher than that in pH 7.0 treatment group, demonstrating the enhanced sulfur dioxide (SO
2) toxicity in acidic medium. It was found that the pH of waterdrop on the surface of SO
2-fumigated table grapes was around 3.5 to 4.0, which was lower than the control without SO
2fumigation, suggesting that acid environment caused by SO
2fumigation is a way to prevent infection and prolong the shelf life of table grapes.
Key words:sodium metabisulfite; preservative; yeast cell; growth inhibition; cell death
中图分类号:Q945.6
文献标志码:A
文章编号:1002-6630(2015)21-0010-05
doi:10.7506/spkx1002-6630-201521003
收稿日期:2014-12-20
基金项目:国家自然科学基金面上项目(30870454;30470318;31371868);
2012年度高等学校博士学科点专项科研基金项目(20121401110007)
作者简介:乔瑞芳(1985—),女,硕士,研究方向为环境生物学。E-mail:574150223@qq.com
*通信作者:仪民(1987—),男,博士,研究方向为环境生物学。E-mail:myfd2@mail.missouri.edu
仪慧兰(1963—),女,教授,博士,研究方向为环境生物学。E-mail:yihl@sxu.edu.cn
 和
和
 (SO
2水合物)
[9-10],因此,在葡萄贮藏箱内焦亚硫酸钠(Na
2S
2O
5)释放SO
2,箱内的高湿度(相对湿度约95%)环境使SO
2溶于水分子中形成SO
2水合物,SO
2水合物作用于果穗及其携带的酵母菌、病原菌等,从而发挥防腐保鲜作用。SO
2水合物滞留在果穗表面或进入果实中,果穗表面的SO
2水合物能直接作用于微生物,进入果实内部的
(SO
2水合物)
[9-10],因此,在葡萄贮藏箱内焦亚硫酸钠(Na
2S
2O
5)释放SO
2,箱内的高湿度(相对湿度约95%)环境使SO
2溶于水分子中形成SO
2水合物,SO
2水合物作用于果穗及其携带的酵母菌、病原菌等,从而发挥防腐保鲜作用。SO
2水合物滞留在果穗表面或进入果实中,果穗表面的SO
2水合物能直接作用于微生物,进入果实内部的
 和
和
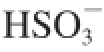 在植物细胞内的代谢转化可能激活细胞氧化应激防御系统
[1,9],提高自身防御能力。但目前为止,SO
2的防腐保鲜机制尚不清楚,其通过何种机制影响葡萄果实衰老和病原菌致病性还有待研究。
在植物细胞内的代谢转化可能激活细胞氧化应激防御系统
[1,9],提高自身防御能力。但目前为止,SO
2的防腐保鲜机制尚不清楚,其通过何种机制影响葡萄果实衰老和病原菌致病性还有待研究。




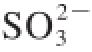 在植物细胞内的代谢和转化过程有关。进入果实内部的
在植物细胞内的代谢和转化过程有关。进入果实内部的
 和
和
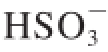 可经过植物细胞内的硫代谢途径得以转化,其中氧化途径可将
可经过植物细胞内的硫代谢途径得以转化,其中氧化途径可将
 转化为
转化为
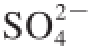 ,还原途径生成半胱氨酸,半胱氨酸是细胞内其他含硫氨基酸、肽和蛋白质的前体,SO
,还原途径生成半胱氨酸,半胱氨酸是细胞内其他含硫氨基酸、肽和蛋白质的前体,SO
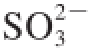 、
、
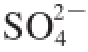 及还原性含硫产物水平提高
及还原性含硫产物水平提高
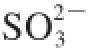 的同时产生ROS,如超氧阴离子自由基(
的同时产生ROS,如超氧阴离子自由基(
 ·)、过氧化氢(H
·)、过氧化氢(H