丁 豪 1,2,杨海燕 1,*,辛志宏 2,*
(1.新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052;2.南京农业大学食品科技学院,江苏 南京 210095)
摘 要:目的:选取昆仑雪菊中5 种具有强抗氧化活性的黄酮类化合物马里苷、金鸡菊噢、黄杉素、紫铆因和奥卡宁,研究其抗氧化相互作用。方法:以1,1-二苯基-2-三硝基苯肼(1,1-dinhenyl-2-picrylhydrazyl,DPPH)自由基清除能力为指标,采用Chou-Talalay中效原理设计实验,分析抗氧化相互作用。结果:金鸡菊噢与紫铆因、黄杉素与紫铆因之间具有抗氧化中等协同作用,它们对清除DPPH自由基的加权平均联合作用指数(weighted average combination index,CI wt)值分别为0.824和0.749。另外,金鸡菊噢与紫铆因复配时,当半抑制浓度(IC 50)大于1且CI wt值小于0.90时,出现协同效应。3 种化合物联合使用时,清除DPPH自由基的CI wt值均大于1,不存在协同抗氧化作用。结论:昆仑雪菊中黄酮类化合物之间的抗氧化相互作用关系与化合物的结构和浓度有关。
关键词:黄酮类化合物;抗氧化;中效原理;相互作用
氧自由基是由机体氧化反应产生的有害化合物,具有强氧化性,能破坏细胞内DNA,加速人体衰老,导致癌症的产生 [1]。自由基导致衰老的加速,衰老又使得人体在“消灭”自由基方面的功能减弱,自由基和衰老使得人体的健康陷入了一个恶性循环。因此,及时消除机体内过多的氧化自由基,能够有效预防由自由基引发的一系列疾病,如癌症、动脉硬化、糖尿病、心血管病等 [2]。天然抗氧化剂与人工合成的抗氧化剂相比,具有安全、无毒、高效等特点,而复合抗氧化剂相比于单一抗氧化剂不仅抗氧化活性提高 [3],而且降低了成本,还可以避免因抗氧化剂使用过多从而带来安全问题,具良好的应用前景。许多研究表明,植物的强抗氧化能力并非单个化合物作用的结果,而是由多个化合物共同作用产生的 [4],因而对于多种抗氧化剂协同抗氧化作用的研究已成为天然抗氧化剂的研究热点。不同抗氧化剂的协同抗氧化作用的研究已有报道,如麦苗中阿魏酸、抗坏血酸、总黄酮两两复配显示协同抗氧化作用 [5],白藜芦醇与黑木耳多糖具有协同抗氧化作用 [6-7],荔枝皮原花青素与VC、VE存在协同抗氧化作用 [8],茶多酚与几种天然抗氧化物质之间存在协同抗氧化作用 [9-10],VC、VE对鹰嘴豆抗氧化多肽的抗氧化能力具有显著增效作用 [11],花椒叶提取物与VC、柠檬酸具有协同增效作用 [12],咖啡渣提取物与VC、柠檬酸存在协同抗氧化作用等 [13]。目前,黄酮类化合物的抗氧化能力已被科学界广泛接受 [14],雪菊提取物中分离纯化的黄酮类化合物的抗氧化作用也有初步的研究 [15-16],但关于它们之间协同抗氧化作用的研究尚未见报道。
本实验是在研究雪菊中分离纯化的几个黄酮类化合物的基础上,将其相互组合,探讨它们之间抗氧化活性的相互作用,以期筛选出协同抗氧化作用的最佳组合,为深入研究昆仑雪菊抗氧化活性奠定基础,也为开发复合型天然抗氧化剂提供理论依据。
1.1 材料与试剂
昆仑雪菊(购于新疆乌鲁木齐北园春批发市场)中分离纯化得到的5 种黄酮类化合物,经谱学方法分别鉴定为马里苷(化合物1)、金鸡菊噢(化合物2)、黄杉素(化合物3)、紫铆因(化合物4)和奥卡宁(化合物5) [17];1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、α-生育酚 美国Sigma公司。
1.2 仪器与设备
UV-2102C/PC/PCS型分光光度计 尤尼柯(上海)仪器有限公司;电子天平 北京赛多利斯仪器系统有限公司。
1.3 方法
1.3.1 DPPH自由基清除能力测定
DPPH自由基清除法参照Alvarez-Jubete等 [18],并稍作修改。0.2 mmol/L DPPH溶液用乙醇配制,吸取2.0 mL DPPH溶液分别与2.0 mL不同浓度的化合物溶液混合,室温避光放置30 min,每个浓度重复3 次,517 nm波长处测定吸光度(A 517 nm)。清除率计算见公式(1)。
式中:A 空白为加入DPPH溶液与无水乙醇的A 517 nm值;A 样品为DPPH溶液与样品溶液的A 517 nm值;A 对照为样品溶液与无水乙醇的A 517 nm值。
1.3.2 抗氧化活性的测定
将5 种化合物分别配制为浓度2.5、5、7.5、10、12.5、15、20、25、30、40、60、80、100 μmol/L的溶液,测定其DPPH自由基清除率,根据所得清除率曲线计算出半抑制浓度(50% inhibition concentration,IC 50)。以α-生育酚为阳性对照组。
1.3.3 抗氧化相互作用的实验设计
以5 种化合物各自的IC 50(μmol/L)为基础,每种化合物分别配制浓度为0.1 IC 50(即0.1×IC 50,下同)、0.2 IC 50、0.3 IC 50、0.4 IC 50、0.5 IC 50、0.75 IC 50、1.0 IC 50、1.25 IC 50、1.5 IC 50的溶液。两种化合物复配,各个浓度均以体积比1:1混合均匀(如:1 mL 0.1 IC 50的化合物1与1 mL 0.1 IC 50的化合物2混合),测定其DPPH自由基清除率 [19-20]。3 种化合物复配,各个浓度以体积比1∶1∶1混合均匀(如0.67 mL 0.1 IC 50的化合物1与0.67 mL 0.1 IC 50的化合物2及0.67 mL 0.1 IC 50的化合物3混合),按1.3.1节方法测定复合组分的抗氧化活性。
1.3.4 中效原理
采用Chou-Talalay的中效原理设计实验,研究5 种黄酮类化合物之间的相互作用。可用如下公式表示:
式中:f a为反应系统中D浓度所产生效应的部分;f u为未产生效应的部分;f u=1-f a;D为药物浓度/(mol/L);D m为中效浓度/(mol/L);m为中效曲线斜率。
两边取对数,即
设Y=lg(f a/f u),X=lgD,b=m,a=mlgD m,可得线性方程式:
药物联合作用指数(combination index,CI)的一般式为:
其中两药物联合作用指数的公式为:
式中:D 1和D 2分别为药物1与2联合作用产生x效应时各自所需浓度/(mol/L);D x1和D x2为药物1和2单用产生x效应时各自所需浓度/(mol/L) [21],通过CI值的大小可以定量判断药物间相互作用的性质以及强度,详见表1。用于衡量综合相互作用的加权平均CI(weighted average CI,CI wt)值的一般式为:
式中:CI 50表示在达到中效剂量,即50%作用浓度(50% effect concentration,EC 50)时候的CI值,CI 75、CI 90、CI 95同理 [22]。
表1 药物联合作用的CI值区间及评价
Table 1 Average CI and description in drug combination studies
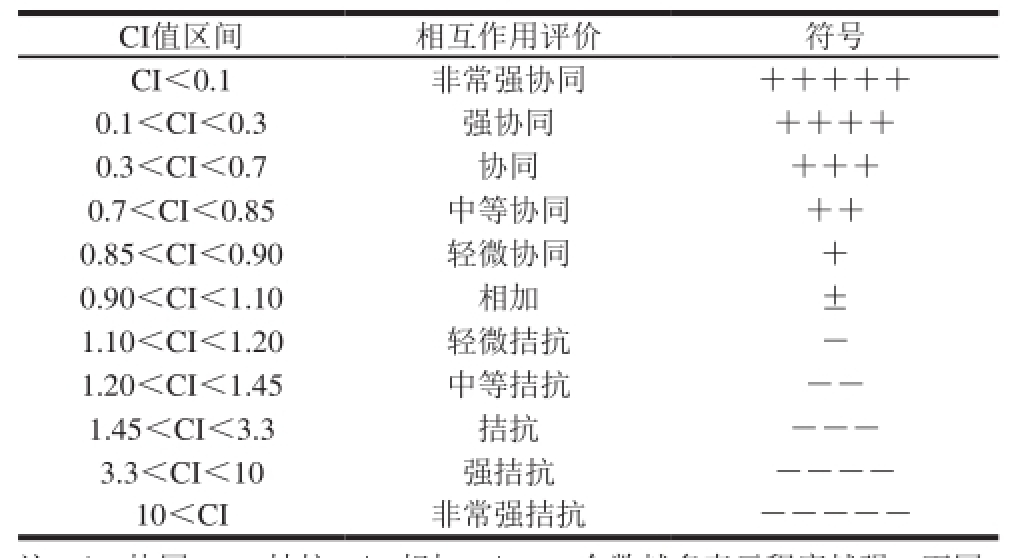
注:+.协同;-.拮抗;±.相加;+、-个数越多表示程度越强。下同。
CI值区间相互作用评价符号CI<0.1非常强协同+++++ 0.1<CI<0.3强协同++++ 0.3<CI<0.7协同+++ 0.7<CI<0.85中等协同++ 0.85<CI<0.90轻微协同+ 0.90<CI<1.10相加± 1.10<CI<1.20轻微拮抗-1.20<CI<1.45中等拮抗--1.45<CI<3.3拮抗---3.3<CI<10强拮抗----10<CI非常强拮抗-----
1.4 统计分析
实验中所有测试均进行3 次重复,数据以
![]() 表示。使用Excel 2007和Calcusyn Version 2.1进行数据分析。
表示。使用Excel 2007和Calcusyn Version 2.1进行数据分析。
2.1 5 种化合物的抗氧化活性
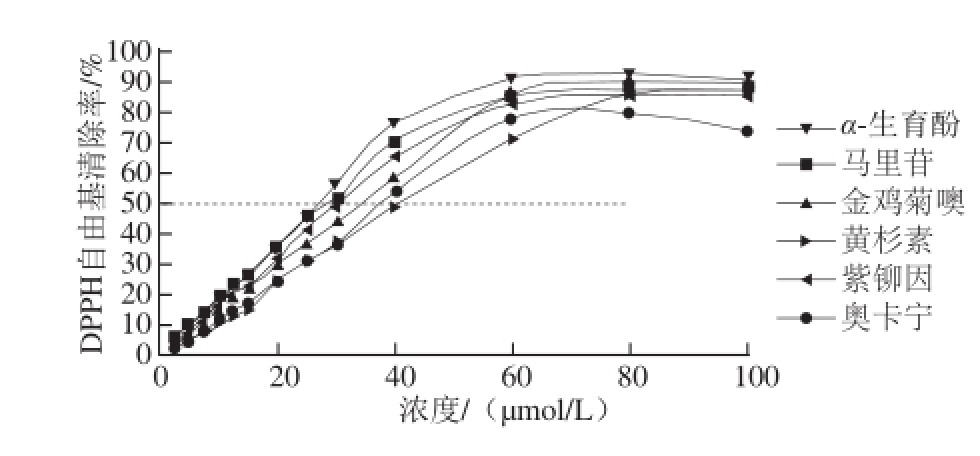
图1 5种化合物的DPPH自由基清除效果
Fig.1 DPPH radical scavenging effects of five compounds
由图1可知,马里苷、金鸡菊噢、黄杉素、紫铆因和奥卡宁的IC 50分别为28.33、34.35、41.69、30.81、38.72 μmol/L,而对照组α-生育酚的IC 50为27.07 μmol/L,说明这5 种化合物对DPPH自由基清除能力略弱于α-生育酚,且马里苷(化合物1)的抗氧化能力强于其他4 种化合物。图2则是本实验所选取的5 种黄酮类化合物的化学结构以及黄酮的基本结构。


图2 5种化合物的结构及黄酮类物质的基本结构
Fig.2 Structures of five compounds and basic structure of flavonoids
A.马里苷;B.金鸡菊噢;C.黄杉素;D.紫铆因;E.奥卡宁;F.黄酮。
2.2 5 种化合物两两复合物的抗氧化活性


图3 两化合物组合的DPPH自由基清除率和浓度关系
Fig.3 Relationship of DPPH free radical clearance and concentrations of two flavonoid compounds in combination
由图3可知,化合物两两组合时,除了化合物2+4和化合物3+4以外,其他8 组联合使用清除DPPH自由基的清除率都小于它们各自单个化合物的清除率。
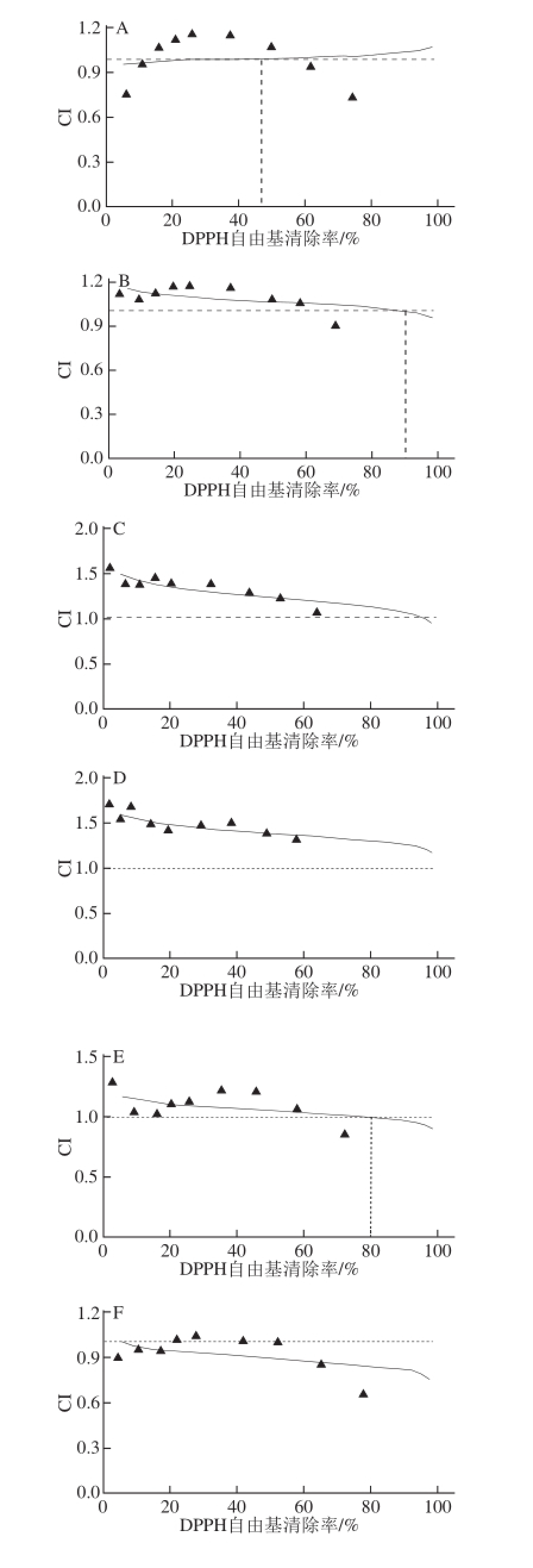
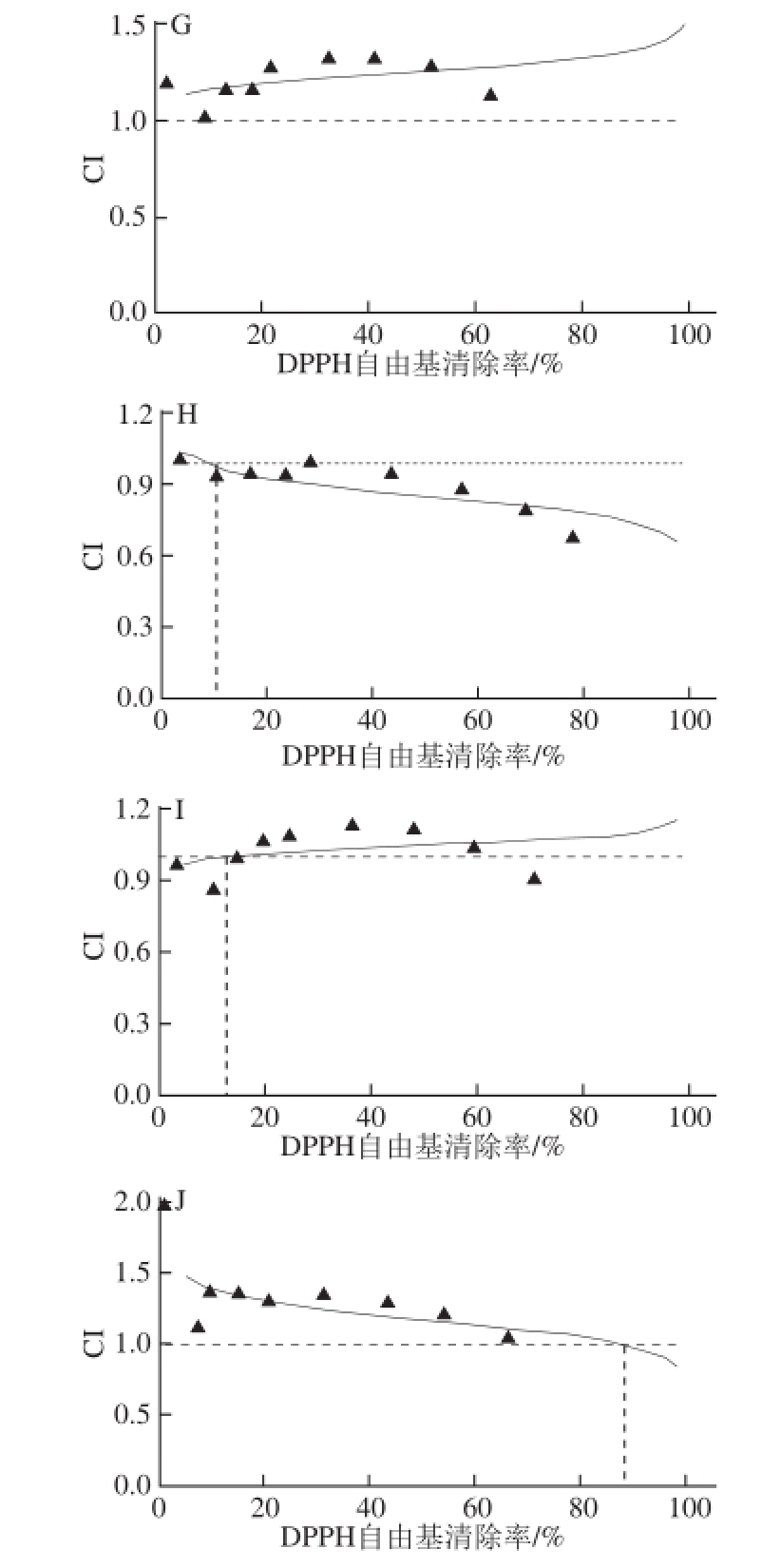
图4 5种化合物的联合作用指数
Fig.4 CI-effect plots for five compounds in combination
A.化合物1+2;B.化合物1+3;C.化合物1+4;D.化合物1+5;E.化合物2+3;F.化合物2+4;G.化合物2+5;H.化合物3+4;I.化合物3+5;J.化合物4+5。
由图4F可知,化合物2+4在半抑制浓度为0.1 IC 50、0.2 IC 50、0.3 IC 50、0.4 IC 50、0.5 IC 50、0.75 IC 50、1.0 IC 50、1.25 IC 50、1.5 IC 50时,其CI值分别为0.91、0.95、0.95、1.02、1.03、1.00、1.00、0.85、0.65。由此可见,在半抑制浓度<1.0 IC 50的时候,CI值在0.90~1.10内,表明是相加效应;当半抑制浓度>1.0 IC 50时,CI值<0.90,说明两化合物之间具有协同抗氧化作用。化合物3+4在半抑制浓度为0.1 IC 50、0.2 IC 50、0.3 IC 50、0.4 IC 50、0.5 IC 50、0.75 IC 50、1.0 IC 50、1.25 IC 50、1.5 IC 50时,其CI值分别为1.00、0.93、0.95、0.94、1.00、0.95、0.88、0.79、0.67,各半抑制浓度下的CI值均≤1,说明这两个化合物具有协同抗氧化作用(图4H)。其中,图4F、4H的CI值曲线在判别线(CI=1.0)的下方,说明化合物2+4和化合物3+4之间存在协同作用;图4A、4B、 4E、4I的CI值≈1,表现为相加效应;图4C、4D、4G、4J的CI值曲线在判别线上方,即CI值>1,说明这几个组合之间存在拮抗作用。
表2 两化合物复配清除DPPH自由基的CI值
Table 2 CI values of combinations two flavonoid compounds for scavenging DPPH free radical

化合物组合CI 50CI 75CI 90CI 95CI wt相互作用判定化合物1+21.0011.0201.0401.0541.038 ±化合物1+31.0641.0311.0010.9831.006 ±化合物1+41.2381.1551.0781.0301.090 ±化合物1+51.3861.3201.2631.2291.273 --化合物2+31.0541.0130.9730.9480.979 ±化合物2+40.8940.8550.8190.7950.824 ++化合物2+51.2591.3131.3721.4161.367 --化合物3+40.8520.7950.7410.7070.749 ++化合物3+51.0471.0761.1061.1271.103 -化合物4+51.1761.0790.9900.9341.004 ±
由表2可知,化合物2+4、3+4时的CI wt值分别为0.824、0.749,表现为中等协同作用,且协同效果后者略大于前者;同样,化合物1+2、1+3、1+4、化合物2+3、化合物4+5分别组合时的CI wt值分别为1.038、1.006、1.090、0.979、1.004,全部位于0.90~1.10之间,说明两两之间存在相加作用;另外,化合物1+5,化合物2+5的CI wt值分别为1.273、1.367,位于1.20~1.45之间,说明两两之间存在中等拮抗作用;化合物3+5组合时的CI wt值为1.103,略大于1.10,说明两化合物之间存在轻微拮抗作用。
2.3 5 种化合物三者复合物的抗氧化活性
表3 3种化合物复配清除DPPH自由基的CI值
Table 3 CI values of combinations of three flavonoid compounds for scavenging DPPH free radical
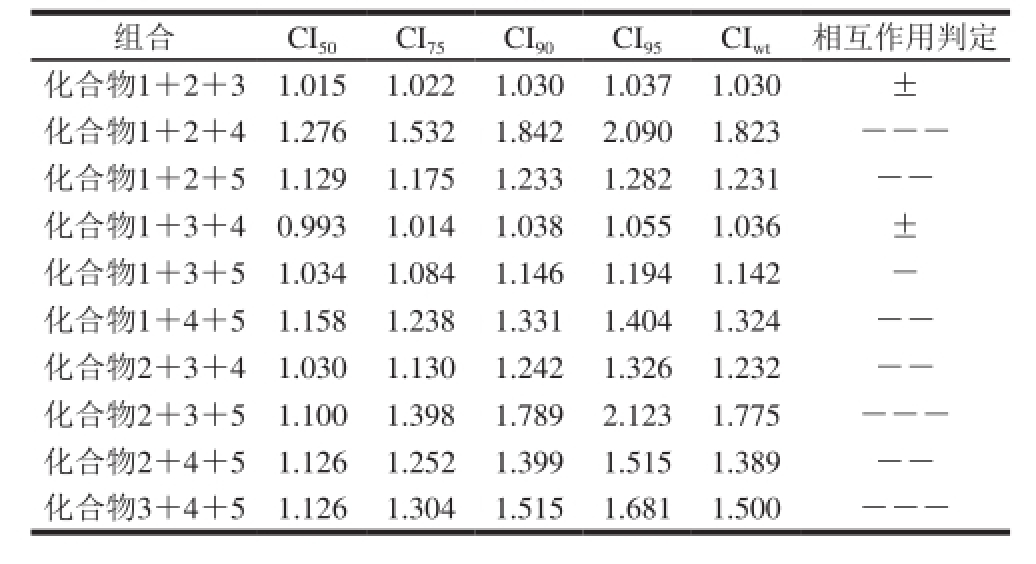
组合CI 50CI 75CI 90CI 95CI wt相互作用判定化合物1+2+31.015 1.022 1.030 1.037 1.030 ±化合物1+2+41.276 1.532 1.842 2.090 1.823 ---化合物1+2+51.129 1.175 1.233 1.282 1.231 --化合物1+3+40.993 1.014 1.038 1.055 1.036 ±化合物1+3+51.034 1.084 1.146 1.194 1.142 -化合物1+4+51.158 1.238 1.331 1.404 1.324 --化合物2+3+41.030 1.130 1.242 1.326 1.232 --化合物2+3+51.100 1.398 1.789 2.123 1.775 ---化合物2+4+51.126 1.252 1.399 1.515 1.389 --化合物3+4+51.126 1.304 1.515 1.681 1.500 ---
由表3可知,3 种化合物复合使用时,除了化合物1、2、3复配和1、3、4复配时的CI wt值在1.00~1.10区间表现为相加作用,其余8 组组合的CI wt值均大于1.10,表现出不同程度的拮抗作用。其中CI wt最高的组合为化合物1+2+4,说明其抗氧化拮抗作用相对于其他组合较强。
本实验选取昆仑雪菊中5 种黄酮类化合物作为研究对象,包括马里苷(化合物1)、金鸡菊噢(化合物2)、黄杉素(化合物3)、紫铆因(化合物4)和奥卡宁(化合物5),以DPPH自由基清除能力为评价指标,简单易行,灵敏可靠,并采用Chou-Talalay中效原理分析化合物之间的相互作用,具有科学依据。
3.1 结构的影响
影响黄酮类化合物抗氧活性的因素,最主要的是羟基化的程度和羟基的位置 [23]。研究表明,黄酮结构中,B环邻二羟基、2,3-双键与4-羰基、以及3,5-羟基是决定黄酮类化合物自由基清除活性的重要因素,一般认为B环中的邻二羟基对黄酮类化合物的抗氧活性起主要作用 [24]。实验所选的5 种昆仑雪菊黄酮类化合物都具有3’,4’-二羟基结构(图2),因此,它们都具有较高的自由基清除能力(图1)。但是,当黄酮化合物两两复配和三者复配后,混合物的自由基清除能力却多数呈相加和拮抗作用(表2、3),仅两组具有协同作用(化合物2+4、化合物3+4)。Samra等 [25]的研究表明,若两种黄酮均有3’,4’-二羟基结构,则混合物经反应后,由于2 种黄酮均生成邻二苯醌结构,混合物抗氧化活性受到较强抑制。三者复配的实验结果突出表明3’,4’-二羟基结构对多黄酮化合物复配抗氧化活性的抑制作用(表3)。
除此之外,Choueiri等 [26]发现,槲皮素与儿茶素混合后易成为氧化强化剂,增强活性氧类物质(reactive oxygen species, ROS)的作用,从而导致细胞毒性。Hidalgo等 [27]认为,槲皮素、异槲皮素与花青素混合后,由于二者间发生氢键缔合,减少了羟基数目,降低了供电子能力,从而削弱了与DPPH自由基的反应能力。Meyer等 [28]的研究结果表明,表儿茶素与具有4-羰基结构的黄酮混合后,儿茶素、表儿茶素的邻二酚羟基可与羰基发生氢键缔合,阻碍儿茶素、表儿茶素的供氢能力,从而降低黄酮混合物的抗氧化性。由此可见,昆仑雪菊5 种黄酮类化合物复配清除DPPH自由基的实验多数呈相加和拮抗作用的原因是5 种黄酮化合物都具有4-羰基结构,相互混合以后,邻二酚羟基可与羰基发生氢键缔合,阻碍了其供氢能力,导致混合物缺少能够中断自由基链式反应的氢电子,从而降低DPPH自由基清除能力。
3.2 浓度的影响
有研究表明抗氧化物质之间的协同抗氧化作用与抗氧化物质的浓度有关 [29]。化合物两两复配清除DPPH自由基实验的结果显示,在不同浓度下,有的混合物DPPH自由基清除能力比两种化合物各自的清除能力都高,有的高于其中一个,也有的比两种化合物都低,表明化合物浓度对昆仑雪菊黄酮类化合物复配的抗氧化活性有很大影响(图3)。另外,不同DPPH自由基清除效果时,CI值也存在较大差异(图4),说明作用效果对昆仑黄酮类化合物的相互作用关系有影响。由此推测,昆仑雪菊黄酮类化合物的抗氧化相互作用与化合物浓度有关。王岳飞等 [9]研究了茶多酚与几种天然抗氧化物质的协同作用,研究结果也表明,抗氧化物质之间的协同抗氧化作用与抗氧化物质本身的抗氧化能力、抗氧化物质有效浓度的高低等因素有关。孙世利等 [10]研究茶多酚与VC、VE的协同抗氧化作用,结果表明,高浓度的茶多酚与VC、VE存在很好的协同抗氧化效应。因此,选择合适的复配浓度可以有效地降低昆仑雪菊黄酮类化合物之间的拮抗作用,或者增强其协同作用。
3.3 体内实验的有关研究
对黄酮类化合物体外抗氧化活性的评价取决于DPPH自由基的性质以及反应机理,而这些机理又受到黄酮羟基的数量、位置、甲基化基团、糖基化结构、反应试剂的结构与极性等因素影响 [30]。然而,除了体外抗氧化活性评价,更全面研究黄酮化合物的抗氧化相互作用还需要进一步通过体内实验探究黄酮混合物抗氧化活性的生物反应。Rossetto等 [31]以抗亚油酸氧化为评价指标发现,儿茶素可促进矢车菊素-3-O-葡萄糖苷等花青素的氢再生,从而提高混合物的抗氧化能力。Pignatelli等 [32]则通过人体质粒实验发现,儿茶素与槲皮素混合物能显著抑制血小板聚集,从而显著抑制胶原质引起的过氧化氢的产生。因此,昆仑雪菊黄酮类化合物的体内抗氧化相互作用有待进一步研究。
昆仑雪菊中含有很多强抗氧化活性的黄酮类化合物,它们的抗氧化活性与其化学结构密切相关。黄酮化合物的化学结构也对黄酮混合物的抗氧化活性有很大影响。而且黄酮混合物的抗氧化相互作用关系跟黄酮化合物的复配浓度有关,合适的复配浓度可以增强协同作用,或降低拮抗作用。但由于昆仑雪菊中的黄酮类化合物种类繁多,并且相互作用的机理研究尚不十分明确,因此,对更多种类黄酮化合物的相互作用研究将是下一步的研究方向。此外,随着体内抗氧化活性评价体系的日益完善,昆仑雪菊黄酮类化合物的体内抗氧化活性及其相互作用研究也将成为其抗氧化相互作用的研究重点。与此同时,进一步研究黄酮类化合物的抗氧化相互作用,将为开发昆仑雪菊复合型天然抗氧化剂提供重要依据。
参考文献:
[1] 张丽芬, 郭玉萍, 周军, 等. 运动对人体自由基代谢的影响[J]. 现代生物医学进展, 2012, 12(17): 3388-3393.
[2] 李勇, 孔令青, 高洪, 等. 自由基与疾病研究进展[J]. 动物医学进展, 2008, 29(4): 85-88.
[3] 盛雪飞, 彭燕, 陈健初. 天然抗氧化剂之间的协同作用研究进展[J].食品工业科技, 2010, 31(7): 414-417.
[4] MEERA B, SUSHMA R G, GHAZIA A, et al. Ginger phytochemicals exhibit synergy to inhibit prostate cancer cell proliferation[J]. Nutrition and Cancer, 2013, 65(2): 263-272.
[5] 张志清, 向建军, 周利茗, 等. 麦苗中阿魏酸、抗坏血酸(VC)、总黄酮协同抗氧化能力分析[J]. 中国粮油学报, 2013, 28(7): 5-11.
[6] 白海娜, 王振宇, 张华, 等. 多酚类化合物与黑木耳多糖协同抗氧化作用研究[J]. 食品工业科技, 2013, 34(22): 124-134.
[7] 白海娜, 王振宇, 刘瑞海, 等. 白藜芦醇与黑木耳多糖协同清除ABTS自由基活性的研究[J]. 现代食品科技, 2014, 30(3): 64-68.
[8] 周玮婧, 隋勇, 孙智达, 等. 荔枝皮原花青素与VC、VE的协同抗氧化研究[J]. 食品科学, 2012, 33(3): 5-8.
[9] 王岳飞, 徐平, 李磊, 等. 茶多酚与几种天然抗氧化物质的协同作用研究[J]. 茶叶科学, 2010, 30(2): 109-114.
[10] 孙世利, 刘淑媚, 赵超艺, 等. 茶多酚与维生素C/E的协同抗氧化作用研究[J]. 广东农业科学, 2013, 40(1): 96-98.
[11] 李翠莲, 方北曙, 申双贵. 鹰嘴豆抗氧化多肽与其它抗氧化剂的协同作用[J]. 中国农学通报, 2008, 24(10): 57-60.
[12] 罗爱国, 胡变芳, 赵健. 花椒叶提取物抗氧化性及协同效应[J]. 江苏农业科学, 2014, 42(5): 240-242.
[13] 潘文洁, 黄晓东, 张玲. 咖啡渣提取物抗氧化性及其协同效应的研究[J]. 食品工业科技, 2008, 29(11): 130-132.
[14] YI Long, CHEN Chunye, JIN Xin, et al. Structural requirements of anthocyanins in relation to inhibition of endothelial injury induced by oxidized low-density lipoprotein and correlation with radical scavenging activity[J]. FEBS Letters, 2010, 584(3): 583-590.
[15] 杨英士, 陈伟, 杨海燕, 等. 昆仑雪菊中2个黄酮类化合物的分离鉴定及其抗氧化活性评价[J]. 南京农业大学学报, 2014, 37(4): 149-154.
[16] 陈伟, 杨英士, 杨海燕. 昆仑雪菊结合型黄酮类化合物的分离与鉴定[J]. 食品科学, 2014, 35(11): 72-78. doi:10.7506/spkx1002-6630-201411015.
[17] WANG Wei, CHEN Wei, YANG Yingshi, et al. New phenolic compounds from Coreopsis tinctoria Nutt. and their antioxidant and angiotensin I-converting enzyme inhibitory[J]. Journal of Agricultural and Food Chemistry, 2015, 62(63): 200-207.
[18] ALVAREZ-JUBETE L, WIJIGAARD H, ARENDT E K, et al. Polyphenol composition and in vitro antioxidant activity of amaranth, quinoa buckwheat and wheat as affected by sprouting and baking[J]. Food Chemistry, 2010, 119(2): 770-778.
[19] HO J H, YOUNG J K, DONGHWA C, et al. Antioxidant capacities of individual and combined phenolics in a model system[J]. Food Chemistry, 2007, 104(1): 87-92.
[20] CHEN Zheng, RICCARDO B, GUGLIELMINA F. EC 50estimation of antioxidant activity in DPPH assay using several statistical programs[J]. Food Chemistry, 2013, 138(1): 414-420.
[21] CHOU T C. Drug combination studies and their synergy quantification using the Chou-Talalay method[J]. Cancer Research, 2010, 70(2): 440-446.
[22] CHOU T C. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies[J]. Pharmacological Reviews, 2006, 58(3): 621-681.
[23] 万素英, 赵亚军, 李琳, 等. 天然食品抗氧化剂: 黄酮类化合物[J]. 河北大学学报: 自然科学版, 1998, 18(3): 110-115.
[24] 刘岭, 陈复生, 薛静玉. 复配抗氧化剂的研究进展[J]. 中国食品添加剂, 2012(2): 172-176.
[25] SAMRA M A, CHEDEA V S, ECONOMOU A, et al. Antioxidant/ prooxidant properties of model phenolic compounds: Part I. Studies on equimolar mixtures by chemiluminescence and cyclic voltammetry[J]. Food Chemistry, 2010, 125(2): 622-629.
[26] CHOUEIRI L, CHEDEA V S, CALOKERINOS A C, et al. Antioxidant/pro-oxidant properties of model phenolic compounds. Part II: studies on mixtures of polyphenols at different molar ratios by chemiluminescence and LC-MS[J]. Food Chemistry, 2012, 133(3): 1039-1044.
[27] HIDALGO M, SANCHEZ-MORENO C, PASCUAL-TERESA S. Flavonoid-flavonoid interaction and its effect on their antioxidant activity[J]. Food Chemistry, 2010, 121(3): 691-696.
[28] MEYER A S, HEINONEN M, FRANKEL E N. Antioxidant interactions of catechin, cyanidin, caffeic acid, quercetin, and ellagic acid on human LDL oxidation[J]. Food Chemistry, 1997, 61(1/2): 71-75.
[29] 汤晓, 焦泽武, 龚淑珍, 等. 黄酮混合物体外抗氧化活性的相互作用[J].食品科技, 2013, 38(2): 198-206.
[30] 汤晓, 方伟, 沈秀丽, 等. 多黄酮混合物抗氧化活性的协同与拮抗作用[J]. 食品科学, 2014, 35(5): 111-115. doi:10.7506/spkx1002-6630-201405022.
[31] ROSSETTO M, VANZANI P, MATTIVI F, et al. Synergistic antioxidant effect of catechin and malvidin 3-glucoside on free radicalinitiated peroxidation of linoleic acid in micelles[J]. Archives of Biochemistry and Biophysics, 2002, 408(2): 239-245.
[32] PIGNATELLI P, PULCINELLI F M, CELESTINI A, et al. The flavonoids quercetin and catechin synergistically inhibit platelet function by antagonizing the intracellular production of hydrogen peroxide[J]. The American Journal of Clinical Nutrition, 2000, 72(5): 1150-1155.
Antioxidant Interaction of Flavonoids from Coreopsis tinctoria Nutt.
DING Hao
1,2, YANG Haiyan
1,*, XIN Zhihong
2,*
(1. College of Food Science and Pharmacy, Xinjiang Agricultural University, Ürümqi 830052, China; 2. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:Objective: To study the interaction of five powerful antioxidant flavonoids isolated from Coreopsis tinctoria Nutt. including marein, maritimetin, taxifolin, butein and okanin. Methods: The DPPH scavenging capacity was used as the indicator of antioxidant activity, and Chou-Talalay method was used to analyze antioxidant interactions among these flavonoids. Results: There was moderate synergistic antioxidant interaction between maritimetin and butein, and between taxifolin and butein with weighed average combination index (CI wt) values of 0.824 and 0.749 for scavenging 1,1-diphenyl-2-picrylhydrazyl (DPPH) free radical, respectively. In addition, the IC 50for maritimetin combined with butein was higher than 1, and the CI wtvalue was less than 0.90, suggesting an obvious synergistic interaction. Nevertheless, a combination of maritimetin, butein and taxifolin scavenged DPPH free radical with a CI value of higher than 1.0, indicating no synergistic interaction among these three antioxidants. Conclusion: The structure and concentration of flavonoids from Coreopsis tinctoria Nutt. can influence their antioxidant interaction.
Key words:flavonoids; antioxidant; Chou-Talalay method; interaction
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2015)21-0026-07
doi:10.7506/spkx1002-6630-201521006
收稿日期:2015-01-31
基金项目:乌鲁木齐市科学技术计划项目(Y121120008);国家自然科学基金地区科学基金项目(31260377)
作者简介:丁豪(1992—),男,硕士研究生,研究方向为天然产物提取与利用。E-mail:943880577@qq.com
*通信作者:杨海燕(1962—),女,教授,博士,研究方向为天然产物提取与利用。E-mail:yanghaiyan163@163.com
辛志宏(1974—),男,教授,博士,研究方向为食品营养与化学。E-mail:xzhfood@njau.edu.cn