陈国薇,吴 嫚,张 超,刘武康,丁承超,吴淑燕,李 森 *,刘 箐*
(上海理工大学医疗器械与食品学院,上海 200093)
摘 要:用还原性烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide-adenine dinucleotide phosphate,NADPH)氧化酶抑制剂二苯基氯化碘盐(diphenyleneiodonium chloride,DPI)处理单核细胞增生李斯特菌(Listeria monocytogenes)后,用2’,7’-二氯荧光素二乙酸酯荧光法测定L. monocytogenes中的活性氧(reactive oxygen species,ROS),结果显示细胞内源性ROS明显降低且有DPI浓度依赖性。进而用ROS产生能力降低的L. monocytogenes侵袭7721肝癌上皮细胞,结果显示:在1~10 μmol/L的DPI浓度范围内,随着L. monocytogenes内ROS水平的降低,L. monocytogenes侵袭7721上皮细胞的能力却随之增长。本研究提示:L. monocytogenes可能和高等动植物一样存在类似于负责产生ROS的NADPH氧化酶,由其介导产生的ROS可能调控L. monocytogenes侵袭细胞的能力。
关键词:单核细胞增生李斯特菌;活性氧;侵袭;上皮细胞
单增李斯特菌(Listeria monocytogenes)是一种人畜共患的病原菌 [1],被世界卫生组织列为仅次于大肠杆菌O157、沙门氏菌、志贺氏菌之后的第四大重要的食源性致病菌 [2],广泛寄生于土壤、污水、人和动物的粪便、饲料及肉类、蛋类、禽类等食品中。食源性L. monocytogenes可以经受高温烹饪、胃部强酸环境等考验后随食物一同到达肠道,首先跨越人体的肠道屏障,通过内化作用进入肠道上皮细胞或吞噬细胞,在宿主细胞内和细胞间进行复制,进而随淋巴系统和血液循环系统到达胎盘和大脑,越过胎盘屏障、血脑屏障,造成一系列疾病 [3]。在食用被单增李斯特菌污染的食物后,将会导致脑膜炎、骨髓炎、心肌炎、孕妇流产以及产褥感染等疾病 [4]。在美国,每年至少有500 例因食用L. monocytogenes污染的食品而中毒死亡的事件发生 [5]。2004年北京市食品中L. monocytogenes污染状况调查发现,L. monocytogenes在熟肉制品中检出率高达48%;2007年珠海市冷冻食品中L. monocytogenes污染状况调查发现,L. monocytogenes在冷冻水产品中的检出率达36% [6]。
还原性烟酰胺腺嘌呤二核苷酸磷酸(reduced form of nicotinamide-adenine dinucleotide phosphate,NADPH)氧化酶是动植物细胞中专门产生活性氧(reactive oxygen species,ROS)自由基最重要的酶之一,该酶由gp91phox、p22phox、p40phox、p47phox和p67phox 5 个亚基组成 [7],由NADPH氧化酶介导产生的内源性ROS主要包括超氧阴离子自由基、羟自由基、过氧化物、烷氧基、以及O 2衍生的非自由基物种如过氧化氢 [8]。研究表明 [9-11],由NADPH氧化酶介导产生的ROS是高等动植物基因表达调控的重要信号分子。原核生物的呼吸作用一般发生在细胞膜上,由细胞膜上相关的酶催化反应的进行,因此细菌中ROS主要产生部位是细胞膜。细菌中ROS大部分是在呼吸链上的酶催化的氧分子连续单价电子的传递反应产生的,例如大肠杆菌细胞膜呼吸链中所产生的过氧化氢能够占到总量的87%左右 [12]。此外,生长环境也对ROS的产生有影响,例如电离、紫外辐射以及环境中某些小分子物质等作用于细菌时,也会对ROS的产量造成影响 [13-14]。Lam等 [15]发现由NADPH氧化酶介导产生ROS在L. monocytogenes侵染吞噬细胞过程中首先激发了吞噬细胞NADPH氧化酶活力,进而产生应答。Adolph等 [16]研究发现NADPH氧化酶产生ROS是宿主细胞受到外源信号刺激时激活细胞自身凋亡程序的一个关键因素。但是,由NADPH氧化酶介导产生的ROS对于L. monocytogenes侵袭上皮细胞过程中所起到的作用,在此方面研究还较少。本实验主要通过改变L. monocytogenes的ROS水平,在此基础上去侵袭7721肝癌上皮细胞,然后统计侵袭水平,进行对比,进而确定ROS在L. monocytogenes侵袭上皮细胞中是否具有一定作用。
1.1 材料与试剂
菌株:L. monocytogenes(ATCC 43251) 上海慧耘生物科技有限公司;Li英诺克李斯特菌株(CICC 10297) 中国工业微生物菌种保藏管理中心。
细胞:人肝癌上皮细胞7721。
脑心浸液(brain heart infusion,BHI)培养基 北京陆桥技术有限责任公司;改良Eagle培养基(Dulbecco’s modification of Eagle’s medium Dulbecco,DMEM)细胞培养基 美国Gibco公司;二苯基氯化碘盐(diphenyleneiodonium chloride,DPI)、2’,7’-二氯荧光素二乙酸酯(2’,7’-dichloro fluorescein diacetate easter,DCFH-DA)、聚乙二醇辛基苯基醚(octyl phenoxy poly ethoxy,Triton X-100) 美国Sigma公司;4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)荧光染料 美国Vector公司;四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT) 上海碧云天生物技术有限公司;硫酸庆大霉素 上海世泽生物科技有限公司。
1.2 仪器与设备
SpectraMax M2多功能酶标仪 美国分子仪器公司;Nikon A1激光扫描共聚焦显微镜 日本尼康公司;Eppendorf 5424离心机 德国艾本德公司。
1.3 方法
1.3.1 L. monocytogenes的DPI处理及ROS含量的测定
挑取L. monocytogenes单菌落接种于灭菌BHI液体培养基中,37 ℃条件下摇床培养过夜。培养完成后再吸取少量新鲜菌液于新鲜灭菌BHI液体培养基中继续培养至光密度(OD 600 nm)为0.3。取1 mL菌液分别加入终浓度为0、1、5、10、100 μmol/L的DPI,37 ℃条件下静置1 h后离心并用磷酸盐缓冲液(phosphate buffer solution,PBS)清洗3 次后重悬(下同)。吸取重悬菌液100 μL添加到96 孔细胞培养板中,用酶标仪检测OD 600 nm值,以检测细菌的初始浓度。将培养板于37 ℃条件下静置培养24 h后用酶标仪检测培养板中菌液的增殖状况(OD 600 nm)和荧光值(激发光波长488 nm,发射光波长530 nm,下同),再向每个孔中添加20 μmol/L的DCFH-DA,密封避光置于37 ℃温度下,30 min后用酶标仪检测每孔菌液的荧光值 [17],结果以相对未处理组的百分比表示。
1.3.2 DPI对细菌活性及生长状况影响的测定
细菌DPI处理及PBS清洗同上1.3.1节,24 h后测量细菌浓度(OD 600 nm)以确定细菌的增殖状况,之后向每孔添加20 μL、5 mg/mL的MTT,密封后置于37 ℃条件下反应4 h后离心,弃去上层液体后添加二甲基亚砜(dimethylslphoxide,DMSO),振荡溶解蓝色结晶后在570 nm波长处测量各孔光密度值。该MTT方法可确定细菌自身的活性,这是因为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒并沉积在细胞中,而死细胞无此功能。DMSO能溶解细胞中的甲瓒,用多功能酶标仪在570 nm波长处测定其光密度值,可间接反映细胞活性。生长状况则是在DPI处理细菌并清洗后,使用生理盐水进行稀释,均匀涂布于BHI固体培养基上于37 ℃条件下静置培养过夜,统计菌落总数。细菌活性(OD 570 nm)和生长状况(OD 600 nm)结果均以相对未处理组的百分比表示。
1.3.3 细胞培养基对细菌生长影响的测定
细菌DPI处理及PBS清洗同1.3.1节,清洗后重悬,取适量菌液接种于不含胎牛血清的DMEM不完全细胞培养基中培养,每30 min为一组,测定OD 600 nm及MTT活性测试(同1.3.2节)。根据结果选取不同DPI处理组分之间细菌活性及数量差异很小的最大时间点,以确定细菌侵袭细胞时间。
1.3.4 抗生素及Triton X-100对细菌的作用检测
使用庆大霉素处理细菌,设置不同质量浓度庆大霉素加于BHI固体培养基中,然后取培养的新鲜L. monocytogenes稀释并涂布于固体培养基,37 ℃条件下静置过夜培养后统计菌落数。选取合适的庆大霉素质量浓度并加入到新鲜菌液中,37 ℃条件下静置1 h后稀释涂布,进行验证。取新鲜培养的L. monocytogenes及L. monocytogenes菌液于离心管内,加入1%的Triton X-100于25 ℃条件下处理0、45、60 min后,稀释并涂于BHI固体培养基,37 ℃条件下静置培养过夜,统计菌落总数,结果以相对未处理组的百分比表示。
1.3.5 细菌侵袭细胞及免疫组化
细菌DPI处理及清洗同1.3.1节细菌清洗后使用不含胎牛血清的不完全DMEM细胞培养基重悬,细胞已在此之前已计数并接入24 孔细胞培养板并贴壁。取适量重悬菌液于孔板中,控制感染复数(multiplicity of infection,MOI)为100∶1(细菌数量∶细胞数量) [18]。于37 ℃、体积分数5% CO 2条件下培养1.5 h后,加入终质量浓度为700 μg/mL的庆大霉素,37 ℃条件下作用1 h后用PBS清洗3 次。加入1% Triton X-100 25 ℃条件下处理30 min,然后进行稀释并涂布于BHI固体培养基,37 ℃条件下静置培养过夜后统计菌落数 [19]。免疫组化则为提前在细胞培养板中接入细胞爬片,将7721贴壁细胞接种于细胞爬片上进行侵袭实验,完成后清洗,进行免疫组化。
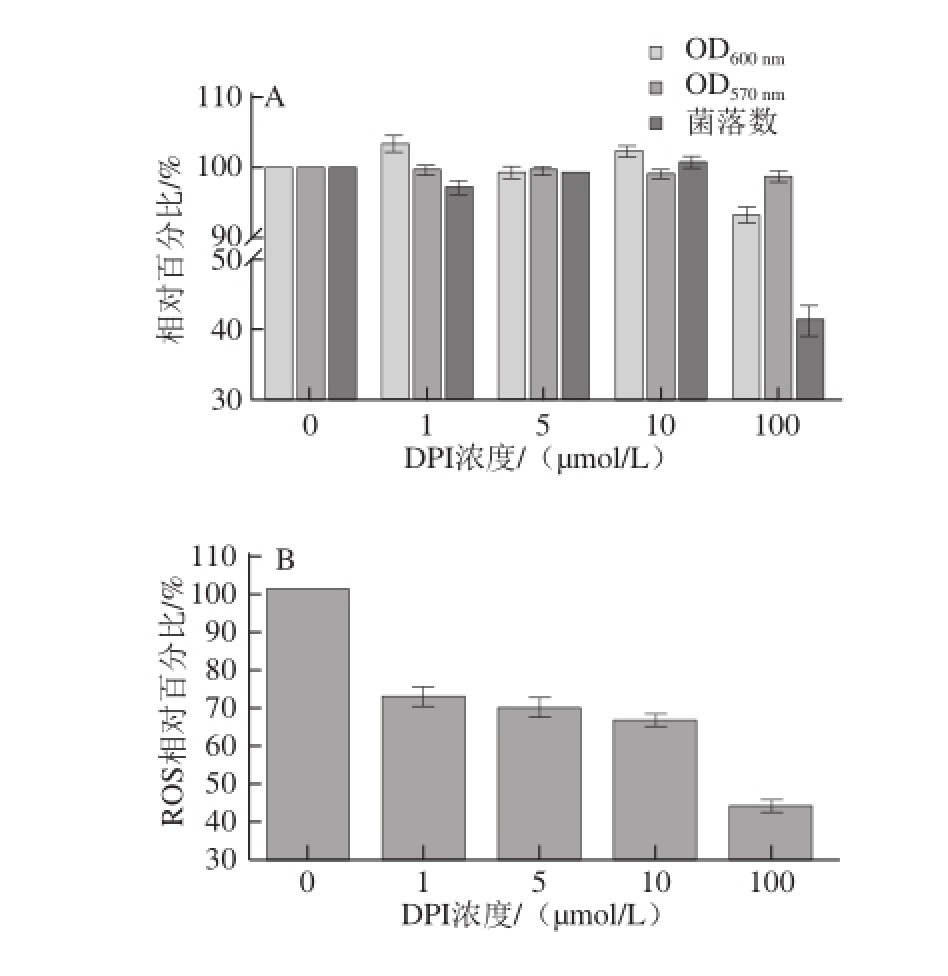
2.1 DPI处理后对细菌生长状况及ROS的影响

图1 DPI处理后对细菌生长状况及ROS的影响
Fig.1 Effect of DPI on bacterial growth and ROS production
C 1~C 4分别表示细菌中添加DPI浓度为0、5、10、100 μmol/L。
将L. monocytogenes在其最适生长条件下使用DPI处理1 h后,检测其生长增殖、活性及ROS的变化。如图1A所示,用DPI处理1 h后,细菌生长没有受到较大影响,OD 600 nm及MTT活性(OD 570 nm)相对比较稳定。当DPI浓度增至100 μmol/L时,细菌生长状况大幅降低。图1B是ROS相对值随着DPI抑制浓度的增大而逐渐降低,当DPI浓度为10、100 μmol/L时,ROS相对值分别下降38%、59%。由此可见,当DPI达到100 μmol/L时,L. monocytogenes生长受到了较大的抑制,活菌数量降低明显,但是在低于DPI浓度10 μmol/L情况下,活菌数量并未有较大差异,结合图1B,ROS相对值却有了明显的降低,所以选取细菌侵袭细胞DPI抑制浓度最大到10 μmol/L。图1C为L. monocytogenes在被不同浓度DPI处理后稀释涂BHI平板后生长状况的直观结果。
2.2 不完全细胞培养基对细菌增殖及活性的影响
由于在细菌侵袭实验过程中需要细菌与细胞在细胞培养基中共培养一定时间,而胎牛血清营养成分复杂并难以分析,所以使用不含胎牛血清的不完全DMEM细胞培养基作为营养源。不同的细菌在不完全细胞培养基中生长速率及活性变化是不一样的,并且随着共培养时间的增长,细菌数量将发生较大的改变,将会改变设定好的MOI=100∶1,所以把DPI抑制处理过的细菌洗掉DPI后接种于DMEM细胞培养基中,37 ℃条件下静置培养,选取不同时间点进行OD 600 nm及MTT活性测试。
由图2A可知,3 种细菌在不完全细胞培养基中培养1.5 h后检测其OD 600 nm和MTT活性,在这5 个浓度阶梯内,OD 600 nm及MTT并未发生明显变化,但是在100 μmol/L时有较为明显的降低。图2B为培养4 h后OD 600 nm和MTT活性值,发现在DPI浓度为100 μmol/L时,OD 600 nm和MTT活性发生了明显的降低,但其他组分之间差异并不明显。因此,当细菌与细胞共培养到4 h时,细菌数量及活性已经发生了非常大的变化,干扰细菌侵袭细胞数量的统计,但是1.5 h时细菌能够进入细胞并且数量及活性并未发生较大变化,所以侵袭时间确定为1.5 h,DPI浓度则选取0~10 μmol/L。
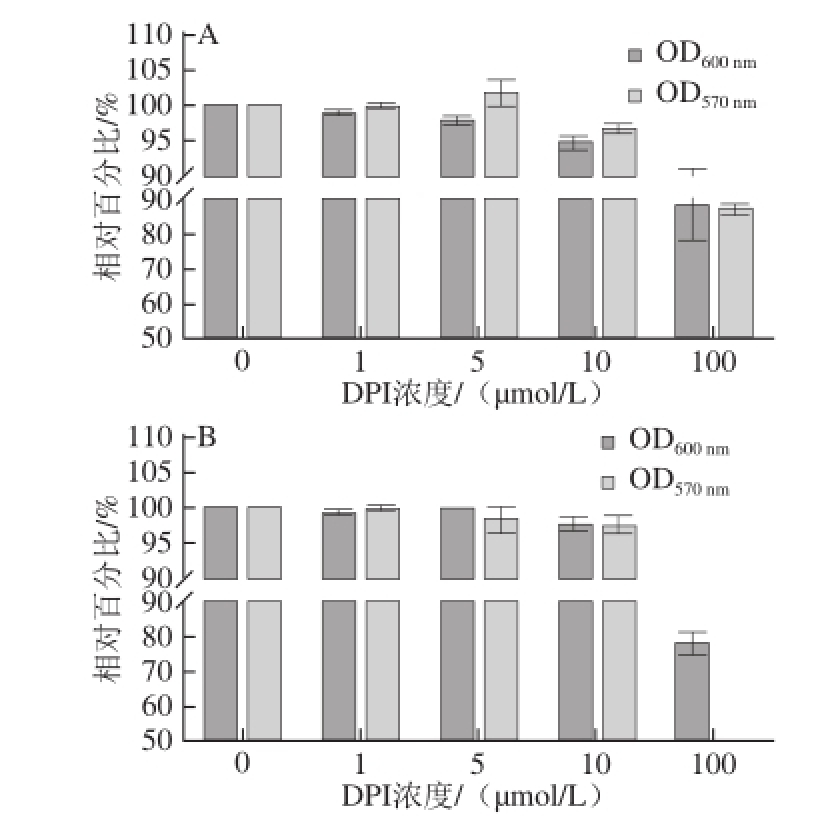
图2 不完全细胞培养基对细菌增殖及活性的影响
Fig.2 Effect of incomplete cell culture medium on bacterial growth and activity
2.3 抗生素质量浓度及Triton X-100作用时间的确定
在细菌与细胞共培养1.5 h后,已经有部分活性较好的细菌进入细胞,但是在外部还是存有大量的细菌,需将细胞外部细菌最大程度的灭活并且不影响细胞活性。设置不同质量浓度的庆大霉素固体培养基,将已经生长到饱和状态的新鲜菌液涂布于含不同质量浓度的庆大霉素固体培养基上,基于不完全细胞培养基对庆大霉素作用有所抵消,故要适当加大庆大霉素的质量浓度。最终确定庆大霉素质量浓度为700 μg/mL,将新鲜饱和菌液接种于含有庆大霉素700 μg/mL的培养基中,于37 ℃条件下作用1 h后稀释涂板,对照组为接种于不含庆大霉素的培养基,于37 ℃条件下静置过夜培养后统计菌落总数(图3A)。使用庆大霉素处理1 h后的L. monocytogenes涂布于BHI平板培养基,已经基本不会生长细菌,证明在700 μg/mL的庆大霉素处理下,细菌已经基本全部被杀死,和对照组形成鲜明对比。因此,在细菌侵袭细胞实验中选择庆大霉素700 μg/mL杀死胞外细菌。
选取1%的Triton X-100,经过台盼蓝染色证明在0.5 h内细胞已被破碎掉,胞内菌得到释放。由于Triton X-100处理细胞的过程时组分较多,会造成一定的时间误差,为确保在误差范围内不会对胞内细菌的生长造成影响,故设置不同时间梯度的组分,将新鲜菌液直接暴露于1%的Triton X-100中,然后分别稀释涂板。如图3B所示,L. monocytogenes 43251处理60 min后,数量都没有发生较大变化,说明L. monocytogenes在被1%的Triton X-100作用长达1 h后生长状况没有受到影响,保证可以破坏细胞使细菌完整释放。图3C为使用Triton X-100处理不同时间后稀释涂平板结果。
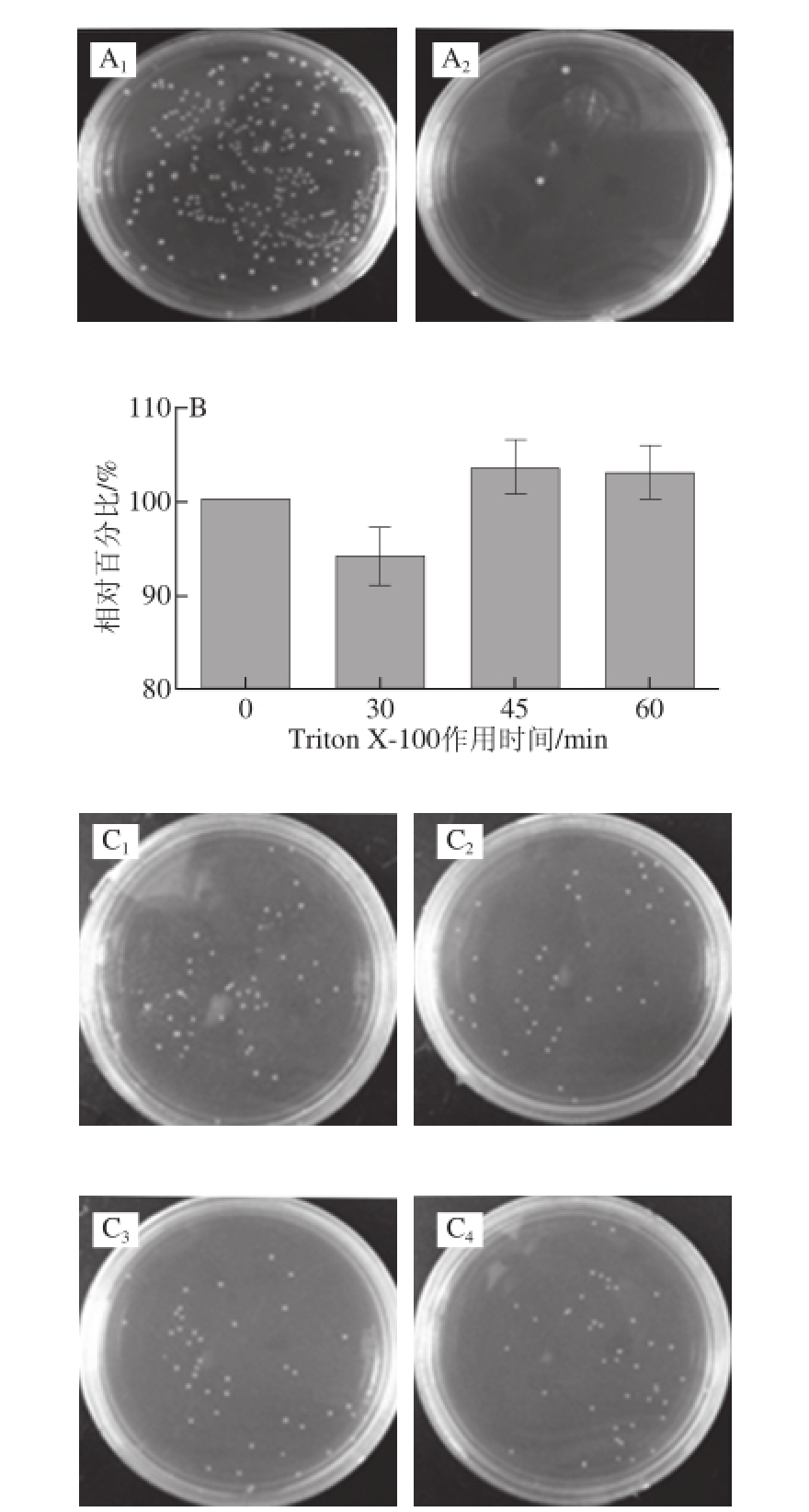
图3 抗生素质量浓度及Triton X-100作用时间的确定
Fig.3 Screening of optimal concentration of antibiotics and optimal treatment duration with Triton X-100
A 1. 未处理,A 2. 700 μg/mL的庆大霉素处理1 h;B. L. monocytogenes 43251使用Triton X-100处理不同时间后的生长状况;C 1~C 4分别表示使用1% Triton X-100处理细菌时间0、30、45、60 min后于BHI固体培养基的菌落生长状况。
2.4 细菌侵袭细胞
由图4A可知,在ROS被抑制到不同程度后,L. monocytogenes侵袭细胞的能力也有所改变,随着ROS的降低,细菌侵袭细胞的数量却随之增加。在DPI浓度为10 μmol/L时,侵袭比率增至4 倍。图4B为L. monocytogenes侵袭细胞后,免疫组化处理后采用共聚焦显微镜拍摄图片,并使用Li英诺克李斯特菌株作为对照。
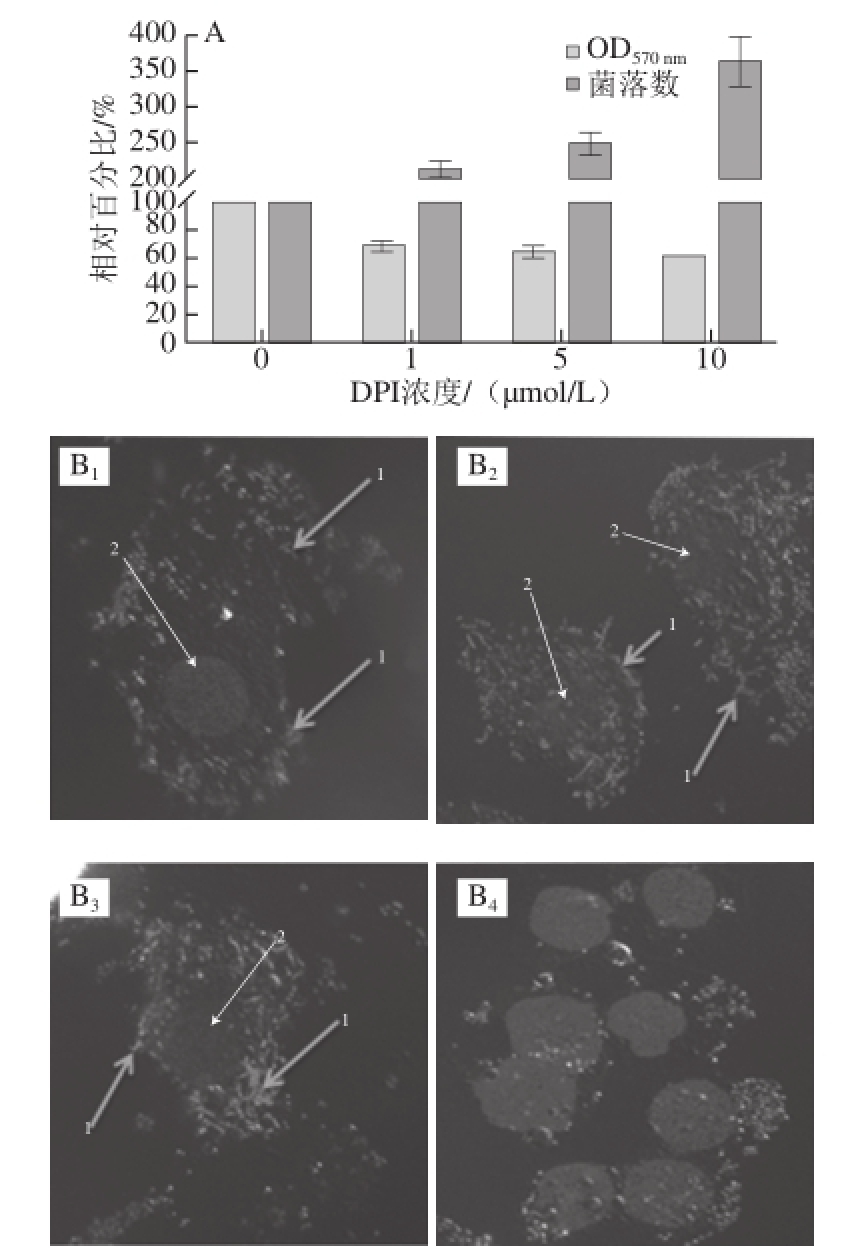
图4 细菌侵袭细胞实验
Fig.4 Observation of bacterial invasion of epithelial cells
A图.不同浓度DPI处理后L. monocytogenes 43251侵袭7721细胞的数量统计,以未处理组做对照,设其为“100%”;B图:B 1~B 3分别表示细菌中添加DPI浓度为0、5、10 μmol/L,B 4. Li英诺克李斯特菌株作为对照,1.细菌,2.细胞核。
本研究证实,在L. monocytogenes中存在有类似高等动植物的NADPH氧化酶,由其介导产生的ROS在其侵袭上皮细胞时具有一定的作用。在一定浓度范围内,L. monocytogenes侵袭7721上皮细胞的能力呈现的趋势为随着细菌携带ROS水平的降低而升高。ROS对致病菌致病力一般有上调或是下调两种影响,根据细菌的种类不同影响程度也有所不同。Corcionivoschi等 [20]在研究ROS与空肠弯曲菌(致病力时发现,黏膜免疫过程中释放的ROS会扰乱磷酸酪氨酸信号,从而下调了该细菌的致病力)。Bao Gaihong等 [21]在研究硫色镰刀菌对马铃薯块茎造成干腐病的致病性时发现,该细菌的ROS过量生成以及消除ROS的相关还原性酶活力降低,使马铃薯块茎的细胞脂质过氧化且细胞膜失去完整性,是其侵袭和致病的机理之一。在益生菌方面,Lin等 [22]的研究发现对出生后肠道发育未成熟的小鼠使用鼠李糖乳杆菌灌胃可以明显降低感染性肠炎的发病率,其机理是该种益生菌可以使肠道上皮细胞局部的ROS产量增加,使与炎症信号产生相关的酶类被氧化后失活,大大降低炎症发生的概率。并且较高的ROS水平会对细菌本身的生长造成影响,但是环境中少量的ROS会激发细菌的防御体系,增殖减缓并非细菌本身受到杀伤,而可能是细菌的主动行为,目的是为了减少突变的发生和原发性损伤 [23],较小范围抑制ROS并不会对细菌的生长造成较大影响。
但是,由NADPH氧化酶介导产生的ROS并不是调控L. monocytogenes侵袭上皮细胞的唯一因素,已有研究 [24-25]表明在L. monocytogenes侵染进入各种上皮细胞的过程中,L. monocytogenes分泌的内化素A和B是起关键作用的毒力因子,通过与宿主细胞上的受体E-cadherin和Met分别配位,实现L. monocytogenes与宿主细胞间的相互识别。并且也有研究 [18]证实L. monocytogenes分泌的毒力因子RecA可以帮助L. monocytogenes抵御胃酸和胆汁的侵害,并能加速侵染肠道上皮细胞。L. monocytogenes作为致死率极高的胞内寄生菌,其跨越人体内肠道屏障的机制是其侵害人体的关键步骤。本实验表明,ROS对于L. monocytogenes进入上皮细胞是有影响的,从细菌内部的ROS入手,通过摸索菌的ROS水平及生长特性,调控ROS水平后进行侵袭实验。在改变ROS水平后,L. monocytogenes的侵袭能力发生了一定的变化,但是在细菌中ROS水平可能并不是完全由NADPH氧化酶所决定的,所以可能是ROS在L. monocytogenes侵袭上皮细胞的过程中起到了“信号分子”的作用。本研究是从细菌的ROS水平入手进行研究,在研究过程中,7721肝癌上皮肿瘤细胞本身的ROS水平具体的变化并未具体探明,是否在细胞ROS及细菌ROS之间存在一定的关系还需要进一步研究说明。但是,总体来说,本研究在2.1~2.3节结果稳定的条件下,精选细菌后调控了其ROS水平,在组分之间细胞水平一致的情况下,确实证明L. monocytogenes的ROS水平与L. monocytogenes对上皮细胞的侵袭有关联,随着ROS水平的降低,侵袭能力随之增加。
综上所述,L. monocytogenes中主要由NADPH氧化酶调控的ROS在被改变的情况下,L. monocytogenes侵袭上皮细胞的能力也有所改变,可能是作为一种信号分子而发挥作用。这一观点对研究L. monocytogenes如何在人体内对身体造成严重的危害提供了新思路,对于食源性致病菌L. monocytogenes的致病机理也有一定的探索,并且启发了对于其他食源性致病菌侵害人体的机理的研究,以便更好地控制食源性致病菌L. monocytogenes对人类健康造成的影响。
参考文献:
[1] NAKAMA A, MATSUDA M, ITOH T, et al. Molecular trying of Listera monocytogenes isolated in Japan by pulsed-field gelelectrophoresis[J]. Journal of Veterinary Medical Science, 1998, 60(6): 749-752.
[2] de AGUIRRE CARCER D, CUIV P O, WANG Tingting, et al. Morrison M: numerical ecology validates a biogeographical distribution and gender-based effect on mucosa-associated bacteria along the human colon[J]. Isme Journal, 2011, 5(5): 801-809.
[3] HOLCH A, GOTTLIEB C T, LARSEN M H, et al. Gram L: poor invasion of trophoblastic cells but normal plaque formation in fibroblastic cells despite actA deletion in a group of Listeria monocytogenes strains persisting in some food processing environments[J]. Applied and Environmental Microbiology, 2010, 76(10): 3391-3397.
[4] 王为黎, 马景红, 牟荣, 等. 食源性单核细胞增生李斯特菌的带染研究[J]. 中国医学理论与实践, 2002, 3002(4): 501-502.
[5] MEJLHOLM O, GUNVIG A, BORGGAARD C, et al. Dalgaard P: predicting growth rates and growth boundary of Listeria monocytogenes: an international validation study with focus on processed and ready-to-eat meat and seafood[J]. International Journal of Food Microbiology, 2010, 141(3): 137-150.
[6] 李爱华, 叶长芸. 单核细胞增生性李斯特菌致病相关机制的研究进展[J]. 疾病监测, 2011, 26(11): 914-919.
[7] 韩晓燕, 高丽萍, 刘箐. NOX家族蛋白的研究进展[J]. 生命科学, 2012, 24(6): 568-577.
[8] MOBARAK A M, BILLION A, MOHAMED W, et al. Adaptation of Listeria monocytogenes to oxidative and nitrosative stress in IFN-γ-activated macrophages[J]. International Journal of Medical Microbiology, 2011, 301(7): 547-555.
[9] AHNMAD P, SARWAT M, SHARMA S. Reactive oxygen species, antioxidants and signaling in plants[J]. Journal of Plant Biology, 2008, 51(3): 167-173.
[10] KRESLAVSKI V D, LOS D A, ALLAKHVERDIEV S I, et al. Signaling role of reactive oxygen species in plants under stress[J]. Russian Journal of Plant Physiology, 2012, 59(2): 141-154.
[11] MATSUNAGA Y, KAWAI Y, KOHDA Y, et al. Involvement of activation of NADPH oxidase and extracellular signal-regulated kinase(ERK) in renal cell injury induced by zinc[J]. The Journal of Toxicological Sciences, 2005, 30(2): 135-144.
[12] GONZÁLEZ-FLECHA B, DEMPLE B. Metabolic sources of hydrogen peroxide in aerobically growing Escherichia coli[J]. Journal of Biological Chemistry, 1995, 270(23): 13681-13687.
[13] SANTOS A L, GOMES N C, HENRIQUES I, et al. Contribution of reactive oxygen species to UV-B-induced damage in bacteria[J]. Journal of Photochemistry and Photobiology B Biology, 2012, 117(5): 40-46.
[14] SUBRAMANIAN M, GOSWAMI M, CHAKRABORTY S, et al. Resveratrol induced inhibition of Escherichia coli proceeds via membrane oxidation and independent of diffusible reactive oxygen species generation[J]. Redox Biology, 2014, 2: 865-872.
[15] LAM G Y, FATTOUH R, MUISE A M, et al. Listeriolysin O suppresses phospholipase C-mediated activation of the microbicidal NADPH oxidase to promote Listeria monocytogenes infection[J]. Cell Host Microbe, 2011, 10(6): 627-634.
[16] ADOLPH S, SCHOENIGER A, FUHRMANN H, et al. Unsaturated fatty acids as modulators of macrophage respiratory burst in the immune response against Rhodococcus equi and Pseudomonas aeruginosa[J]. Free Radical Biology Medicine, 2012, 52(11/12): 2246-2253.
[17] 冯飞飞, 张强, 王莉, 等.毒力基因调控蛋白PrfA促进单核细胞增生李斯特菌生物被膜的形成[J]. 微生学通报, 2011, 38(9): 1450-1457
[18] van der VEEN S, ABEE T. Contribution of Listeria monocytogenes RecA to acid and bile survival and invasion of human intestinal Caco-2 cells[J]. International Journal of Medical Microbiology, 2011, 301(4): 334-340.
[19] WILBER Q T, DANESH C, ARTHEE J, et al. Nontoxic radioactive Listeria at is a highly effective therapy against metastatic pancreatic cancer[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(21): 8668-8673.
[20] CORCIONIVOSCHI N, ALVAREZ L A, SHARP T H, et al. Mucosal reactive oxygen species decrease virulence by disrupting Campylobacter jejuni phosphotyrosine signaling[J]. Cell Host Microbe, 2012, 12(1): 47-59.
[21] BAO Gaihong, BI Yang, LI Yongcai, et al. Overproduction of reactive oxygen species involved in the pathogenicity of Fusarium in potato tubers[J]. Physiological and Molecular Plant Pathology, 2014, 86: 35-42.
[22] LIN P W, MYERS L E, RAY L, et al. Lactobacillus rhamnosus blocks inflammatory signaling in vivo via reactive oxygen species generation[J]. Free Radical Biology Medicine, 2009, 47(8): 1205-1211.
[23] HAN Xuelin, YU Rentao, JI Lei, et al. InlB-mediated Listeria monocytogenes internalization requires a balanced phospholipase D activity maintained through phospho-cofilin[J]. Molecular Microbiology, 2011, 81(4): 860-880.
[24] YESILKAYA H, ANDISI V F, ANDREW P W, et al. Streptococcus pneumoniae and reactive oxygen species: an unusual approach to living with radicals[J]. Trends Microbiology, 2013, 21(4): 187-195.
[25] GRUNDLER T, QUEDNAU N, STUMP C, et al. The surface proteins InlA and InlB are interdependently required for polar basolateral invasion by Listeria monocytogenes in a human model of the bloodcerebrospinal fluid barrier[J]. Microbes and Infection, 2013, 15(4): 291-301.
Effect of Reactive Oxygen Species (ROS) on the Invasion of Listeria monocytogenes to 7721 Epithelial Cells
CHEN Guowei, WU Man, ZHANG Chao, LIU Wukang, DING Chengchao, WU Shuyan, LI Sen*, LIU Qing*
(School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China)
Abstract:Diphenyleneiodonium chloride (DPI), which can inhibit the activity of NADPH oxidase and reduce endogenous reactive oxygen species (ROS), was used to reduce the generation of ROS in Listeria monocytogenes, which was then allowed to invade 7721 epithelial cells of human hepatocellular carcinoma. The results showed that the endogenous ROS in L. monocytogenes was markedly decreased in the presence of DPI in a concentration-dependent way. Within the DPI concentration range of 1-10 μmol/L, as the level of ROS in reduced, its ability to invade 7721 epithelial cells increased. This illustrates that L. monocytogenes may have a NADPH oxidase similar to that of higher plants and animals, which is responsible for the production of ROS and regulates the invasion ability possibly by mediating ROS production, suggesting that NADPH oxidase may be an important signal molecule for L. monocytogenes to invade 7721 epithelial cells.
Key words:Listeria monocytogenes; reactive oxygen species (ROS); invasion; epithelial cells
中图分类号:Q932
文献标志码:A
文章编号:1002-6630(2015)21-0117-06
doi:10.7506/spkx1002-6630-201521023
收稿日期:2014-12-31
基金项目:国家自然科学基金面上项目(31371776)
作者简介:陈国薇(1989—),女,博士研究生,研究方向为食源性致病菌致病机理。E-mail:vickey5895@126.com
*通信作者:李森(1982—),女,讲师,博士,研究方向为食源性致病菌治病机理。E-mail:lisen_1027@126.com
刘箐(1970—),男,教授,博士,研究方向为食源性致病菌致病机理及安全控制。E-mail:liuq@usst.edu.cn