郭自涛,张 梁 *,李由然,李 赢,顾正华,丁重阳,石贵阳
(粮食发酵工艺与技术国家工程实验室,江南大学生物工程学院,江苏 无锡 214122)
摘 要:目的:利用基因重组技术,构建腺苷酸脱氨酶高效表达的重组菌株。方法:以前期构建的产腺苷酸脱氨酶重组大肠杆菌BL21(DE3)/pET28α-AMPD中来源于鼠灰链霉菌(Streptomyces murinus)目的基因为模板,设计特异性引物扩增腺苷酸脱氨酶基因,亚克隆至游离型表达载体pHY-WZX,转化枯草芽孢杆菌WB600。结果:成功筛选获得了一株产腺苷酸脱氨酶重组枯草芽孢杆菌WB600/pHY-AMPD,进一步在摇瓶中探究了发酵培养基成分对重组酶发酵的影响。获得了较优发酵培养基为:葡萄糖10 g/L、 酵母膏30 g/L、CaCl 20.5 g/L、柠檬酸三钠1 g/L、NaH 2PO 410 g/L、K 2HPO 410 g/L、(NH 4) 2SO 45 g/L,37 ℃、200 r/min发酵60 h摇瓶发酵液酶活力可达到(2 230±50) U/mL。结论:本研究实现了鼠灰链霉菌来源的腺苷酸脱氨酶基因在枯草芽孢杆菌中表达。
关键词:腺苷酸脱氨酶;鼠灰链霉菌;枯草芽孢杆菌;重组表达
腺苷酸脱氨酶(adenosine deaminase,AMPD,EC 3.4.5.6)广泛存在于各种生物体内,包括微生物、动物以及人体内,它在真核生物能量代谢中起着非常重要的作用 [1]。腺苷酸脱氨酶是一种氨基水解酶,在嘌呤代谢循环中起着至关重要的作用。在一定反应条件下,它能催化腺苷酸脱去氨基产生肌苷酸(inosinic acid,IMP)和NH 3 [2],IMP是一种在核糖核酸(RNA)中发现的核苷酸,可用作食品调味剂和药品。其二钠盐与谷氨酸钠(味精)混合使用,呈味作用比单用味精高数倍,有“强力味精”之称;在医药方面,适用于各种原因引起的白细胞减少症、血小板减少症、各种心脏疾患、急性及慢性肝炎、肝硬化等,此外尚可治疗中心视网膜炎、视神经萎缩等。
伴随着食品、医药等领域的不断发展,人类对腺苷酸脱氨酶需求量不断增大。早期主要应用哺乳动物细胞进行生产腺苷酸脱氨酶,不仅生产工艺复杂,生产成本高,而且效率低,产量不高,不能满足需求。目前,工业生产腺苷酸脱氨酶通常使用微生物进行固态或液态发酵,所使用的微生物多数为经过筛选得到的可产生腺苷酸脱氨酶的野生菌株,如蜂蜜曲霉 [3]、米曲霉 [4-5]、酵母 [6]等,但是酶活性普遍较低。例如,普为民等 [7]从青霉和曲霉中筛选到一株产AMPD的蜂蜜曲霉,通过紫外诱变处理和优化后,该菌所产的脱氨酶活性达到1 300 U/mL。梅光明等 [8]从自然发酵乳中筛选出AMPD活性最高的菌株进行初步鉴定,结果为毛霉菌属,经发酵优化后,酶活力达到472.3 U/mL。王普行等 [9]从曲霉菌中筛选到一株产AMPD较高的菌株,对其发酵培养基以及发酵条件进行研究后,该菌株酶活力为600 U/mL。同时,在生产过程中存在诸多问题,如固态发酵过程中发酵培养基中的蛋白质、色素等物质混入酶液,造成酶的提取纯化工艺复杂,生产成本增加;液态发酵时酶活力提高困难和发酵稳定性问题等。目前,国内外使用基因重组技术构建重组菌株进行生产方面的研究较少,公开的报道主要由日本天野酶株式会社 [10]和江南大学发布的专利 [11-13]。利用基因重组技术,寻找合适的微生物来源的AMPD基因以及合适的表达体系,从而获得AMPD高效表达,具有十分重要的学术意义和应用价值。
1.1 材料
1.1.1 菌株和质粒
菌株:枯草芽孢杆菌(Bacillus subtilis)WB600/ pHY-WZX,产腺苷酸脱氨酶重组大肠杆菌(Escherichia coli)BL21(DE3)/pET28α-AMPD,腺苷酸脱氨酶基因来源于鼠灰链霉菌(Streptomyces murinus)(菌种保藏号:MCCC 1A01641),为江南大学国家工程实验室构建和保藏。
质粒:pHY-WZX,为江南大学国家工程实验室构建和保藏。
1.1.2 培养基
种子培养基:胰蛋白胨10 g/L、酵母提取物5 g/L、NaCl 10 g/L、四环素0.03 g/L,蒸馏水1 L,115 ℃灭菌20 min。
初始发酵培养基:麦芽糊精10 g/L、棉籽粉40 g/L、NaH 2PO 410 g/L、K 2HPO 410 g/L、柠檬酸三钠2 g/L、(NH 4) 2SO 45 g/L、CaCl 20.5 g/L、四环素0.03 g/L,蒸馏水1 L,115 ℃灭菌20 min。
1.1.3 试剂
Taq DNA聚合酶、限制性内切酶 加拿大Fermentas公司;酵母膏、胰蛋白胨、腺苷酸(5’-AMP) 美国Sigma公司;质粒小量提取试剂盒、DNA片段纯化试剂盒、胶回收试剂盒 北京博大泰克生物技术公司;Ex Taq DNA聚合酶 日本TaKaRa公司;四环素、溶菌酶与RNase 生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯。
1.2 AMPD基因的克隆
以美国国立生物技术信息中心(National Center of Biotechnology Information,NCBI)报道的鼠灰链霉菌(Streptomyces murinus)AMPD基因为模板,设计聚合酶链式反应(polymerase chain reaction,PCR)引物:前端序列EcoRI:5’-TTAGAATTCGCGCCGCCGCCCCGGC AGGC-3’,末端序列KpnI:5’-TTAGGTACCTCACCCCC GGGCGTGCGCCC-3’(下划线为EcoRⅠ和KpnⅠ酶切位点)。
以已构建好的E. coli BL21(DE3)/pET28-AMPD的染色体为模板,以SE up EcoRⅠ,SE up KpnⅠ为引物进行PCR扩增。PCR扩增体系为:模板4 µL,2×GC buffer 50 µL,上下游引物各2 µL,Ex Taq 1 µL,dNTPmix 10 µL,灭菌的ddh 2O 31 µL。PCR扩增条件为:96 ℃预变性5 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸100 s,30 个循环;72 ℃延伸10 min。琼脂糖凝胶电泳进行结果分析。PCR产物通过纯化试剂盒纯化后用于表达质粒的构建。
1.3 枯草芽孢杆菌WB600感受态制备
参照方炜 [14]方法制备。
1.4 重组枯草芽孢杆菌表达质粒的构建
将经过EcoRⅠ-KpnⅠ线性化的载体pHY-WZX与经EcoRⅠ-KpnⅠ消化的PCR基因片段用纯化试剂盒纯化后,按照质量比1∶10的比例加入10 µL体系,于16 ℃培养箱连接过夜。向刚准备好的枯草芽孢杆菌wB600感受态中加入适量的质粒,轻轻混匀于37 ℃、200 r/min摇床培养2.5 h。以5 000 r/min离心3 min收集菌体,弃部分上清后留100 µL重悬菌体,涂布含有四环素的LB培养基平板,37 ℃过夜培养10 h。挑取转化子用SE up EcoRⅠ/SE down KpnⅠ为引物进行菌落PCR,挑取菌落PCR正确的转化子提取质粒,用EcoRⅠ-KpnⅠ酶切验证目的基因的大小。
1.5 AMPD酶活力测定 [15-16]
准确称取13.9 mg腺苷酸溶于1 mL 0.08 mol/L的NaHCO 3溶液中作为原始底物,然后用399 mL的0.1 mol/L琥珀酸-NaOH缓冲液(pH 5.9)将其稀释400 倍,最终得到终浓度为0.1×10 -3mol/L的反应底物。移取3 mL反应底物在35 ℃保温5 min,加入预稀释的AMP脱氨酶酶液0.1 mL,立刻计时反应15 min,15 min后加入3 mL 10 g/100 mL的过氯酸溶液终止反应。
对照组实验方法同上,反应底物保温后用冰水预冷,加过氯酸溶液后再加酶液。反应结束后,在265 nm波长处,用光程10 mm的石英比色皿,以水为参比测量吸光度。
酶活力单位定义:在上述条件下每分钟吸光度改变0.001,定义为一个酶活力单位。计算公式为:
式中:ΔA 265 nm为反应液与对照吸光度的差值;K为粗酶液的稀释倍数;t为酶反应时间/min。
1.6 重组菌生长曲线的测定
从平板上挑取重组枯草芽孢杆菌单菌落接种于装有50 mL的含有四环素终质量浓度30 μg/mL的LB培养基中,37 ℃、200 r/min过夜培养。之后,以10%的接种量接种于若干装有50 mL的含有四环素的LB培养基中,37 ℃、200 r/min振荡培养,每隔2 h取样测OD 600 nm值。以时间为横坐标,OD 600 nm为纵坐标作图。
1.7 重组蛋白的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析
将筛选得到的阳性枯草芽孢杆菌重组子WB600/pHYAMPD以及枯草芽孢杆菌WB600/pHY-WZX接种于50 mL LB液体培养基中,37 ℃、200 r/min培养24 h,然后取发酵上清进行SDS-PAGE分析。
1.8 重组枯草芽孢杆菌摇瓶发酵研究 [17-20]
1.8.1 考察不同碳源对重组菌发酵的影响
分别以葡萄糖、蔗糖、麦芽糖、乳糖、甘油、麦芽糊精各10 g/L为碳源对重组菌进行摇瓶发酵。
1.8.2 考察不同氮源对重组菌发酵的影响
确定碳源后,分别以40 g/L的鱼粉蛋白胨、酵母膏、玉米浆、牛肉膏、硫酸铵、鱼粉蛋白胨+酵母膏(质量比1∶1)复合氮源替代初始发酵培养基中棉籽粉为氮源进行摇瓶发酵。
1.8.3 考察不同金属离子对重组菌发酵的影响
在确定碳源和氮源的基础上,分别向培养基中添加0.5 g/L的CaCl 2、FeSO 4·7H 2O、ZnSO 4、MgSO 4·7H 2O、MnSO 4、CuSO 4,以不添加任何其他金属离子的培养基为空白对照进行摇瓶发酵。
1.8.4 考察不同质量浓度柠檬酸盐对重组菌发酵的影响
分别向培养基中加入质量浓度分别为1.0、1.5、2.0、2.5、3.0 g/L的柠檬酸三钠,以不加柠檬酸三钠的培养基为空白对照进行摇瓶发酵实验。
1.8.5 正交试验优化 [21-23]
通过以上4 种培养基成分的探究,为了选择出一个最佳的培养基组合,进行了四因素三水平的正交试验。
2.1 产AMPD重组枯草芽孢杆菌的构建与表达
2.1.1 AMPD基因的克隆与分析
扩增片段的琼脂糖凝胶电泳图如图1所示,在1 100~1 700 bp中间部分有单一的扩增片段,与目的基因片段大小(1 476 bp)基本一致。
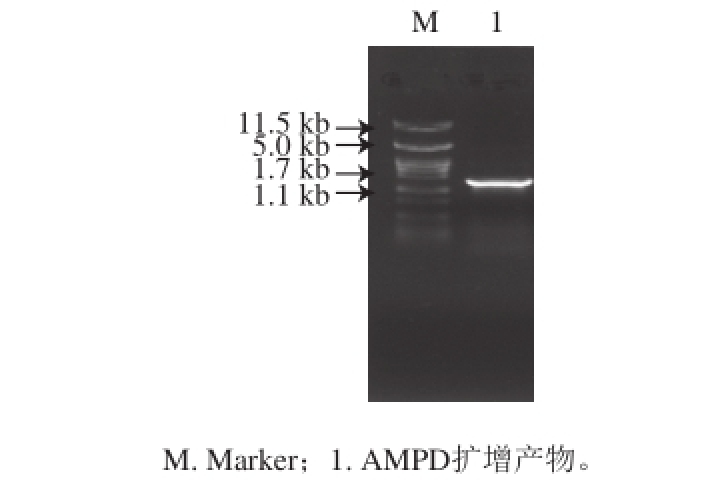
的PCR扩增结果
Fig.1 PCR product of the AMPD gene
图1 AMPD 基因
2.1.2 重组表达质粒的构建与验证
挑取阳性克隆菌的质粒经EcoRⅠ-KpnⅠ酶切验证,如图2所示,pHY-WZX质粒大小为6 702 bp,目的基因片段为1 476 bp,结果表明目的片段已经成功插入到pHY-WZX质粒中。
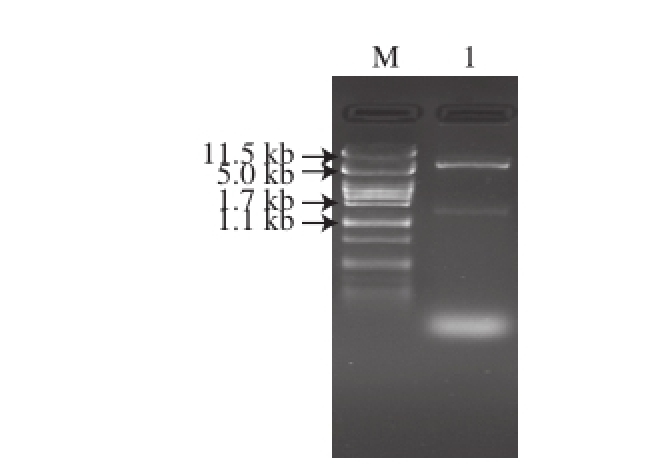
Ⅰ酶切验证结果
Fig.2 Restriction enzyme digestion of the recombinant vector pHY-AMPD by EcoRI-KpnI
图2 pHY-AMPD用EcoRⅠ-Kpn
M. Marker;1. 重组载体pHY-AMPD双酶切片段。
2.1.3 重组枯草芽孢杆菌表达产物的SDS-PAGE分析
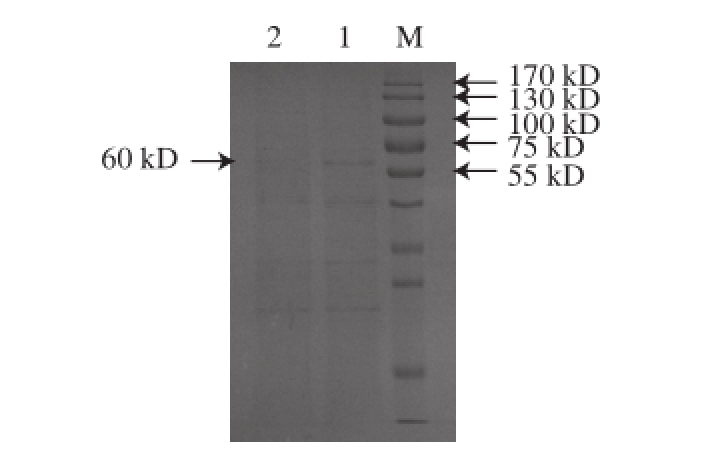
图 3Bacillus subtilis /pHY-AMPD的SDS-PAGE蛋白电泳分析结果
Fig.3 SDS-PAGE of pHY-AMPD Bacillus subtilis
M. Marker;1. WB600/pHY-AMPD;2. WB600/pHY。
如图3所示,转化子的发酵上清液在60 kD出现一条明显的条带,而对照菌株(Bacillus subtilis WB600/pHY)在该处没有条带。该条带的分子质量与日本专利文献[7]报道中的大小相吻合,说明目的基因已经得到了表达。
2.1.4 重组菌生长曲线
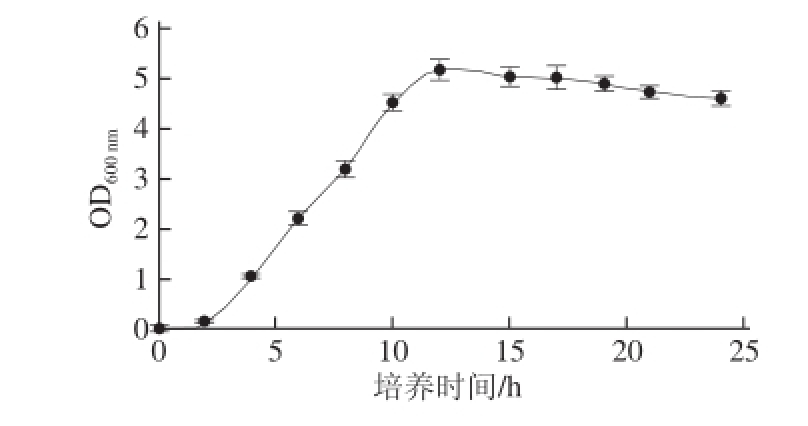
图4 重组枯草芽孢杆菌WB600/pHY-AMPD生长曲线
Fig.4 The gorwth curve of recombinant Bacillus subtilis WB600/pHY-AMPD
如图4所示,0~2 h为适应期,2~12 h为对数生长期,12~17 h为稳定期,17~24 h菌体逐渐衰亡。
2.2 重组菌摇瓶发酵培养基成分的优化
2.2.1 培养基碳源的优化
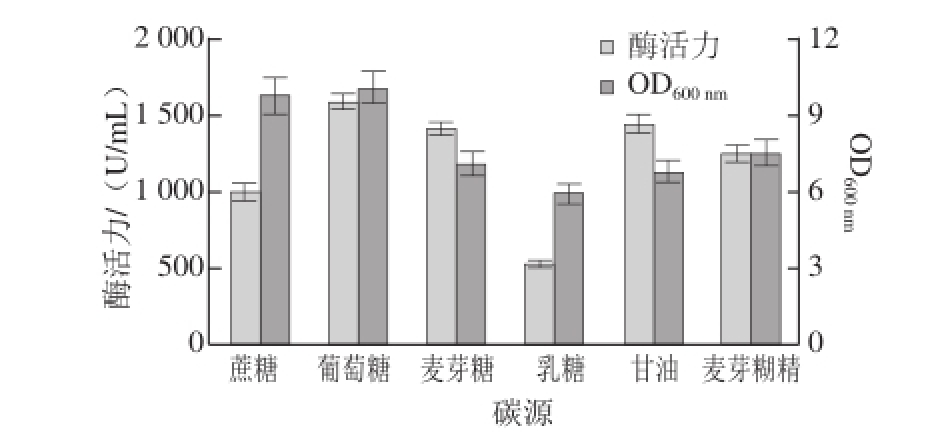
图5 不同碳源对菌体生长和酶活力的影响
Fig.5 Effect of different carbon sources on the growth and AMP deaminase activity of recombinant strain
由图5可知,各种碳源对重组菌的酶活力影响较大。其中以葡萄糖为碳源时,目标菌的酶活力水平最高,超过了1 500 U/mL。而以麦芽糊精为碳源的基础发酵培养基酶活力为1 240 U/mL。说明在所有碳源中,葡萄糖是最有利于目标菌的产酶。同时,葡萄糖与蔗糖对细胞的生长均有明显的促进作用,但蔗糖对目标菌的产酶相对较低。因此,培养基的碳源选择葡萄糖。
2.2.2 培养基氮源的优化
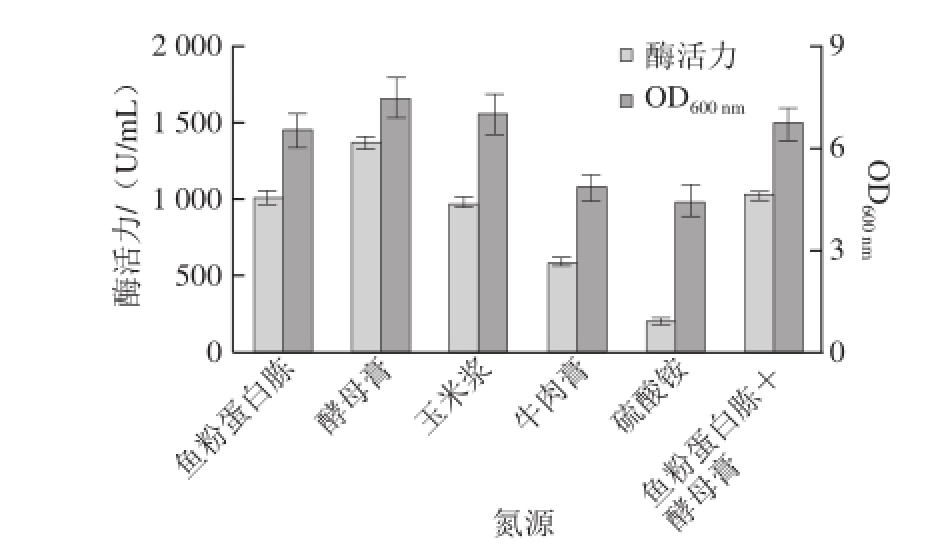
图6 不同氮源对菌体生长和酶活力的影响
Fig.6 Effect of different nitrogen sources on the growth and AMP deaminase activity of recombinant strain
如图6所示,无机氮源产酶能力较低且菌体生长相对较差;有机氮源更有利于促进产酶和菌体的生长。在有机氮源中,酵母膏相对来说能够更好地促进该重组菌的生长和产酶。因此,选取酵母膏作为氮源。
2.2.3 培养基金属离子的优化

图7 不同金属离子对菌体生长和酶活力的影响
Fig.7 Effect of different metal ions on the growth and AMP deaminase activity of recombinant strain
如图7所示,在0.5 g/L的质量浓度下,Ca 2+对细胞生长及产酶有较大的促进作用,而其他的金属离子则没有表现出对目标菌的生长及产酶很好的促进作用,甚至出现了一定程度的抑制作用。而当培养基中加入Cu 2+时,尽管OD 600 nm值很高,但是酶活水平却很低,而酶活水平又与细胞量成正相关。因此,可能的原因是:Cu 2+抑制了酶与底物的反应,或者Cu 2+抑制了细胞的产酶过程。
2.2.4 柠檬酸盐质量浓度的优化

图8 不同质量浓度柠檬酸盐对菌体生长和酶活力的影响
Fig.8 Effect of citrate concentration on the growth and AMP deaminase activity of recombinant strain
由图8可知,在实验选定的柠檬酸盐质量浓度范围内,与空白对照组相比,细胞的生长量及酶的产量均有一定程度的提高,此结果说明,柠檬酸对目标菌的生长及产酶是有促进作用的。当柠檬酸盐质量浓度为2 g/L时产酶活力最高,比不添加柠檬酸盐时酶活力提高了78.8%。
2.2.5 正交试验优化培养基配方
由表1可知,最优的培养基组合方案为:葡萄糖10 g/L、酵母膏30 g/L、CaCl 20.5 g/L、柠檬酸三钠1.0 g/L。在该培养基组合下,酶活力最高可达2 100 U/mL,相对于初始发酵培养基的酶活力(1 240 U/mL),提高了近70%。
根据正交试验得出的最优培养基组合,进行对试验结果的验证实验,以验证该最优培养基是否能使目标菌达到菌体生长量及酶活力水平都有较大地提高。该验证实验中,最高酶活力在2 230 U/mL,最高OD 600 nm值可达到8.0,说明正交试验得到的结论是有效的。
表1 培养基配方的正交试验设计方案及结果
Table 1 Orthogonal array design with experimental results for optimizing medium components
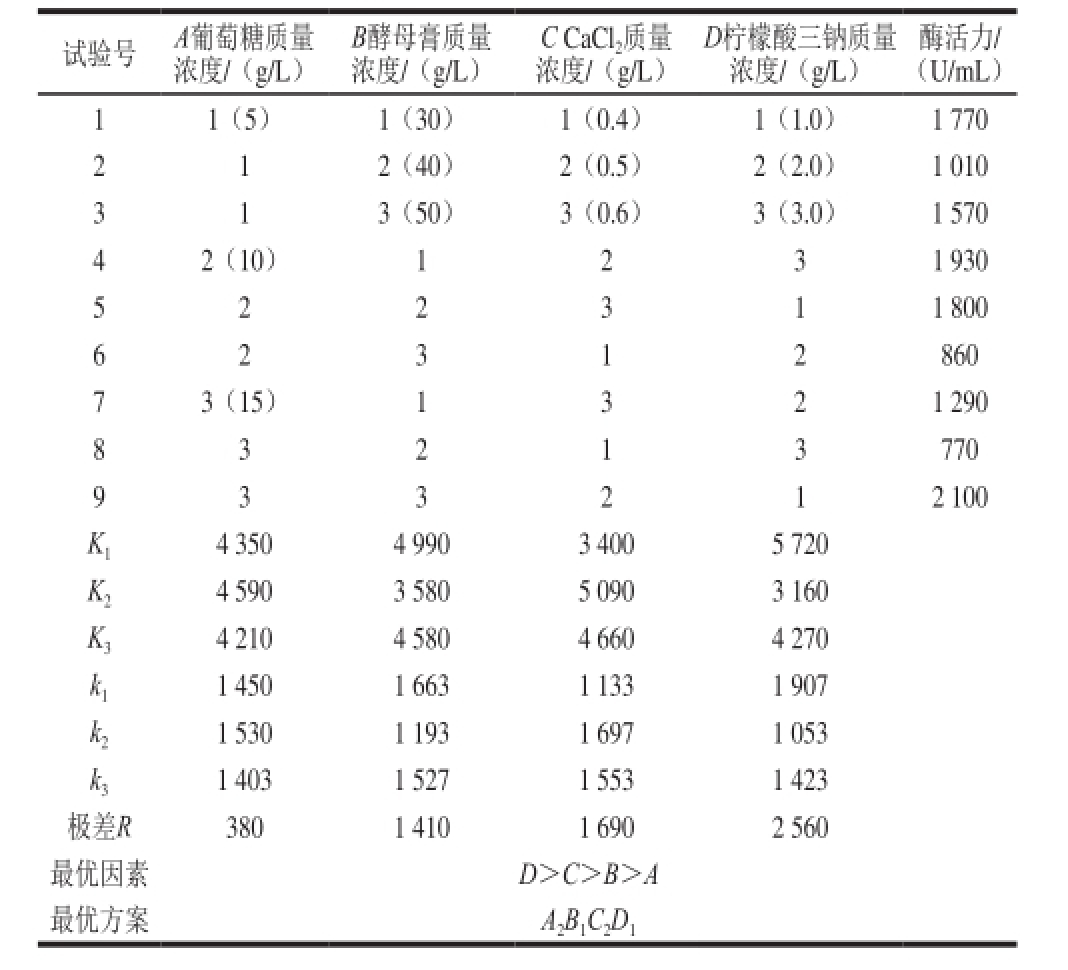
试验号A葡萄糖质量浓度/(g/L)酶活力/(U/mL)11(5)1(30)1(0.4)1(1.0)1 770 2 1 2(40)2(0.5)2(2.0)1 010 3 13(50)3(0.6)3(3.0)1 570 42(10)1231 930 5 2 2 3 11 800 B酵母膏质量浓度/(g/L)C CaCl 2质量浓度/(g/L)D柠檬酸三钠质量浓度/(g/L)6 860 73(15)1321 290 8 3 2 1 3 770 2 3 1 2 12 100 K 14 3504 9903 4005 720 K 24 5903 5805 0903 160 K 34 2104 5804 6604 270 k 11 4501 6631 1331 907 k 21 5301 1931 6971 053 k 31 4031 5271 5531 423极差R3801 4101 6902 560最优因素D>C>B>A最优方案A 2B 1C 2D 19 3 3 2
本实验通过基因重组技术,成功地将来源于鼠灰链霉菌的目的基因通过克隆构建载体,转化枯草芽孢杆菌进行表达;利用单因素和正交试验对重组枯草芽孢杆菌摇瓶发酵培养基成分进行了研究,确定了较优培养基组成,最高酶活力可达(2 230±50) U/mL,约为原始菌株鼠灰链霉菌AMPD表达水平的3.7 倍(原始菌株酶活力约为600 U/mL)。利用基因重组技术构建重组菌生产的酶的活性明显优于野生菌株,更能够满足AMPD未来在行业内的需求。
本实验实现了鼠灰链霉菌来源的AMPD在枯草芽孢杆菌中的表达,该研究对国内通过基因重组技术生产AMPD具有一定的指导意义,但是距离工业化应用的要求还有一定的差距。后续工作将着重于生产放大工艺的研究,以期通过研究提高酶活水平,为AMPD的工业化生产提供参考。
参考文献:
[1] MAHNKE-ZIZELMAN D K, SABINA R L. N-terminal sequence and distal histidine residues are responsible for pH-regulated cytoplasmic membrane binding of human AMP deaminase isoform[J]. Journal of Biological Chemistry, 2002, 277(45): 42654-42662.
[2] MERKLER D J, WALI A S. AMP deaminase from yeast. Role in AMP degradation, large scale purification, and properties of the native and proteolyzed enzyme[J]. Journal of Biological Chemistry, 1989, 35: 21422-21430.
[3] 刘春剑, 王玉宇, 雷华, 等. 蜂蜜曲霉产AMP脱氨酶菌株的选育及固态发酵培养基的优化[J]. 食品科技, 2014, 39(6): 2-6.
[4] 段作营, 刘军昌, 毛忠贵, 等. 米曲霉腺苷酸脱氨酶的产酶条件[J].无锡轻工大学学报, 2002, 21(5): 472-476.
[5] 刘军昌, 段作营, 沈梅生, 等. 固态发酵生产腺苷酸脱氨酶[J]. 工业微生物, 2002, 32(1): 36-39.
[6] 方炜, 张梁, 顾正华, 等. 用GAP启动子在Pichia pastoris GS115中组成型表达鼠灰链霉菌腺苷酸脱氨酶[J]. 微生物学通报, 2014(10): 2022-2028.
[7] 普为民, 丁骅孙, 陶元器. 5’-腺苷酸脱氨酶产生菌选育及发酵生态学研究[J]. 云南大学学报, 1994, 16(2): 184-188.
[8] 梅光明, 郭远明, 饶胜其, 等. 源于自然发酵腐乳中5’-AMP脱氨酶高产菌株的筛选[J]. 中国酿造, 2013, 32(8): 30-34.
[9] 王普行, 许惟治, 厉雪君, 等. 双酶法呈味核苷酸的研制高产腺嘌呤核苷酸脱氨酶菌种筛选、酶的形成及其作用条件的研究[J]. 上海调味品, 1989(4): 8-11.
[10] 天野酶株式会社. 放线菌来源的AMP脱氨酶及其应用: 中国, 200580013789.3[P]. 2007-04-18.
[11] 江南大学. 鼠灰链霉菌AMP脱氨酶基因的原核表达方法及其表达产物的应用: 中国, 201410039809.5[P]. [2014-05-07].
[12] 江南大学. 鼠灰链霉菌AMP脱氨酶基因的乳酸克鲁维酵母真核表达方法: 中国, 201410040528.1[P]. [2014-04-30].
[13] 江南大学. 鼠灰链霉菌AMP脱氨酶基因的毕赤酵母真核表达方法:中国, 201410042060.X[P]. [2014-05-21].
[14] 方炜. 腺苷酸脱氨酶基因的克隆与重组表达[D]. 无锡: 江南大学, 2014.
[15] 何战胜, 邓健, 许金生, 等. 催化光度法测定体液腺苷脱氨酶的活性[J].中国卫生检验杂志, 2005, 15(5): 546-547.
[16] 刘军昌, 段作营, 毛忠贵. AMP脱氨酶活性测定的一种改进方法[J].食品与发酵工业, 2000, 27(7): 30-33.
[17] 洒荣波, 石贵阳, 王正祥. 基因工程菌Pichia pastoris高密度培养条件的摇瓶研究[J]. 食品研究与开发, 2005, 26(2): 52-57.
[18] 杨尚彤, 肖安风, 倪辉, 等. 枯草芽孢杆菌JMUKC2产肌苷摇瓶发酵培养基优化[J]. 食品科学, 2012, 33(11): 167-171.
[19] 焦龙, 于宏伟, 郭润芳, 等. 毕赤酵母工程菌pk53产纤溶酶发酵条件的优化[J]. 食品与发酵工业, 2011, 37(3): 94-98.
[20] 刘逸寒, 薄嘉鑫, 王亚品, 等. 枯草芽孢杆菌工程菌株产普鲁兰酶发酵条件的优化[J]. 食品研究与开发, 2012, 33(7): 136-139.
[21] 张路路, 朱朝华, 郭刚, 等. 苏云金芽孢杆菌A322菌株发酵培养基和发酵条件的优化[J]. 热带生物学报, 2014, 5(3): 253-259.
[22] 董婷, 周志江, 韩烨. 乳酸片球菌PA003发酵培养基及发酵条件的优化[J]. 食品工业科技, 2014, 35(14): 192-196.
[23] 韩德权, 许永君, 吴桐, 等. 多菌复合酸菜发酵剂工业化培养基的优化[J]. 食品工业科技, 2012, 33(14): 179-182.
Expression of Adenosine Deaminase in Recombinant Bacillus subtilis
GUO Zitao, ZHANG Liang*, LI Youran, LI Ying, GU Zhenghua, DING Zhongyang, SHI Guiyang
(National Engineering Laboratory for Cereal Fermentation Technology, College of Biological Engineering, Jiangnan University, Wuxi 214122, China)
Abstract:Objective: To construct a recombinant strain to express adenosine deaminase (AMPD) efficiently. Methods: The AMPD gene from Streptomyces murinus was expressed in E. coli DE3/pET28α-AMPD. Specific primers were designed to amplify the AMPD gene. The PCR product was cloned into the plasmid pHY-WZX, and the recombinant plasmid was transformed into Bacillus subtilis WB600. Results: The recombinant Bacillus subtilis WB600/pHY-AMPD was successfully constructed to express AMPD. Furthermore, the fermentation medium was optimized to contain 10 g/L glucose, 30 g/L yeast extract, 0.5 g/L CaCl 2, 1 g/L sodium citrate, 10 g/L NaH 2PO 4, 10 g/L K 2HPO 4, and 0.5 g/L (NH 4) 2SO 4. The enzyme activity reached (2 230 ± 50) U/mL after shake flask cultivation at 37 ℃ for 60 h with a shaking speed of 200 r/min. Conclusion: The AMPD gene from Streptomyces murinus has been successfully expressed in Bacillus subtilis.
Key words:adenosine deaminase; Streptomyces murinus; Bacillus subtilis; recombinant expression
中图分类号:Q815
文献标志码:A
文章编号:1002-6630(2015)21-0135-05
doi:10.7506/spkx1002-6630-201521026
收稿日期:2014-11-26
基金项目:国家高技术研究发展计划(863计划)项目(2011AA100905);教育部“新世纪优秀人才支持计划”项目(NCET-11-0665);
江南大学食品科学与技术国家重点实验室自由探索课题(SKLF-ZZA-201201)
作者简介:郭自涛(1987—),男,硕士研究生,研究方向为发酵过程工程。E-mail:hnpygzt@163.com
*通信作者:张梁(1978—),男,教授,博士,研究方向为酶工程与技术和农业益生菌。E-mail:zhangl@jiangnan.edu.cn