 )和标准差(s),以
)和标准差(s),以
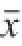 ±s从标准曲线中找到该相应值的最低浓度,即为方法的检测限(limit of detection,LOD)。根据标准曲线的线性范围确定定量限(limit of quantity,LOQ),并确定该方法的线性相关性。
±s从标准曲线中找到该相应值的最低浓度,即为方法的检测限(limit of detection,LOD)。根据标准曲线的线性范围确定定量限(limit of quantity,LOQ),并确定该方法的线性相关性。
甄玉萍,裴世春 *,高建伟,王 岩,蒋媛媛
(齐齐哈尔大学食品与生物工程学院,黑龙江 齐齐哈尔 161006)
摘 要:研究不同培养条件对禾谷镰刀菌(Fusarium graminearum)产玉米赤霉烯酮(zearalenone,ZEN)能力的影响。选取不同的培养基配比、培养时间、培养温度、摇床转速及光暗反应对禾谷镰刀菌进行培养。在单因素试验的基础上,分别采用正交试验设计和响应面设计的方法进行统计学分析。结果表明:禾谷镰刀菌的最适培养基为每升超纯水含葡萄糖60 g、KNO 3 1.5 g、酵母浸出膏1.0 g、蛋白胨20 g、NaNO 36.0 g、MgSO 40.5 g、K 2HPO 4·3H 2O 1.0 g、KCl 0.5 g、Fe 2(SO 4) 30.025 g;当摇床转速为92 r/min、照明时间为10 h/d、培养温度为22.9 ℃时,20 d毒素质量浓度可达到249.80 μg/L。
关键词:禾谷镰刀菌;玉米赤霉烯酮;酶联免疫吸附分析法;真菌毒素
禾谷镰刀菌(Fusarium graminearum)是禾本科作物的重要病原菌之一 [1-3],中国北方地区的谷物均受到其不同程度的污染 [4-7]。同时,禾谷镰刀菌在侵染过程中会产生对人体和动物有害的玉米赤霉烯酮(zearalenone,ZEN)等真菌毒素 [8-9]。现今国内外诸多研究者都在致力于玉米赤霉烯酮的检测及其在生物和化学领域脱毒及拮抗性的研究 [10-11],使得该毒素的需求越来越大。但现阶段,国内没有专门生产高纯度玉米赤霉烯酮毒素的机构,国内研究者所使用的玉米赤霉烯酮标准品多数来自国外进口,不仅购买价格昂贵,而且进口程序复杂,这为国内真菌毒素研究带来诸多不便。因此,为了促进玉米赤霉烯酮生产的国产化进程,有必要开展不同培养条件对禾谷镰刀菌产玉米赤霉烯酮能力的影响研究。
1.1 材料与试剂
葡萄糖、K 2HPO 4·3H 2O、蛋白胨、NaNO 3、酵母浸出膏、Fe 2(SO 4) 3、KCl、MgSO 4均为分析纯 天津市光复科技发展有限公司;110250 5B-05-3-3禾谷镰刀菌标准菌株(Fusarium boothii) 荷兰汉福生物科技公司;玉米赤霉烯酮标准品、吐温-20、3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB) 美国Sigma公司;玉米赤烯酮BSA抗原 北京中科汇文遗传技术发展中心;山羊抗小鼠IgG/辣根酶标记 北京中杉金桥生物技术有限公司;抗玉米赤霉烯酮抗体 实验室自行制备。
1.2 仪器与设备
HZQ-Q全温振荡器 哈尔滨市东联电子技术开发有限公司;ZHJH-C1109B超净工作台 上海智城分析仪器制造有限公司;VICTOR X4多功能酶标仪、Wahser400 96孔洗板机 美国GE公司;SHP-250生化培养箱 上海森信实验仪器有限公司;MILLIPOREPEFERENCE超纯水系统 美国密理博公司;FA1004N电子天平 上海菁海仪器有限公司。
1.3 方法
1.3.1 ZEN的添加回收率及酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)方法的检出限
随机抽取10 个新配制的液体培养基,将每个培养基平均分为3 份,在每组培养基中分别添加1 mL标准ZEN溶液,质量浓度为5、50、500 µg/L,分别采用ELISA方法
[12]和超高压液相色谱质谱-串联质谱(ultra-performance liquid chromatography-mass spectrometry,UPLC-MS)法
[13-18]进行检测,多次重复该实验。对ELISA方法进行检测限及灵敏度的分析
[19]:计算10 个阴性孔OD
450
nm的平均值(
 )和标准差(s),以
)和标准差(s),以
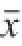 ±s从标准曲线中找到该相应值的最低浓度,即为方法的检测限(limit of detection,LOD)。根据标准曲线的线性范围确定定量限(limit of quantity,LOQ),并确定该方法的线性相关性。
±s从标准曲线中找到该相应值的最低浓度,即为方法的检测限(limit of detection,LOD)。根据标准曲线的线性范围确定定量限(limit of quantity,LOQ),并确定该方法的线性相关性。
1.3.2 菌株活化及液体培养
对菌种进行2 次活化,第1次活化是从购买的标准品中挑取菌丝放入制备好的PDA平板培养基内;第2次活化是从该平板培养基内挑取小块菌丝放入下一个制备好的PDA平板培养基中央,再放入25 ℃培养箱内培养7 d。在超净工作台内用直径为2 cm的打孔器取1 个活化菌种的外圈菌饼,接种到灭菌后的液体培养基内,塞好棉塞,用牛皮纸包扎好后放入摇床进行培养。
1.3.3 液体培养基配方筛选
1.3.3.1 液体培养基配方的单因素试验
综合相关文献中的多种液体培养基配方 [20-23],以培养基成分中的葡萄糖、KNO 3、酵母浸出膏、蛋白胨、NaNO 3的质量浓度为单因素自变量,以ZEN的产量为指标,进行单因素试验,每组单因素试验水平重复进行3 次。以葡萄糖30 g/L、KNO 3 3.0 g/L、酵母浸出膏2.0 g/L、蛋白胨10 g/L、NaNO 33.0 g/L、MgSO 40.5 g/L、K 2HPO 4·3H 2O 1.0 g/L、KCl 0.5 g/L、Fe 2(SO 4) 30.025 g/L、1.0 L超纯水为基准,培养时间为4 d,分别考察葡萄糖为0、10、20、30、40 g/L,KNO 3为0、1.0、2.0、3.0、4.0 g/L,酵母浸出膏为0、1.0、2.0、3.0、4.0 g/L,蛋白胨为0、10、15、20、25 g/L,NaNO 3为0、1.0、2.0、3.0、4.0 g/L时对ZEN产量的影响。
1.3.3.2 液体培养基配方的正交试验
综合以上单因素试验,确定了培养基的主要成分,根据确定的因素和水平设计正交试验。
1.3.4 培养条件的确立
1.3.4.1 产ZEN培养条件的单因素试验
通过结合文献[24-26],确定以照明时间、培养时间、培养温度、摇床转速为单因素变量,以ZEN的产出量为指标,进行单因素试验,每组单因素试验水平重复进行3 次,以白炽灯照明时间12 h/d、培养时间15 d、培养温度25 ℃、摇床转速90 r/min为基准,分别考察白炽灯照明时间为0、3、6、12、24 h,培养时间为3、6、12、24、48 d,培养温度为5、10、20、30、40 ℃,摇床转速为0、30、60、90、120 r/min时对ZEN产量的影响。将培养液于1 000 r/min离心5 min,取上清液进行ZEN产量的测定。
1.3.4.2 响应面法优化生产ZEN的培养条件
综合以上所做的单因素试验,选取培养中最主要的几个外界因素为自变量,以ZEN的产出量为响应值,根据Box-Behnken [27-29]设计原理,设计响应面曲面分析试验,确定最佳培养条件。
2.1 液体培养基中ZEN的添加回收率及ELISA方法的检出限
表1 玉米赤霉烯酮添加回收率
Table 1 Spiked recovery of ZEN

注:同列大写字母不同表示不同添加水平下对ZEN毒素检测的回收率差异显著(P<0.05);同行小写字母不同表示不同检测方法对ZEN毒素检测的回收率差异显著(P<0.05)。
ELISA法UPLC法回收率/%相对标准偏差/%回收率/%相对标准偏差/% 5 84.88 Ba8.6679.93 Ba4.62 50121.07 Ab8.8590.46 Ab2.62 50095.89 Ba5.4692.66 Aa0.54添加水平/(µg/L)
通过在液体培养基中添加不同水平的毒素用ELISA和UPLC两种检测方法进行添加回收实验,结果如表1所示。当添加水平为5、50 µg/L时,两种检测方法无显著性差异,故仅对ELISA方法进行检测,其LOD为0.01 µg/L,LOQ为0.1 µg/L,线性回归方程为y = -0.544 8x +1.896 6(相关系数R 2=0.920 9),因R 2>0.9,可说明ZEN质量浓度在0.01~10 µg/L范围内与OD 450 nm值之间具有很强的线性相关性,表明通过ELISA方法来进行菌液中ZEN产量的检测是可行的。
2.2 产ZEN培养基配方的单因素试验

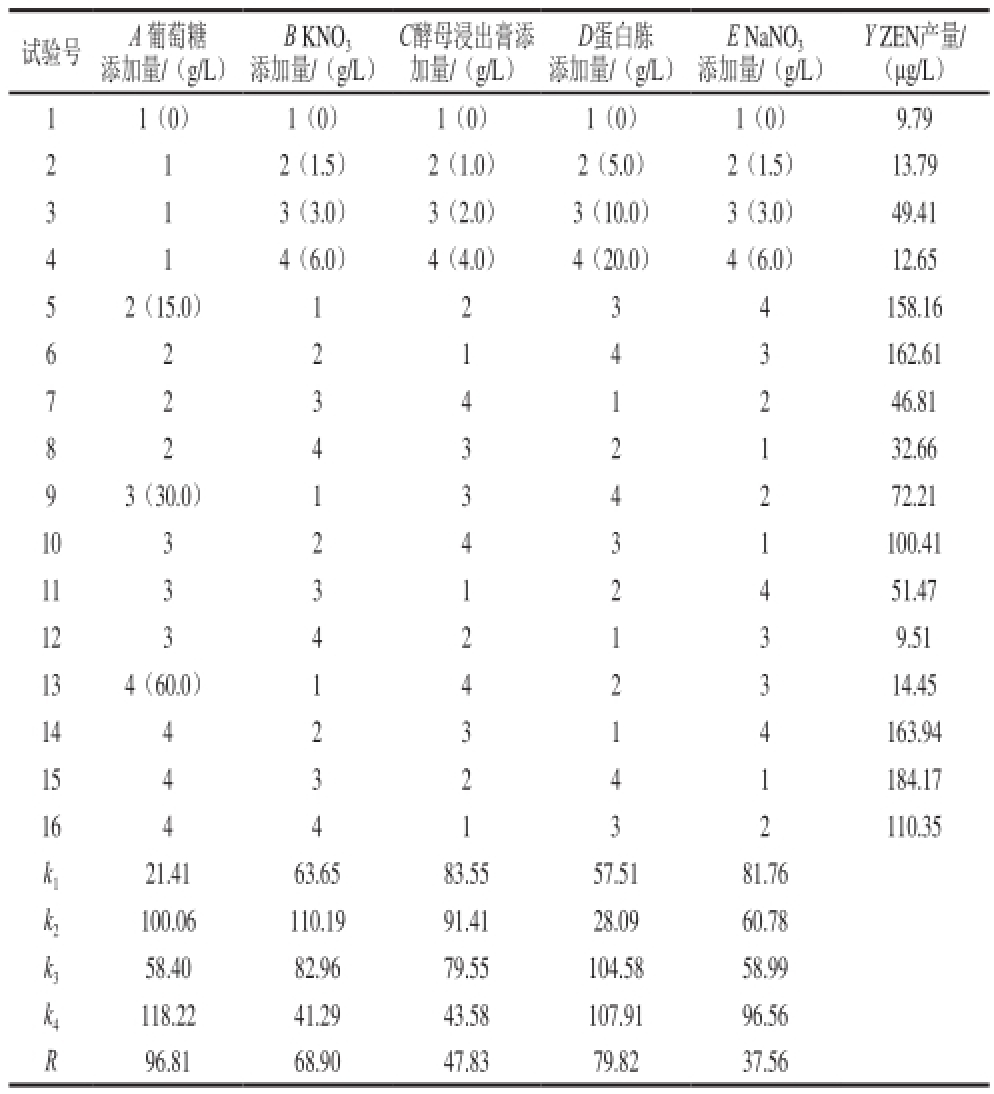
图1 培养基各单因素对ZEN产量的影响
Fig.1 Effect of culture medium components on the yield of ZEN
由图1a可知,随着葡萄糖添加量的增加,ZEN的产量逐渐上升,当葡萄糖添加量达到30 g/L以后,ZEN产量仍增加,但整体趋势平缓,差异不显著(P>0.05)。由图1b可知,随着KNO 3添加量的增加,ZEN的产量逐渐上升,当KNO 3添加量达到3.0 g/L以后,整体趋势平缓,差异不显著(P>0.05)。由图1c可知,随着酵母浸出膏添加量的增加,ZEN的产量呈上升趋势,当酵母浸出膏添加量达到3.0 g/L以后,ZEN产量仍有增加的趋势,但差异不显著(P>0.05)。由图1d可知,随着蛋白胨添加量的增加,ZEN的产量呈上升趋势,当蛋白胨添加量达到20 g/L以后,ZEN产量变化趋于平缓,差异不显著(P>0.05)。由图1e可知,随着NaNO 3添加量的增加,ZEN的产量呈上升趋势,当NaNO 3添加量达到3.0 g/L以后,ZEN产量仍增加,但整体趋势平缓,差异不显著(P>0.05)。
2.3 产ZEN最佳培养基配方的正交试验及结果
通过结合文献[20-23]以及前面所做的单因素试验得出葡萄糖、KNO 3、酵母浸出膏、蛋白胨、NaNO 3的添加量为主要培养基配方,固定其他培养基成分,对5 种因素进行正交试验设计,如表2所示。
表2 培养基配方的正交试验L
16(4
5)结果
Table2 L
16(4
5) Orthogonal array design with experimental results for optimization of culture medium components
试验号A 葡萄糖添加量/(g/L)Y ZEN产量/(μg/L)11(0)1(0)1(0)1(0)1(0)9.79 212(1.5)2(1.0)2(5.0)2(1.5)13.79 313(3.0)3(2.0)3(10.0)3(3.0)49.41 414(6.0)4(4.0)4(20.0)4(6.0)12.65 52(15.0)1234158.16 622143162.61 72341246.81 82432132.66 93(30.0)134272.21 1032431100.41 113312451.47 12342139.51 134(60.0)142314.45 1442314163.94 1543241184.17 1644132110.35 k 121.4163.65 83.55 57.51 81.76 k 2100.06110.19 91.41 28.09 60.78 k 358.40 82.96 79.55 104.58 58.99 k 4118.22 41.29 43.58 107.91 96.56 R96.81 68.90 47.83 79.8237.56 B KNO 3添加量/(g/L)C酵母浸出膏添加量/(g/L)D蛋白胨添加量/(g/L)E NaNO 3添加量/(g/L)
根据表2极差R的大小进行因素的主次排列,5 个影响因素的主次顺序是:A(葡萄糖添加量)>D(蛋白胨添加量)>B(KNO 3添加量)>C(酵母浸出膏添加量)>E(NaNO 3添加量)。
从试验的综合衡量指标ZEN产量及各水平的平均值k i可直观看出,培养基配方的最优水平组合为A 4B 2C 2D 4E 4,即葡萄糖添加量为60 g/L、KNO 3添加量为1.5 g/L、酵母浸出膏添加量为1.0 g/L、蛋白胨添加量为20 g/L、NaNO 3添加量为6.0 g/L。
2.4 产ZEN培养条件的单因素试验
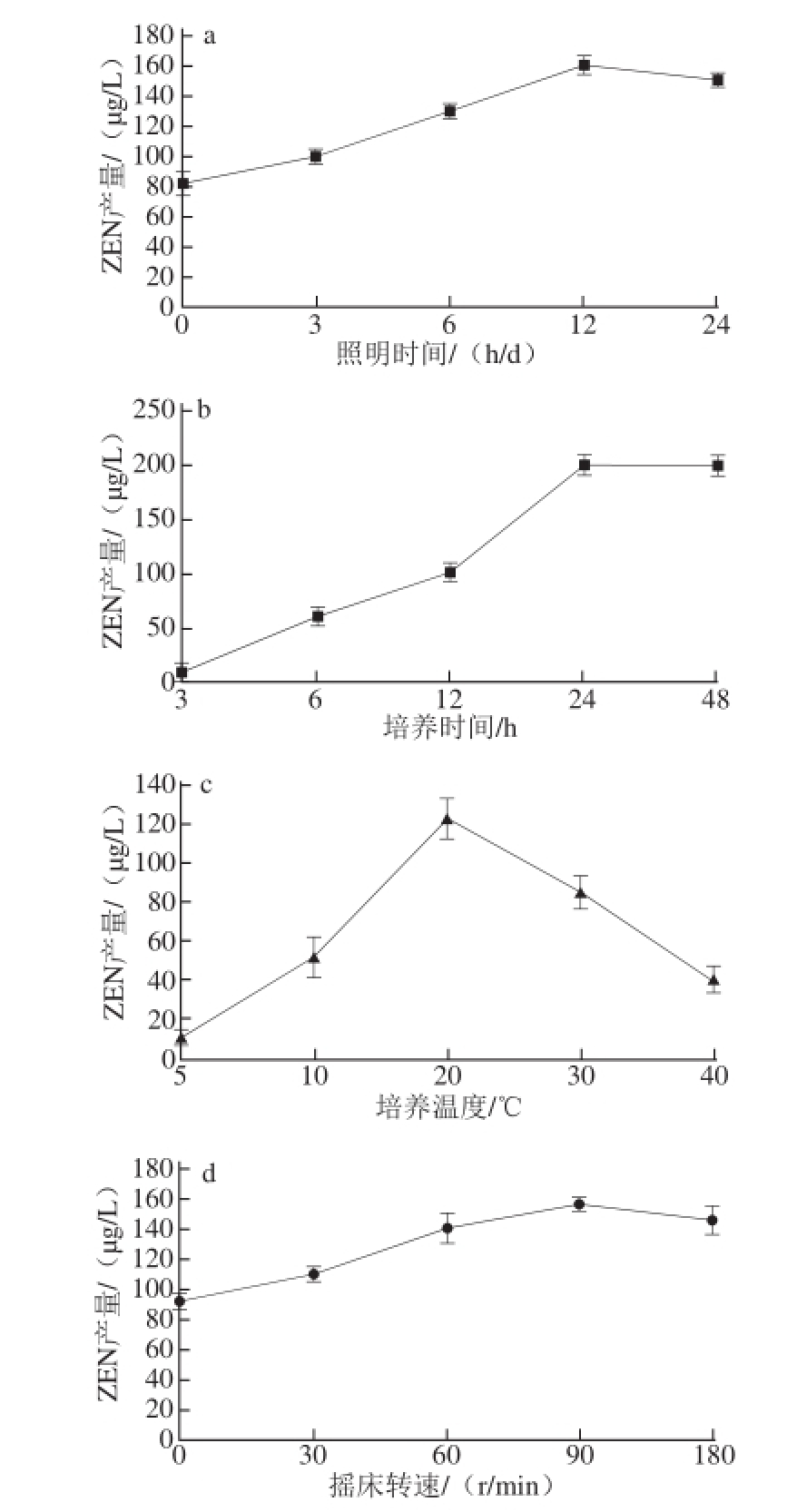
图2 各单因素培养条件对ZEN产量的影响
Fig.2 Effect of culture conditions on the yield of ZEN
由图2a可知,随着每天照明时间的延长,ZEN的产量逐渐升高,当照明时间达到12 h以后,ZEN产量有所下降,说明12 h为可参考的照明时间。由图2b可知,随着培养时间的加长,ZEN的产量迅速升高,当培养时间达到24 d以后,ZEN产量的趋势保持不变,说明24 d左右为可参考的培养时间。由图2c可知,随着培养温度的升高,ZEN的产量先升高后下降,温度超过30 ℃后,可明显看出,液体培养基中的菌丝逐渐停止生长,由此可说明20 ℃左右为可参考的培养温度。由图2d可知,随着摇床转速的加快,ZEN的产量逐渐升高,当转速为90 r/min时,ZEN产量达到最大值,其后有下降的趋势,但差异不显著(P>0.05),说明90 r/min左右为可参考的摇床转速。
2.5 响应面法优化生产ZEN的培养条件
2.5.1 Box-Behnken设计试验
通过结合文献[24-26]以及前面所做的单因素试验得出影响禾谷镰刀菌产ZEN的主要外界条件为照明时间、培养时间、培养温度、摇床转速,因此本实验以照明时间(X 1)、培养时间(X 2)、培养温度(X 3)、摇床转速(X 4)为自变量,以菌液中测得的ZEN含量为响应指标,采用Box-Behnken方法设计响应面分析试验,试验设计及结果如表3所示。
表3 培养条件优化响应面试验设计方案及结果
Table 3 Experimental design and results for response surface analysis for optimization of culture conditions
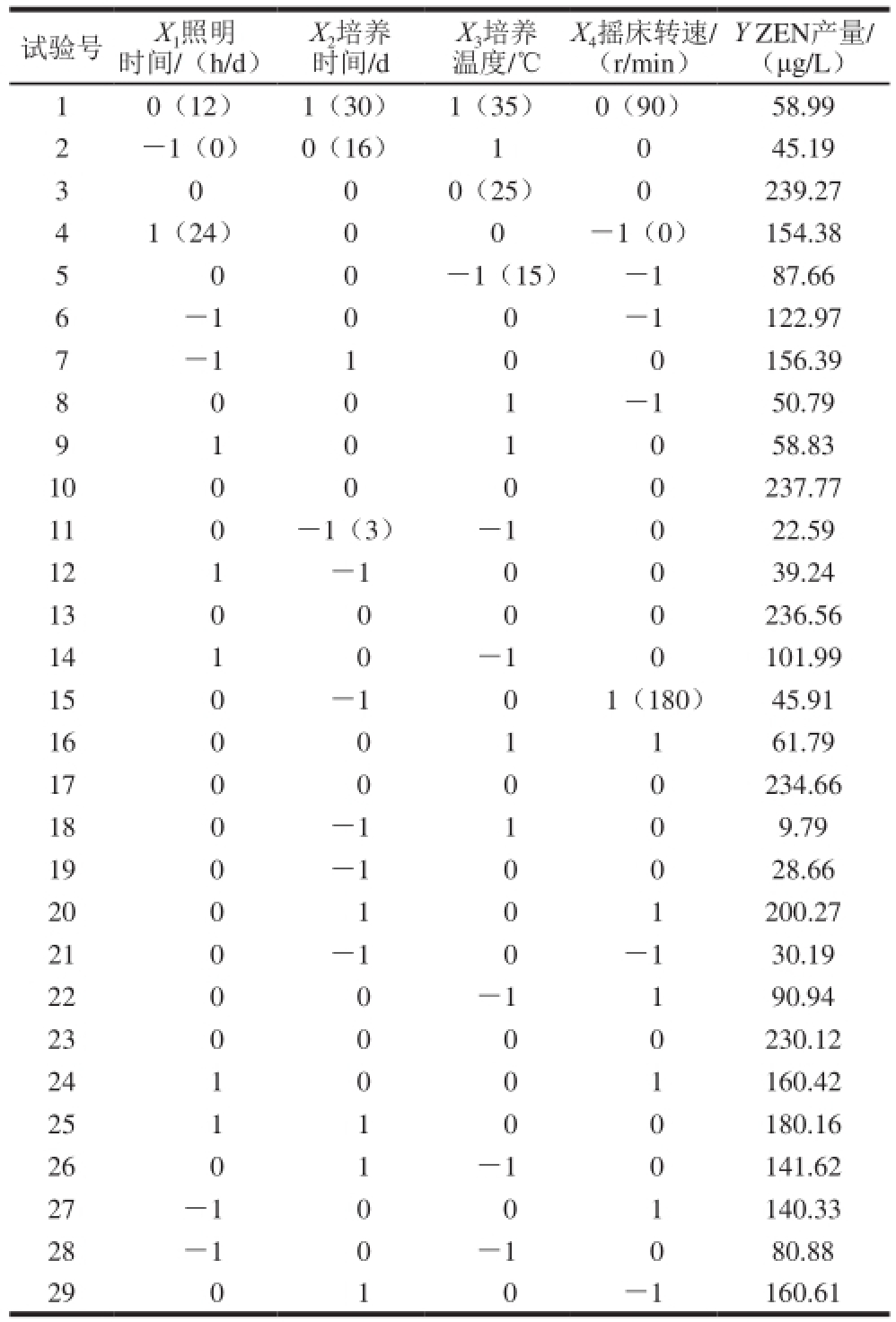
试验号X 1照明时间/(h/d)Y ZEN产量/(μg/L)10(12)1(30)1(35)0(90)58.99 2-1(0)0(16)1045.19 3000(25)0239.27 41(24)00-1(0)154.38 5 00-1(15)-187.66 6-100-1122.97 7-1100156.39 8 001-150.79 9 101058.83 100000237.77 110-1(3)-1022.59 121-10039.24 130000236.56 1410-10101.99 150-101(180)45.91 16001161.79 170000234.66 180-1109.79 190-10028.66 200101200.27 210-10-130.19 2200-1190.94 230000230.12 241001160.42 251100180.16 2601-10141.62 27-1001140.33 28-10-1080.88 29010-1160.61 X 2培养时间/d X 3培养温度/℃X 4摇床转速/(r/min)
2.5.2 模型建立与方差分析
根据表3的试验结果,利用Design Expert v8.0.6软件对试验数据进行分析,所得主要分析结果如表4所示。
对表3试验结果进行回归分析,得到如下方程:
Y=235.68+10.01X
1+68.42X
2-19.81X
3+7.68X
4+ 3.36X
1X
2-1.87X
1X
3-2.83X
1X
4-18.23X
2X
3+6.43X
2X
4+
![]()
因素X
2、X
3、
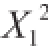 、
、
 、
、
 、
、
 对ZEN产量效果的线性效应极显著,因素X
1、X
2X
3对ZEN产量效果的线性效应显著,因素X
4、X
1X
2、X
1X
3、X
1X
4、X
2X
4、X
3X
4对ZEN产量效果的线性效应不显著。
对ZEN产量效果的线性效应极显著,因素X
1、X
2X
3对ZEN产量效果的线性效应显著,因素X
4、X
1X
2、X
1X
3、X
1X
4、X
2X
4、X
3X
4对ZEN产量效果的线性效应不显著。
比较影响ZEN产量显著程度大小的各因素可知,其影响程度由大到小依次为培养时间、培养温度、照明时间、摇床转速,模型的回归值F=46.888>F 0.01(14,4)=14.24,P<0.000 1,表明该模型极显著;相关系数R 2=0.979 1,调整R 2=0.958 2,说明该模型能解释95.82%响应值的变化,因而表明该模型对试验实际情况拟合较好,可以用此模型对影响ZEN产量的培养条件进行预测和分析。
表4 回归方程方差分析结果
Table 4 Analysis of variance of regression equation

注:**. P<0.01,表示差异极显著;*. P<0.05,表示差异显著。
方差来源平方和自由度均方F值Prob>F显著性模型155 248.787 1411 089.199 46.888 <0.000 1** X 11 202.066 11 202.066 5.083 0.0407* X 251 427.802 151 427.802 217.451 <0.000 1** X 34 706.251 14 706.251 19.899 0.000 5** X 4707.008 1707.008 2.989 0.105 8 X 1X 242.058 142.058 0.178 0.679 6 X 1X 313.962 113.962 0.059 0.811 6 X 1X 432.019 132.019 0.135 0.718 4 X 2X 31 237.825 11 237.825 5.234 0.038 2* X 2X 4154.133 1154.133 0.652 0.433 0 X 3X 414.867 114.867 0.063 0.805 7 X1 2 17 605.627 117 605.627 74.442 <0.000 1** X2 2 40 150.304 140 150.304 169.767 <0.000 1** X3 277 626.315 177 626.315 328.226 <0.000 1** X4 2 14 633.099 114 633.099 61.873 <0.000 1**残差3 311.039 14236.503
2.5.3 响应面分析与条件优化

图3 培养时间与温度及其交互作用对ZEN产量影响的响应面和等高线图
Fig.3 Response surface and contour plots for the effect of culture time and temperature on the yield of ZEN
由图3可知,响应曲面的坡度陡峭,表明ZEN产量对培养时间与培养温度的变化敏感。固定每天照明时间为12 h,摇床转速90 r/min,当培养温度处于较低和较高水平时,随着培养时间的延长,ZEN产量呈先升高后趋于平缓下降的趋势;当培养时间处于较低水平时,随着培养温度的升高,ZEN产量先升高后下降,且变化较大。从等高线可看出对ZEN产量的影响,培养时间大于培养温度,培养时间与温度之间的交互作用显著,与表4中交互项P值的分析结果一致。
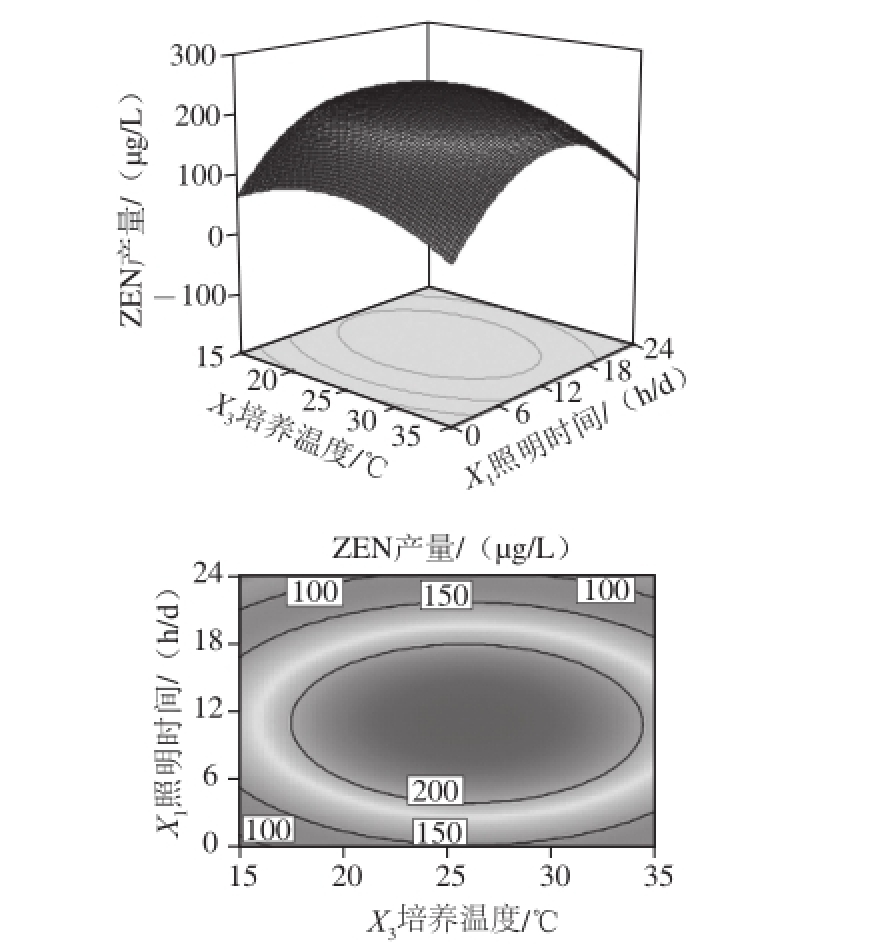
图4 照明时间与培养温度及其交互作用对ZEN产量影响的响应面和等高线图
Fig.4 Response surface and contour plots for the effect of light irradiation time and culture temperature on the yield of ZEN
由图4可知,响应曲面的坡度较为陡峭,表明ZEN产量对照明时间与培养温度的变化较为敏感。固定培养时间为16 d,摇床转速为90 r/min,在照明时间不变的条件下,随着培养温度的逐渐升高,ZEN产量先升高后下降,且趋势缓慢;在培养温度不变的条件下,随着照明时间的逐渐加长,ZEN产量先升高后下降。从等高线可看出二者之间对ZEN产量的影响,培养温度大于照明时间,与表4分析中影响ZEN产量显著程度大小的各因素分析结果一致。
由图5可知,响应曲面的坡度略为陡峭,表明ZEN产量对照明时间与摇床转速的变化略为敏感。固定培养时间为16 d,培养温度为25 ℃,在照明时间不变的条件下,随着摇床转速的逐渐加快,ZEN产量呈先升高后下降的变化趋势;在摇床转速不变的条件下,随着照明时间的逐渐加长,ZEN产量先升高后下降。从等高线可看出二者之间对ZEN产量的影响,照明时间大于摇床转速,与表4分析中影响ZEN产量显著程度大小的各因素分析结果一致。等高线略偏圆形,表明两因素之间的交互作用强度较弱,影响不显著。
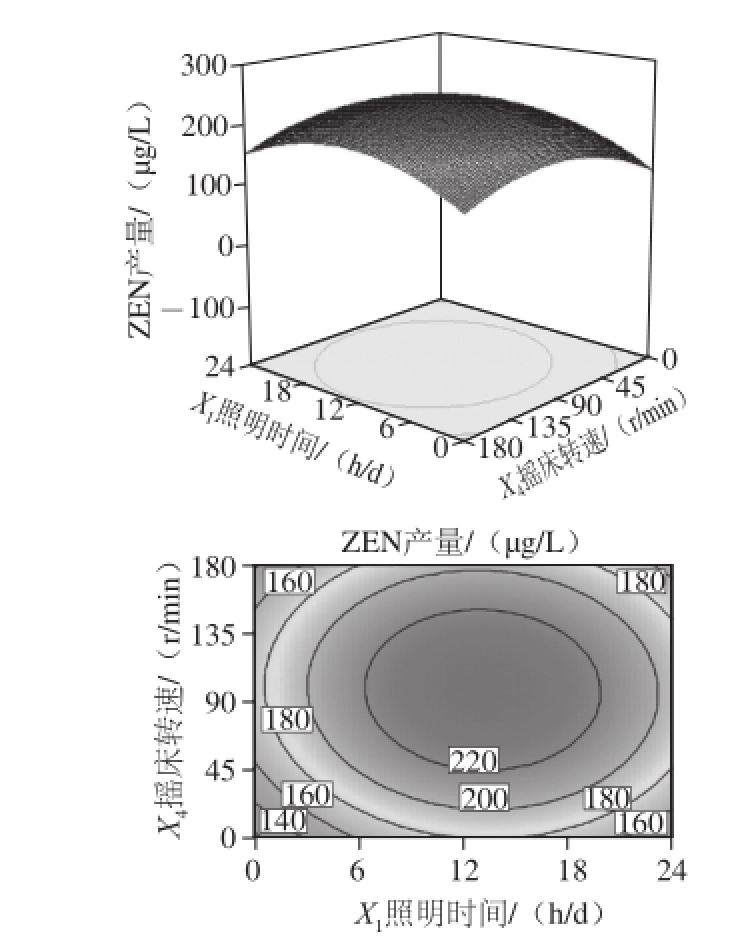
图5 照明时间与摇床转速及其交互作用对ZEN产量影响的响应面和等高线图
Fig.5 Response surface and contour plots for the effect of light irradiation time and shaking speed on the yield of ZEN
通过模型优化得出ZEN生产的最优培养条件为:照明时间每天9.58 h、培养时间20.38 d、培养温度22.85 ℃、摇床转速91.71 r/min,在此条件下ZEN的产量为244.97 μg/L。
2.6 验证实验
为了检验正交试验与响应面法所得结果的准确性,采用上述培养基与培养条件进行禾谷镰刀菌在液态培养基中的培养,并在该优化条件下进行3 次平行实验,考虑到实际操作的情况,将条件参数修正为培养温度22.9 ℃、培养时间20 d、照明时间10 h/d、摇床转速92 r/min。培养基配方为每升超纯水中含葡萄糖60 g、KNO 3 1.5 g、酵母浸出膏1.0 g、蛋白胨20 g、NaNO 36.0 g、MgSO 40.5 g、K 2HPO 4·3H 2O 1.0 g、KCl 0.5 g、Fe 2(SO 4) 30.025 g,得到ZEN产量可达到249.80 μg/L,与理论预测值的相对误差在1.93%左右。因此,正交试验法与响应面法结合所得的产ZEN条件参数准确可靠,具有实用价值。
实验采用酶联免疫方法与液-质联用的方法同时进行菌液中标准毒素的添加回收实验,通过比较分析,两者之间的添加回收率无显著性差异,考虑到ELISA检测方法快速简便,且灵敏度高,因此,ELISA方法可适用于菌液中ZEN毒素的检测。结合正交试验与响应面试验分析了不同培养条件下液体培养基中禾谷镰刀菌产玉米赤霉烯酮的能力,筛选出了最佳的培养基配方和最优的培养条件为每升超纯水含葡萄糖60 g、KNO 3 1.5 g、酵母浸出膏1.0 g、蛋白胨20 g、NaNO 36.0 g、MgSO 40.5 g、K 2HPO 4·3H 2O 1.0 g、KCl 0.5 g、Fe 2(SO 4) 30.025 g,培养温度22.9 ℃、培养时间为20 d、照明时间为10 h/d、摇床转速92 r/min,所得液体培养基中ZEN的产量可达249.80 μg/L。本实验结果为ZEN的国产化研究提供了一定的基础性实验依据。
参考文献:
[1] 张素轩. 镰刀菌属分类进展[J]. 真菌学报, 1991, 10(2): 85-94.
[2] 张大军, 邱德文, 蒋伶活. 禾谷镰刀菌基因组学研究进展[J]. 安徽农业科学, 2009, 37(17): 7892-7894.
[3] 杨靖然, 蒋伶活. 禾谷镰刀菌的生物防治研究进展[J]. 安徽农业科学, 2008, 36(23): 10043-10045.
[4] 纪莉景. 中国不同生态地区禾谷镰刀菌种群分化及遗传多样性分析[D]. 保定: 河北农业大学, 2007: 89-103.
[5] 徐雍皋, 徐敬友, 方中达. 禾谷镰刀菌菌落角变的观察[J]. 植物病理学报, 1992, 22(1): 11-14.
[6] BOUTIGNYA A L, BEUKESA I, SMALL I, et al. Quantitative detection of Fusarium pathogens and their mycotoxins in South African maize[J]. Plant Pathology, 2012, 61(3): 522-531.
[7] 胡亚娟, 贺运春, 郭明霞. 山西晋中地区植物病原镰刀菌(Fusarium)种类鉴定[J]. 山西农业大学学报, 2007, 27(3): 277-280.
[8] BALIUKONIENE V, BAKUTIS B, VAIVADAITE T, et al. Prevalence of fungi and mycotoxins in silage and milk in lithuania[J]. Veterinarija ir Zootechnik, 2012, 59: 3-9.
[9] MARAGOS C M, APPELL M, LIPPOLIS V, et al. Use of cyclodextrins as modifiers of fluorescence in the detection of mycotoxins[J]. Food Additives and Contaminants, 2008, 25(2): 164-171.
[10] 路子显, 伍松陵, 孙长坡. 玉米赤霉烯酮生物合成和降解的研究进展[J]. 中国生物工程杂志, 2011, 31(2): 116-123.
[11] 邓友田, 袁慧. 玉米赤霉烯酮毒性机理研究进展[J]. 中国卫生检验杂志, 2007, 28(2): 89-92.
[12] 王元凯, 王君, 王雨晨, 等. 玉米赤霉烯酮单克隆抗体的制备及间接竞争ELISA检测方法的建立[J]. 微生物学通报, 2011, 38(12): 179-188.
[13] 王百川, 付绍平, 王丹, 等. 超高压液相色谱-飞行时间质谱法分析国产油橄榄叶中酚类化合物[J]. 食品科学, 2011, 32(18): 225-229.
[14] 申红红, 仇峰, 杨美华, 等. 高效液相色谱-串联质谱法同时测定中药中的玉米赤酶烯酮和α-玉米赤霉烯醇[J]. 中国卫生检验杂志, 2011, 21(6): 1322-1327.
[15] NAKAGAWAA H, OHMICHIB K, SAKAMOTOB S, et al. Detection of a new Fusarium masked mycotoxin in wheat grain by highresolution LC-Orbitrap TMMS[J]. Food Additives and Contaminants, 2011, 28(10): 1447-1456.
[16] 邢萌萌, 朱科学, 聂少平, 等. UPLC-Q-TOF-MS检测槲皮素代谢产物在大鼠血清及组织中的分布[J]. 食品科学, 2013, 34(24): 158-162. doi:10.7506/spkx1002-6630-201324033.
[17] 刘莉敏, 郭军, 米智慧, 等. 蜂胶样品乙醇提取物的UPLC-Q-TOF-MS指纹特征[J]. 食品科学, 2014, 35(18): 96-99. doi:10.7506/spkx1002-6630-201418019.
[18] de BOEVREA M, di MAVUNGUA J D, MAENE P, et al. Maene development and validation of an LC-MS/MS method for the simultaneous determination of deoxynivalenol, zearalenone, T-2-toxin and some masked metabolites in different cereals and cereal-derived food[J]. Food Additives and Contaminants, 2012, 29(5): 819-835.
[19] PEI Shichun, ZHEN Yuping, GAO Jianwei, et al. Screening and monitoring zearalenone-producing Fusarium species by PCR and zearalenone by monoclonal antibodies in feed from China[J]. Food Additives and Contaminants: Part B, 2014, 7(4): 37-41.
[20] 陆鸣, 王裕中, 陈怀谷, 等. 禾谷镰刀菌产毒素培养条件及粗毒素提取法[J]. 江苏农业学报, 1992, 8(1): 30-34.
[21] 徐得月, 王伟, 陈西平, 等. 禾谷镰刀菌产毒影响因子预测微生物学筛选[J]. 中国公共卫生, 2013, 29(1): 72-76.
[22] 张枫, 张蕾, 张重阳, 等. 一株产T-2毒素镰孢菌的分离、鉴定及其产毒条件的研究[J]. 微生物学通报, 2015, 42(2): 340-348.
[23] 张初署, 刘阳, 邢福国, 等. 七种培养基对黄曲霉分离效果的比较[J].核农学报, 2013, 27(2): 208-212.
[24] KIM H, SON H, LEE Y W. Effects of light on secondary metabolism and fungal development of Fusarium graminearum[J]. Journal of Applied Microbiology, 2014, 116(2): 380-389.
[25] DORN B, FORRER H R, JENNY E, et al. Fusarium species complex and mycotoxins in grain maize from maize hybrid trials and from grower’s fields[J]. Journal of Applied Microbiology, 2011, 111(3): 693-706.
[26] JOSEPHS R D, SCHUHMACHER R, KRSKA R. International interlaboratory study for the determination of the Fusarium mycotoxins zearalenone and deoxynivalenol in agricultural commodities[J]. Food Additives and Contaminants, 2001, 18(5): 417-430.
[27] 李娟, 曹泽虹,李超,等. 响应面法优化黑曲霉深层发酵产内切型菊粉霉工艺[J]. 食品科学, 2014, 35(9): 207-212. doi:10.7506/spkx1002-6630-201409041.
[28] 祝赛峰, 吴建峰,赵希荣. 响应面法优化枯草芽孢杆菌S0507产四甲基吡嗪的培养条件[J]. 食品科学, 2014, 35(9): 218-223. doi:10.7506/ spkx1002-6630-201409043.
[29] 吴红洋, 姜太玲,胡惠茗,等. 响应面法优化酶解花椒籽蛋白制备降血压肽工艺[J]. 食品科学, 2014, 35(21): 180-185. doi:10.7506/ spkx1002-6630-201421035.
Effect of Different Culture Conditions on the Production of Zearalenone by Fusarium graminearum
ZHEN Yuping, PEI Shichun*, GAO Jianwei, WANG Yan, JIANG Yuanyuan
(College of Food and Biological Engineering, Qiqihar University, Qiqihar 161006, China)
Abstract:In the present study, the effects of different incubation conditions on the production of zearalenone (ZEN) by Fusarium graminearum were explored. Culture medium, incubation time, incubation temperature, shaking speed and light irradiation time were selected as important parameters affecting ZEN production. Single factor method was used in combination with orthogonal array design and response surface methodology to optimize the medium composition and culture conditions employing statistical analysis, respectively. The results showed that the optimal culture medium for Fusarium graminearum was comprised of 60 g/L C 6H 12O 6, 1.5 g/L KNO, 1.0 g/L yeast extract paste, 20 g/L peptone, 6.0 g/L NaNO 3, 0.5 g/L MgSO 4, 1.0 g/L K 2HPO 4·3H 2O, 0.5 g/L KCl, and 0.025 g/L Fe 2(SO 4) 3in 1.0 L of ultrapure water. The concentration of ZEN was 249.80 μg/L when the cultivation was carried out for 20 days with a shaking speed of 92 r/min, 22.9 ℃ under light irradiation for 10 h a day.
Key words:Fusarium graminearum; zearalenone; enzyme-linked immunosorbent assay; mycotoxin
中图分类号:R446.61
文献标志码:A
文章编号:1002-6630(2015)21-0168-07
doi:10.7506/spkx1002-6630-201521032
收稿日期:2015-06-29
基金项目:齐齐哈尔大学研究生创新科研项目(YJSCX2014-015X);国家科技基础性工作专项(2013FY113400);
黑龙江省教育厅科学技术研究项目(12541871)
作者简介:甄玉萍(1990—),女,硕士研究生,研究方向为食品营养与安全。E-mail:15146694340@139.com
*通信作者:裴世春(1966—),男,教授,博士,研究方向为食品营养与安全。E-mail:peishichun@qqhru.edu.cn