梁新红,孙俊良 *,马汉军,王田林
(河南科技学院食品学院,河南 新乡 453003)
摘 要:采用50 kD和10 kD两种超滤膜对甘薯β-淀粉酶进行两步超滤,研究了超滤分离甘薯中β-淀粉酶的最佳工艺。结果表明,膜超滤中跨膜压力为0.12 MPa、超滤时间40 min、操作温度35 ℃、物料pH值为7.0。在此条件下,β-淀粉酶比活力为71 627 U/mg,纯化倍数为11.85,酶活回收率为82.79%,表明分离后的酶经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析为单一条带。
关键词:两步超滤法;分离纯化;甘薯;β-淀粉酶
β-淀粉酶(E.C.3.2.1.2)是外切型糖化酶,作用于淀粉的水解产物是麦芽糖及大分子β-界限糊精,主要应用于食品、发酵、纺织、制药等工业过程中 [1-5]。β-淀粉酶广泛存在于高等植物中,如甘薯、大麦、小麦、大豆等 [6-9]。甘薯中β-淀粉酶是块根中仅次于甘薯贮藏蛋白的一种蛋白质成分,约占块根可溶性蛋白的5% [10-11]。与微生物β-淀粉酶相比,植物中的β-淀粉酶具有酶活力高、耐热性好、作用pH值范围广等特点 [12-13]。随着淀粉行业的迅猛发展,β-淀粉酶的应用范围越来越广,而我国β-淀粉酶的研制并没有取得大的突破。
β-淀粉酶纯化一般先用硫酸铵沉淀获得粗酶液,然后用凝胶柱如Sephadex G-200 [14-15],离子交换柱如DEAECellulofine [14,16]、DEAE-Sephrose [17]等,以及FPLC MonoQ柱层析技术 [18]进行层析分离,这些分离方法虽然产品纯度高,但分离规模有限且酶活回收率较低。
超滤是以大分子与小分子分离为目的,以压力为推动力的膜分离技术之一 [19]。超滤法以膜的截留分子质量对物料进行分离 [20-21]。超滤应用于蛋白的分离纯化已有报道,Datta等 [22]应用两步超滤法分离纯化蛋清中卵清蛋白,郝更新等 [23]应用超滤法富集了牡蛎蛋白活性肽,Zhou等 [24]应用超滤法分离纯化了玉米蛋白的抗氧化活性肽。未见有应用两步超滤法分离纯化甘薯β-淀粉酶的文献报道。
本实验采用两种不同孔径的中空纤维超滤膜,研究两步超滤分离纯化甘薯中β-淀粉酶,并研究超滤时跨膜压力、超滤时间、温度及酶液pH值等对膜通量的影响,优化两步超滤工艺参数,为甘薯β-淀粉酶高效分离提供实践及理论基础,以期为β-淀粉酶工业化生产提供参考。
1.1 材料
甘薯:徐薯18号,采自河南科技学院甘薯实验田。
1.2 仪器与设备
膜超滤分离装置(中空纤维超滤膜(孔径分别为50、10 kD)) 上海亚东核级树脂有限公司;RC5C型冷冻离心机 美国Sovall公司。
1.3 方法
1.3.1 甘薯β-淀粉酶粗酶液制备
称取1 000 g甘薯,洗净后切块,加入蒸馏水2 000 mL,于粉碎机中粉碎1 min。过40 目筛,滤液置于冷冻离心机中4 ℃、4 000 r/min离心15 min。取上清液于4 ℃冰箱中保存。
称取硫酸铵472 g,上清液1 000 mL,调至硫酸铵的饱和度为70%,用磷酸盐缓冲液调pH值至5.0,于4 ℃冰箱中静置4 h。然后用冷冻离心机4 ℃、8 000 r/min离心15 min,收集沉淀。将沉淀溶解至500 mL,选用截留分子质量为10 kD的透析袋透析除盐24 h。
1.3.2 膜通量的测定
膜通量即单位时间内通过单位膜面积的透过液体积。超滤系统运行稳定后,控制压力、温度、pH值等操作参数,待运行稳定后取样,记录一定时间内的透过液体积,膜通量计算见下式。
式中:J为膜通量/(L/(m 2·h));V为透过液总体积/L;t为过滤时间/h;A为有效膜面积/m 2。
1.3.3 超滤操作
第1步:粗酶液经50 kD膜超滤,主要截留粗酶液中大分子蛋白及其他大分子有机物,甘薯β-淀粉酶分子质量小于50 kD [25-26],进入透过液中,进行第2步超滤。
第2步:用10 kD膜超滤,主要将第1步透过液中低分子蛋白及其他小分子物质与β-淀粉酶分离,同时将β-淀粉酶浓缩。β-淀粉酶被截留,冷冻干燥后获得纯化的β-淀粉酶。
1.3.4 超滤工艺参数对膜通量的影响
将透析除盐过后的样液进行抽滤。抽滤过后,取滤液1 000 mL置于烧杯中待用。连接好超滤装置,提取100 mL滤液与烧杯中加水稀释至500 mL。经离心泵压入膜组件,透过液经膜外侧流出,用刻度量筒收集,截留液经膜内侧流回烧杯中。调节压力旋钮分别记录在压力为0.02~0.16 MPa、温度20~40 ℃、pH 4~8、时间5~60 min时的不同透过液体积,计算膜通量。
1.4 分析方法
1.4.1 蛋白质含量测定
采用Folin-酚法 [27]测定。
1.4.2 β-淀粉酶活力的测定
采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法 [28]测定β-淀粉酶活力。酶活力单位定义为:在60 ℃、pH 5.6条件下,每小时从1.1%的可溶性淀粉溶液中释放出1 mg麦芽糖的酶量定义为1 个酶活力单位(U)。
1.4.3 β-淀粉酶的纯化
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE) [28]测定。
1.5 数据统计分析
采用DPS 7.55数据处理软件对实验数据的方差显著性进行分析。
2.1 跨膜压力对超滤膜通量的影响
在粗酶液pH 6.0、温度35 ℃条件下,对粗酶液进行两步超滤,两步超滤时间均为40 min,考察操作压力为0.02~0.14 MPa时对膜通量的影响,结果见图1。
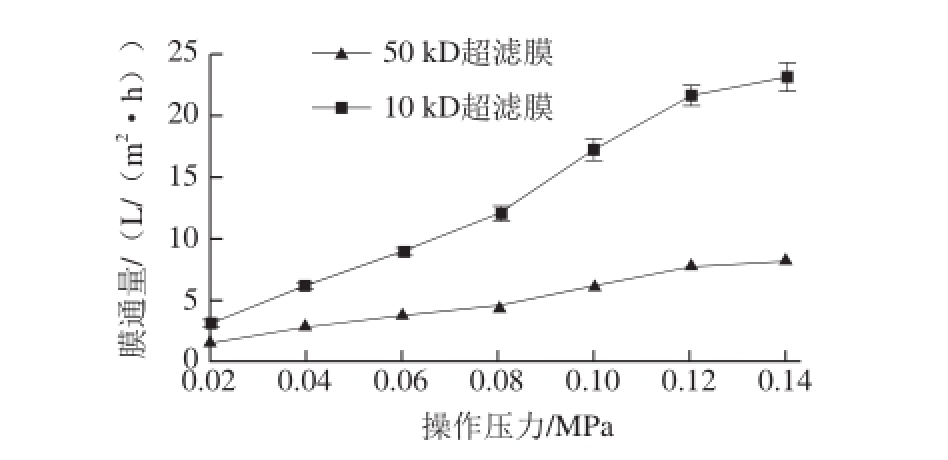
n=3)
Fig.1 Effect of transmembrane pressure on ultrafiltration efficiency (n = 3)
图1跨膜压力对膜超滤效果的影响(
由图1可知,随着操作压力的增加,50 kD和10 kD两种膜的膜通量均随着操作压力的升高而逐渐增加。在操作压力由0.02 MPa升至0.12 MPa时,50 kD膜的膜通量达到最高值,为(8.12±0.22)L/(m 2·h),随着压力继续升至0.14 MPa,膜通量没有显著增加。经方差显著性分析,操作压力为0.12 MPa和0.14 MPa时,膜通量没有显著性差异(P<0.05)。而截留分子质量为10 kD的膜随着操作压力由0.02 MPa升至0.14 MPa,膜通量逐渐升高,最高为(22.96±0.95)L/(m 2·h)。这是因为在粗酶液进行超滤时,压力引起的溶质集聚速率小于料液切向流带走的溶质速率,在一定压差范围内,膜通量随着压力差的增加而增加;50 kD膜在压力达到0.12 MPa之后,吸附和凝胶层迅速形成并且增大,这时增大压力产生的压差会很快被加厚和压实的凝胶层所抵消,故在压力达到0.12 MPa后即使再升高,通量不再随着压力的增大而增大,这时的压力称为临界压力。10 kD膜随着操作压力升高,膜通量有升高趋势,但压力过大会将一些与膜孔大小相近的分子压进膜孔,增加膜污染危险,反而会使通量降低,更加严重的还会将膜压实,造成膜不可逆的损坏。因此,超滤膜组件的操作压力选择为0.12 MPa。
2.2 操作时间对超滤膜通量的影响
在粗酶液pH 6.0、温度35 ℃、超滤压力0.12 MPa条件下,对粗酶液进行两步超滤,考察操作时间5~60 min时对膜通量的影响,结果见图2。

n=3)
Fig.2 Effect of operating time on ultrafiltration efficiency (n = 3)
图2操作时间对膜超滤效果的影响(
由图2可知,50 kD和10 kD膜的膜通量随时间的变化均可分为3 个阶段。
第1阶段:5~15 min内,膜通量迅速下降阶段。50 kD膜的膜通量由(11.63±0.51) L/(m 2·h)迅速下降至(8.33±0.35) L/(m 2·h)。10 kD膜的膜通量由(27.67±0.99) L/(m 2·h)迅速下降至(21.73±0.90) L/(m 2·h)。在此阶段内膜通量的迅速下降主要是由于物料中的溶质和膜接触的过程中,迅速产生了浓差极化、膜孔堵塞、凝胶层、膜吸附等一系列的现象,而这些现象的产生都容易增加透过的阻力,导致通量迅速下降。
第2阶段:15~40 min内,膜通量值的变化趋于平稳。50 kD膜的膜通量由(8.33±0.35)L/(m 2·h)降至(8.12±0.32) L/(m 2·h)。10 kD膜的膜通量由(21.73±0.90)L/(m 2·h)降至(21.59±0.88)L/(m 2·h)。在15~40 min内膜通量缓慢下降,趋于平稳,主要由于在超滤的过程中不断加入比较稀的物料,使得浓缩物料又恢复到原来的浓度,所以在物料的浓度变化不大,压力保持不变的情况下,浓差极化、膜孔堵塞、凝胶层、膜吸附增加的幅度很小,透过阻力增加很小,膜通量也下降很慢。
第3阶段:40~60 min,膜通量又呈迅速下降趋势。50 kD膜的膜通量由(8.12±0.32)L/(m 2·h)降至(3.59±0.15)L/(m 2·h),10 kD膜的膜通量由(21.59±0.88)L/(m 2·h)降至(9.41±0.37)L/(m 2·h)。这主要是优于随着超滤的进行,超滤膜的膜孔被堵塞以及蛋白质浓度极差化的形成。
因此,中空纤维膜在对甘薯β-淀粉酶进行超滤浓缩时,超滤时间应控制在40 min,然后对膜进行清洗,恢复通量后再使用。
2.3 操作温度对超滤膜通量的影响
在粗酶液pH 6.0、超滤时间40 min、超滤压力0.12 MPa条件下,对粗酶液进行两步超滤,考察操作温度20~40 ℃时对膜通量的影响,结果见图3。
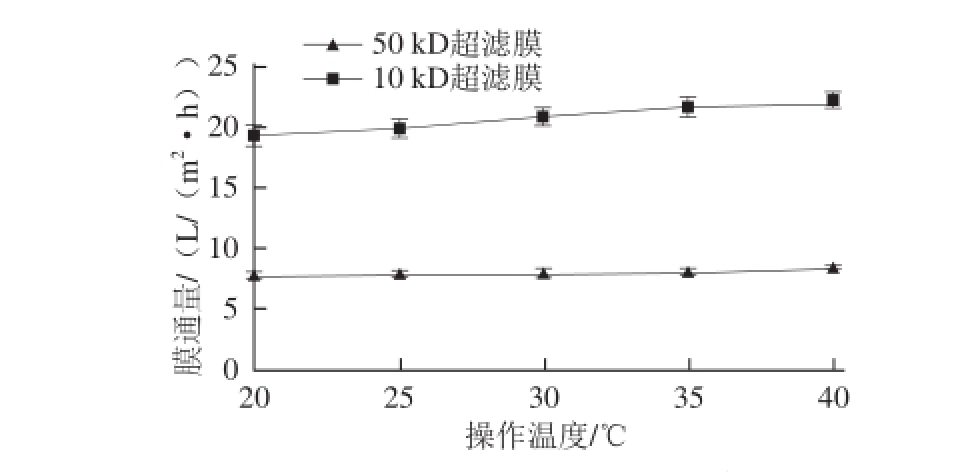
n=3)
Fig.3 Effect of operating temperature on ultrafiltration efficiency (n = 3)
图3操作温度对膜超滤效果的影响(
由图3可知,随着操作温度的提高,膜通量逐渐增加,并且通过数据分析,膜通量和温度成线性关系。50 kD膜的线性方程为y=0.193x+7.365(R 2=0.997 5),10 kD膜的线性方程为y=0.774x+18.338(R 2=0.982 2)。因此,在一定温度范围内,膜通量随着温度的升高而增加。这可能是由于随着操作温度的升高,酶的扩散系数增加,黏度减小。且在一定的压力下,随着温度的增加,物料沿凝胶层表面的切线流速有所增加,凝胶层中由界面向液相主体的反向扩散也会增加,浓差极化影响随之减小,使酶的透过阻力减小,膜通量就会提高。
虽然增加粗酶液的操作温度可以提高膜通量,但是在选择操作温度时还需要考虑膜的耐受能力和物料对温度的敏感性。由于本实验采用的中空纤维超滤膜的最高耐受温度为40 ℃,并且不适合在40 ℃左右长期操作,而且β-淀粉酶具有生物活性,在高温下长时间操作会导致酶活性的损失,因此,中空纤维膜组件的操作温度选择35 ℃。
2.4 粗酶液pH值对超滤膜通量的影响
β-淀粉酶作用pH值范围为4.0~7.0,在粗酶液的超滤时间40 min、超滤压力0.12 MPa、温度35 ℃条件下对粗酶液进行两步超滤,考察粗酶液pH 4.0~7.0时对膜通量的影响,结果见图4。
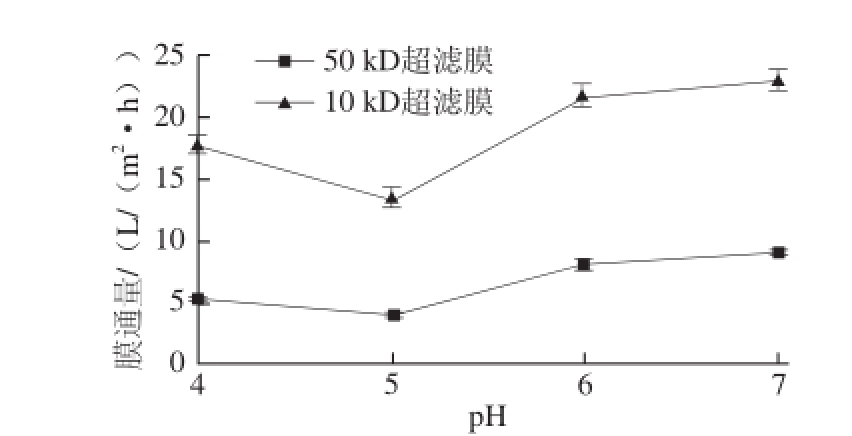
n=3)
Fig.4 Effect of crude enzyme solution pH on ultrafiltration efficiency (n = 3)
图4粗酶液pH值对膜超滤效果的影响(
由图4可知,粗酶液pH值为4.0和6.0~7.0时,50 kD超滤膜和10 kD超滤膜的膜通量均高于pH 5.0。50 kD和10 kD超滤膜在粗酶液pH 5.0时,膜通量均最低,分别为(3.96±0.09) L/(m 2·h)和(13.28±0.65) L/(m 2·h);在粗酶液pH 7.0时,膜通量最高,分别为(9.03±0.31) L/(m 2·h)和(22.73±0.90) L/(m 2·h)。这是因为粗酶液的pH值会影响膜表面对蛋白质的吸附。甘薯β-淀粉酶等电点为pH 5.0左右 [29],当溶液pH值远离等电点时,蛋白质静电斥力增加,溶解度增大,不容易被膜表面吸附;而当pH值接近等电点时,蛋白质静电斥力最小,相应溶解度降低,导致蛋白质在膜表面的吸附力增加,并在膜表面形成吸附层,使膜污染增加,传质阻力增大,导致膜通量降低。因此应用50 kD和10 kD超滤膜时,选择物料pH值为7.0。
2.5 两步超滤法对β-淀粉酶纯化效果
两步超滤法具有纯化和浓缩的作用,运用截留分子质量的不同对蛋白质分子进行截留,从而达到纯化的目的;其次,将酶液中的中、低分子质量蛋白及其他小分子物质与β-淀粉酶分离,从而进行浓缩。在超滤膜组件的跨膜压力为0.12 MPa、超滤时间40 min、操作温度35 ℃、物料pH值为7.0条件下,研究选用截留分子质量为50 kD和10 kD的中空纤维膜,以酶比活力及提纯倍数等为指标对β-淀粉酶进行两步超滤法纯化,结果见表1。β-淀粉酶比活力提高至71 627 U/mg,纯化倍数为11.85,酶活回收率为82.79%。对两步超滤纯化后的β-淀粉酶进行SDS-PAGE分析,检验其纯度,电泳图谱如图5。
表1 两步超滤法对β-淀粉酶纯化效果
Table 1 Purification ofβ-amylase using two-stage ultrafiltration technique

注:经50 kD超滤膜后的246 mL为透过液体积;经10 kD超滤膜后148 mL为截留液体积。
经10 kD超滤膜后酶活力/(U/mL)119 068204 981333 068蛋白质含量/(mg/mL)19.73.474.65体积/mL500246148酶比活力/(U/mg)6 04459 07271 627纯化倍数1.009.6711.85酶活回收率/%10084.7182.79项目粗酶液经50 kD超滤膜后
由图5可知,经两步超滤后,甘薯β-淀粉经SDS-PAGE分析为单一条带,表明经两步超滤法β-淀粉酶分离纯化效果较理想,研究结果与Teotia等 [26]相近。

-淀粉酶SDS-PAGE图谱
Fig.5 SDS-PAGE electrophoresis of β-amylase from sweet potato after ultrafiltration
图5超滤后甘薯β
两步超滤分离纯化技术操作简便,不需添加任何化学试剂,尤其是超滤技术实施条件温和,而且不引起温度、pH值的变化,因而可以防止生物大分子的变性、失活和自溶。用于β-淀粉酶的分离与纯化,具有耗用化学试剂少,操作简单,成本低,易于工业化生产等优点,具有较大的推广价值。采用超滤技术分离纯化甘薯β-淀粉酶,最佳操作条件为跨膜压力为0.12 MPa、超滤时间40 min、操作温度35 ℃、物料pH值为7.0。在此条件下,β-淀粉酶比活力为71 627 U/mg,纯化倍数为11.85,酶活回收率为82.79%,酶进行SDS-PAGE电泳为单一条带。研究表明,采用两步超滤法分离纯化甘薯β-淀粉酶效果较佳。研究将为甘薯β-淀粉酶工业化生产提供理论及实践依据。
参考文献:
[1] DABA T, KOJIMA K, INOUYE K. Kinetic and thermodynamic analysis of the inhibitory effects of maltose, glucose, and related carbohydrates on wheat β-amylase[J]. Enzyme and Microbial Technology, 2013, 52: 251-257.
[2] DERDE L J, GOMAND S V, COURTIN C M. Characterisation of three starch degrading enzymes: thermostable β-amylase, maltotetraogenic and maltogenic α-amylases[J]. Food Chemistry, 2012, 135(2): 713-721.
[3] FATMA K, DONG Y S, CHARLES L G. Roles of β-amylase and starch breakdown during temperatures stress[J]. Physiologia Plantarum, 2006, 126(1): 120-128.
[4] DABA T, KOJIMA K, INOUYE K. Interaction of wheat β-amylase with maltose and glucose as examined by fluorescence[J]. Journal of Biochemistry, 2013, 154: 85-92.
[5] 雷俊华, 高群玉. 用β-淀粉酶制备蜡质大米糊精及其性质研究[J]. 食品与发酵工业, 2014, 40(10): 22-26.
[6] 田亚平, 郭鸿飞, 肖光焰. 一种麦芽β-淀粉酶的纯化和特性研究[J].食品工业科技, 2003, 24(9): 26-28.
[7] 周裔彬, 汪东风. 甘薯β-淀粉酶的提取、纯化及其性质的研究[J]. 中国粮油学报, 2005, 20(4): 50-53.
[8] 周春海. 大豆β-淀粉酶和大麦β-淀粉酶糖化特性的比较[J]. 现代食品科技, 2011, 27(12): 1454-1456.
[9] TADESSA D, KENJI K, KUNIYO I. Chemical modification of wheat β-amylase bytrinitrobenzenesulfonic acid, methoxypolyethylene glycol, andglutaraldehyde to improve its thermal stability and activity[J]. Enzyme and Microbial Technology, 2013, 53: 420-426.
[10] LI H, KAZUKO O. Major soluble protein of sweet potato roots and changes in proteins after cutting, infection, or storage[J]. Agricultural and Biological Chemistry, 1985, 49(3): 734-744.
[11] JUN S, TSUYOSHI N, ATSUSHI H. A comparison of the hydrolysis of sweet potato starch with β-amylase and infrared radiation allows prediction of reducing sugar production[J]. International Journal of Food Science and Technology, 2004, 39: 967-974.
[12] 周蓓芸, 王峥, 孔德育. 热稳定β-淀粉酶高产菌株选育及发酵条件研究[J]. 生物工程学报, 1994, 10(3): 258-262.
[13] 邹艳玲, 徐美娟, 饶志明. 耐热β-淀粉酶高产菌株的筛选及其产酶条件优化[J]. 应用与环境生物学报, 2013, 19(5): 845-850.
[14] YAMASAKI Y. β-Amylase in germinating millet seeds[J]. Phytochemistry, 2003, 64: 935-939.
[15] LIZOTTE P A, HENSON C A, DUKE S H. Purification and characterization of pea epicotyl β-amylase[J]. Plant Physiology, 1990, 92: 615-621.
[16] LUNDGARD R, SVENSSON B. The four major forms of barley β-amylase. Purification, characterization and structural relationship[J]. Carlsberg Research Communications, 1987, 52: 313-326.
[17] KOLAWOLE A O, AJELE J O, SIRDESHMUKHA R. Purification and characterization of alkaline-stable β-amylase in malted African finger millet (Eleusine coracana) seed[J]. Process Biochemistry, 2011, 46: 2178-2186.
[18] DICKO M H, LEEUWEN M J F S, BELDMAN G. Purification and characterization of β-amylase from Curculigo pilosa[J]. Applied Microbiology and Biotechnology, 1999, 52: 802-805.
[19] 王健, 叶波平. 超滤技术在蛋白质分离纯化中的应用[J]. 药学进展, 2012, 36(3): 116-122.
[20] WAN Yinhua, LU Junren, CUI Zhanfeng. Separation of lysozyme from chicken egg white using ultrafiltration[J]. Separation and Purification Technology, 2006, 48(2): 133-142.
[21] MYUNG S W, CHOI I H, LEE S M. Separation of silk proteins and silk oligopeptides by thin film composite ultrafiltration membrane[J]. Desalination, 2008, 234: 158-165.
[22] DATTA D, BHATTACHARJEE S, NATH A. Separation of ovalbumin from chicken egg white using two-stage ultrafiltration technique[J]. Separation and Purification Technology, 2009, 66: 353-361.
[23] 郝更新, 曹文红, 郝记明. 超滤法浓缩富集牡蛎蛋白抗氧化活性肽[J].食品工业科技, 2013, 34(11): 77-80.
[24] ZHOU K, SUN S, CANNING C. Production and functional characterisation of antioxidative hydrolysates from corn protein via enzymatic hydrolysis and ultrafiltration[J]. Food Chemistry, 2012, 135: 1192-1197.
[25] 何秉旺. β-淀粉酶的国外研究动态[J]. 微生物学通报, 1990(6): 370-373.
[26] TEOTIA S, KHARE S K, GUPTA M N. An efficient purification process for sweet potato beta-amylase by affinity precipitation with alginate[J]. Enzyme and Microbial Technology, 2001, 28(9/10): 792-795.
[27] LOWRY O H, ROSEBROUGH N J, FARR N L, et al. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry, 1951, 193(1): 265-275.
[28] SAGU S T, NSO E J, HOMANN T. Extraction and purification of beta-amylase from stems of Abrus precatorius by three phase partitioning[J]. Food Chemistry, 2015, 183: 144-153.
[29] 张剑, 林庭龙, 秦瑛. β-淀粉酶研究进展[J]. 中国酿造, 2009, 28(4): 5-8.
Separation of β-Amylase from Sweet Potato Using Two-Stage Ultrafiltration Technique
LIANG Xinhong, SUN Junliang*, MA Hanjun, WANG Tianlin
(School of Food Science, Henan Institute of Science and Technology, Xinxiang 453003, China)
Abstract:The separation of β-amylase from sweet potato using ultrafiltration was investigated. A two-stage ultrafiltration scheme employing 50 and 10 kD membranes was used for accomplishing the desired separation. The results showed that β-amylase with high purity could be obtained by the proposed separation technique transmembrane pressure of 0.12 MPa, ultrafiltration time of 40 min, ultrafiltration temperature of 35 ℃ and crude enzyme solution pH of 7.0. Under these conditions, the specific activity of β-amylase was 71 627 U/mg, with a purification fold of 11.85 and a recovery yield of 82.79%. The high purity of β-amylase was also reflected by the single band on SDS-PAGE.
Key words:two-stage ultrafiltration technique; separation; sweet potato; β-amylase
中图分类号:TS209;TQ925.1
文献标志码:A
文章编号:1002-6630(2015)21-0180-05
doi:10.7506/spkx1002-6630-201521034
收稿日期:2015-05-10
基金项目:河南省教育厅自然科学研究资助计划项目(14A550010);河南省高校科技创新团队支持计划项目(13IRTSTHN006);
国家农业科技成果转化项目
作者简介:梁新红(1971—),女,副教授,博士,研究方向为食品生物技术。E-mail:liangxinhong2005@163.com
*通信作者:孙俊良(1964—),男,教授,博士,研究方向为食品生物技术。E-mail:sjl338@163.com