蓝莓花青素氯化锦葵色素在人脐静脉内皮细胞中的抗氧化作用
徐丽萍
1,付 琳
1,2,黄午阳
2,李春阳
2,*,朱运明
2
(1.哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 150076;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014)
摘 要:目的:研究氯化锦葵色素对人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)中活性氧(reactive oxygen species,ROS)和黄嘌呤氧化酶-1(xanthine oxidase-1,XO-1)含量的影响,探讨氯化锦葵色素在血管内皮细胞中的抗氧化作用。方法:体外培养HUVEC,分别设定空白组(仅加入二甲基亚砜),血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)刺激组(10
-2μmol/L),终浓度为1、5、10 μmol/L氯化锦葵色素组,以及终浓度为1、5、10 μmol/L氯化锦葵色素联合AngⅡ刺激(10
-2μmol/L)组。采用荧光免疫法测定HUVEC内ROS含量的变化,酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)测定细胞上清液中可溶性XO-1含量的变化,Western blotting法检测细胞中XO-1含量的变化。结果:氯化锦葵色素处理HUVEC时,细胞ROS和XO-1含量降低;AngⅡ引起HUVEC内ROS和上清液中XO-1含量显著增加,各浓度氯化锦葵色素预处理能有效抑制ROS和XO-1含量的增加。结论:氯化锦葵色素在HUVEC中具有抑制ROS和XO-1的作用,从而达到抗氧化、保护内皮细胞的功效。蓝莓花青素氯化锦葵色素具有抑制ROS和XO-1的作用,为蓝莓的开发利用提供了理论依据。
关键词:蓝莓;锦葵色素;人脐静脉内皮细胞;活性氧;黄嘌呤氧化酶-1
随着活性氧自由基研究的日趋深入,大量研究证明动脉粥样硬化、心律失常、充血性心力衰竭、高血压等心血管疾病的发生、发展与氧化应激密切相关
[1]。氧化应激在慢性疾病,包括冠状动脉心脏疾病、癌症和老化的发生发展中扮演了重要角色。活性氧(reactive oxygen species,ROS)是体内氧化应激的主要来源,ROS主要包括超氧阴离子自由基(
 ·)、羟自由基(·OH)及过氧化氢(H
2O
2)等,是生物体内随代谢活动不断产生的。正常情况下,低浓度的ROS能调节血管细胞的功能,对于机体血管维持正常功能是必需的,但是若ROS产生过多或不能迅速消除,则会造成人体组织细胞损伤
[2-3]。血管内皮细胞参与产生的ROS有多种,如黄嘌呤氧化酶-1(xanthine oxidase-1,XO-1)、还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)等
[4-5]。XO-1是嘌呤分解代谢过程中一种很重要的酶,催化黄嘌呤形成尿酸以及次黄嘌呤形成黄嘌呤的氧化过程,反应时会生成过氧化物,引起连锁反应
[6-8]。XO-1已被证实在动脉粥样硬化中是引起内皮细胞损伤的过氧化物的主要来源
[9-10]。内皮细胞中XO-1含量的增加及其产生的超氧化物产物会导致细胞内ROS含量增加,从而引起冠心病、心血管等疾病
[11-15],而XO-1抑制剂可以用于治疗相关疾病。
·)、羟自由基(·OH)及过氧化氢(H
2O
2)等,是生物体内随代谢活动不断产生的。正常情况下,低浓度的ROS能调节血管细胞的功能,对于机体血管维持正常功能是必需的,但是若ROS产生过多或不能迅速消除,则会造成人体组织细胞损伤
[2-3]。血管内皮细胞参与产生的ROS有多种,如黄嘌呤氧化酶-1(xanthine oxidase-1,XO-1)、还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)等
[4-5]。XO-1是嘌呤分解代谢过程中一种很重要的酶,催化黄嘌呤形成尿酸以及次黄嘌呤形成黄嘌呤的氧化过程,反应时会生成过氧化物,引起连锁反应
[6-8]。XO-1已被证实在动脉粥样硬化中是引起内皮细胞损伤的过氧化物的主要来源
[9-10]。内皮细胞中XO-1含量的增加及其产生的超氧化物产物会导致细胞内ROS含量增加,从而引起冠心病、心血管等疾病
[11-15],而XO-1抑制剂可以用于治疗相关疾病。
蓝莓(Vaccinium spp.)属于杜鹃花科越橘属植物,是一种具有极高经济价值的世界性新兴小浆果果树。蓝莓含有花青素等多种酚类活性物质,使蓝莓果实具有很强的抗氧化活性
[16-19]。花青素被证明是人类历史上最有效的天然抗氧化剂,有增强心脏功能、抗心血管疾病、抗衰老、抗癌及抗突变等多种生理活性功能
[20-25]。本课题组前期的研究
[26-27]表明锦葵色素在兔眼蓝莓(Vaccinium ashei)中是含量最高的花青素,并且具有良好的体外抗氧化活性和抑制内皮细胞炎症因子的作用。因此,本研究进一步探讨氯化锦葵色素(malvidin-Cl,Mv-Cl)在人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)内的抗氧化作用机制,检测其对内皮细胞ROS和XO-1产生的作用。
1 材料与方法
1.1 材料与试剂
人脐静脉内皮细胞 上海中乔新舟生物科技有限公司;氯化锦葵色素(Mv-Cl)、血管紧张素Ⅱ(angiotensinⅡ,AngⅡ) 美国Sigma公司。
DMEM高糖培养液、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)-胰酶、胎牛血清 美国Gibco公司;ROS检测试剂盒、硝酸纤维素膜、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF) 碧云天生物技术有限公司;Western blotting及IP裂解液、BCA蛋白浓度测定试剂盒、XO-1一抗、β-actin一抗、辣根过氧化酶标记兔二抗、辣根过氧化酶标记鼠二抗 武汉博士德公司;XO-1酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)试剂盒 上海博谷生物科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
Airtech超净工作台 苏州安泰空气技术有限公司;CO
2细胞培养箱 美国热电公司;Berthold LB941微孔板式多功能分析仪 德国Berthold Technologies公司;电子分析天平 上海精密科学仪器有限公司;全自动电热高压力蒸汽锅 上海申安医疗器械厂;TDZ5-WS水平离心机 上海沪湘仪器有限公司;3K15离心机 德国Sigma公司;IX53倒置荧光显微镜 日本Olympus公司。
1.3 方法
1.3.1 HUVEC培养
取出液氮中保存的HUVEC,用含有体积分数10%胎牛血清、2%青链霉素的DMEM高糖培养液在37 ℃、5% CO
2培养箱中复苏细胞,再用0.25% EDTA-胰酶进行消化,细胞计数、传代、冻存。选择生长良好的3~7 代细胞用于实验。
1.3.2 Mv-Cl处理HUVEC
待细胞长至80%~90%融合时,进行细胞消化制备成细胞悬液,取10 μL于血球计数板上计数,调整细胞浓度为1×10
6个/mL。
6 孔板培养HUVEC,设立以下分组:空白组(仅加入二甲基亚砜(dimethyl sulfoxide,DMSO)),AngⅡ刺激组(10
-2μmol/L),终浓度为1、5、10 μmol/L Mv-Cl组(分别命名为M1组、M5组、M10组),以及终浓度为1、5、10 μmol/L Mv-Cl联合AngⅡ刺激(10
-2μmol/L)组(分别命名为M1A组、M5A组、M10A组)。预先加入不同浓度的Mv-Cl处理18 h,加入或不加入AngⅡ再培养6 h,测定细胞各项指标变化。
1.3.3 细胞活力测定
收集对数期HUVEC,制备细胞悬浮液,每孔100 μL接种于96 孔板中,5% CO
2、37 ℃培养,待长满至孔底时,弃去培养液,换无血清培养基培养至细胞处于同步生长状态。加入不同浓度Mv-Cl刺激18 h,随后加入AngⅡ刺激8 h。每孔加入5 mg/mL四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)溶液10 μL,继续培养4 h。终止培养,小心弃去孔内的培养液。每孔加入100 μL DMSO,置摇床上低速振荡10 min,使结晶物充分溶解;在酶标免疫检测仪上于490 nm波长处测定各孔的光密度(OD)值。同时设置空白组(只加入培养基、MTT、DMSO)重复3 次实验,按照下式计算HUVEC的细胞活力。
1.3.4 荧光免疫法测定细胞中ROS水平
按照1.3.2节方法刺激HUVEC 24 h后,弃去上清液,在无菌条件下装载2’,7’-二氯荧光黄双乙酸盐(2’,7’-dichlorodihydrofluorescein diacetate,DCFH-DA)探针(终浓度10 μmol/L),37 ℃细胞培养箱内孵育20 min,用无血清DMEM培养液或无菌磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤细胞3 次,以充分去除未进入细胞内的DCFH-DA。在暗室中用倒置荧光显微镜进行荧光拍照观察各组细胞中ROS水平,并用Berthold LB941荧光酶标仪在激发波长485 nm、发射波长535 nm检测荧光强度,以荧光强度值(arbitrary unit,a.u.)表示细胞中ROS水平(以β-actin为内参)。操作严格按照试剂盒说明书步骤进行。
1.3.5 ELISA法测定细胞上清液中XO-1含量
HUVEC经不同分组药物刺激后,取细胞上清液,按一定比例稀释,根据ELISA试剂盒说明书方法进行操作,在酶标仪上于450 nm波长处测定OD值。
根据样品的OD值在标准曲线上找出对应的蛋白质水平,乘以稀释度计算样品的最终蛋白质水平,测定出样品XO-1含量(以β-actin为内参)。
1.3.6 Western blotting测定细胞中XO-1含量
弃去6 孔板中培养液,裂解细胞得到蛋白样品,12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)检测XO-1含量。聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜进行1.5 h湿转,取膜37 ℃封闭、一抗孵育各1 h,TBST缓冲液(Tris-HCl缓冲液+吐温)洗涤5 次,每次6 min,37 ℃二抗孵育1 h,TBST缓冲液洗涤,二氨基联苯胺(diaminobenzidine,DAB)显色,拍照,根据凝胶成像系统分析目的蛋白XO-1的含量(以β-actin为内参)。
1.4 数据处理
所有样品进行3 次测定,结果表示为
 ±s。相关性与显著性差异采用SPSS 18.0统计软件进行分析。多组均数间采用单因素方差分析,两两之间比较采用Dunnett-t检验。重复实验结果采用相同的数据处理方法,当P<0.05时表示存在显著性差异。
±s。相关性与显著性差异采用SPSS 18.0统计软件进行分析。多组均数间采用单因素方差分析,两两之间比较采用Dunnett-t检验。重复实验结果采用相同的数据处理方法,当P<0.05时表示存在显著性差异。
2 结果与分析
2.1 不同浓度Mv-Cl对HUVEC的保护作用
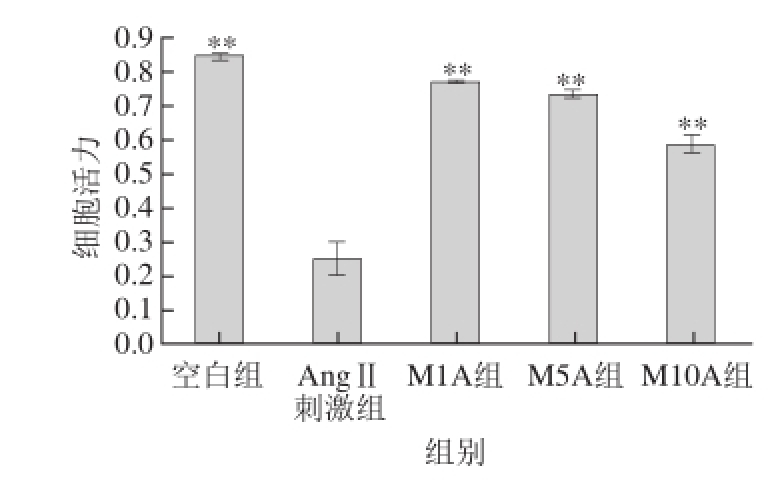
图1 不同浓度Mv-Cl对HUVEC细胞活力的影响
Fig.1 Effects of different Mv-Cl concentrations on HUVEC cell viability
**. 与AngⅡ刺激组相比,差异极显著(P<0.01)。
由图1可知,与空白组相比,AngⅡ刺激组HUVEC的细胞活力受到抑制,说明AngⅡ具有显著的损伤细胞作用;当使用1、10、50 μmol/L Mv-Cl与AngⅡ共同作用于HUVEC时,细胞活力相比AngⅡ刺激组极显著升高(P<0.01),说明Mv-Cl对HUVEC具有一定的保护作用。
2.2 Mv-Cl对HUVEC中ROS水平的影响
Mv-Cl单独处理HUVEC时,细胞中超氧化物水平会降低。随着Mv-Cl浓度的增大,细胞内ROS水平降低(均小于空白组),1、5、10 μmol/L的Mv-Cl处理HUVEC后,细胞内ROS水平分别降低了4%、6%、11%。然而,1、5 μmol/L的Mv-Cl对HUVEC中ROS水平的影响不显著。只有当Mv-Cl浓度达到10 μmol/L时,细胞内的ROS水平才显著降低(P<0.001)(图2)。图3观察结果同样显示M10组荧光强度大幅下降,即HUVEC内的ROS水平明显减少。这表明高浓度的Mv-Cl可以直接作用于HUVEC,抑制细胞中ROS的生成。
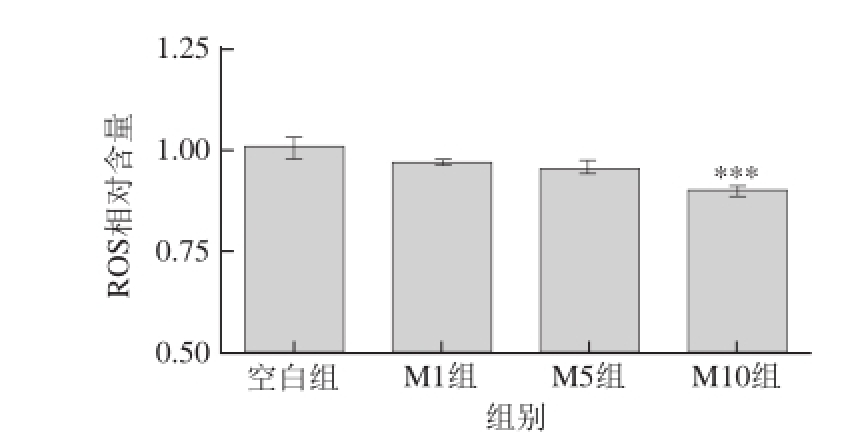
图2 不同浓度Mv-Cl对HUVEC内ROS水平的影响
Fig.2 Effects of different Mv-Cl concentrations on ROS level in HUVECs
***. 与空白组相比,差异高度显著(P<0.001)。

图3 倒置荧光显微镜观察不同浓度Mv-Cl对HUVEC内ROS水平的影响
Fig.3 Effects of different Mv-Cl concentrations on ROS level in HUVECs as observed under inverted fluorescence microscope
a. 空白组;b. M1组;c. M5组;d. M10组。
AngⅡ(10
−2μmol/L)刺激HUVEC后,内皮细胞中超氧化物含量增加。用Mv-Cl预处理HUVEC,可以保护细胞减少氧化应激反应,ROS水平降低。随着Mv-Cl浓度的增大,细胞内ROS含量减小(均小于空白组),1、5、10 μmol/L的Mv-Cl预处理HUVEC后,相对于AngⅡ刺激组,细胞内ROS水平分别降低了12%、18%、20%(P<0.001)。由图4、5可知,Mv-Cl对HUVEC中ROS水平的影响显著,可以完全保护HUVEC免受AngⅡ引起的氧化应激损伤,具有统计学意义。
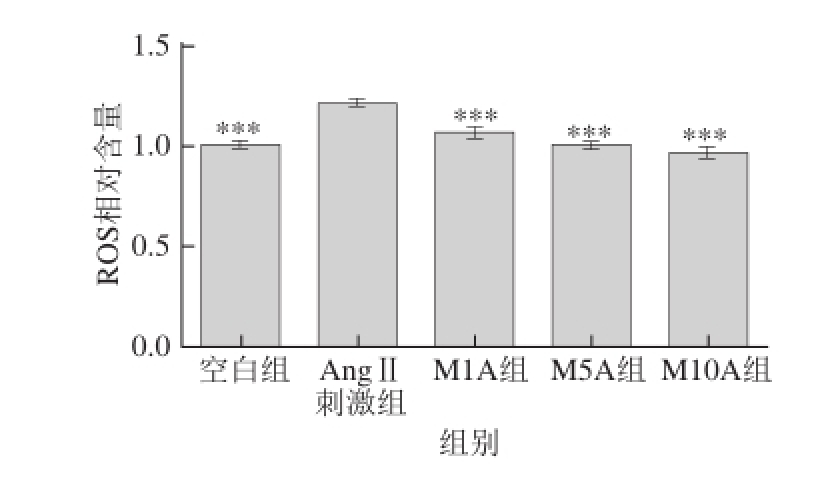
图4 不同浓度Mv-Cl对AngⅡ诱导的HUVEC内ROS水平的影响
Fig.4 Effects of different Mv-Cl concentrations on Ang II-induced ROS level in HUVECs
***. 与AngⅡ刺激组相比,差异高度显著(P<0.001)。

图5 倒置荧光显微镜观察不同浓度Mv-Cl对AngⅡ诱导的HUVEC内ROS水平的影响
Fig.5 Effects of different Mv-Cl concentrations on Ang II-induced ROS level in HUVECs as observed under inverted fluorescence microscope
a. 空白组;b. AngⅡ刺激组;c. M1A组;d. M5A组;e. M10A组。
2.3 Mv-Cl对HUVEC中XO-1含量的影响
由图6可知,与空白组相比,使用Mv-Cl单独处理HUVEC时,细胞上清液中XO-1含量降低(各Mv-Cl浓度组XO-1含量均小于空白组)。空白组HUVEC上清液中XO-1含量为(5.21±0.84) μg/L,1、5、10 μmol/L的Mv-Cl处理细胞后,上清液中XO-1含量分别为(3.53±0.04)、(3.95±0.43)、(4.79±0.26) μg/L,分别为空白组的0.68、0.76、0.92 倍,其中M1组与空白组相比差异显著(P<0.05)。
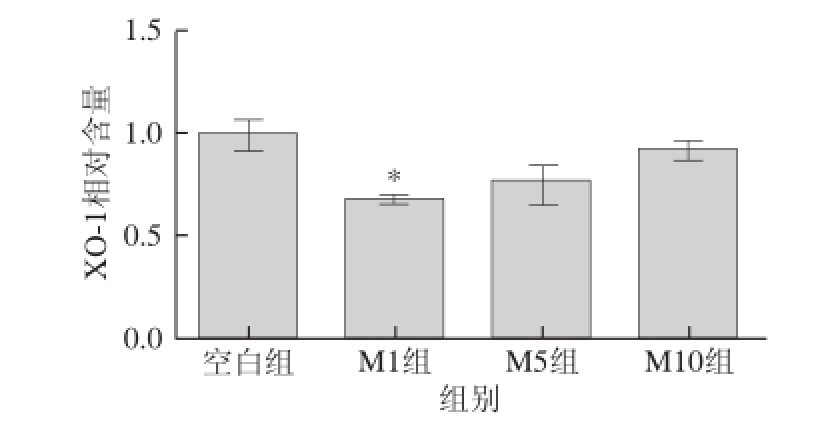
图6 不同浓度Mv-Cl对HUVEC上清液中XO-1水平的影响
Fig.6 Effect of different Mv-Cl concentrations on XO-1 level in culture supernatant of HUVECs
*. 与空白组相比,差异显著(P<0.05)。
Western blotting测定HUVEC中XO-1含量变化也得到相似的结果。由图7可知,空白组细胞的XO-1相对含量为0.69±0.03,1、5、10 μmol/L的Mv-Cl处理细胞后,XO-1相对含量分别为0.61±0.04(P<0.05)、0.59±0.03(P<0.01)、0.68±0.03,分别为空白组的0.88、0.86、0.98 倍。这表明低浓度Mv-Cl可以直接作用于HUVEC细胞,通过减少细胞中XO-1含量来降低细胞中过氧化物的水平,从而达到抗氧化的效果。Mv-Cl浓度过高反而会影响HUVEC细胞的生长,使抗氧化效果减弱。

图7 不同浓度Mv-Cl对HUVEC中XO-1水平的影响
Fig.7 Effects of different Mv-Cl concentrations on XO-1 level in culture supernatant of HUVECs
a. Western blotting结果;b. 蛋白灰度比值分析。*. 与空白组相比,差异显著(P<0.05);**. 与空白组相比,差异极显著(P<0.01)。
由图8可知,AngⅡ(10
-2μmol/L)刺激HUVEC后,内皮细胞上清液中XO-1含量极显著增加(P<0.01)。使用Mv-Cl预处理HUVEC,可以保护细胞,显著抑制氧化应激反应引起的XO-1水平升高。随着Mv-Cl浓度的增大,细胞内XO-1水平先减小后增加,但均低于空白组。空白组的XO-1含量为(7.17±0.18) μg/L,AngⅡ刺激组的XO-1含量为(8.84±0.29) μg/L(为空白组的1.23 倍),1、5、10 μmol/L的Mv-Cl预处理细胞后,再加10
-2μmol/L的AngⅡ刺激,细胞内XO-1含量分别为(6.24±0.01)、(5.35±0.11)、(6.27±0.25) μg/L(P<0.001),分别为空白组的0.87、0.75、0.88 倍。由此可以看出,Mv-Cl对HUVEC中XO-1水平的影响高度显著,完全可以保护HUVEC免受AngⅡ引起的氧化损伤,显著抑制XO-1水平升高,具有统计学意义。Mv-Cl对HUVEC中XO-1水平的影响也随其浓度的升高先增强后减弱,在Mv-Cl浓度为5 μmol/L时,抗氧化活性最强。

图8 不同浓度Mv-Cl对AngⅡ诱导的HUVEC中XO-1水平的影响
Fig.8 Effects of different Mv-Cl concentrations on AngII-induced XO-1 level in culture supernatant of HUVECs
**. 与AngⅡ刺激组相比,差异极显著(P<0.01);
***. 与AngⅡ刺激组相比,差异高度显著(P<0.001)。
3 结 论
本实验以HUVEC为研究对象,通过荧光免疫法、ELISA法及Western blotting法检测了不同浓度的Mv-Cl对HUVEC及AngⅡ刺激(10
-2μmol/L)后的HUVEC中ROS水平变化和XO-1表达量的影响,从分子水平上发现抗氧化物蓝莓花青素Mv-Cl对内皮细胞中ROS和XO-1表达具有显著的抑制作用。蓝莓花青素的抗氧化功能与抑制炎症、保护心血管功能有关,本实验结果表明Mv-Cl可抑制由AngⅡ诱导的内皮细胞ROS和XO-1过表达,降低细胞氧化应激水平,保护血管内皮细胞免受损伤。综上所述,蓝莓花青素Mv-Cl具有抗氧化作用,可作为一种潜在的XO-1抑制剂,对防治心血管疾病起到积极作用,为蓝莓的开发利用提供了一定的理论基础。
参考文献:
[1] GRIENDLING K K, FITZGERALD G A. Oxidative stress and cardiovascular injury part I: basic mechanisms and in vivo monitoring of ROS[J]. Circulation, 2003, 108(16): 1912-1916.
[2] CALHOUN D A, JONES D, TEXTOR S, et al. Resistant hypertension: diagnosis, evaluation, and treatment a scientific statement from the American Heart Association Professional Education Committee of the Council for High Blood Pressure Research[J]. Hypertension, 2008, 51(6): 1403-1419.
[3] LENZ T L, MONAGHAN M S. Lifestyle modifications for patients with hypertension[J]. Journal of the American Pharmacists Association, 2008, 48: 92-102.
[4] KANTEMAN J, SADEFELDMAN M, BANIYASH M. New insights into chronic inflammation-induced immunosuppression[J]. Seminars in Cancer Biology, 2012, 22(4): 307-318.
[5] AVRAM Z E, KRISHNAN E. Hyperuricaemia-where nephrology meets rheumatology[J]. Rheumatology, 2008, 47(7): 960-964.
[6] LANG D, MOSFER S I, SHAKESBY A, et al. Coronary microvascular endothelial cell redox state in left ventricular hypertrophy the role of angiotensin II[J]. Circulation Research, 2000, 86(4): 463-469.
[7] LANDMESSER U, SPIEKERMANN S, DIKALOV S, et al. Vascular oxidative stress and endothelial dysfunction in patients with chronic heart failure role of xanthine oxidase and extracellular superoxide dismutase[J]. Circulation, 2002, 106(24): 3073-3078.
[8] NOMURA J, BUSSO N, IVES A, et al. Xanthine oxidase inhibition by febuxostat attenuates experimental atherosclerosis in mice[J]. Scientific Reports, 2013, 4: 4554.
[9] LANDMESSER U, SPIEKERMANN S, PREUSS C, et al. Angiotensin II induces endothelial xanthine oxidase activation role for endothelial dysfunction in patients with coronary disease[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2007, 27(4): 943-948.
[10] SPIEKERMANN S, LANDMESSER U, DIKALOV S, et al. Electron spin resonance characterization of vascular xanthine and NAD(P)H oxidase activity in patients with coronary artery disease relation to endothelium-dependent vasodilation[J]. Circulation, 2003, 107(10): 1383-1389.
[11] OTTERBEIN L E, CHOI A M K. Heme oxygenase: colors of defense against cellular stress[J]. American Journal of Physiology-Lung Cellular and Molecular Physiology, 2000, 279(6): 1029-1037.
[12] GROSSER N, OBERLE S, BERNDT G, et al. Antioxidant action of L-alanine: heme oxygenase-1 and ferritin as possible mediators[J]. Biochemical and Biophysical Research Communications, 2004, 314(2): 351-355.
[13] POLTE T, ABATE A, DENNERY P A, et al. Heme oxygenase-1 is a cGMP-inducible endothelial protein and mediates the cytoprotective action of nitric oxide[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2000, 20(5): 1209-1215.
[14] BELOVA L A. Angiotensin II-generating enzymes[J]. Biochemistry (Moscow), 2000, 65(12): 1337-1345.
[15] BRIONES A M, TOUYZ R M. Oxidative stress and hypertension: current concepts[J]. Current Hypertension Reports, 2010, 12(2): 135-142.
[16] ERDMANN K, GROSSER N, SCHIPPOREIT K, et al. The ACE inhibitory dipeptide Met-Tyr diminishes free radical formation in human endothelial cells via induction of heme-oxygenase-1 and ferritin[J]. Journal of Nutrition, 2006, 136(8): 2148-2152.
[17] CASTREJÓN A D R, EICHHOLZ I, ROHN S, et al. Phenolic profile and antioxidant activity of highbush blueberry (Vaccinium corymbosum L.) during fruit maturation and ripening[J]. Food Chemistry, 2008, 109(3): 564-572.
[18] ZAFRA-STONE S, YASMIN T, BAGCHI M, et al. Berry anthocyanins as novel antioxidants in human health and disease prevention[J]. Molecular Nutrition & Food Research, 2007, 51(6): 675-683.
[19] LAU F C, BIELINSKI D F, JOSEPH J A. Inhibitory effects of blueberry extract on the production of inflammatory mediators in lipopolysaccharide-activated BV2 microglia[J]. Journal of Neuroscience Research, 2007, 85(5): 1010-1017.
[20] de la SIERRA A, LARROUSSE M. Endothelial dysfunction is associated with increased levels of biomarkers in essential hypertension[J]. Journal of Human Hypertension, 2010, 24(6): 373-379.
[21] AQIL F, GUPTA A, MUNAGALA R, et al. Antioxidant and antiproliferative activities of anthocyanin/ellagitannin-enriched extracts from Syzygium cumini L.(jamun, the Indian blackberry)[J]. Nutrition and Cancer, 2012, 64(3): 428-438.
[22] MIGUEL M G. Anthocyanins: antioxidant and/or anti-inflammatory activities[J]. Journal of Applied Pharmaceutical Science, 2011, 1(6): 7-15.
[23] KALT W, MCDONALD J E, DONNER H. Anthocyanins, phenolics, and antioxidant capacity of processed lowbush blueberry products[J]. Journal of Food Science, 2000, 65(3): 390-393.
[24] BENVENUTI S, PELLATI F, MELEGARI M, et al. Polyphenols, anthocyanins, ascorbic acid, and radical scavenging activity of Rubus, Ribes, and Aronia[J]. Journal of Food Science, 2004, 69(3): 164-169.
[25] MCANULTY S R, MCANULTY L S, NIEMAN D C, et al. Consumption of blueberry polyphenols reduces exercise-induced oxidative stress compared to vitamin C[J]. Nutrition Research, 2004, 24(3): 209-221.
[26] HUANG W Y, WANG J, LIU Y M, et al. Inhibitory effect of malvidin on TNF-α-induced inflammatory response in endothelial cells[J]. European Journal of Pharmacology, 2014, 723: 67-72.
[27] LI C, FENG J, HUANG W Y, et al. Composition of polyphenols and antioxidant activity of rabbiteye blueberry (Vaccinium ashei) in Nanjing[J]. Journal of Agricultural and Food Chemistry, 2013, 61(3): 523-531.
Antioxidant Effect of Blueberry Malvidin Chloride in Human Umbilical Vein Endothelial Cells
XU Liping
1, FU Lin
1,2, HUANG Wuyang
2, LI Chunyang
2,*, ZHU Yunming
2
(1. College of Food Engineering, Harbin University of Commerce, Harbin 150076, China; 2. Institute of Farm Product Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
Abstract:Objective: The effect of malvidin chloride (Mv-Cl) extracted from blueberries on the amounts of reactive oxygen species (ROS) and xanthine oxidase-1 (XO-1) in human umbilical vein endothelial cells (HUVECs) was investigated to explore the antioxidant potential of the anthocyanin compound. Methods: HUVECs were in vitro cultured in the presence of Mv-Cl (1, 5 and 10 μmol/L), angiotensinⅡ(Ang II, 10
-2μmol/L) and their combination, respectively. DMSO was used as control. The ROS content in the cells was detected by immunofluorescence. The soluble XO-1 protein content in the cell culture supernatant was detected by ELISA. The protein expression of XO-1 in the cells was assessed by Western blotting. Results: The content of ROS and the protein expression of XO-1 in HUVECs were decreased when treated with low concentration of Mv-Cl. Ang II significantly increased ROS and XO-1 content, and Mv-Cl appeared to specifically down-regulate the production of ROS and XO-1. Conclusion: Malvidin chloride can prevent endothelial dysfunction by inhibiting ROS and XO-1. Therefore, blueberry anthocyanin may be a new inhibitor of ROS and XO-1, which provides a theoretical basis for the application of blueberry anthocyanins to prevent cardiovascular diseases as a functional food or nutraceutical ingredient.
Key words:blueberry; malvidin; human umbilical vein endothelial cells; reactive oxygen species; xanthine oxidase-1
中图分类号:R329.25;R332
文献标志码:A
文章编号:1002-6630(2015)21-0233-05
doi:10.7506/spkx1002-6630-201521043
收稿日期:2014-12-01
基金项目:2014年江苏省基础研究计划(自然科学基金)面上研究项目(BK20141386)
作者简介:徐丽萍(1963—),女,教授,硕士,研究方向为食品营养与安全。E-mail:xuliping@126.com
*通信作者:李春阳(1966—),男,研究员,博士,研究方向为营养与活性物质,农产品深加工。E-mail:lichunyang968@126.com
 ·)、羟自由基(·OH)及过氧化氢(H
2O
2)等,是生物体内随代谢活动不断产生的。正常情况下,低浓度的ROS能调节血管细胞的功能,对于机体血管维持正常功能是必需的,但是若ROS产生过多或不能迅速消除,则会造成人体组织细胞损伤
[2-3]。血管内皮细胞参与产生的ROS有多种,如黄嘌呤氧化酶-1(xanthine oxidase-1,XO-1)、还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)等
[4-5]。XO-1是嘌呤分解代谢过程中一种很重要的酶,催化黄嘌呤形成尿酸以及次黄嘌呤形成黄嘌呤的氧化过程,反应时会生成过氧化物,引起连锁反应
[6-8]。XO-1已被证实在动脉粥样硬化中是引起内皮细胞损伤的过氧化物的主要来源
[9-10]。内皮细胞中XO-1含量的增加及其产生的超氧化物产物会导致细胞内ROS含量增加,从而引起冠心病、心血管等疾病
[11-15],而XO-1抑制剂可以用于治疗相关疾病。
·)、羟自由基(·OH)及过氧化氢(H
2O
2)等,是生物体内随代谢活动不断产生的。正常情况下,低浓度的ROS能调节血管细胞的功能,对于机体血管维持正常功能是必需的,但是若ROS产生过多或不能迅速消除,则会造成人体组织细胞损伤
[2-3]。血管内皮细胞参与产生的ROS有多种,如黄嘌呤氧化酶-1(xanthine oxidase-1,XO-1)、还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)等
[4-5]。XO-1是嘌呤分解代谢过程中一种很重要的酶,催化黄嘌呤形成尿酸以及次黄嘌呤形成黄嘌呤的氧化过程,反应时会生成过氧化物,引起连锁反应
[6-8]。XO-1已被证实在动脉粥样硬化中是引起内皮细胞损伤的过氧化物的主要来源
[9-10]。内皮细胞中XO-1含量的增加及其产生的超氧化物产物会导致细胞内ROS含量增加,从而引起冠心病、心血管等疾病
[11-15],而XO-1抑制剂可以用于治疗相关疾病。
 ±s。相关性与显著性差异采用SPSS 18.0统计软件进行分析。多组均数间采用单因素方差分析,两两之间比较采用Dunnett-t检验。重复实验结果采用相同的数据处理方法,当P<0.05时表示存在显著性差异。
±s。相关性与显著性差异采用SPSS 18.0统计软件进行分析。多组均数间采用单因素方差分析,两两之间比较采用Dunnett-t检验。重复实验结果采用相同的数据处理方法,当P<0.05时表示存在显著性差异。







