蛹虫草对紫外诱导果蝇氧化损伤的保护作用
黄雅琴
1,2,李尽哲
1,*,段鸿斌
1,殷东林
1
(1.信阳农林学院生物与制药工程学院,河南 信阳 464000;2.郑州大学 河南省离子束生物工程重点实验室,河南 郑州 450052)
摘 要:为了探讨蛹虫草对紫外辐射所致氧化损伤果蝇的保护作用,以不同质量分数的蛹虫草培养基饲养经不同时间紫外辐射的果蝇,观察统计其体内的超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛(malondialdehyde,MDA)含量。结果表明:蛹虫草粉质量分数为0.4%的培养基能极显著提高紫外辐射20 min雄果蝇的SOD活性(13.09%,P=0.005 9<0.01)并极显著降低MDA含量(17.11%,P=0.003 2<0.01);蛹虫草粉质量分数为0.2%的培养基能极显著提高紫外辐射40 min雄果蝇的SOD活性(8.99%,P=0.006 6<0.01)并极显著降低MDA含量(9.06%,P=0.006 1<0.01);蛹虫草对雄性果蝇的抗氧化保护作用优于对雌性的。由此可见,适宜质量分数的蛹虫草粉能够修复紫外辐射对果蝇造成的损伤,对机体起到抗氧化保护作用。
关键词:蛹虫草;紫外辐射;果蝇;超氧化物歧化酶;丙二醛
蛹虫草(Cordyceps militaris)为子囊菌亚门,麦角菌目,麦角菌科,虫草属的模式种,又名北冬虫夏草、北虫草等。它含有大量的虫草素、虫草酸、虫草多糖,是国际医学界公认的人体免疫增强剂,能提高肝脏解毒能力和机体抗病毒、抗辐射能力,还能清除自由基、扩张血管、消除黄褐斑、老年斑,抗衰防皱
[1]。现有的众多研究也表明,多糖具有免疫调节、抗辐射、抗突变、抗衰老等多种药理作用,比如枸杞多糖、黑木耳多糖、海带多糖、松茸多糖等,因此,目前多糖正作为一种天然有效的辐射防护剂,被越来越多的人所关注
[2]。
紫外线是一种由原子的外层电子受到激发后产生的电磁波,波长比可见光短,能引发多种生物学效应,过量的紫外线照射能够诱发白内障,使皮肤老化粗糙,产生皱纹、斑点,甚至造成皮肤癌
[3-7]。已有研究表明,紫外线能对亚油酸
[8]、脂质体
[9]、小白鼠血液免疫酶
[10]、家兔皮肤
[11]产生氧化性损伤。在真菌中,前人已研究过灰树花
[12]、香菇
[13]、灵芝
[14]、红菇
[15]、银耳
[16]、滑子菇
[17]的抗辐射保护作用,对于蛹虫草,前人只做过体外抗氧化分析
[18]和小鼠的抗氧化酶活性研究
[19],然而,将蛹虫草作为抗辐射保护剂的开发,目前在国内还是一片空白,虫草多糖能否抗紫外线辐射及其抗辐射效果如何也有待探索。本实验以紫外线为诱变源,以野生果蝇为受试动物,研究蛹虫草对辐射处理后果蝇体内的超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛(malondialdehyde,MDA)含量的影响,旨在为蛹虫草作为辐射保护剂的开发利用提供科学参考。
1 材料与方法
1.1 材料与试剂
野生型果蝇由信阳师范学院生命科学学院遗传学教研室友情赠送。蛹虫草采自信阳农林学院应用真菌实训基地。样品的制备:将蛹虫草40 ℃烘12 h至恒质量,粉碎后过50 目筛备用。
无水乙醇 武汉市中天化工有限责任公司;琼脂粉上海医学化验所试剂厂;蔗糖 天津市科密欧化学试剂有限公司;丙酸 天津市德恩化学试剂有限公司;安琪酵母粉、乙醚 天津市津梅化工有限公司。以上所有试剂均为国产分析纯。SOD测定试剂盒、MDA测定试剂盒南京建成生物工程研究所。
1.2 仪器与设备
ZF系列紫外透射反射仪(电源:220 V,50 Hz;功率:6 W;波长:302 nm) 上海康华生化仪器制造有限公司;GXM-400D型智能光照培养箱、DHG-9023AS型电热恒温鼓风干燥箱 宁波东南仪器有限公司;FA2104N电子分析天平 上海菁海仪器有限公司;电子万用炉 北京市永光明医疗仪器有限公司。
1.3 方法
1.3.1 培养基的制备
基本培养基按照每100 mL蒸馏水中添加玉米粉11.2 g、蔗糖8.9 g、琼脂1.0 g、丙酸0.8 mL、干酵母粉1.0 g的比例配制。设基本培养基为对照(CK),在CK的基础上配制不同质量分数的蛹虫草培养基,将蛹虫草粉添加于刚煮沸的基本培养基中,然后分装、冷却、凝固,使蛹虫草粉终质量分数为0.1%、0.2%、0.4%,分别命名为Ⅰ、Ⅱ、Ⅲ。
1.3.2 果蝇分组和紫外辐射
收集8 h内羽化的未交配的果蝇,乙醚麻醉后区分雌雄,转移到基本培养基和3 个蛹虫草培养基中培养3 d,每组雌、雄果蝇各60 只,共8 瓶。3 d后,麻醉果蝇,每组雌、雄果蝇再分别分成3 份(每份20 只),转移到空的100 mL容量三角瓶(高约10 cm)中,用纱布包扎封口。先将紫外透射反射仪打开,预热10 min,再将装有果蝇的三角瓶倒置在反射仪暗箱中央的玻璃板上,每组的3 份雌、雄果蝇,第1份不辐照,第2份辐照20 min,第3份辐照40 min。辐照结束后用乙醚麻醉果蝇,将每一份果蝇再等分成两份,一份直接用于测定各项指标,另一份转移到各自相应的培养基中,于培养箱中25 ℃暗培养10 d,测定各项指标。本实验重复3 次,所有数据取平均值。
1.3.3 果蝇体内SOD活性和MDA含量的测定
每组称取雌雄果蝇各40 mg,加0.5 mL生理盐水,在冰浴中以2 000 r/min匀浆10 s,间歇10 s,反复进行3 次,制成匀浆;按照试剂盒说明书方法测定每组果蝇组织蛋白质含量(双缩脲法,mg/mL)、SOD活性(黄嘌呤氧化酶法,U/mg pro)及MDA含量(TBA法,nmol/mg pro)。
1.4 数据统计分析
应用SPSS 13.0数据处理软件对实验数据进行t检验,分析差异显著性(P<0.05表明差异显著;P<0.01表明差异极显著;P>0.05表明无显著差异)。
2 结果与分析
2.1 蛹虫草对紫外辐射果蝇体内SOD活性的影响
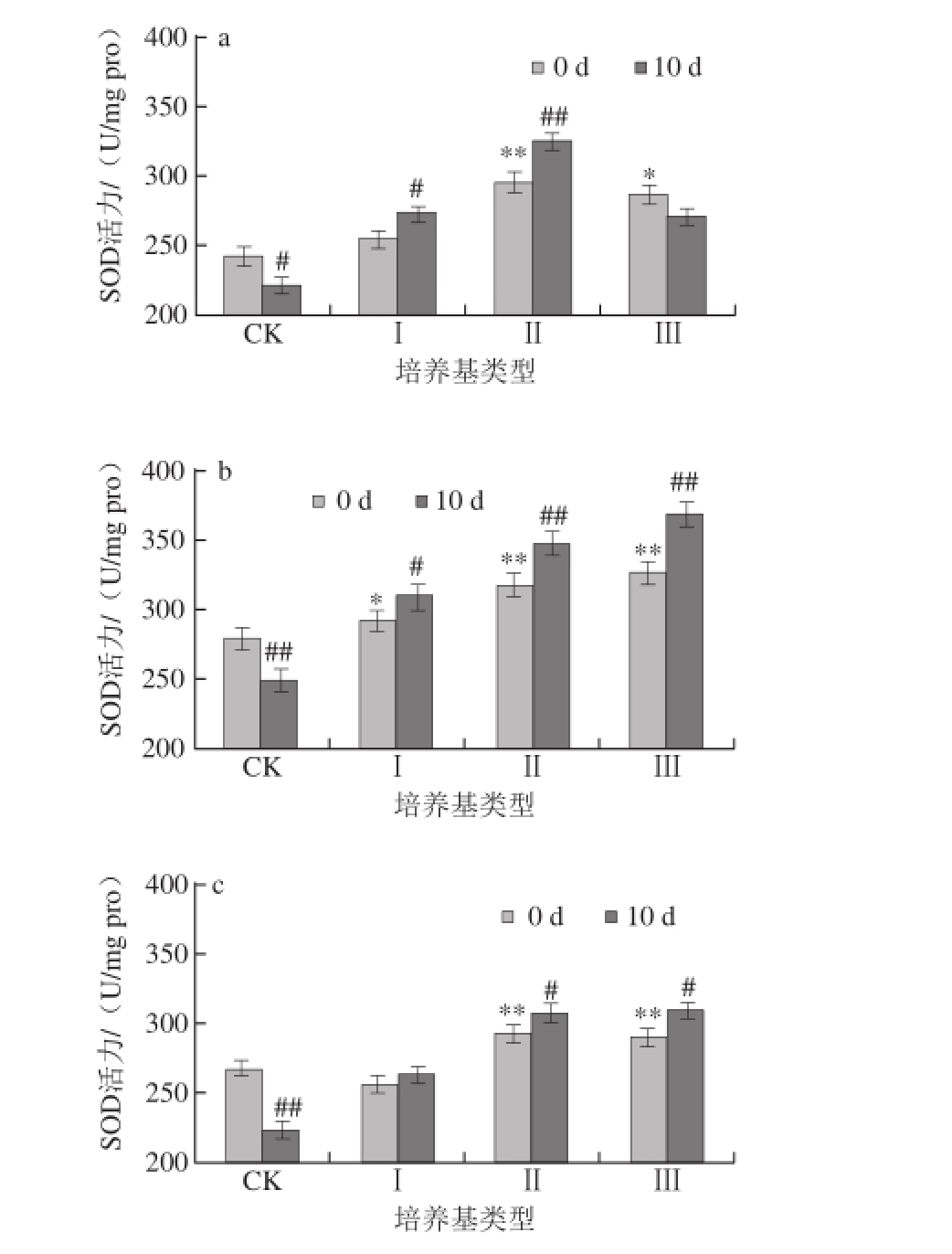
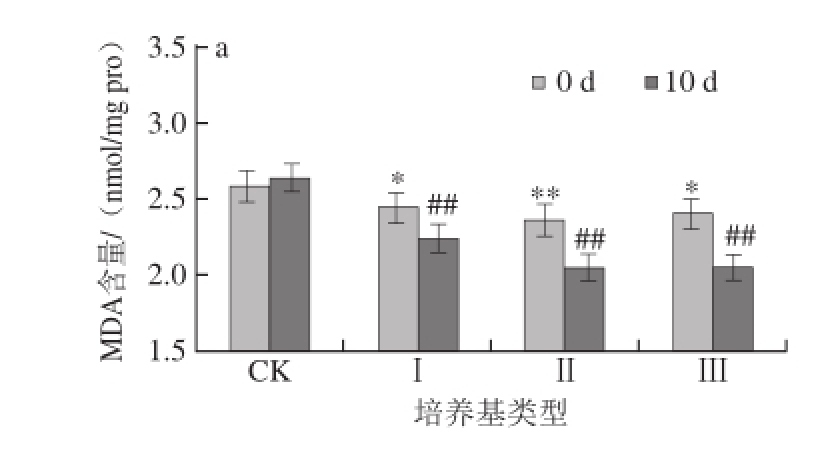
图1 蛹虫草对经紫外辐射的雌性果蝇体内SOD活性的影响
Fig.1 Effect of Cordyceps militaris on SOD activity in female Drosophila melanogaster after UV radiation
a. 不辐照;b. 辐照20 min;c. 辐照40 min;*. 与培养0 d的CK组比较,差异显著(P<0.05);**. 与培养0 d的CK组比较,差异极显著(P<0.01);#. 与相同培养基培养0 d比较,差异显著(P<0.05);##. 与相同培养基培养0 d比较,差异极显著(P<0.01)。下同。
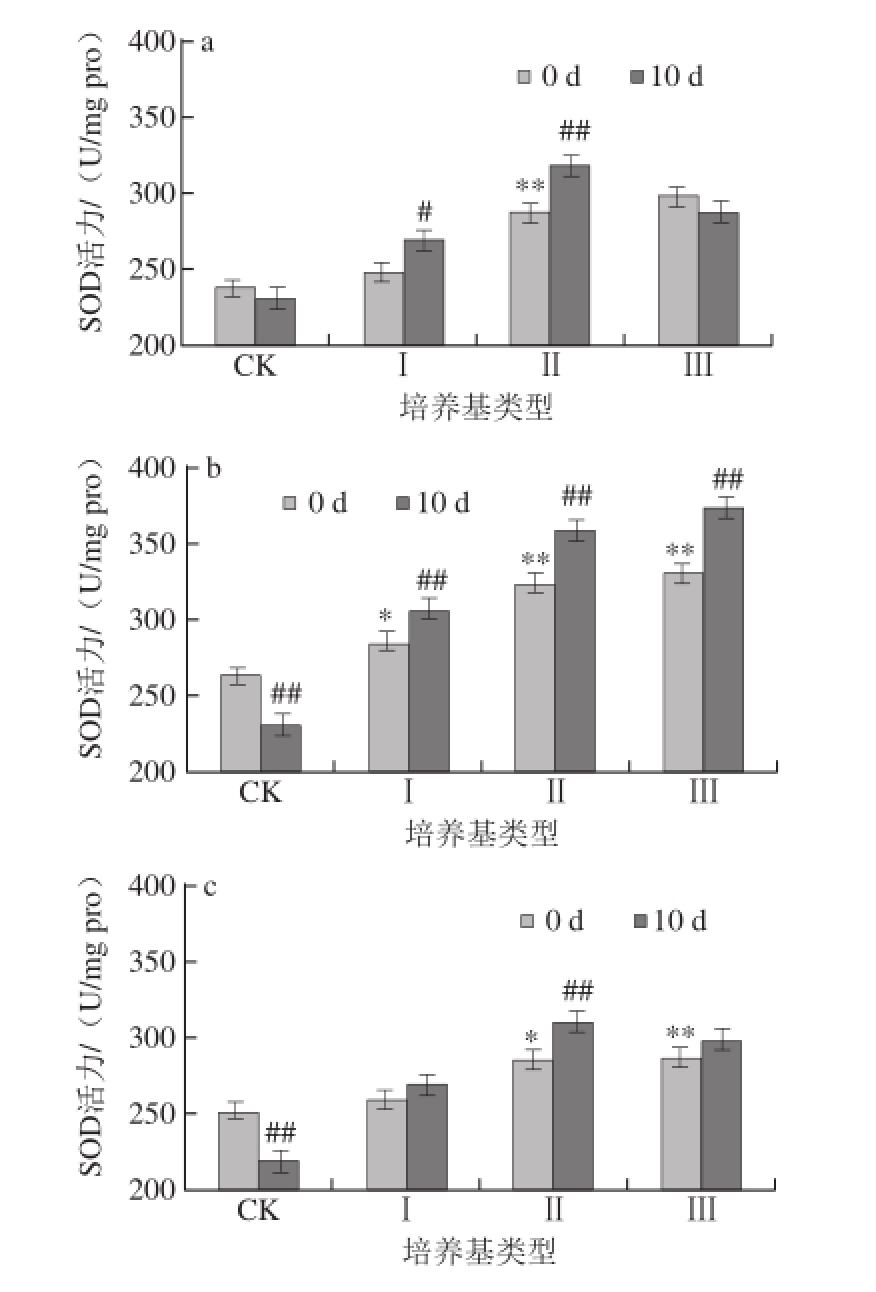
图2 蛹虫草对经紫外辐射的雄性果蝇体内SOD活性的影响
Fig.2 Effect of Cordyceps militaris on SOD activity in male Drosophila melanogaster after UV radiation
如图1、2所示,对雌、雄果蝇体内的SOD活性进行统计分析,发现在辐射刚结束时,果蝇体内的SOD活性表现为随着辐射时间的延长先上升后下降,在CK培养基上培养10 d后,辐射20 min的雌性果蝇体内SOD活力下降10.84%,雄性果蝇体内SOD活力下降12.69%;辐射40 min的雌性果蝇体内SOD活力下降16.52%,雄性果蝇体内SOD活力下降13.09%,均达到极显著水平(P<0.01)。
如图1a、2a所示,将未经辐射的果蝇在不同质量分数的蛹虫草培养基中培养,当培养基类型为Ⅰ和Ⅱ时,10 d后果蝇体内的SOD活力上升,其中Ⅱ型培养基效果最明显,雌性果蝇体内的SOD活力上升10.03%,雄性果蝇体内的SOD活力上升11.02%;当培养基类型为Ⅲ时,10 d后雌性果蝇体内的SOD活力下降5.6%,雄性果蝇体内的SOD活力下降3.38%。由此可见,在未经紫外辐射的情况下,蛹虫草能够提高果蝇体内的SOD活性,其中Ⅱ型培养基效果最佳。
如图1b、2b所示,将辐射20 min的果蝇在不同质量分数的蛹虫草培养基中培养,10 d后果蝇体内的SOD活力均上升,当培养基类型为Ⅱ和Ⅲ时,果蝇体内SOD活力的上升率均达到极显著水平(P<0.01),其中以Ⅲ型培养基效果最明显,雌性果蝇体内的SOD活力上升12.71%,雄性果蝇体内的SOD活力上升13.09%;如图1c、2c所示,辐射40 min的果蝇培养10 d后体内SOD活力均上升,当培养基类型为Ⅱ时,雄性果蝇体内的SOD活力上升率达到极显著水平(P<0.01),为8.99%,雌性果蝇体内的SOD活力上升率达到显著水平(P<0.05),为4.89%;当培养基类型为Ⅲ时,雌性果蝇体内的SOD活力上升率达到显著水平(P<0.05),为6.62%,雄性果蝇体内的SOD活性与辐射后立即测定值差异不显著;当培养基类型为Ⅰ时,雌、雄果蝇体内的SOD活性与辐射后立即测定值差异不显著(P>0.05)。
因此,综合以上分析认为蛹虫草能够提高果蝇体内的抗氧化酶活性,修复短时间辐射所产生的氧化损伤,而长时间的辐射会导致机体自身的抗氧化酶系统被破坏,相应地蛹虫草清除氧自由基的能力也变弱;同时发现,雄性果蝇体内的SOD活性的上升率高于雌性果蝇。
2.2 蛹虫草对紫外辐射果蝇体内MDA含量的影响
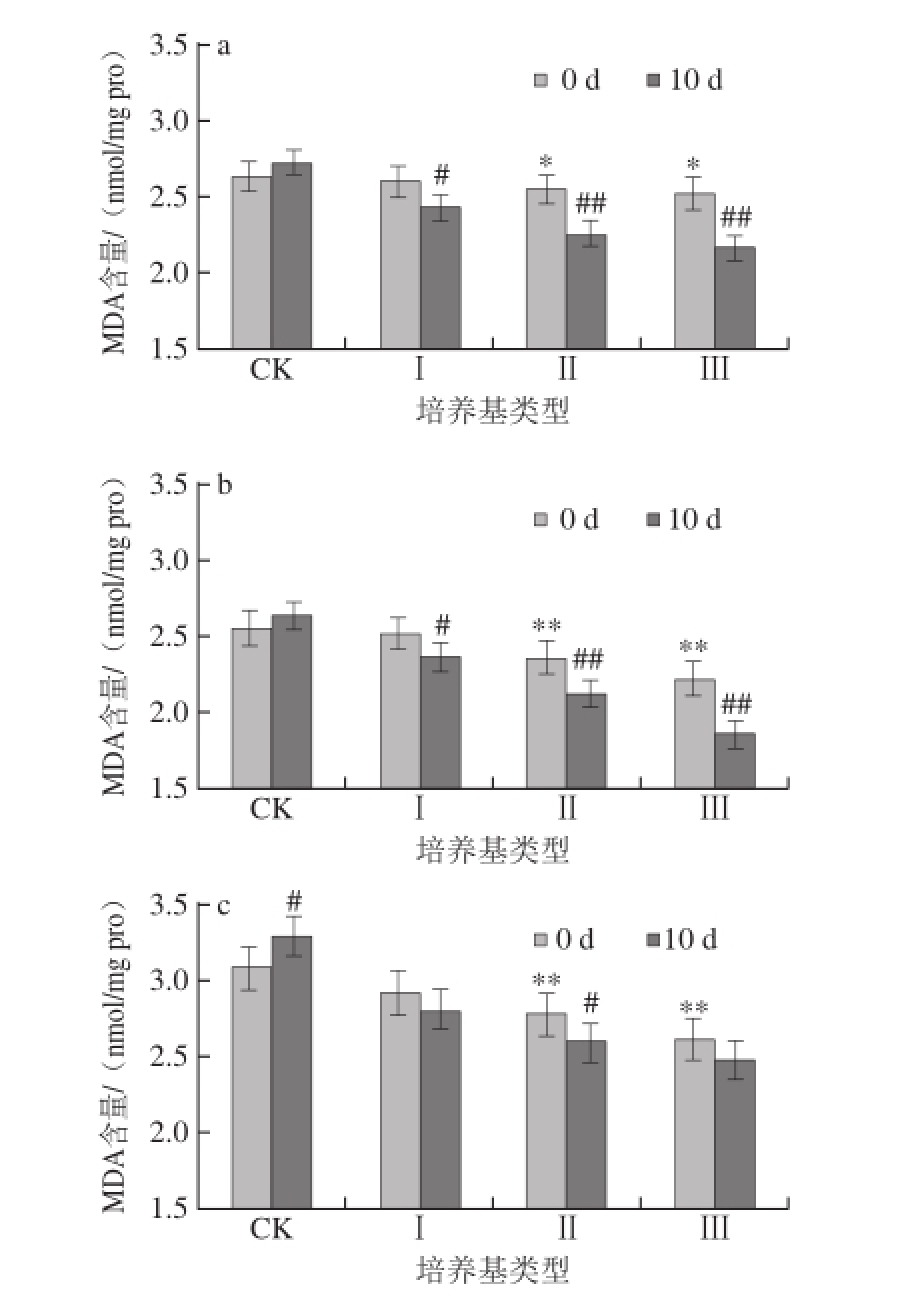
图3 蛹虫草对经紫外辐射的雌性果蝇体内MDA含量的影响
Fig.3 Effect of Cordyceps militaris on MDA content in female Drosophila melanogaster after UV radiation
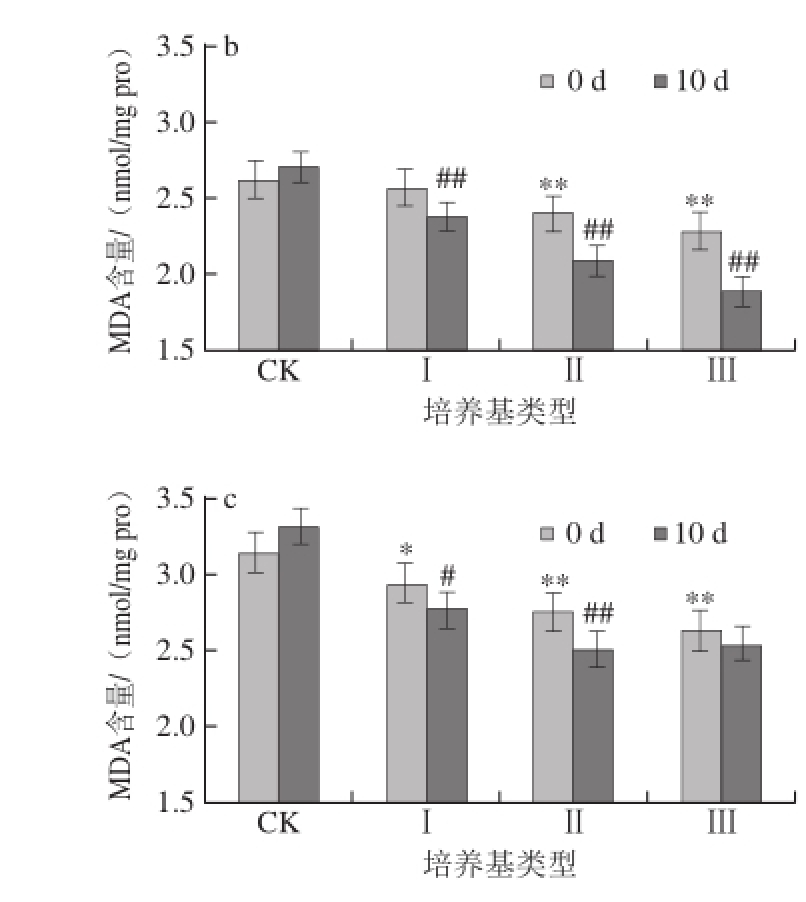
图4 蛹虫草对经紫外辐射的雄性果蝇体内MDA含量的影响
Fig.4 Effect of Cordyceps militaris on MDA content in male Drosophila melanogaster after UV irradiation
如图3、4所示,对雌、雄果蝇体内的MDA含量进行统计,发现在辐射刚结束时,果蝇体内的MDA含量随着辐射时间的延长先下降后上升,在CK培养基上培养10 d后,辐射20 min的雌性果蝇体内MDA含量上升3.14%,雄性果蝇体内MDA含量上升3.04%,但与辐射后立即测定值相比差异均不显著(P>0.05);在CK培养基上培养10 d后,辐射40 min的雌性果蝇体内MDA含量上升6.82%,与辐射后立即测定值相比差异显著(P<0.05),雄性果蝇体内MDA含量上升5.71%,与辐射后立即测定值相比差异不显著(P>0.05)。
如图3a、4a所示,将未经辐射的果蝇在不同质量分数的蛹虫草培养基中培养,当培养基类型为Ⅰ时,10 d后果蝇体内的MDA含量下降最少;当培养基类型为Ⅱ和Ⅲ时,10 d后果蝇体内的MDA含量均下降,并且与辐射后立即测定值相比达差异极显著水平(P<0.01),其中在Ⅲ型培养基上培养10 d后果蝇体内MDA含量下降最多,雌性果蝇体内MDA含量下降13.89%,雄性果蝇体内MDA含量下降14.58%。由此可见,在未经紫外辐射的情况下,蛹虫草能够降低果蝇体内的MDA含量,其中Ⅲ型培养基效果最佳。
如图3b、4b所示,将辐射20 min的果蝇在不同质量分数的蛹虫草培养基中培养,10 d后果蝇体内的MDA含量均下降,当培养基类型为Ⅱ和Ⅲ时,果蝇体内的MDA含量均下降均达到极显著水平(P<0.01),其中以Ⅲ型培养基效果最明显,雌性果蝇体内MDA含量下降16.29%,雄性果蝇体内MDA含量下降17.11%;如图3c、4c所示,辐射40 min的果蝇培养10 d后体内MDA含量均下降,当培养基类型为Ⅱ时,雄性果蝇体内的MDA含量下降率达到极显著水平(P<0.01),为9.06%,雌性果蝇体内MDA含量下降率达到显著水平(P<0.05),为6.83%;当培养基类型为Ⅲ时,雌、雄果蝇体内的MDA含量与辐射后立即测定值差异不显著(P>0.05)。
由此可见,蛹虫草的加入降低了自由基对不饱和脂肪酸的氧化作用,对果蝇体内抗氧化系统起到一定的积极促进效用。同时发现,雄性果蝇体内的MDA含量的下降率高于雌性果蝇。
3 讨 论
前人已研究过紫外线对果蝇的影响,结果表明紫外辐射可诱使果蝇体内自由基水平升高,随辐射时间的延长,果蝇体内MDA含量显著升高
[20]。本研究利用紫外线对果蝇分别照射20 min和40 min,结果表明随着辐射时间的延长,果蝇体内的SOD活性先上升后下降,MDA含量先下降后上升。将未经紫外辐射的雌、雄果蝇培养在不同质量分数的蛹虫草培养基中培养10 d,发现Ⅱ型培养基提高果蝇体内SOD活性的效果最佳,Ⅲ型培养基降低果蝇体内MDA含量的效果最佳,可见蛹虫草质量分数的高低直接影响抗氧化的效果,适宜的蛹虫草质量分数才能达到对果蝇最佳的抗氧化保护作用。
本实验研究了蛹虫草对果蝇紫外辐射的抗氧化保护作用,认为蛹虫草能显著提高果蝇体内的SOD活力,降低MDA含量。这和黑蒜
[21]、乌鸡黑色素
[22]、酸枣提取物
[23]和紫玉米色素
[24]对果蝇的紫外辐射抗氧化保护作用结论相同。同时研究发现,对于短时间辐射,蛹虫草的抗紫外辐射保护作用效果佳,而长时间的辐射会使得果蝇机体自身的抗氧化酶修复系统遭到严重破坏,蛹虫草清除氧自由基的能力也相应减弱。本实验还分别对雌、雄果蝇进行了研究,发现蛹虫草对雄性果蝇的抗氧化保护作用优于对雌性果蝇。由于实验用蛹虫草中虫草多糖、虫草酸、虫草素等物质含量不等,今后还有待于将它们分别提纯,以单一成分来研究其抗辐射效应。本研究的成果为今后开发蛹虫草功能性保健食品提供了科学的理论基础。
参考文献:
[1] 郑壮丽, 黄春花, 梅彩英, 等. 蛹虫草国内外研究的新进展[J]. 环境昆虫学报, 2011, 33(2): 225-233.
[2] 孙艳美, 尤淑霞, 钟秀宏. 多糖抗辐射作用的研究进展[J]. 中国民康医学, 2014, 26(11): 72-73.
[3] MATSUMURA Y, ANANTHASWAMY H N. Molecular mechanisms of photocarcinogenesis[J]. Frontiers in Bioscience, 2002, 7: 765-783.
[4] HERRLING T, JUNG K, FUCHS J. The role of melanin as protector against free radicals in skin and its role as free radical indicator in hair[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2008, 69(5): 1429-1435.
[5] RAVI D, MUNIYAPPA H, DAS K C. Caffeine inhibits UV-mediated NF-κB activation in A2058 melanoma ce1ls: an ATMPKCδ-p38 MAPK-dependent mechanism[J]. Molecular and Cellular Biochemistry, 2008, 308: 193-200.
[6] RAVANAT JL, DOUKI T, CADET J. Direct and indirect effects of UV radiation on DNA and its components[J]. Journal of Photochemistry and Photobiology B: Biology, 2001, 63(1): 88-102.
[7] CHOI J H, BESARATINIA A, LEE D H, et al. The role of DNA polymerase ι in UV mutational spectra[J]. Mutation Research/ Fundamental and Molecular Mechanisms of Mutagenesis, 2006, 599(1): 58-65.
[8] 朱晓蕊, 王卫东, 王俊玲, 等. 紫外辐射对亚油酸的过氧化损伤研究[J].辐射研究与辐射工艺学报, 2009, 27(1): 57-60.
[9] 王宁, 王卫东, 朱晓蕊, 等. 紫外辐射对磷脂和脂质体的过氧化损伤及胆固醇对过氧化损伤的保护作用[J]. 辐射研究与辐射工艺学报, 2007, 25(2): 115-118.
[10] 杨明建, 申海玉, 郭海燕, 等. 紫外辐射对小白鼠血液免疫酶活性的影响[J]. 凯里学院学报, 2011, 29(6): 50-52.
[11] 陈国建, 邹凡凯, 石萌萌, 等. 紫外线A对家兔皮肤的氧化损伤研究[J].现代预防医学, 2014, 41(3): 419-421; 428.
[12] 颜燕, 杨非, 姚文环, 等. 灰树花多糖免疫调节及抗辐射损伤作用研究[J]. 中国辐射卫生, 2010, 19(1): 6-7.
[13] LIU F, OOI V E, CHANG S T. Free radical scavenging activities of mushroom polysaccharide extracts[J]. Life Sciences, 1997, 60(10): 763-771.
[14] PILLAI T G, NAIR C K, JANARDHANAN K K. Polysaccharides isolated from Ganoderma lucidum occurring in Southern parts of India, protects radiation induced damages both in vitro and in vivo[J]. Environmental Toxicology and Pharmacology, 2008, 26(1): 80-85.
[15] 邢增威. 红菇多糖的提取及体外抗氧化抗癌性质研究[D]. 广州: 华南理工大学, 2013: 41-43.
[16] 杨萍. 银耳多糖磷酸酯化结构修饰及辐射防护作用的研究[D]. 北京: 北京协和医学院, 2013: 28.
[17] 向莹. 滑子菇多糖结构和生物活性的研究[D]. 广州: 华南理工大学, 2013: 66-67.
[18] 叶文娇, 冯武, 黄文, 等. 蛹虫草胞外多糖的体外抗氧化活性分析[J].华中农业大学学报, 2014, 33(5): 105-110.
[19] 陈慧婵, 裴斐, 杨文建, 等. 金针菇、香菇和蛹虫草对小鼠体内抗氧化酶活性的影响[J]. 食品科学, 2014, 35(1): 219-223. doi: 10.7506/ spkx1002-6630-201401043.
[20] WANG Z P, LI R F, WANG A R, et al. Phototoxic effect of UVR on wild type, ebony and yellow mutants of Drosophila melanogaster: life span, fertility, courtship and biochemical aspects[J]. Science in China Series C: Life Sciences, 2008, 51(10): 885-893.
[21] 雷萌萌, 张民, 张泽生, 等. 黑蒜对紫外照射损伤果蝇寿命和抗氧化能力的影响[J]. 食品科技, 2014, 39(8): 87-90.
[22] 王哲鹏, 邓学梅, 王安如. 乌鸡黑色素对果蝇的紫外辐射保护作用[J].中国农业大学学报, 2007, 12(1): 17-21.
[23] 张泽生, 邵婵, 胡莎. 酸枣提取物对紫外损伤果蝇抗衰老的作用[J].中国老年学杂志, 2013, 33(22): 5642-5644.
[24] 曾慕衡, 张雅君, 梁佳勇. 紫玉米色素对果蝇紫外辐射的保护作用[J].核农学报, 2013, 27(5): 619-622.
Protective Effect of Cordyceps militaris on UV-Induced Oxidative Damage in Drosophila melanogaster
HUANG Yaqin
1,2, LI Jinzhe
1,*, DUAN Hongbin
1, YIN Donglin
1
(1. College of Biological and Pharmaceutical Engineering, Xinyang College of Agriculture and Forestry, Xinyang 464000, China; 2. Henan Provincial Key Laboratory of Ion Beam Bio-engineering, Zhengzhou University, Zhengzhou 450052, China)
Abstract:In order to study the protective effect of Cordyceps militaris against ultraviolet radiation-induced oxidative damage in Drosophila melanogaster, fruit flies were radiated by UV and fed with Cordyceps militaris-supplemented medium at different concentrations. We found that 0.4% Cordyceps militaris powder added to the medium could significantly increase SOD activity (by up to 13.09%, P = 0.005 9) and decrease MDA content (by up to 17.11%, P = 0.003 2) in male fruit flies irradiated by UV for 20 min and that the same effects were obtained for fruit flies with 40 min UV radiation, when 0.2% Cordyceps militaris powder added to the medium, showing an 8.99% in increase SOD activity (P = 0.006 6) and a 9.06% decrease in MDA content (P = 0.006 1). The antioxidant protection of Cordyceps militaris on male fruit flies was better than on the female ones. Thus, the appropriate concentration of Cordyceps militaris powder was able to repair UV irradiation-induced oxidative damage and played an anti-UV radiation role in fruit flies.
Key words:Cordyceps militaris; ultraviolet radiation; Drosophila melanogaster; superoxide dismutase; malondialdehyde
中图分类号:S646.9
文献标志码:A
文章编号:1002-6630(2015)21-0258-05
doi:10.7506/spkx1002-6630-201521048
收稿日期:2015-01-08
基金项目:河南省科技攻关计划项目(132102110047);信阳农林学院青年基金项目(201401010)
作者简介:黄雅琴(1986—),女,讲师,博士研究生,研究方向为辐射生物学。E-mail:hyaqin88@163.com
*通信作者:李尽哲(1982—),男,讲师,硕士,研究方向为生物制药技术。E-mail:xynz1688@163.com