水果蔬菜中常见植物生长调节剂分析检测方法研究进展
郝 杰,冯 楠,姜 洁
*,路 勇
(北京市食品安全监控和风险评估中心,北京 100041)
摘 要:植物生长调节剂是一类广泛应用于现代农业生产的化学物质,能够调节果蔬生长,使之达到增产、丰收等目的,是农业生产中不可缺少的重要手段。近年来,由于超量、超范围滥用植物生长调节剂而造成的食品安全问题时有发生,其安全性及残留问题也引起了广泛关注。相关的研究也不断增多,检测手段层出不穷。本文综述了国内外对植物生长调节剂残留检测的主要分析技术、优缺点及其应用。分别介绍了前处理方法和多种仪器分析方法。并对国内外植物生长调节剂的限量法规进行了简要对比,为相关限量法规及检测标准的制定和研究提供参考。
关键词:植物生长调节剂;检测方法;限量法规
植物生长调节剂(plant growth regulators,PGRs)是一种人工合成的,具有和植物内源性激素相同生理功效和相似化学结构的化学合成物。植物生长调节剂可由产生的部位或组织运送到植物的其他器官,分别或互相协作地调节植物细胞的分裂、伸长,组织与器官分化,开花结果,成熟衰老以及休眠萌发等方面,从而影响植物生长发育,使之达到人们所期望的效果
[1-3]。植物生长调节剂能够有效地“掌控”植物的生长和加强其抗逆性,有效地解决了许多农业生产中常见的技术问题,展现出了良好的高效的调控能力和广阔的应用前景。植物生长调节剂也属于农药的一种,虽大部分毒性较低,但是长期食用含有PGRs的食品,会对人体健康造成潜在的健康危害
[4-6]。从目前来看,植物生长调节剂的残留检测技术正处于起步初期,逐步发展的阶段,而植物生长调节剂的法规制定也逐渐受到重视。本文对食品中常见植物生长调节剂的分析检测技术以及相关的法规情况进行了综述。
1 植物生长调节剂的概况
1.1 植物生长调节剂的分类
植物生长调节剂根据调控生长活动的作用不同,可以分为以下三类
[7]:
第一类,植物生长促进剂。其可以促进植物细胞分裂、分化及伸长生长,促进营养器官生长、生殖器官发育,防止果实脱落,促进植物生根、发芽,诱导单性结实。调控作用与内源植物激素中的生长素、细胞分裂素或赤霉素类似。常见的植物生长促进剂有吲哚-3-乙酸、吲哚-3-丁酸、α-萘乙酸、6-苄基腺嘌呤、4-氯苯氧乙酸、2,4-二氯苯氧乙酸等。
第二类,植物生长抑制剂。其可以抑制植物顶端分生组织生长、植物发芽,消除顶端优势增加侧枝,除灭杂草等。植物生长抑制剂的作用不能通过施加赤霉素所恢复。许多除草剂类的农药,在极低浓度使用时,也可以达到生长抑制剂的作用。调控作用与内源植物激素中的脱落酸相类似。常见的植物生长抑制剂有马来酰肼、草甘双磷、整形素、抑芽唑、抑芽丹、三碘苯甲酸等。
第三类,植物生长延缓剂。其可以抑制植物亚顶端分生组织生长,能抑制节间伸长而不抑制顶芽生长,使得植物茎秆变短变粗,增加叶片的厚度和叶绿素含量等。由于其主要是通过调节植物体内赤霉素的合成,因而其作用可以通过施加赤霉素来恢复。常见的植物生长延缓剂包括:矮壮素、缩节胺、多效唑、丁酰肼、烯效唑、抗倒酯等。
1.2 植物生长调节剂的食品安全风险
大部分植物生长调节剂属于低毒农药的范畴,但由于其广泛应用,且所包含的化合物种类繁多,性质各异,因此毒理性质和残留安全期尚不十分明确。随着人们对PGRs研究的逐步深入,一些对人体健康造成的负面影响和长期危害逐渐明确,例如丁酰肼的水解产物,不对称二甲基肼具有致畸作用
[8],青鲜素和三唑酮被认为具有致癌作用
[9]。对赤霉酸安全性研究显示其具有一定的发育毒性和致畸作用,且目前在芒果种植中也存在果农加大赤霉酸和氯吡脲用量的问题
[10]。在农业生产中广泛使用的2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D)也在美国国家环境保护局的评估中被认为具有眼部刺激性
[11]。另一方面,PGRs对环境也有负面作用,由于自然界中降解PGRs这类化学合成物质的途径较少,因此,PGRs的残留期会比内源性植物激素更长
[12]。且某些PGRs的降解产物具有更为强烈的危害,例如多效唑的微生物降解产物具有致突变作用
[13]。PGRs通过各种途径进入人体,是否在人体内产生慢性毒害或产生致癌、致畸、致突变等危害,各国对此均非常重视,2001年意大利出现23 例因接触某种氢氰酰胺为活性成分的PGRs而导致急性中毒的病人
[14]。而资料显示乙烯利是一种衰老素,长期食用乙烯利催熟且乙烯利含量超标的果蔬,衰老素会在体内沉积,影响健康
[15]。目前普遍认为饮食是人类摄入PGRs类物质的最主要途径。而且会通过食物链进行生物累积和放大,因此处于食物链顶端的人类无疑将受到一定的潜在健康危害。
2 常用植物生长调节剂检测的前处理技术
样品前处理技术在分析技术中是十分重要的一环,通过前处理可以净化样品基质,减少杂质干扰,提高分析检出限。在分析检测过程中,有50%的误差来源于前处理步骤
[16]。食品基质复杂,植物生长调节剂种类复杂,且含量通常为微量甚至痕量级,因此恰当合适的前处理技术显得尤为重要。表1中列出了一些不同的植物生长调节剂前处理方法。
表1 植物生长调节剂检测前处理的多种方法
Table 1 Various pretreatment methods for detecting plant growth regulators

测定化合物样品基质提取方法净化方法回收率/%参考文献氯吡脲葡萄乙腈液-液萃取[17]吲哚-3-乙酸、玉米素、赤霉素棉株80%甲醇(V/V)液-液萃取76.8~81.3[18] 2,4-D、玉米赤霉烯酮、赤霉素、氯吡脲、灭草松葡萄干1∶1(V/V)甲醇-水67.9~114.3[19] 1-萘乙酸、吲哚-3-乙酸、赤霉素苹果、猕猴桃、西瓜、脐橙、葡萄乙酸乙酯QuChERS75.4~112.9[20]赤霉素、吲哚-3-乙酸、吲哚-3-丁酸、脱落酸毛竹笋99∶1(V/V)甲醇∶甲酸ODS C
18-固相萃取柱75.2~105.0[21] 2,4-D、赤霉素、吲哚-3-乙酸、吲哚-3-丁酸、1-萘乙酸、对氟苯氧乙酸、对氯苯氧乙酸橙含2%甲酸-乙腈溶液Poly-Sery MAX固相萃取柱79.6~110.3[22]赤霉素、氯吡脲、萘乙酸、玉米素、乙烯利、丁酰肼、抑芽丹、矮壮素苹果,香蕉乙腈Certify II固相萃取柱70.0~101.0[23]矮壮素、助壮素、6-苄基腺嘌呤、多效唑、烯效唑、莠去津、西玛津番茄、苹果、梨、米、荞麦、黄豆、白菜90∶10(V/V)甲醇-水溶液WCX固相萃取柱80.2~119.3[24]吲哚-3-乙酸、水杨酸、脱落酸、吲哚-3-丁酸椰子汁分散液-液微萃取82.1~112.6[25]西玛津、莠去津、甲萘威、三唑酮、多效唑、烯效唑、戊唑醇苹果、番茄、玉米乙腈QuEChERS74.8~109.2[26] 16 种植物生长调节剂黄瓜、茄子、豆芽、番茄、梨、桃、西瓜、苹果AOAC 2007.1方法HILIC固相萃取柱80.5~119.2[27]
浸提法是最简单的提取方法,根据目标化合物的不同,对提取溶剂进行优化以及辅以超声等手段后可以满足浸提的需要,但是缺点在于提取的专一性不强,通常会提取出大量脂溶性色素、蛋白或者其他杂质分子等。因此浸提法适用于色素、脂肪含量较低的果蔬基质,通常作为前处理工作中第一步的目标物质提取手段。对于大部分植物生长调节剂,采用甲醇、乙腈、与水的混合液或者经酸化的提取剂进行提取
[28]。
在净化方面,液-液萃取法为经典的前处理方法,通过化合物在两相中分配系数的不同起到富集和净化的效果。液-液萃取的方法通常用于去除脂肪等杂质的净化步骤中,由于工作繁复,溶剂易耗,费时费力,稳定性差等原因,逐渐的被更高效的前处理方法所取代。Pan Xiangqing等
[29]使用二氯甲烷对提取液进行液-液萃取之后进行检测,检出了生长素、脱落酸和茉莉酸等。
固相萃取(solid-phase extraction,SPE)技术是一种常用于食品中微量痕量物质检测的前处理技术,相比传统的处理技术,具有溶剂节约、回收率高、组间差异小等特点。常见用于植物生长调节剂的固相萃取柱有C
18柱
[30]、亲水亲脂平衡柱
[31]、中性氧化铝柱
[32]、弗罗里硅土柱
[33]等。对于复杂基质的样品,一根固相萃取柱可能达不到较好的净化效果,会采取多柱串联的净化策略
[30,34-35]。
基质分散固相萃取技术是近年新兴的前处理技术,最初用于果蔬中的农药残留检测,后被推广至更大范围和基质中使用。由于植物生长调节剂是属于农药的范畴,因此,QuEChERS技术在植物生长调节剂的检测技术上也广为应用,Valverde等
[36]使用QuEChERS技术进行预处理,使用液相色谱飞行时间质谱仪(liquid chromatographytime of flight/mass spectometry,LC-TOF/MS)对西瓜、番茄和西葫芦中的氯吡脲进行了定量测定。黄何何等
[37]使用QuEChERS前处理结合液-质联用,进行了21 种植物生长调节剂的快速筛查。
另外,也有一些独特的前处理技术运用于食品中植物生长调节剂的检测。吴刚等
[38]使用加速溶剂萃取(accelerated solvent extractor,ASE)技术对棉花中噻苯隆、脱落酸等8 种脱叶剂进行了测定。孔德洋等
[39]使用加速溶剂萃取,自动凝胶渗透色谱(gel permeation chromatography,GPC)净化对水稻中萘乙酸的残留量进行了测定。
3 常见植物生长调节剂的仪器分析技术
3.1 气相色谱(gas chromatography,GC)及气-质联用法(gas chromatography-mass spectometry, GC-MS)
GC法是分析农药残留的常用手段,用于测定易挥发性的农药,在植物生长调节剂的检测方面,多用于乙烯利的测定
[40]。Tseng等
[41]根据乙烯利在高温下分解生成乙烯的特性,使用顶空气相色谱法分析了苹果、番茄、葡萄、猕猴桃和甘蔗中的乙烯利残留。储晓刚等
[42]也使用顶空气相色谱测定了浓缩菠萝汁中的乙烯利。顶空进样法前处理极为简单,且方法灵敏稳定,非常适用于食品中乙烯利的检测。另外也有使用GC法测定其他植物生长调节剂的报道,包括有气相色谱-电子捕获检测器测定丁酰肼
[43-44]、三碘苯甲酸
[45]、2,4-D
[46-47]、抗倒胺
[48],气相色谱-火焰离子化检测器测定赤霉酸
[49]、萘乙酸
[50],气相色谱-氮磷检测器测定丁酰肼残留
[51]。
GC-MS法具有更强的定性能力和更低的检出限。在植物生长调节剂的测定方面也有较多应用。在测定乙烯利的实验中,Tseng等
[41]所能达到的检出限为0.1 mg/kg,而Shigeyuki
[52]使用GC-MS法对多种果蔬乙烯利残留进行测定,检出限可低至11 pg,达到了极佳的效果。GC-MS法也开始进行多残留检测的应用,吴平谷等
[53]测定了豆芽中10 种植物生长调节剂的残留,Claudia等
[54]对烟草根中吲哚-3-乙酸、脱落酸、茉莉酸、水杨酸进行了测定。
随着仪器及技术的进步,使用GC及GC-MS法在植物生长调节剂检测方面的研究越发广泛,具有高灵敏度、进样量小等特点,适用于挥发性、热稳定性的植物生长调节剂分析,例如乙烯利等。但由于多数植物生长调节剂具有分子质量较大、极性较强、不易挥发或易受热分解等性质,因此若使用气相色谱及气-质联用法,则需进行衍生化前处理,例如矮壮素
[30]、丁酰肼
[43]、2,4-D和α-萘乙酸
[53]等,该方法的应用受到了较大制约。
3.2 高效液相色谱(liquid chromatography,LC)及液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)技术
LC法是分析领域最成熟的检测方法,LC及LC-MS/MS技术是植物生长调节剂最常见的分析方法。与GC相比,LC技术前处理较为灵活、简便、无需衍生化反应,与质谱检测器联用后,更可以达到较低的检出限和更强大的定性能力。张莹
[55]详细研究了果蔬中多种植物生长促进剂残留的LC和LC-MS/MS测定方法。Hu Jiye等
[56]使用HPLC-二极管阵列检测器(diode array detector,DAD)建立了卷心菜和土壤样品中双酰肼类植物生长调节剂JS-118的测定方法,陆益民等
[57]建立了西瓜中2,4-D、赤霉素、多效唑及6-BA的分析方法。HPLC-UV/DAD方法在多残留检测方面也作出了一些尝试,周艳明等
[58]使用HPLC-DAD法对7 种果蔬中常见的植物生长调节剂进行了方法研发,7 种化合物分离良好,且检出限低至0.004 mg/kg。
LC-MS/MS法作为现有的能力最强的定量分析技术,其具有几乎通用的多残留分析能力、更低的检出限、更强的抗基质干扰的能力、以及更为准确的定性能力。LC-MS/MS法在植物生长调节剂检测方面也有广泛应用,且更多的是应用在多残留检测的方面。如黄何何等
[37]建立了21 种植物生长调节剂的检测方法,Cho等
[59]使用低温萃取与串联质谱检测同时分析了豆芽中多菌灵、噻苯咪唑和6-苄基腺嘌呤,Hernandez等
[60]使用LC-MS/MS法测定了多种食物基质中52 种气相色谱法无法测定的植物生长调节剂及其代谢物。
高分辨质谱,是近年来发展起来的新型检测技术,能够提供精确质量数并推算分子式,因此具有了精准的定性能力,更高的分辨力意味着减小了基质效应的影响,从而减少了假阳性发生的几率。这方面的应用报道也越来越多。Akiyama等
[61]使用高分辨飞行时间质谱对柠檬和日本梨中95 种酸性农药进行了筛查方法的建立,其中包括有氯吡脲、噻苯隆和2,4-D等植物生长调节剂。Valverde等
[36]也进行了尝试,使用QuEChERS前处理技术结合飞行时间质谱技术对番茄、西葫芦和西瓜中的氯吡脲进行了测定,达到了10 μg/kg的检出限。
LC及LC-MS/MS技术克服了GC法需繁琐衍生化的缺点,特别是LC-MS/MS技术,既能发挥色谱法的高分离能力,又能发挥串联质谱高灵敏度、高选择性的特点,适合用于复杂基质中多种植物生长调节剂多残留检测分析,但缺点在于检测某些基质中的植物生长调节剂时基质效应较大
[62],为了消除基质效应在痕量植物生长调节剂检测中的影响,在方法开发时多会选择基质匹配标准曲线法进行定量
[18,22]。
3.3 其他分析手段
在经典的GC及LC法之外,还有多种各有特点的分析技术被应用于植物生长调节剂的残留测定。这些方法作用机理各异,所关注的化合物不同,在各自的应用领域也均达到了一定的效果。包括有酶联免疫吸附法(enzyme linked immuno-sorbent assay,ELISA)、毛细管电泳技术、荧光分光比色法、化学发光技术等(表2)。
ELISA具有高特异性、高灵敏度、快速简便、易于推广等优点,但缺点在于较高的假阳性率。吴松茹等
[63]早在1985年就在ELISA技术应用于植物激素的检测方面进行了尝试,其极限量可以达到0.01 pmol,Watanabe等
[64]建立了水稻中抗倒胺的ELISA测定方法,与HPLC和GC方法进行了对比验证,达到了较好的相关性。目前,除乙烯外,几大类的内源激素ELISA检测方法均已建立,并有成套的商业化产品出售
[65]。
毛细管电泳技术是经典电泳技术和微柱技术相结合的产物,不仅分离效率高,时间短,且可以对样品有在线富集的作用,这对微量的植物生长调节剂和内源植物激素非常有利。程远
[66]使用毛细管电泳法双波长测定了4 种生长促进剂,检出限能达到1.2~6 μg/mL。Kubilius等
[67]利用SPE前处理结合毛细管胶束电动色谱技术分析了土豆和洋葱中的马来酰肼,定量限达到2 mg/kg。
比色法是最早应用于植物生长调节剂分析的光谱技术,随着技术发展,引入了荧光分光光度技术,改善了该法的选择性,得到了一定的应用。吴翚等
[68]发现脱落酸在浓硫酸和沸水环境下会发射较强的荧光,据此建立了脱落酸的荧光分析法。该方法应用于柑橘
[69]及马铃薯
[70]中赤霉素的测定也有报道。
化学发光技术是一种基于鲁米诺反应的高灵敏度分析检测技术,之前由于硬件设备的灵敏度较低,技术的应用受到了限制。随着光电检测器的发展,化学发光法逐渐成为一种重要的分析检测手段
[71]。刘丽珍等
[72]用鲁米诺化学发光体系测定了吲哚-3-乙酸。王珊
[73]研究了双水相萃取-流动注射化学发光法测定果蔬中残留α-萘乙酸技术以及分散固相萃取-流动注射化学发光法测定果蔬中氯吡脲残留技术,从结果看,分别达到了3.98 ng/g和0.163 ng/g,取得了较好的效果。
表2 测定植物生长调节剂的多种仪器检测技术
Table 2 Various instrumental techniques for detecting plant growth regulators
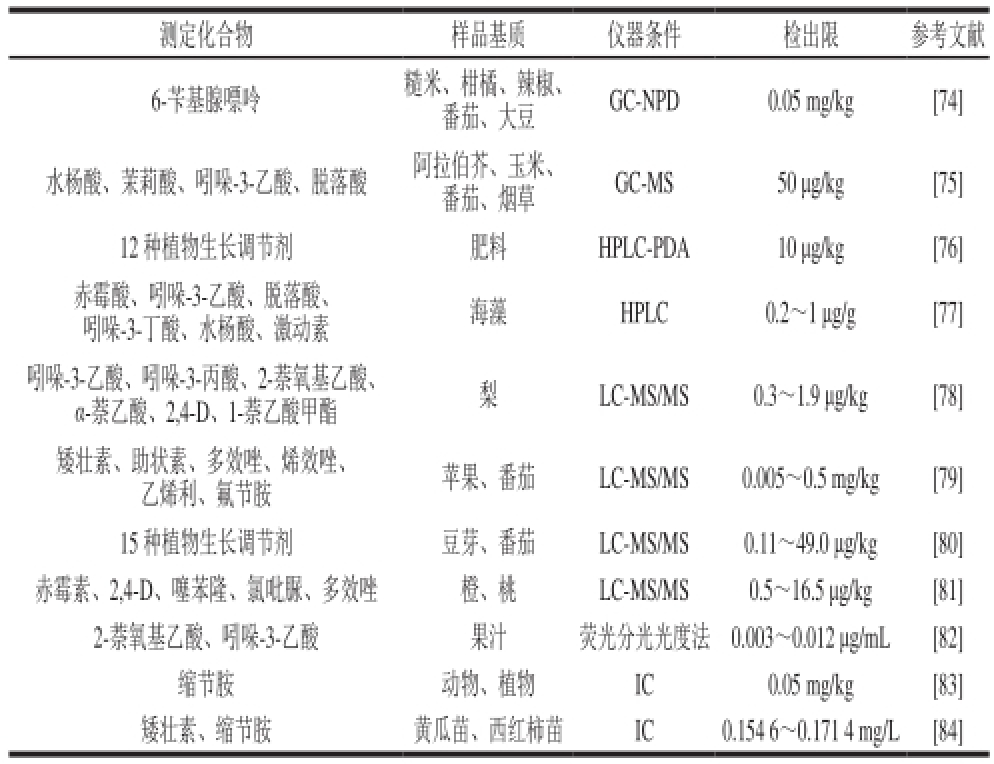
注:NPD.氮磷检测器(nitrogen phosphorus detector);PDA.光电二极管阵列检测器(photo-diode array);IC.离子色谱法(ion chromatography)。
测定化合物样品基质仪器条件检出限参考文献6-苄基腺嘌呤糙米、柑橘、辣椒、番茄、大豆GC-NPD0.05 mg/kg[74]水杨酸、茉莉酸、吲哚-3-乙酸、脱落酸阿拉伯芥、玉米、番茄、烟草GC-MS50 μg/kg[75] 12 种植物生长调节剂肥料HPLC-PDA10 μg/kg[76]赤霉酸、吲哚-3-乙酸、脱落酸、吲哚-3-丁酸、水杨酸、激动素海藻HPLC0.2~1 μg/g[77]吲哚-3-乙酸、吲哚-3-丙酸、2-萘氧基乙酸、α-萘乙酸、2,4-D、1-萘乙酸甲酯梨LC-MS/MS0.3~1.9 μg/kg[78]矮壮素、助状素、多效唑、烯效唑、乙烯利、氟节胺苹果、番茄 LC-MS/MS0.005~0.5 mg/kg[79] 15 种植物生长调节剂豆芽、番茄LC-MS/MS0.11~49.0 μg/kg[80]赤霉素、2,4-D、噻苯隆、氯吡脲、多效唑橙、桃LC-MS/MS0.5~16.5 μg/kg[81] 2-萘氧基乙酸、吲哚-3-乙酸果汁荧光分光光度法0.003~0.012 μg/mL[82]缩节胺动物、植物IC0.05 mg/kg[83]矮壮素、缩节胺黄瓜苗、西红柿苗IC0.154 6~0.171 4 mg/L[84]
4 常用植物生长调节剂的监管现状
4.1 使用方面
近年来,植物生长调节剂应用日益广泛。在世界农药市场中,植物生长调节剂的销售额比率和销售市场逐年增长。我国是世界上应用植物生长调节剂最广泛的国家,主要用作调节农作物的生长发育,提高产量和改良品质。数据显示,20世纪末以来,我国施用植物生长调节剂的量每年的增速达几千吨,而每年施用植物生长调节剂的面积则多年排名世界第一,达到2500多万公顷
[5]。
在农业生产中,植物生长调节剂也被广泛地推广应用,用于调节作物的生育过程,达到稳产增产、改善品质、增强作物抗逆性等目的。已有的科学研究表明,植物生长调节剂的使用,可使蔬果产量增加5%~30%。国际上已把植物生长调节剂的应用作为21世纪农业实现超产的主要措施之一
[85]。然而,由于对其调节增产效果的盲目追求,以及夸张宣传、不当使用等多方面因素,植物生长调节剂滥用的混乱情况时有出现,造成了一些食品安全风险的产生,例如2011年爆发的“西瓜爆炸”事件和“激素黄瓜”事件,特别是各种反季节蔬菜水果的出现尤为突出,个头增大、颜色改变、味道平淡、果体畸形等现象加重了人们对食品安全问题的担忧。
4.2 法规方面
另一方面,植物生长调节剂依然属于农药的范畴,因此,我国在相关法规中也对植物生长调节剂的使用限量进行了明确的规定。在2014年8月1日最新实施的GB 2763—2014《食品安全国家标准 食品中农药最大残留量》中将作为PGRs使用的农药范围扩大到了11 种,使用范围涉及10余种产品
[86]。然而,这与国外相关标准仍然存在一定差距,例如:国际食品法典委员会限量标准中涉及植物生长调节剂8 种,涉及植物产品49 种,动物产品15 种;欧盟限量标准中涉及植物生长调节剂9 种,涉及植物产品694 种,动物产品6 种;美国限量标准中涉及植物生长调节剂14 种,涉及植物产品146 种,动物产品118 种;日本肯定列表中对2,4-D、萘乙酸、对氯苯氧乙酸、矮壮素等多种植物生长调节剂的限量进行了规定,涉及产品351 种。另外,我国不仅在化合物的种类与涉及食品范围上较为局限,在做出规定的限量值上,也较其他国家有所不同
[87-89]。
5 结 语
在现代农业生产中,植物生长调节剂的使用是不可缺少的科学技术手段,但为了避免由利益驱使而导致的违法滥用植物生长调节剂的事件,研究、完善水果蔬菜中植物生长调节剂的分析检测技术是一项重要而艰巨的任务。
作为分析工作中及其重要的一环,前处理技术经历了不断的发展。目前溶剂浸提-固相萃取技术已经成为了果蔬中植物生长调节剂分析的主流前处理技术,其优点在于简单、回收率高、经济等。但无法满足多残留分析中高通量的要求,相比之下基质分散固相萃取技术可以做到在更短的时间内,完成更多中目标化合物的净化工作。但任何一种前处理技术都不是万能的,在实际测定中依然要根据样品特性(色素、脂肪、蛋白含量等)、目标化合物特性(极性、结合状态等)来优化特异性、高回收率的前处理手段。
随着科技进步,仪器分析方法能够不断达到更低的检出限,从而具有更好的选择性。LC-MS/MS技术由于其具有几近通用的多组分分析能力和应对复杂基质的适应性而被推举为痕量检测的第一手段。在农药残留检测领域,LC-MS/MS法已经逐步取代了GC法及GC-MS法,绝大部分的常用植物生长调节剂,均可用LC-MS/MS法来测定,且具有极佳的灵敏度和选择性。
综上所述,QuEChERS法结合LC-MS/MS技术将是果蔬中植物生长调节剂多残留检测分析的首选技术。但其仍有回收率不高、测定某些类样品会伴随较大基质效应等不足,随着检测手段和仪器设备的不断发展,相信其技术手段会不断完善。另外,ELISA法、鲁米诺发光法也将不断完善成熟,发挥其快速、灵敏的特点,成为植物生长调节剂分析的一个重要补充技术。
植物生长调节剂种类繁多,应用广泛,但相应的检测技术手段还有待于继续发展和丰富,同时标准法规还有较为滞后的情况。我国作为农产品大国,需要更积极地建立高灵敏、高精确、多组分的高效检测技术,科学地对植物生长调节剂的使用和相关法律法规的制定提出依据,更好地指导规范植物生长调节剂的使用,同时也能够打破针对我国的出口贸易壁垒。通过对植物生长调节剂的科学合理使用,使之成为现代科学农业的好帮手,也能够让广大消费者吃的安心,吃的放心。
参考文献:
[1] GIANAKOULA A E, ILIAS I F, DRAGISIC MAKSIMOVIC J J, et al. The effects of plant growth regulators on growth, yield, and phenolic profile of lentil plants[J]. Journal of Composition and Analysis, 2012, 28(1): 46-53.
[2] THIMANN K V, 王熊. 植物生长物质的过去、现在和未来[J]. 植物生理学通讯, 1964(5): 51-57.
[3] 张锋, 潘康标, 田子华. 植物生长调节剂研究进展及应用对策[J]. 现代农业科技, 2012(1): 192-195.
[4] 何瑞, 刘艾平, 曹玉广. 植物生长调节剂使用中的安全问题[J]. 中国卫生监督杂志, 2003, 10(2): 99-101.
[5] 赵敏, 邵凤赟, 周淑新, 等. 植物生长调节剂对农作物和环境的安全性[J]. 环境与健康杂志, 2007, 24(5): 370-372.
[6] 徐爱东. 我国蔬菜中常用植物生长调节剂的毒性及残留问题研究进展[J]. 中国蔬菜, 2009(8): 1-6.
[7] 黄何何. 水果中植物生长调节剂残留检测及其筛查技术研究[D]. 福州: 福建农林大学, 2014: 4-5.
[8] 梁显菊. 比久对遗传作用的影响及其在加工中动态变化研究[D]. 重庆: 西南大学, 2009: 2-3.
[9] 潘瑞炽. 重视植物生长调节剂的残毒问题[J]. 生物学通报, 2002, 37(4): 4-7.
[10] 郭利军, 范鸿雁, 何凡, 等. 芒果常用植物生长调节剂毒性和残留研究进展[J]. 中国果树, 2014(3): 78-81.
[11] United State Environment Protection Agency. Reregistration eligibility decision for 2,4-D[R]. Washington: USEPA, 2005: 16.
[12] 陶龙兴, 王熹, 俞美玉. 烯效唑和多效唑在土壤中的残留的比较研究[J]. 农药, 1995, 34(3): 19-20.
[13] 黄海. 多效唑在苹果树体内的残留及其在抑制生长中的作用[J]. 果树科学, 1995, 12(3): 165-167.
[14] 郭潇, 赵文. 植物生长调节剂的安全性分析[C]//中国中部地区农产品加工产学研研讨会. 保定: 中国农业工程学会农产品加工及贮藏工程分会, 2007: 233-236.
[15] 刘淑艳, 胡喜珍. 市售水果中乙烯利残留量调查[J]. 中国卫生工程学, 2004, 3(4): 221-222.
[16] 王静, 金芬, 邵华, 等. 农药多残留检测样品前处理技术研究进展[J].农业质量标准, 2007(1): 28-31.
[17] DEBI S, AWASTHI M D. Behaviour of forchlorfenuron residues in grape, soil and water[J]. Chemosphere, 2003, 50(5): 589-594.
[18] 陈波浪, 郑春霞, 盛建东, 等. HPLC分离和测定棉花中3种植物激素[J].新疆农业大学学报, 2006, 29(1): 28-30.
[19] 李海艳, 尚德军, 巩志国, 等. 高效液相色谱-串联质谱法检测葡萄干中五种植物生长调节剂的残留[J]. 保鲜与加工, 2014, 14(1): 32-36.
[20] 黄何何, 徐敦明, 周昱, 等. 高效液相色谱-串联质谱法测定水果中多种天然植物生长调剂的残留量[J]. 食品安全质量检测学报, 2014, 5(4): 1133-1141.
[21] 钟冬莲, 丁明, 汤富彬, 等. 高效液相色谱-串联质谱同时测定毛竹笋中4种内源性植物激素[J]. 分析化学研究, 2013, 41(11): 1739-1743.
[22] 牟艳莉, 郭德华, 丁卓平. 高效液相色谱-串联质谱法检测瓜果中的4种植物生长调节剂的残留量[J]. 色谱, 2013, 31(10): 1016-1020.
[23] 吴凤琪, 靳保辉, 陈波, 等. 水果中8种外源性植物生长调节剂的液相色谱-串联质谱法测定[J]. 中国农学通报, 2010, 26(15): 115-119.
[24] 曹慧, 陈小珍, 王瑾, 等. 超高效液相色谱-串联质谱技术同时分析食品中多种植物激素残留[J]. 农药, 2012, 51(10): 738-741.
[25] 胡西洲, 彭西甜, 余琼卫, 等. 固相萃取-分散液液微萃取-高效液相色谱法测定椰子汁中酸性植物激素[J]. 分析科学学报, 2013, 29(5): 593-598.
[26] 徐宜宏, 蒋施, 付海滨, 等. 苹果、番茄、玉米中7种植物生长调节剂的气相色谱-串联质谱检测方法[J]. 农药, 2014, 53(2): 113-115.
[27] LU Qian, WU Jianlong, YU Qiongwei, et al. Using pollen grains as novel hydrophilic solid-phase extraction sorbents for the simultaneous determination of 16 plant growth regulators[J]. Journal of Chromatography A, 2014, 1367: 39-47.
[28] 吴倩, 王璐, 吴大朋, 等. 植物激素样品前处理方法的研究进展[J].色谱, 2014, 32(4): 319-329.
[29] PAN Xiangqing, WELTI R, WANG X. Quantitative analysis of major plant hormones in crude plant extracts by high-performance liquid chromatographymass spectrometry[J]. Nature Protocols, 2010, 5(6): 986-992.
[30] HOU Shengjie, ZHU Jiang, DING Mingyu, et al. Simultaneous determination of gibberellic acid, indole-3-acetic acid and abscisic acid in wheat extracts by solid-phase extraction and liquid chromatographyelectrospray tandem mass spectrometry[J]. Talanta, 2008, 76(4): 798-802.
[31] 杨涛, 王静静, 鹿毅. HPLC-MS/MS内标法同时测定果蔬中7种植物生长延缓剂残留[J]. 广州化工, 2013, 41(12): 150-152.
[32] 赵永信, 宋国良, 张晶, 等. 气相色谱/质谱法测定粮食中矮壮素残留[J].中国卫生检验杂志, 2008, 18(6): 1064-1066.
[33] 吕燕, 赵健, 杨挺, 等. 气相色谱质谱法检测蔬菜中多效唑的残留[J].中国测试, 2010, 36(4): 57-59.
[34] 湛杜霞, 孙世宏, 臧李纳, 等. SPE-HPLC法测定水果中的赤霉素、苯甲酸、糖精钠和胭脂红[J]. 中国卫生检验杂志, 2009, 19(3): 579-581.
[35] 马有宁. 液相串联质谱测定水稻37种内源激素方法的研究[D]. 北京: 中国农业科学院, 2011: 30-37.
[36] VALVERDE A, ARUILERA A, FERRER C, et al. Analysis of forchlorfenuron in vegetables by LC/TOF-MS after extraction with the buffered QuEChERS method[J]. Journal of Agricultural and Food Chemistry, 2010, 58(5): 2818-2823.
[37] 黄何何, 张缙, 徐敦明, 等. QuEChERS-高效液相色谱-串联质谱法同时测定水果中21种植物生长调节剂的残留量[J]. 色谱, 2014, 32(7): 707-716.
[38] 吴刚, 董锁拽, 潘璐璐, 等. 加速溶剂萃取-超高效液相色谱-串联质谱快速测定棉花中残留的8种脱叶剂[J]. 色谱, 2013, 31(7): 697-702.
[39] 孔德洋, 石利利, 单正军, 等. 萘乙酸残留的高效液相色谱法测定[J].分析测试学报, 2010, 29(4): 382-385.
[40] 陈卫军, 张耀海, 李云成, 等. 果蔬中常用植物生长调节剂分析方法研究进展[J]. 食品科学, 2012, 33(11): 283-289.
[41] TSENG S H, CHANG P C, CHOU S S, et al. A rapid and simple method for the determination of ethephon residue in agricultural products by GC with headspace sampling[J]. Journal of Food and Drug Analysis, 2000, 8(3): 213-217.
[42] 储晓刚, 雍炜, 蔡慧霞, 等. 顶空气相色谱法快速测定浓缩菠萝汁中乙烯利的残留量[J]. 色谱, 2001, 19(3): 286-288.
[43] 吴淑秀, 公茂金. 衍生化气相色谱法测花生米中丁酰肼的残留量[J].农业与技术, 2005, 25(6): 116-118.
[44] SUZUKI T, NEMOTO S, SAITO Y, et al. Determination of plant growth regulator, deminozide and 1,1-dimethylhydrazine in fruits and fruit juice by gas chromatography[J]. Journal of the Food Hygiene Society of Japan, 1990, 31(2): 117-181.
[45] 周艳明, 付婷, 胡睿, 等. 气相色谱法测定蔬菜中三碘苯磺酸残留量[J].食品科学, 2010, 31(12): 178-181.
[46] 张丽华, 柳琪. 肉品中2,4-D残留量测定方法[J]. 山东农业科学, 1997(4): 41-42.
[47] 匡华, 储晓刚, 侯玉霞, 等. 气相色谱法同时测定大豆中13种苯氧羧酸类除草剂的残留量[J]. 中国食品卫生杂志, 2007, 18(6): 503-508.
[48] 刘同英, 崔淑华, 张立东, 等. 抗倒胺在大米中的残留分析[J]. 农药, 2011, 50(1): 58-60.
[49] 付磊, 陶燕飞. 气相色谱法测定草莓中的赤霉素[J]. 武汉科技大学学报: 自然科学版, 2002, 25(4): 359-360.
[50] 许庆琴, 杜黎明, 张水利. 水果中的萘乙酸残留测定[J]. 山西师范大学学报: 自然科学版, 1999, 13(2): 41-43.
[51] 贾健, 王晓云, 杨天祝. 气相色谱法测定花生中丁酰肼残留[J]. 化学工程师, 2004(7): 57-58.
[52] SHIGEYUKI T. New method for ethphon ((2-chloroethyl)phosphonic acid) residue analysis, and detection of residual levels in the fruit and vegetable of Western Japan[J]. Journal of Agricultural and Food Chemistry, 2002, 50(26): 7515-7519.
[53] 吴平谷, 谭莹, 张晶, 等. 分级净化结合气相色谱-质谱联用发测定豆芽中10种植物生长调节剂[J]. 分析化学, 2014, 42(6): 866-871.
[54] CLAUDIA B, ANIA K, JOACHIM K, et al. Comprehensive chemical derivatization for gas chromatography-mass spectrometry-based multi-targeted profiling of the major phytohormones[J]. Journal of Chromatography A, 2003, 993(1/2): 89-102.
[55] 张莹. HPLC法和HPLC-MS/MS法检测果蔬中植物生长促进剂残留[D].乌鲁木齐: 新疆大学, 2012: 25-46.
[56] HU Jiye, DENG Zhubo, QIN Dongmei. Determination of diacylhydrazines: type insect growth regulator JS-118 residues in cabbage and soil by high performance liquid chromatography with DAD detection[J]. Bulletin Environmental Contamination Toxicology, 2009, 83(6): 803-807.
[57] 陆益民, 易国斌, 陈创彬, 等. 西瓜中4种植物生长调节剂残留的分析方法研究[J]. 分析测试学报, 2011, 30(2): 186-189.
[58] 周艳明, 忻雪. 高效液相色谱法测定果蔬中7种植物激素的残留量[J].食品科学, 2010, 31(18): 301-304.
[59] CHO S K, ABD EL-ATY A M, PARK K H, et al. Simple multiresidue extraction method for the determination of fungicides and plant growth regulator in bean sprouts using low temperature partitioning and tendem mass spectrometry[J]. Food Chemistry, 2013, 136(3/4): 1414-1420.
[60] HERNANDEZ F, POZO O J, SANCHO J V, et al. Multiresidue liquid chromatography tandem mass spectrometry determination of 52 non gas chromatography-amenable pesticides and metabolites in different food commodities[J]. Journal of Chromatography A, 2006, 1109(2): 242-252.
[61] AKIYAMA Y, MATSUOKA T, MITSUHASHI T. Multi-residue screening method of acidic pesticides in agricultural products by liquid chromatography/time of flight mass spectrometry[J]. Journal of Pesticide Science, 2009, 34(4): 265-272.
[62] 范素芳. 基于LC-MS的黄曲霉毒素和植物生长调节剂确证性痕量检测技术研究[D]. 北京: 中国农业科学院, 2011: 31.
[63] 吴松茹, 陈婉芬, 周燮. 酶联免疫法(ELISA)测定内源植物激素[J]. 植物生理学通讯, 1988(5): 53-57.
[64] WATANABE E, TSUDA Y, WATANABE S, et al. Development of an enzyme immunoassay for the detection of plant growth regulator inabenfide in rice[J]. Analytica Chimica Acta, 2000, 424(2): 149-160.
[65] 黄晓荣, 张平治, 吴新杰, 等. 植物内源激素测定方法研究进展[J].中国农学通报, 2009, 25(11): 84-87.
[66] 程远. 毛细管电泳双波长同时分离测定四种生长素[C]//第三届中国中西部地区色谱学术交流会论文集. 西安: 中国化学会, 陕西省化学学会, 2010: 217-218.
[67] KUBILIUS D T, BUSHWAY R J. Determination of maleic hydrazide in potatoes and onions by capillary electrophoresis[J]. Journal of Agricultural and Food Chemistry, 1998, 46(10): 4224-4227.
[68] 吴翚, 宛瑜. 脱落酸(ABA)荧光性质的研究[J]. 徐州师范大学学报:自然科学版, 2002, 20(2): 39-41.
[69] 唐红芳, 毛丽珍. 薄层层析-荧光光谱法测定柑桔中赤霉素残留量[J].农药, 1996, 35(6): 31-32.
[70] 索兰弟, 李秉真, 田瑞华, 等. 马铃薯生长过程中赤霉素含量的荧光测定法[J]. 内蒙古农牧学院学报, 1996, 17(2): 70-73.
[71] 米娟, 周敏, 丁兰, 等. 固相萃取-化学发光法测定植物中的吲哚乙酸[J].分析实验室, 2011, 30(8): 44-47.
[72] 刘丽珍, 韩素琴. 鲁米诺-铁氰化钾化学发光体系测定吲哚乙酸[J].山西师范大学学报: 自然科学版, 2009, 23(2): 74-77.
[73] 王珊. 果蔬中植物生长调节剂残留的快速检测方法研究[D]. 郑州:河南农业大学, 2013: 31-38.
[74] LEE S M, KIM J Y, LEE H J, et al. Establishment of analytical method for 6-benzylaminopurine residue, a plant growth regulator for brown rice, mandarin, pepper, potato, and soybean by using GC/NPD[J]. Journal of the Korean Society for Applied Biological Chemistry, 2014, 57(1): 83-89.
[75] ERIC A S, JUERGEN E, HANS T A, et al. Simultaneous analysis of phytohormones, phytotoxins, and volatile organic compounds in plants[J]. Proceedings of the National Academy of Sciences of the United States of American, 2003, 100(18): 10552-10557.
[76] GAMBINO G A, PAGANO P, SCORDINO M, et al. Determination of plant hormones in fertilizers by high-performance liquid chromatography with photodiode array deterction: method development and single-laboratory validation[J]. Journal of AOAC International, 2008, 91(6): 1245-1256.
[77] GUPTA V, KUMAR M, BRAHMBHATT H, et al. Simultaneous determination of different endogenetic plant growth regulators in common green seaweeds using dispersive liquid-liquid micro extraction method[J]. Plant Physiology and Biochemistry, 2011, 49(11): 1259-1263.
[78] MAO Xuejin, TANG Lijuan, TAN Ting, et al. Determination of plant regulators in pears by microwave-assisted extraction and liquid chromatography with electrospray ionization mass spectrometry[J]. Journal of Separation Science, 2014, 37(11): 1352-1358.
[79] XUE Jiangying, WANG Suli, YOU Xianwei, et al. Multi-residue determination of plant growth regulators in apple and tomatoes by liquid chromatography/tandem mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2011, 25(21): 3289-3297.
[80] MA Liyan, ZHANG Hongyan, XU Wentao, et al. Simultaneous determination of 15 plant growth regulators in bean sprout and tomato with liquid chromatography-triple quadrupole tandem mass spectrometry[J]. Food Analytical Methods, 2013, 6(3): 941-951.
[81] SHI Xiaomei, JIN Fen, HUANG Yuting, et al. Simultaneous determination of five plant growth regulators in fruits by modified quick, easy, cheap, effective, rugged, and safe (QuEChERS) extraction and liquid chromatography-tendem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2012, 60(1): 60-65.
[82] LIU Xianxiang, WAN Yiqun. Simultanous determination of 2-naphthoxyacetic acid and indole-3-acetic acid by first derivation synchronous fl uorescence spectroscopy[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2013, 111(12): 230-236.
[83] FEGERT A, SCHEPERS U, SCHWARZ B. Determination of mepiquatchloride in animal and plant matrices by ion chromatography with conductivity detection[J]. Fresenius’ Journal of Analytical Chemistry, 1991, 339(6): 441-443.
[84] 周旭, 许锦钢, 陈智栋, 等. 流动相离子色谱法同时测定植物中残留的矮壮素和缩节胺[J]. 色谱, 2011, 29(3): 244-248.
[85] 徐爱东. 我国蔬菜中常用植物生长调节剂的毒性及残留问题研究进展[J]. 中国蔬菜, 2009(8): 1-6.
[86] 中华人民共和国国家卫生和计划生育委员会, 中华人民共和国农业部. GB 2763—2014食品安全国家标准 食品中农药最大残留量[S]. 北京: 中国标准出版社, 2014.
[87] 朱杰丽, 杨柳, 柴振林, 等. 国内外植物生长调节剂限量标准分析研究[J]. 生物灾害科学, 2013, 36(2): 232-236.
[88] 丁昌东. 我国与CAC及贸易伙伴国植物生长调节剂最大残留限量标准的比较[J]. 中国标准导报, 2006(1): 18-20.
[89] 金芬, 邵华, 杨锚, 等. 国内外几种主要植物生长调节剂残留限量标准比较分析[J]. 农产品质量与安全, 2007(6): 26-27.
Recent Advances in Analytical Techniques for the Detection of Plant Growth Regulators in Common Fruits and Vegetables
HAO Jie, FENG Nan, JIANG Jie*, LU Yong
(Beijing Municiple Center for Food Safety Monitoring and Risk Assessment, Beijing 100041, China)
Abstract:Plant growth regulators are a class of chemical substances widely used in modern agricultural industry, which can regulate the growth of vegetables and fruits for increasing yield. In recent years, food safety risks caused by excessive and over-range abuse of plant growth regulators occurred sometimes, which brings about many concerns about the problem of safety and residues. A great deal of research has been conducted to detect plant growth regulator residues in fruits and vegetables and a variety of analytical methods have been developed in this field. This article reviews the main analytical techniques used in China and other countries for detecting plant growth regulator residues in fruits and vegetables with respect to their advantages, disadvantages and applications. Some pretreatment procedures and instrumental methods are also described. A brief comparison of the regulations on the maximum residue limits for plant growth regulators at home and abroad is conducted with the aim of guiding the formulation of relevant regulations and detection standards for plant growth regulators in the future.
Key words:plant growth regulators; detection method; regulation on maximum residue level
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2015)21-0303-07
doi:10.7506/spkx1002-6630-201521056
收稿日期:2015-01-29
基金项目:北京市科委计划重点项目(D151100003815002)
作者简介:郝杰(1984—),男,工程师,硕士,研究方向为食品安全。E-mail:haojiecrab@126.com
*通信作者:姜洁(1972—),女,高级工程师,博士,研究方向为食品安全。E-mail:jybjj2004@126.com

