杨云舒,李 荣,姜子涛*
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
摘 要:通过单因素试验和响应面分析法确定了微波辅助提取广枣黄酮的最佳条件:提取温度75 ℃、液料比62∶1、乙醇体积分数62%、微波功率500 W和提取时间7 min。在此条件下,黄酮得率远高于文献所报道的方法。通过动态法确定了AB-8型大孔树脂纯化广枣黄酮的最优工艺参数:样品液流速2 BV/h、样品液pH 2、洗脱液流速3 BV/h、洗脱液乙醇体积分数60%。同时利用制备色谱对广枣黄酮进行纯化,高效液相色谱法分析结果证明,制备色谱用于纯化广枣黄酮具有可行性。
关键词:广枣;响应面分析;大孔树脂;制备色谱
广枣是漆树科植物南酸枣(Choerospondias axillaris (Roxb.) Burtt et Hill)的干燥果实,又名南酸枣、五眼果、山枣等,在我国有广泛的分布 [1]。我国的许多地区都有生食广枣的习惯,因其具有较高的保健功效,被视为食品加工的优良原料 [2]。广枣具有养心安神的功效,并且对抗心律失常、改善心肌缺血具有明显的效果,常被用于临床心血管疾病的治疗 [3-6],2010版《中华人民共和国药典》 [7]已将其收录。经过国内外的一些学者对于广枣的化学成分所进行的系列研究,目前已知其果实中含有黄酮类化合物、酚酸类化合物、甾醇、脂肪酸、氨基酸以及钾、钙和镁等多种成分 [8-14]。其中,广枣中大量的黄酮类成分被认为是有效成分,具有多种生理活性。目前,广枣黄酮 的提取方法主要有回流法和超声提取法 [15-18],此外,易跃能等 [19]使用了较适宜于工业生产的渗漉法进行广枣黄酮的提取,谷福根等 [20]将β-环糊精选择性提取法引入广枣黄酮的提取研究中,然而它们均在不同程度上存在着成本较高、提取不完全、耗时过长等不足。而对于广枣黄酮的分离纯化还鲜有研究 [21]。
本实验利用微波辅助快速提取技术,结合响应面分析法优化广枣总黄酮的提取工艺,并采用大孔吸 附树脂和制备色谱进行纯化,为广枣黄酮的开发和利用提供了一种简单、有效的方法,并为广枣在食品和药品领域的有效应用提供了理论依据。
1.1 材料与试剂
广枣,产地西藏,去核后粉碎约20 目备用。
芦丁标准品(分析纯) 北京化学试剂公司;甲醇(色谱纯) 天津市科密欧化学 试剂有限公司;AB-8大孔树脂 南开大学化工厂;其余试剂均为分析纯。
1.2 仪器与设备
FA1104N型电子天平 上海精密仪器有限公司;Multi SYNTH微波合成仪 意大利Milestone公司;Alpha-1500紫外-可见分光光度计 上海谱元仪器有限公司;U-3900紫外-可见分光光度计 日本日立公司;Grace Reveleris TM全息快速纯化色谱系统、SSI 1500高效液相色谱(high performance liquid chromatography,HPLC)仪(配备四元梯度泵) 美国Alltech公司;RE52-86A型旋转蒸发仪 上海亚荣生化仪器厂。
1.3 方法
1.3.1 标准曲线的绘制
按照文献[22-23]的方法,准确吸取0.2 mg/mL的芦丁标准品溶液0.0、0.5、1.0、1.5、2.0、2.5 mL,置于10 mL比色管中,分别加入5%的NaNO 2溶液0.40 mL,摇匀并放置6 min,再加入10% Al(NO 3) 3溶液0.40 mL,摇匀,放置6 min,然后加入4%的 NaOH溶液4.0 mL,用30%的乙醇溶液定容至刻度并摇匀,静置10 min后于508 nm波长处测定吸光度,参比为试剂空白。得到芦丁标准溶液质量浓度ρ(mg/mL)与吸光度A的回归方程为:A=10.483ρ-0.001 8,相关系数R 2=0.999 2。
1.3.2 广枣黄酮的微波提取
称取0.5 g广枣粉末,加入微波合成仪的圆底烧瓶中,以乙醇溶液为溶剂,在设定条件下按照一定液料比进行微波萃取,对提取液进行减压抽滤,所得滤液即为广枣黄酮提取液。提取液经减压旋转薄膜蒸发后冷冻干燥,得到广枣粗黄酮粉末。准确称取粗黄酮粉末0.5 g,加入少量乙醇溶解后定容至500 mL,得到1.0 mg/mL的广枣粗黄酮储备液,备用。
1.3.3 广枣黄酮含量的测定
准确吸取1.0 mL提取液,以相应提取液作为参比,按照1.3.1节方法显色,测定其在波长508 nm处的吸光度,代入标准曲线回归方程得到黄酮质量浓度,按照下式计算黄酮得率:
式中:ρ为由回归方程计算出的样品液中黄酮质量浓度/(mg/mL);V为提取液体积/mL;N为稀释倍数;m为广枣粉末质量/mg。
1.3.4 单因素试验
以乙醇水溶液为溶剂,准确称取0.5 g广枣粉末,分别改变提取温度(固定液料比40∶1、乙醇体积分数60%、微波功率400 W、提取时间7 min)、液料比(固定提取温度75 ℃、乙醇体积分数60%、微波功率400 W、提取时间7 min)、乙醇体积分数(固定提取温度75 ℃、液料比60∶1、微波功率400 W、提取时间7 min)、提取时间和微波功率(固定提取温度75 ℃、液料比60∶1、乙醇体积分数60%),进行单因素试验,测定提取液在最大吸收波长262 nm处的吸光度。代入标准曲线,得到黄酮得率。实验重复3 次,取平均值。
1.3.5 响应面试验设计
在单因素试验结果的基础上,选取提取温度、液料比和乙醇体积分数作为3 个影响因素,采用Box-Behnken原理,设计三因素三水平的试验方案,对数据进行响应面分析,其中,中心试验重复3 次。根据单因素试验的结果及水平选择的一般规律,因素与水平见表1。
表1 响应面因素及水平
Table1 Factors and levels used in in the response surface design
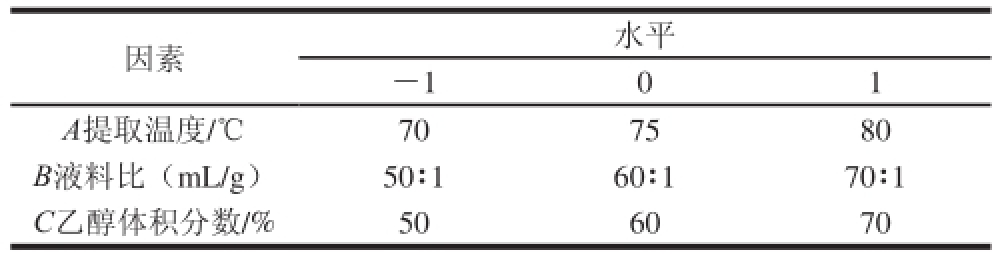
因素水平-101 A提取温度/℃707580 B液料比(mL/g)50∶160∶170∶1 C乙醇体积分数/%506070
1.3.6 大孔树脂纯化广枣黄酮条件的确定
1.3.6.1 大孔吸附树脂的预处理
将AB-8大孔树脂于95%的乙醇溶液中充分浸泡24 h,用蒸馏水洗至无醇味,去除醇溶性杂质。然后用5%的HCl溶液浸泡3 h,洗至流出液的pH值为中性,再用5%的NaOH溶液浸泡3 h,洗至pH值为中性后浸泡备用 [24]。
1.3.6.2 样品液流速的确定
准确称取处理过的AB-8型大孔树脂6.0 g,采用湿法装柱,分别以1.5、2、3 BV/h的流速加入质量浓度为1.0 mg/mL的样品液,每隔3 mL测定流出液在波长262 nm处的吸光度,当流出液的吸光度达到样品液的1/10(泄漏点)时停止上样。
1.3.6.3 样品液pH值的确定
将pH值分别为2、4、6的质量浓度为1.0 mg/mL的样品液以2 BV/h的流速上样,每隔3 mL测定流出液在波长262 nm处的吸光度,以泄漏点最迟为最佳。
1.3.6.4 洗脱液流速的确定
取湿法填装的AB-8型大孔吸附树脂6.0 g,按以上确定的吸附条件上样至泄漏点,用体积分数为60%的乙醇溶液分别以1、2、3 BV/h的流速进行洗脱,每隔3 mL测定流出液在波长262 nm处的吸光度,绘制洗脱曲线。
1.3.6.5 洗脱液乙醇体积分数的确定按以上确定的吸附条件上样至泄漏点,分别用体积分数为50%、60%、70%和80%的乙醇溶液以3 BV/h的流速进行洗脱,收集洗脱液并扫描其在200~700 nm波长范围内的吸收光谱。
1.3.7 制备色谱纯化广枣黄酮
将2.5 g粗黄酮溶解得到质量浓度为5.0 mg/mL的粗黄酮溶液。制备色谱条件:柱填料为40 g Reveleris™RP C 18Cartridge,流动相为0.1%乙酸溶液(A)和甲醇(B),流速为6 mL/min,进样量为20 mL,检测波长为262 nm。梯度洗脱条件为:0~9 min,0~30% B;9~12 min,30%~75% B;12~27 min,75%~100% B;27~30 min,100% B。
1.3.8 纯化效果的检测
采用HPLC法测定纯化前后黄酮的纯度,分别将经大孔树脂和制备色谱纯化的广枣黄酮溶液用旋转蒸发仪除去乙醇,冷冻干燥得到纯化后的广枣黄酮粉末。分别用50%的甲醇溶解,并稀释至1 mg/mL,使用HPLC进行分析。分析条件:ZorbaxSB-C 18(250 mm×4.6 mm, 5 μm),流动相:甲醇(A)、水(B)、1%乙酸溶液(C),流速0.9 mL/min,进样量10 μL。梯度洗脱条件为:0~40 min,0~90% A,C溶液一直维持在10%。检测波长为262 nm。
1.4 数据处理
用SPSS对单因素试验数据进行分析,用Design-Expert对响应面试验数据进行分析。
2.1 单因素试验结果
2.1.1 提取温度的影响
保持其他条件不变,分别测定在提取温度60、65、70、75、80 ℃条件下的广枣黄酮得率,结果见图1。

图1 提取温度对广枣黄酮得率的影响
Fig.1 Effect of extraction temperature on the yield of fl avonoids
由图1可知,在60~80 ℃范围内,随着提取温度的升高,黄酮得率呈现出先增大后减小的趋势,并在75 ℃时达到最高。这可能是因为温度的升高加剧了分子运动,在一定温度范围内,随温度的升高,黄酮在乙醇中的溶解度增大,但温度过高可能会导致黄酮甙分子的结构破坏,从而降低黄酮得率,因此选择广枣黄酮的提取温度为75 ℃。
2.1.2 液料比的影响
在其他条件不变的情况下,分别测定在液料比30∶1、40∶1、50∶1、60∶1和70∶1条件下的广枣黄酮得率,结果见图2。
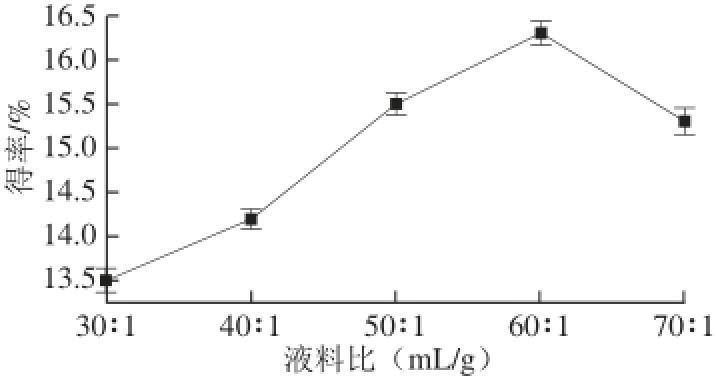
图2 液料比对广枣黄酮得率的影响
Fig.2 Effect of ratio of liquid to material on the yield of fl avonoids
从图2可以看出,在液料比30∶1~70∶1范围内,黄酮类物质的得率呈现先增加后减小的趋势。这是因为液料比过大会导致溶液质量浓度减小,从而影响到原料对微波能的吸收,故选择液料比为60∶1。
2.1.3 乙醇体积分数的影响
在其他条件不变的情况下,分别测定在乙醇体积分数50%、60%、70%、80%和90%条件下的广枣黄酮得率,结果见图3。
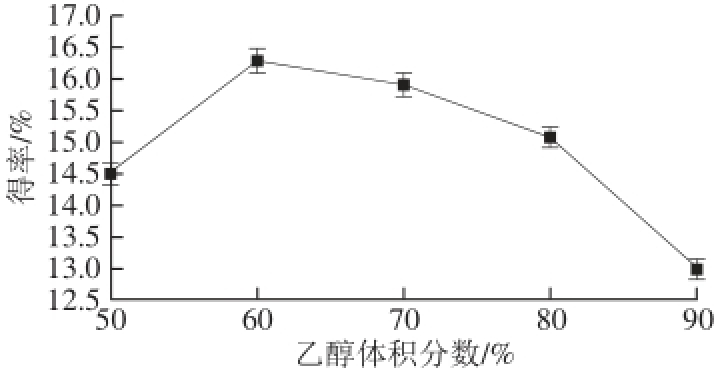
图3 乙醇体积分数对广枣黄酮得率的影响
Fig.3 Effect of ethanol concentration on the yield of fl avonoids
由图3可以看出,广枣黄酮的得率在乙醇体积分数为60%时达到最高。这是因为当乙醇体积分数为60%时与广枣中黄酮类化合物的极性相近,根据“相似相溶”原理,此时广枣黄酮在其中的溶解度最大,更有利于溶出,故选择乙醇体积分数为60%。
2.1.4 提取时间及微波功率的影响
在其他条件不变的情况下,分别测定在不同提取时间及微波功率条件下的广枣黄酮得率,结果见图4。
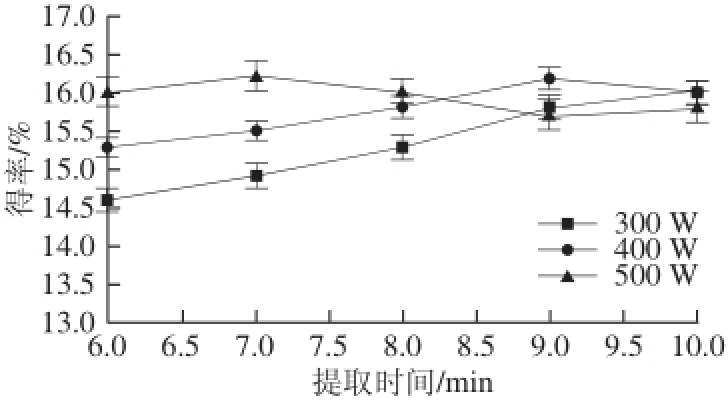
图4 提取时间及微波功率对广枣黄酮得率的影响
Fig.4 Effect of extraction time and microwave power on the yield of fl avonoids
提取时间可影响溶剂与细胞内黄酮类物质接触的充分程度,随着提取时间的延长,溶剂能够更加充分的渗透到细胞内部溶解黄酮,而提取时间过长则会导致细胞内温度过高,氧化黄酮类物质。微波功率的增大会使原料吸收的微波能量增多,从而使黄酮更易进入溶剂中。从图4可以看出,在500 W条件下提取7 min时与400 W提取9 min的提取率相当,从节约时间考虑,选择在微波功率500 W条件下提取7 min。
2.2 响应面法优化提取工艺
表2 单因素试验的方差分析
Table2 Analysis of variance for single factors

因素离差平方和均方差F值P值提取温度0.2750.05517.3360.004液料比0.0550.011223.0450.000乙醇体积分数0.3100.06263.2820.000微波功率0.4320.2161.5390.289提取时间0.3130. 1040.7450.564
表3 响应面试验方案及结果
Table3 Response surface design with experimental results
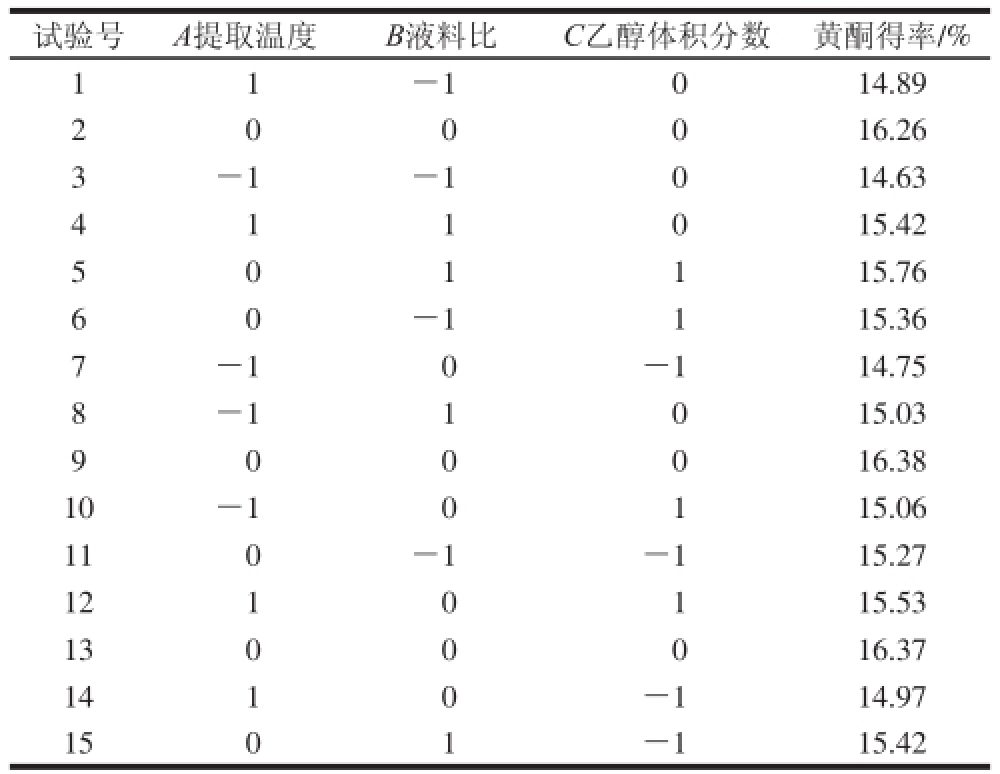
试验号A提取温度B液料比C乙醇体积分数黄酮得率/% 1 1 -1014.89 2 16.26 3-1-1014.63 4 1 1 0 15.42 0 0 0 5 15.76 6 0 -1115.36 0 1 1 7-10-114.75 8-11015.03 9 0 0 0 16.38 10-10115.06 110-1-115.27 1210115.53 1300016.37 1410-114.97 1501-115.42
通过SPSS处理单因素试验数据,确定影响广枣黄酮得率的各因素的大小关系为:液料比>乙醇体积分数>提取温度>微波功率>提取时间,其中液料比、乙醇体积分数和提取温度3 个因素显著影响黄酮得率,其他两个因素的影响不显著(表2)。这是因为微波辅助提取中,起始功率越大,达到目标温度的时间就越短;当达到目标温度后,微波合成仪会自动调整功率以维持此温度。因此,在广枣黄酮的提取中,提取温度、微波功率、提取时间三者表现为协同效应。在应用响应面分析进行最优条件分析时,设定微波功率为500 W,提取时间为7 min,以确定最优工艺条件。试验方案及结果见表3。
2.2.1 二次回归方程拟合和方差分析
利用Design-Expert软件对试验结果进行拟合,得到以广枣黄酮得率为响应值,对自变量提取温度(A)、液料比(B)和乙醇体积分数(C)三因素的回归方程为:
Y=-202.697 08+5.077A+0.513 75B+0.364 5C+0.000 65AB+0.001 25AC+0.000 625BC-0.034 383A 2-0.004 85B 2-0.004C 2
表4 回归方程的方差分析
Table4 Analysis variance of regression equation
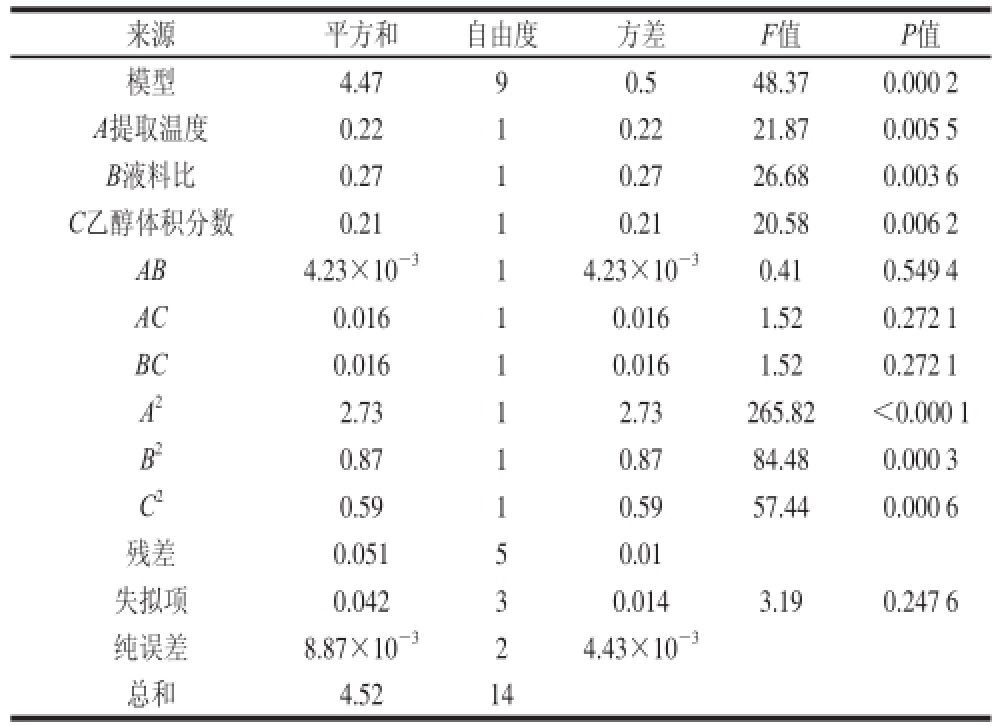
来源平方和自由度方差F值P值模型4.4790.548.370.000 2 A提取温度0.2210.2221.870.005 5 B液料比0.2710.2726.680.003 6 C乙醇体积分数0.2110.2120.580.006 2 AB4.23×10 -314.23×10 -30.410.549 4 AC0.01610.0161.520.272 1 BC0.01610.0161.520.272 1 A 22.7312.73265.82<0.000 1 B 20.8710.8784.480.000 3 C 20.59 10.5957.440.000 6残差0.05150.01失拟项0.04230.0143.190.247 6纯误差8.87×10 -324.43×10 -3总和4.5214
由表4可知,模型的P=0.000 2<0.0 1,说明模型变量与3 个自变量之间的线性关系极显著,即此方法是可靠的。失拟项P=0.247 6>0.05,不显著,说明该方程的拟合情况良好,可以用其进行广枣黄酮得率的预测和分析。R 2=0.980 8,表明只有1.92%的试验不能用此方程确定,在试验中没有其他显著因素的影响,条件是合适的 [25]。对回归方程各项的方差分析结果表明,方程的一次项A、B、C及二次项A 2、B 2和C 2的P值均小于0.01,极显著,而交互项不显著,说明此方程的拟合较充分。各因素对广枣黄酮得率的影响依次为:液料比>提取温度>乙醇体积分数。
对表4的数据进行二次多元回归拟合,去除不显著的交互项AB、AC和BC,得到广枣黄酮得率对3 个因素的二次多项回归方程:y=-213.497 08+5.191A+0.6B+0.495 75C-0.034 383A 2-0.004 85B 2-0.004C 2。优化后,模型(P<0.000 1)极显著,失拟项不显著,决定系数R 2=0.988 6,调整系数R 2= 0.968 2,预测系数R 2=0.845 3,说明测定值(16.41%)与模型预测值(16.38%)之间具有良好的相关度。变异系数0.66%,说明模型重复性良好。提取温度、液料比和乙醇体积分数3 个因素两两交互作用对于广枣黄酮得率的三维空间曲面图见图5。

图5 各因素交互作用对黄酮得率影响的响应面图
Fig.5 Response surface graphs showing the effect of three extraction parameters on the yield of fl avonoids
2.2.2 最优条件验证实验
通过回归模型预测,给出的广枣黄酮提取的最佳工艺条件为提取温度75.55 ℃、液料比62.1∶1、乙醇体积分数62.28%、微波功率500 W、提取时间7 min,在此条件下广枣黄酮得率的预测值为16.38%。考虑到实验的可操作性,修正最佳工艺条件为,提取温度75 ℃、液料比62∶1、乙醇体积分数62%、微波功率500 W和提取时间7 min。在此修正条件下进行3 次平行验证实验,广枣黄酮实际得率为16.41%,相对误差为0.2%,与预测值接近。可见微波法可大大地降低黄酮的提取时间,由常规的2~3 h降低到现在的7 min,且黄酮得率远高于文献所报道的回流法、超声提取法、渗漉法、β-环糊精选择性提取法等的结果 [15-20]。证明由响应面分析法优化得到的广枣黄酮提取条件是可靠的。
2.3 大孔树脂纯化广枣黄酮
2.3.1 样品液流速的确定
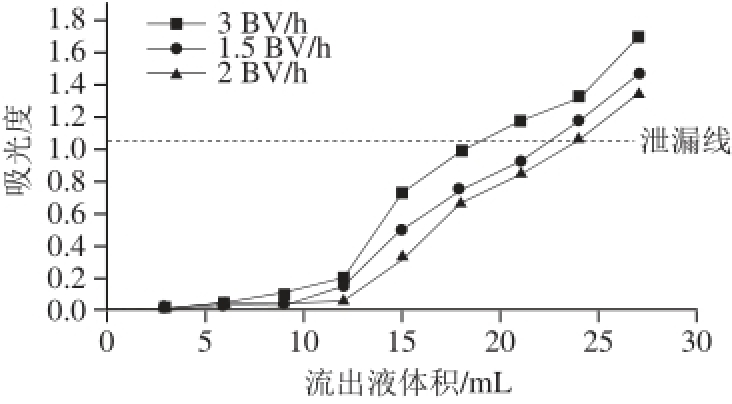
图6 样品液流速对吸附效果的影响
Fig.6 Effect of sample loading fl ow rate on adsorption effi ciency
由图6可以看出,样品液流速为2 BV/h时泄漏点(吸光度为1.09)出现的最晚。这是因为样品液流速过快会使树脂产生不 完全吸附,部分未吸附的黄酮分子随样品液流出,降低了树脂的吸附效率。因此,选择样品液流速为2 BV/h。
2.3.2 样品液pH值的确定

图7 样品液pH值对吸附效果的影响
Fig.7 Effect of sample pH on adsorp tion effi ciency
由图7可知,在样品液pH值为2时,大孔树脂的吸附能力最强,随着pH值的升高,大孔树脂的吸附能力降低。这是因为黄酮类化合物的结构上具有酚羟基,带有一定酸性。黄酮在酸性条件下主要以分子形式存在,有利于大孔树脂的吸附。因此选择样品液pH值为2。
2.3.3 洗脱液流速的确定

图8 洗脱液流速对洗脱效果的影响
Fig.8 Effect of eluent fl ow rate on elution effi ciency
如图8所示,洗脱液流速为3 BV/h时峰的吸收强度最大,且3 个流速条件下几乎均无拖尾现象,解吸率均达到90%以上。因为流速过慢会导致时间延长、生产效率降低等问题,所以选择洗脱液流速为3 BV/h。
2.3.4 洗脱液乙醇体积分数的确定
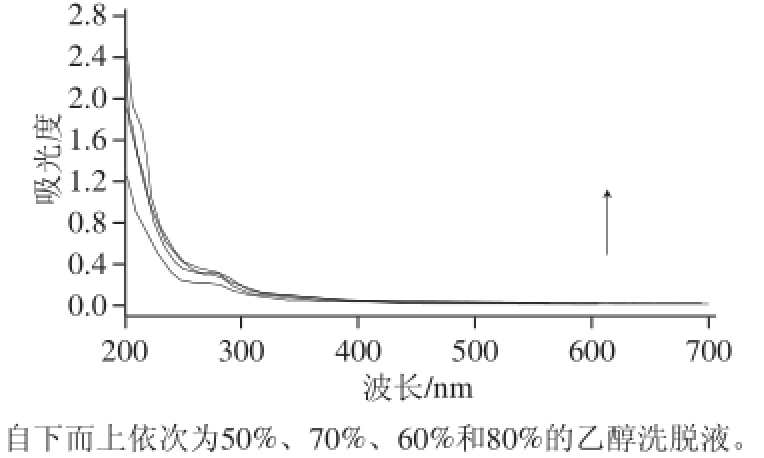
图9 不同乙醇体积分数洗脱液的紫外吸收光谱
Fig.9 UV absorption spectra of eluates with different concentrations of ethanol
由图9可知,当乙醇体积分数为60%和80% 时,洗脱下的黄酮最多;但在乙醇体积分数为80%时,流出液的吸收曲线峰形有了明显的变化,表明有极性杂质被洗脱下来。再加之从经济效益的角度考虑,应尽可能地降低有机溶剂的使用量,因此选择洗脱液乙醇体积分数为60%。在所拟定的最佳条件下,经大孔树脂纯化后黄酮含量由纯化前的28.5%增加到67.3%,黄酮含量提升到纯化前的2.36 倍,纯化效果还是非常明显的。
2.4 制备色谱分离广枣黄酮
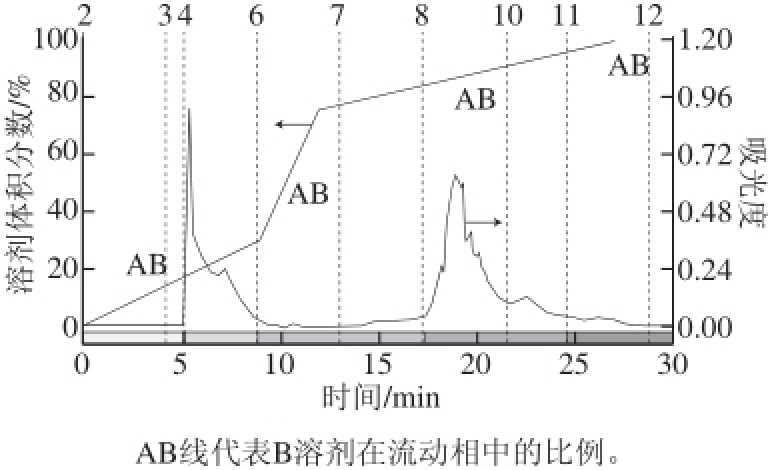
图10 制备色谱纯化广枣黄酮(波长262 nm)
Fig.10 Purifi cation of Choerospondias axillaris fl avonoids by preparative chromatography (262 nm)
图10 显示了广枣黄酮的制备色谱分离结果,制备色谱将广枣黄酮分为2 个组分,即5~8 min为组分1,17.5~24.5 min为组分2。两个组分间的极性有显著区别。
2.5 制备色谱分离效果
由图11可以看出,经大孔树脂纯化得到色谱图与制备色谱分离得到的两个组分的色谱图能一一对应,并且在质量浓度相同的情况下,各组分的响应值均高于分离前纯化黄酮。这说明制备色谱作为一种快速高效的纯化手段,不仅不会丢失成分,而且 还能够起到初步分离的作用,每一组分的纯度也都得到了显著提高。但是由于提取物中含有部分寡聚鞣花酸 [5],在进行柱色谱分离时,有一些寡聚物会在树脂上降解,极性也随之发生改变,而树脂分离纯化的原理就是依据被吸附物质和树脂的极性,所以很难利用在树脂上反复进行色谱分离的方法得到纯化物 [26]。
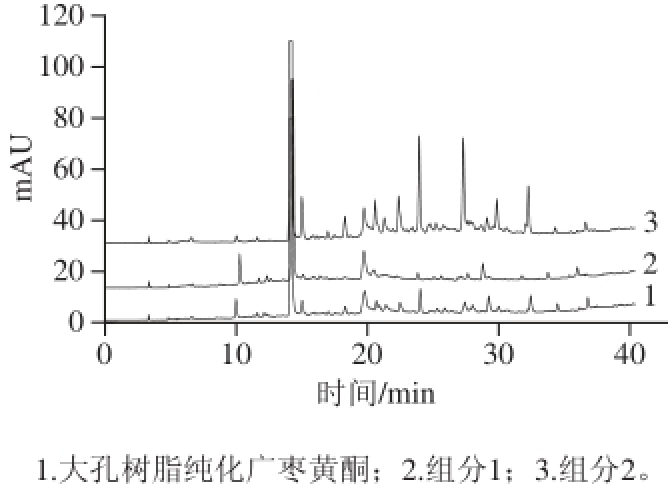
图11 大孔树脂和制备色谱纯化广枣黄酮的HPLC图
Fig.11 HPLC profi les of Choerospondias axillaris fl avonoids after purifi cation by AB-8 resin and preparative chromatography
本研究利用单因素试验筛选关键因素,通过响应面分析法确定微波辅助提取广枣黄酮的最佳条件:提取温度75 ℃、液料比62∶1、乙 醇体积分数62%、微波功率500 W、提取时间7 min。通过动态法确定了AB-8型大孔树脂纯化广枣黄酮的最 佳工艺参数:样品液流速2 BV/h、样品液pH 2、洗脱液流速3 BV/h、洗脱液乙醇体积分数60%。经制备色谱纯化分离出两个组分。对比两种纯化方式,制备色谱不仅能够高效快速地纯化广枣黄酮,还能对黄酮组分进行初步分离。HPLC分析结果证明:制备色谱用于分离纯化广枣黄酮具有可行性。本研究初步确定了微波辅助提取广枣黄酮和大孔树脂、制备色谱纯化广枣黄酮的工艺参数,为进一步进行生物活性的研究及成分分析奠定了基础,为广枣黄酮的利用提供了一定的理论依据。
参考文献:
[1] 王晓琴, 王力伟, 赵岩, 等. 广枣的化学成分和药理活性研究进展[J]. 食品科学, 2014, 35(13): 281-285. doi: 10.7506/spkx1002-6630-201413056.
[2] 刘晓庚, 陈梅梅, 丁悦琴, 等. 南酸枣果的几种加工方法[J]. 林业科技开发, 1995, 9(1): 44-46.
[3] LI Chunmei, HE Jie, GAO Yonglin, et al. Preventive effect of total flavones of Choerospondias axillaries on ischemia/reperfusioninduced myocardial infarction-related MAPK signaling pathway[J]. Cardiovascular Toxicolog y, 2014, 14(2): 1 45-152.
[4] 王凤华, 杨玉梅, 徐继辉, 等. 蒙药广枣3 种黄酮类成分对乌头碱所致心律失常的作用比较[J]. 中国中药杂志, 2005, 30(14): 1096-1098.
[5] 张浩楠, 杨玉梅, 邬国栋, 等. 蒙药广枣抗心律失常作用有效成分的分离[J]. 包头医学院学报, 2013, 29(3): 1-4.
[6] 李增晞, 田风居, 吴秀英, 等. 复方广枣注射液对动物耐缺氧和急性心肌缺血的保护作用[J]. 中药通报, 1985, 10(3): 42-44.
[7] 国家药典委员会. 中华人民共和国药典: 一部[M]. 2010版. 北京: 中国医药科技出版社, 2010: 41.
[8] 邓丽嘉, 王月梅, 顾维彰, 等. 蒙药广枣的化学成分研究[J]. 中草药, 1989, 20(3): 8-9.
[9] 连珠, 张承忠, 李冲, 等. 蒙药广枣化学成分的研究[J]. 中药材, 2003, 26(1): 23-24.
[10] 唐丽, 李国玉, 杨柄友, 等. 广枣化学成分的研究[J]. 中草药, 2009, 40(4): 541-543.
[11] 申旭霁, 格 日力, 王金辉, 等. 广枣的化学成分[J]. 河南大学学报: 医学版, 2009, 28(3): 196-199.
[12] 王乃利, 倪艳, 陈英杰, 等. 广枣活血有效成分的研究[J]. 沈阳药学院学报, 1987, 4(3): 203.
[13] ZHAO Xinfeng, ZHANG Weijin, KONG Shanshan, et al. A valid assay for the pharmacokinetic study of gallic acid from Choerospondiatis fructus in rabbit plasma by LC/MS/MS[J]. Journal of Liquid Chromatography and Related Technologies, 2007, 30(2): 235-244.
[14] PAUDEL K C, EDER R, PAAR E, et al. Chemical composition of Lapsi (Choerospondias axillaris) fruit from Nepal[J]. Mitteilungen Klosterneuburg, 2002, 52(1/2): 45-53.
[15] 巴根那, 吉林白乙, 白玉霞, 等. 正交设计研究广枣总黄酮提取工艺[J].中成药, 2000, 22(4): 253-255.
[16] 樊海燕, 赛音, 敖登高娃, 等. 广枣中黄酮类化合物提取工艺研究[J].内蒙古大学学报: 自然科学版, 2005, 36(1): 81-83.
[17] WANG Hua, GAO Xiangdong, ZHOU Gaochao, et al. In vitro and in vivo antioxidant activity of aqueous extract from Choerospondias axillaris fruit[J]. Food Chemistry, 2008, 106: 888-895.
[18] 孙占才, 赵丹庆, 刘鑫, 等. 蒙药广枣、麻黄、锦草中总黄酮的提取及含量的测定[J]. 内蒙古民族大学学报, 2008, 23(1): 19-21.
[19] 易跃能, 杨华, 赵勇, 等. 渗漉法提取广枣中黄酮类成分的工艺研究[J].中国中药杂志, 2010, 35(14): 1806-1808.
[20] 谷福根, 韩磊, 孟根达来, 等. β-环糊精选择性提取广枣总黄酮的工艺研究[J]. 中药新药与临床药理, 2011, 22(1): 110-114.
[21] 徐金龙. 南酸枣皮黄酮类化合物的提取、纯化及其功能性研究[D].江西: 南昌大学, 2013.
[22] 黎瑞汝, 苏智斌, 陈曦, 等. 正交试验优选广枣提取工艺[J]. 中国实验方剂 学杂志, 2011, 17(10): 47-49.
[23] 侯学敏, 李林霞, 张直峰, 等. 响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J]. 食品科学, 2013, 34(6): 124-128.
[24] 杨立琛, 李荣, 姜子涛, 等. 大孔吸附树脂纯化花椒叶总黄酮的研究[J].中国调味品, 2012, 37(7): 30-35.
[25] 袁志发, 周静芋. 试验设计与分析[M]. 北京: 高等教育出版社, 2000: 381.
[26] DURAN-LARA E F, LOPEZ-CORTES X A, CASTRO R I, et al. Experimental and theoretical binding affinity between polyvinylpolypyrrolidone and selected phenolic compounds from food matrices[J]. Food Chemistry, 2015, 168: 464-470.
Optimization of Microwave-Assisted Extraction by Response Surface Analysis and Purifi cation of Flavonoids from Choerospondias axillaris Fruit
YANG Yunshu, LI Rong, JIANG Zitao*
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Abstract:The optimal conditions for microwave-assisted extraction of fl avonoids from the fl esh of Choerospondias axillaris fruits were e stablished by using single factor experiments and response surface analysis as follows: extraction temperature, 75 ℃; ratio of solvent to material, 62:1 (mL/g); ethanol concentration, 62%; microwave power 500 W; and extraction time, 7 min. Under the proposed conditions, the yield of flavonoids was much higher than that obtained from some methods reported in the literature. The optimal adsorption/desorption conditions for purifying the crude flavonoids with AB-8 macroporous adsorbent resin were determined as follows: the extract solution at pH 2 was passed through the column at a fl ow rate of 2 bed volumes/h (BV/h), and then the column was eluted with 60% al cohol at 3 BV/h. The purifi cation of crude fl avonoids from C. axillaris was also investigated using preparative chromatography and the feasibility was confi rmed by the results of HPLC analysis.
Key words:Choerospondias axillaris; response surface analysis; macroporous resin; preparative chromatography
中图分类号:TS202.3
文献标志码:A
文章编号:1002-6630(2015)22-0018-07
doi:10.7506/spkx1002-6630-201522004
收稿日期:2015-03-21
基金项目:天津市自然科学基金重点项目(12JCZDJC34100);天津市高等学校创新团队培养计划项目(TD12-5049)
作者简介:杨云舒(1991—),女,硕士研究生,研究方向为食品添加剂。E-mail:yangys019@hotmail.com
*通信作者:姜子涛(1956—),男,教授,博士,研究方向为食品添加剂。E-mail:ztjiang@tjcu.edu.cn