
李 斌,雷 月,孟宪军,矫馨瑶,高凝轩,赵 悦,张家臣
(沈阳农业大学食品学院,辽宁 沈阳 110866)
摘 要:选用长白山的蓝靛果忍冬冻果作为原料,以蓝靛果多酚提取量为指标,在单因素试验的基础上,通过三因素三水平的响应面优化试验,得出了蓝靛果多酚最佳的提取工艺条件为:料液比1∶25(g/mL)、提取温度40 ℃、乙醇体积分数50%、超声功率500 W、提取时间90 min。在此条件下,蓝靛果多酚提取量达7.52 mg/g。此外,通过体外抗氧化能力评价方法得出:蓝靛果多酚具有较强的清除超氧阴离子自由基、2,2’-联氨-双-(3-乙基苯并噻唑啉-6-磺酸)二胺盐自由基(2,2’-azino-bis(3-ehtylbenzothiazoline-6-sulfonic acid) diammonium salt radical,ABTS +·)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的能力。由相关性分析结果可知,蓝靛果多酚含量与超氧阴离子自由基、DPPH自由基清除能力之间呈极显著正相关(P<0.01),与ABTS +·清除能力间呈显著正相关(P<0.05)。
关键词:蓝靛果;多酚;超声波辅助提取;响应面法;抗氧化
蓝靛果忍冬(Lonicera caerulea L.)是一种新兴的野生浆果资源,简称为蓝靛果,民间也俗称山茄子、黑瞎子果等,它具有较强的生命力、抗寒能力,适应性也很好 [1-2]。蓝靛果果实呈蓝黑色或紫黑色,是一种营养极为丰富的浆果,含有多种维生素、矿物质和氨基酸等营养成分,具有较高的营养及药用双重价值,也被称为“第三代水果” [3-5]。近几年对于蓝靛果中富含的生物活性物质引起了人们的广泛关注和重视,其主要成分为酚类物质,其中主要包括酚酸类物质、黄酮类物质以及花色苷类物质,它们种类多样,含量极高,并且具有抗氧化功能,可以预防癌症、心血管、神经性等多种慢性疾病 [6-8]。
蓝靛果中酚类物质均以混合物的形式存在于植物细胞中,通过采用适当的提取方法将其从原材料中提取出来,才能对其进行充分的开发利用。目前常用的提取方法有溶剂提取法、酶解法、微波辅助提取法以及超声波辅助提取法等 [9-10]。溶剂提取法和酶解法是较传统且操作简单的提取方法,但通过溶剂提取法得到的多酚粗提物色价和纯度均较低,酶解法因酚类物质在植物中存在形态不同,会使其提取率受到一定影响。李宁 [11]利用溶剂提取法、超声波提取法和酶解法从蓝靛果中提取色素,比较发现溶剂提取法提取率较低,而超声波提取法和酶解法均有利于蓝靛果色素的提取,且提取率相对较高。微波浸提法虽具有时间短、效率高等优点,但成本较高,且其高能量的微波辐射长时间会对操作人员身体健康产生不良影响。超声波辅助提取技术是一项新型的天然产物辅助溶剂提取技术,具有提取时间短、效率高、成本低、可减少高温对提取物质的影响、可提高产品的质量和产量等优点 [12-14]。目前,岳晓霞 [15]、张雁南 [10]等对蓝靛果色素的提取和抗氧化作用已做了相关研究,但针对蓝靛果多酚的提取工艺与抗氧化性的研究鲜有报道。本研究对超声波辅助提取蓝靛果多酚的工艺进行响应面法优化试验设计,确定出最佳的提取工艺条件,同时通过体外抗氧化评价实验分析了蓝靛果多酚的抗氧化活性,旨在为蓝靛果多酚的开发和深加工提供技术参考。
1.1 材料与试剂
蓝靛果忍冬采自吉林省长白山,挑选出无病虫害和机械损伤且成熟度一致的果实,简略清洗沥干后,速冻并于-40 ℃冰箱冻藏。
福林-酚试剂、没食子酸标准品、2,2’-联氨-双-(3-乙基苯并噻唑啉-6-磺酸)二胺盐(2,2’-azinobis(3-ehtylbenzothiazoline-6-sulfonic acid) diammonium salt radical,ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;无水乙醇、95%乙醇、盐酸、氢氧化钠、无水碳酸钠 国药集团化学试剂有限公司。
1.2 仪器与设备
JYL-C012九阳榨汁机、电子分析天平、PHS-3C型pH计 北京赛多利斯科学仪器有限公司;SB25-12 DTN超声波清洗机(超声功率500 W) 宁波新芝生物科技股份有限公司;真空泵 巩义市予华仪器有限责任公司;旋转蒸发仪 上海亚荣生化仪器厂;UV-1600型紫外-可见分光光度仪 北京瑞利分析仪器公司;BCD-186KB型冰箱 青岛海尔电器有限公司。
1.3 方法
1.3.1 蓝靛果多酚提取工艺流程

1.3.2 多酚含量的测定
采用福林-酚法 [16-17]。用移液枪准确移取待测提取液1.0 mL于25 mL的刻度试管中,同时依次加入5.0 mL蒸馏水、1 mL Folin-Ciocalteau显色剂及3 mL 7.5% Na 2CO 3溶液,振荡摇匀,显色2 h,并在765 nm波长处测定吸光度。以没食子酸为标准品,绘制标准曲线,得到回归线性方程y=0.081 05+5.011 43x(R 2=0.999 6),没食子酸在0.005~0.05 mg/mL质量浓度范围内具有良好的线性关系,根据标准曲线方程求出提取液中多酚质量浓度(mg/mL)。
1.3.3 多酚含量的计算
式中:X为样品中多酚含量(蓝靛果中含有相当于没食子酸的毫克数)/(mg/g);ρ为根据标准曲线方程计算出待测液中多酚的质量浓度/(mg/mL);V为待测液体积/mL;N为稀释倍数;m为样品质量/g。
1.3.4 蓝靛果多酚提取工艺优化
1.3.4.1 单因素试验
精确称取5.00 g蓝靛果冻果,经解冻打浆后无损失地转移到烧杯中,加入乙醇溶液,在超声波辅助提取条件下(固定功率为500 W),分别考察料液比(1∶5、1∶10、1∶15、1∶20、1∶25、1∶30、1∶35(g/mL))、乙醇体积分数(40%、45%、50%、55%、60%、65%、70%)、提取时间(30、60、90、120、150 min)和提取温度(25、30、35、40、45、50、55 ℃)对蓝靛果多酚提取量的影响。
1.3.4.2 响应面优化试验设计
在单因素试验的基础上,根据Box-Behnken试验设计原理,以蓝靛果多酚提取量为响应值,选取对蓝靛果多酚提取量影响较为显著的料液比、乙醇体积分数、提取温度3 个因素,通过响应面分析法对工艺条件进行三因素三水平的试验设计,优化超声波辅助提取蓝靛果多酚工艺参数。响应面分析因素及水平见表1。
表1 响应面分析因素及水平
Table1 Factors and levels used in response surface analysis

水平因素A料液比(g/mL)B提取温度/℃C乙醇体积分数/% -11∶153545 0 1∶204050 1 1∶254555
1.3.5 蓝靛果多酚体外抗氧化活性的测定
按照确定的最佳提取工艺条件提取蓝靛果多酚,并对其进行抽滤、真空旋转蒸发后得到多酚粗提液,对其进行抗氧化活性评价分析。
1.3.5.1 超氧阴离子自由基清除能力的测定
参照刘奕琳等 [18]的方法略作改动。为避免温度条件影响结果,所需试剂均放置于25 ℃水浴锅中保温。准确移取200 μL不同质量浓度蓝靛果多酚提取液,加入5.7 mL Tris-HCl缓冲溶液(50 mmol/L,pH 8.20),最后加入6 mmol/L邻苯三酚溶液0.1 mL,漩涡混合后移入石英比色皿中,在320 nm波长处测定反应物的吸光度。直到反应进行至6 min,记录反应混合物的吸光度A i;对照管以等体积蒸馏水代替邻苯三酚溶液,同法操作,测定吸光度A i0;以等体积蒸馏水代替多酚提取液,同法操作,测定吸光度A 0。采用抗坏血酸作为对照,每组3 次重复,取其平均值。超氧阴离子自由基清除率按式(2)计算:
1.3.5.2 DPPH自由基清除能力的测定
参照文献[19-20]的方法略作改动。精确配制浓度为0.1 mmol/L的DPPH乙醇溶液(现用现配),保存于棕色试剂瓶中。向试管中加入2.0 mL的DPPH乙醇溶液和2.0 mL不同质量浓度的蓝靛果多酚提取液,充分混合,室温避光反应30 min后,测定该混合溶液在517 nm波长处的吸光度A i,以等体积的无水乙醇代替多酚提取液,同法操作,测定吸光度为A 0;以等体积的无水乙醇代替DPPH乙醇溶液,加入不同质量浓度的蓝靛果多酚提取液,同法操作,测定吸光度为A i0。采用抗坏血酸作为对照,每组3 次重复,取其平均值。DPPH自由基清除率按式(3)计算:
1.3.5.3 ABTS +·清除能力的测定
参照唐艳平等 [2 1]的方法略作改动。将8 8 μ L(140 mmol/L)氧化剂过硫酸钾溶液与5 mL的7 mmol/L ABTS +·溶液混合,配制成ABTS母液并在室温避光条件下静置过夜,接着用蒸馏水将ABTS母液稀释,使其在734 nm波长处吸光度为0.7±0.02,记作A 0(现用现配)。取0.1 mL不同质量浓度的蓝靛果多酚提取液与1.4 mL的ABTS工作液漩涡振荡混匀,于室温避光处反应6 min后,在734 nm波长处测定吸光度A i。采用抗坏血酸作为对照,每组3 次重复,取其平均值。ABTS +·清除率按式(4)计算:
1.4 数据处理与统计分析
采用Excel 2003对实验数据进行整理后,应用统计分析软件SPSS 17.0对数据进行单因素方差分析、多重比较分析和相关性分析,结果以
 ±s(n=3)表示,显著性水平为P<0.05,极显著水平为P<0.01。同时采用Design-Expert 7.0统计软件进行响应面优化分析。
±s(n=3)表示,显著性水平为P<0.05,极显著水平为P<0.01。同时采用Design-Expert 7.0统计软件进行响应面优化分析。
2.1 超声波辅助提取蓝靛果多酚的单因素试验结果
2.1.1 料液比对蓝靛果多酚提取量的影响
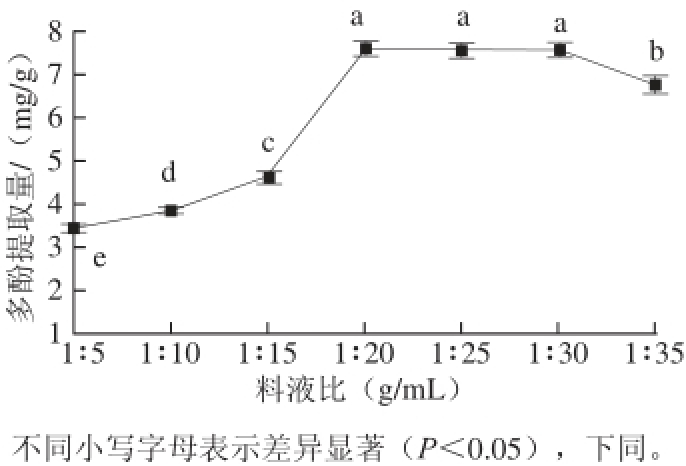
图1 料液比对蓝靛果多酚提取的影响
Fig.1 Effect of material-to-liquid ratio on polyphenol yield
超声功率500 W、提取时间90 min、提取温度45 ℃、乙醇体积分数60%的条件下,分别考察1∶5、1∶10、1∶15、1∶20、1∶25、1∶30、1∶35(g/mL)的料液比对蓝靛果多酚提取量的影响。由图1可知,料液比在1∶5~1∶20的范围内,随着溶剂用量的增大,蓝靛果多酚提取量有明显的提高,不同料液比之间蓝靛果多酚提取量存在显著性差异(P<0.05)。当料液比为1∶20时,多酚含量达到最大值7.593 mg/g,继续增大料液比对多酚提取量无显著性影响(P>0.05),甚至有下降的趋势,表明此时多酚物质已不再溶出。此外,料液比过大不利于后续的分离纯化且还会造成资源的浪费,因此,选择料液比范围为1∶15~1∶25,进行后续响应面优化试验。
2.1.2 提取温度对蓝靛果多酚提取量的影响
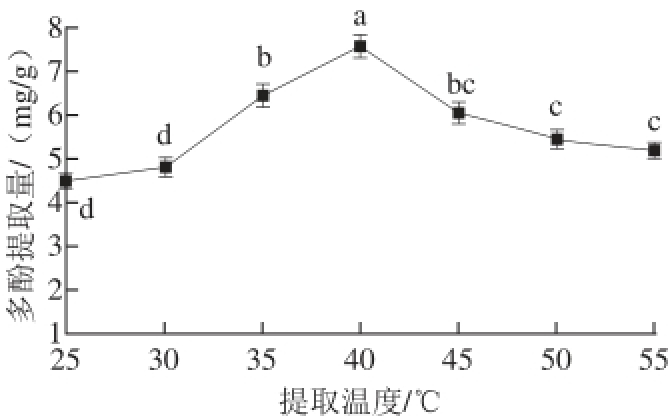
图2 提取温度对蓝靛果多酚提取的影响
Fig.2 Effect of extraction temperature on polyphenol yield
超声功率500 W、提取时间90 min、乙醇体积分数60%、料液比1∶20条件下,分别考察25、30、35、40、45、50、55 ℃的提取温度对蓝靛果多酚提取量的影响。
由图2可知,随着提取温度的升高,蓝靛果多酚提取量也在逐渐增加,这是因为升高提取温度,可以加快溶质中多酚物质的扩散速率,有利于多酚的浸透、溶解,因而酚类物质更容易从原料中浸出,当提取温度达40 ℃时,多酚提取量显著高于25、30、35、45、50 ℃和55 ℃时的多酚提取量(P<0.05),随后当温度继续升高时,蓝靛果提取量呈下降趋势,且差异不显著(P>0.05)。这可能是由于温度过高,热不稳定性或挥发性成分易被破坏或挥发损失,使得提取量有所下降 [22]。因此,将提取温度的范围确定在35~45 ℃,进行后续响应面优化试验。
2.1.3 乙醇体积分数对蓝靛果多酚提取量的影响
超声功率500 W、提取时间90 min、料液比1∶20、提取温度40 ℃的条件下,分别考察40%、45%、50%、55%、60%、65%、70%的乙醇体积分数对蓝靛果多酚提取的影响。
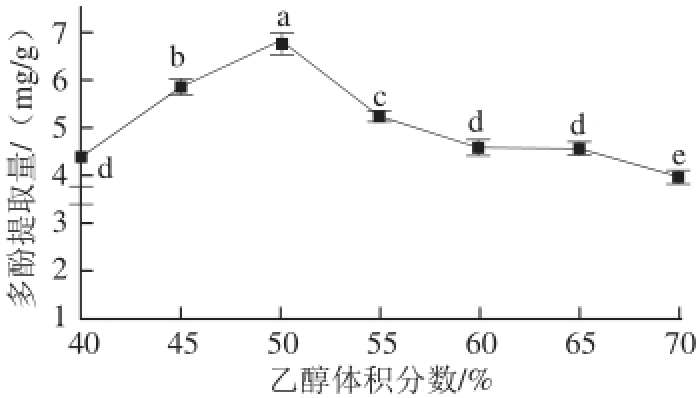
图3 乙醇体积分数对蓝靛果多酚提取的影响
Fig.3 Effect of ethanol concentration on polyphenol yield
由图3可知,乙醇体积分数对蓝靛果多酚提取量有显著性的影响(P<0.05)。在乙醇体积分数40%~50%的范围内,多酚提取量随乙醇体积分数的增大而显著增大(P<0.05),当乙醇体积分数达到50%时,多酚含量达到最大值,此后继续增加乙醇体积分数,多酚提取量呈下降趋势,这可能与蓝靛果多酚的极性大小有关,但是当乙醇体积分数在55%时,多酚提取量显著高于60%、65%和70%体积分数的提取量(P<0.05)。因此,选择乙醇体积分数为45%~55%。
2.1.4 提取时间对蓝靛果多酚提取量的影响
超声功率500 W、料液比1∶20、提取温度40 ℃、乙醇体积分数50%的条件下,分别考察30、60、90、120、150 min的提取时间对蓝靛果多酚提取量的影响。
由图4可知,当提取时间为90 min时,蓝靛果多酚提取量显著高于其他时间段(P<0.05),达到最大值6.93 mg/g,随着提取时间的延长,多酚提取量反而降低,这表明在90 min时蓝靛果多酚已提取完全,而随着多酚在空气中暴露时间的延长,导致部分多酚被分解或氧化,使得含量有所降低,且不同提取时间之间的差异不显著(P>0.05)。因此,选择最佳的提取时间为90 min进行后续优化试验。

图4 提取时间对蓝靛果多酚提取的影响
Fig.4 Effect of ultrasonic time on polyphenol yield
2.2 超声波辅助提取蓝靛果多酚的响应面优化试验结果
2.2.1 响应模型的建立与分析
表2 响应面分析方案及结果
Table2 Experimental design and results for response surface analysis
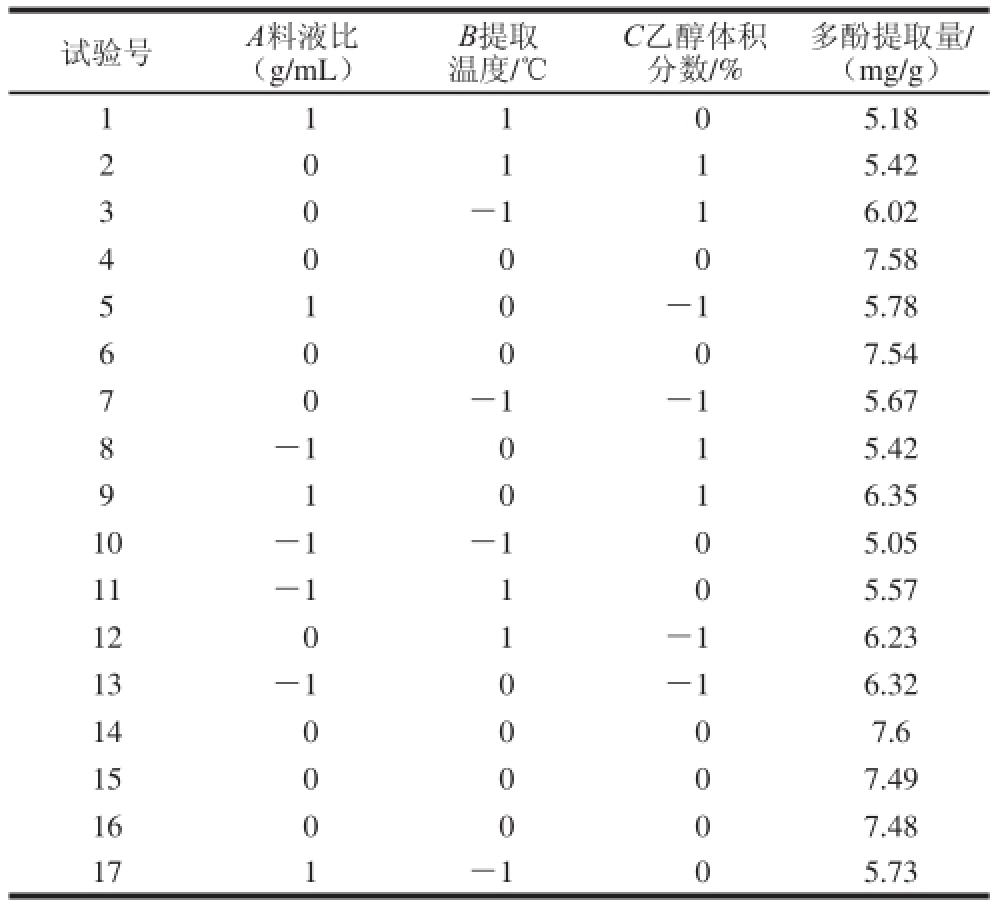
试验号A料液比(g/mL)多酚提取量/(mg/g)1 1 1 0 5.18 B提取温度/℃C乙醇体积分数/% 2 5.42 3 0 -116.02 0 1 1 4 7.58 5 1 0 -15.78 0 0 0 6 7.54 7 0 -1-15.67 0 0 0 8 -1015.42 9 1 0 1 6.35 10-1-105.05 11-1105.57 1201-16.23 13-10-16.32 140007.6 150007.49 160007.48 171-105.73
响应面分析法是一种用于在多因素系统中寻找最佳测试条件的统计方法,常用的是Box-Behnken设计 [23]。利用Design-Expert 7.0软件对表2试验数据进行二次多项式回归拟合,得到多酚含量对料液比(A)、提取温度(B)、乙醇体积分数(C)的回归模型方程为:
多酚提取量/(mg/g)=7.54+0.085A-8.750×10 -3B-0.099C-0.27AB+0.37AC-0.29BC-1.01A 2-1.14B 2-0.56C 2
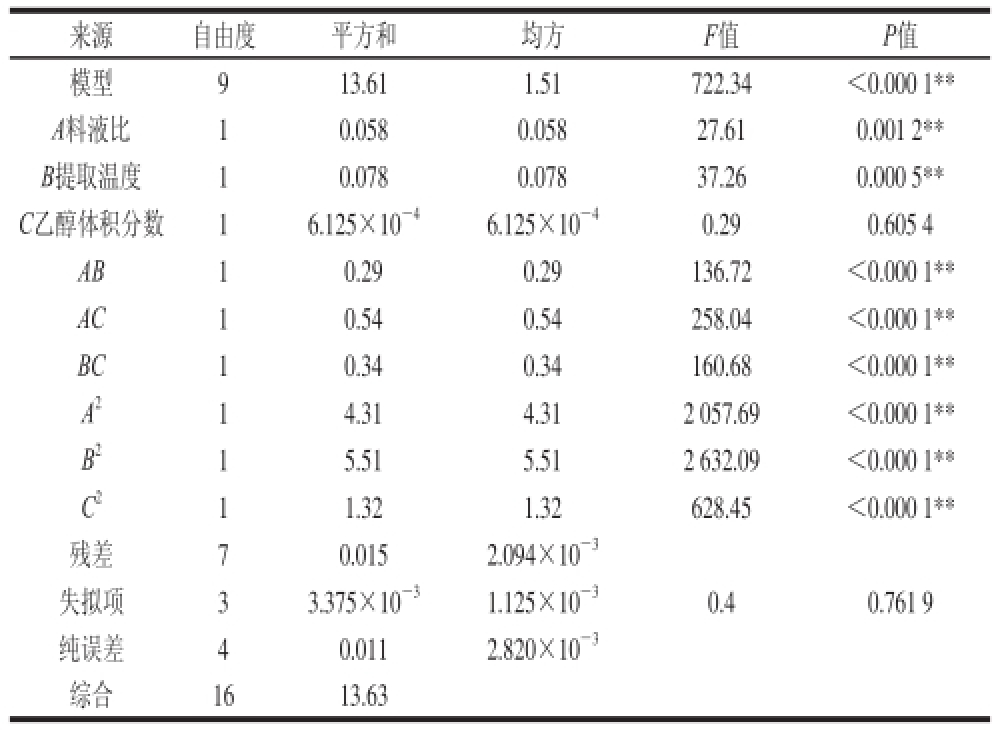
从表3可以看出,回归模型具有高度的显著性(P<0.000 1),失拟项不显著(P =0.761 9>0.05),其校正决定系数(R 2 Adj)为0.997 5,R 2= 0.998 9,表明此模型拟合度好,试验误差小,因此该模型能够反映响应值的变化,可以利用此方程模型对超声波辅助提取蓝靛果多酚的工艺参数进行分析和预测。对回归模型进行显著性检验可知,A、B、AB、AC、BC、A 2、B 2、C 2对多酚提取量有极显著影响(P<0.01),其他因素影响不显著。根据F值可知,各个因素对蓝靛果多酚提取量影响的大小顺序为:提取温度(B)>料液比(A)>乙醇体积分数(C)。
表3 回归方程方差分析
Table3 Analysis and statistical parameters of regression model
注:*.差异显著(P<0.05);**.差异极显著(P<0.01)。下同。
来源自由度平方和均方F值P值模型913.611.51722.34<0.000 1** A料液比10.0580.05827.610.001 2** B提取温度10.0780.07837.260.000 5** C乙醇体积分数16.125×10 -46.125×10 -40.290.605 4 AB10.290.29136.72<0.000 1** AC10.540.54258.04<0.000 1** BC10.340.34160.68<0.000 1** A 214.314.312 057.69<0.000 1** B 215.515.512 632.09<0.000 1** C 211.321.32628.45<0.000 1**残差70.0152.094×10 -3失拟项33.375×10 -31.125×10 -30.40.761 9纯误差 40.0112.820×10 -3综合1613.63
2.2.2 响应面优化
通过观察图5中响应面的变化情况和等高线的稀疏程度可直观地反映料液比(A)、提取温度(B)、乙醇体积分数(C)之间交互作用对蓝靛果多酚提取量的影响,当等高线呈圆形时表示两因素交互作用不显著,而呈椭圆形或马鞍形时则表示两因素交互作用显著 [24-25]。
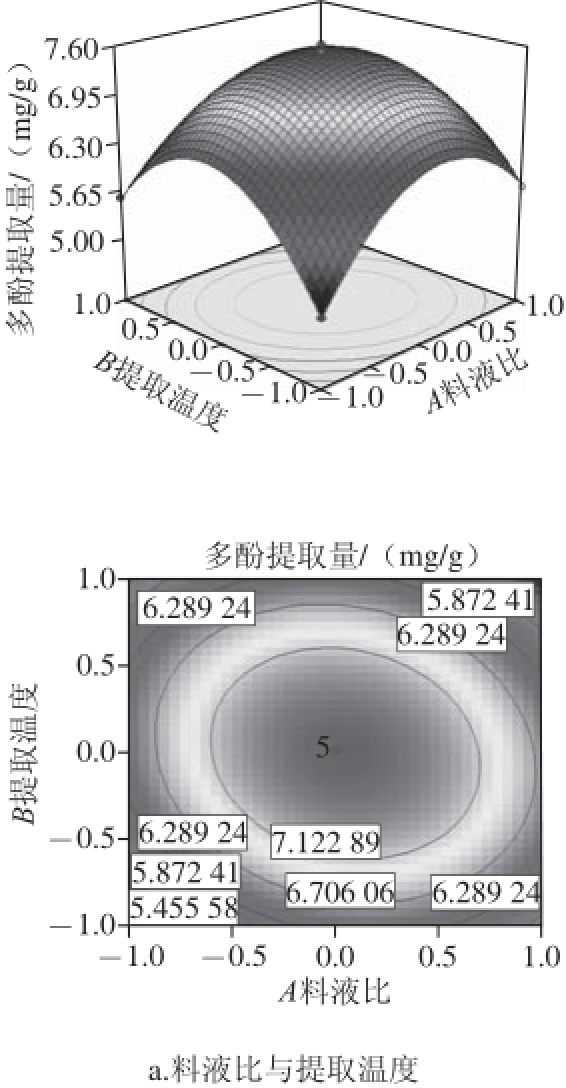

图5 各因素交互作用对多酚提取量影响的响应面和等高线图
Fig.5 Response surface and contour plots showing the interactive effects of extraction parameters on polyphenal yield
由图5a可知,提取温度的变化曲面和料液比的变化曲面均较陡峭,说明提取温度和料液比对蓝靛果多酚提取量影响均较显著,与方差分析结果相符。由图5b可知,料液比的变化曲面比乙醇体积分数的变化曲面陡峭,说明料液比对多酚提取量的影响更显著一些,与方差分析结果相符。由图5c可知,提取温度的变化曲面较陡峭,相比之下,乙醇体积分数的变化曲面平缓一些,说明提取温度较乙醇体积分数对多酚提取量的影响显著,与方差分析结果相符。图5等高线图均呈明显的椭圆形,说明料液比和提取温度、料液比和乙醇体积分数及提取温度和乙醇体积分数之间交互作用均较为显著,对蓝靛果多酚提取量影响较大。
2.2.3 最佳条件的确定和回归模型的验证
通过响应面法得到超声波辅助提取蓝靛果多酚最佳工艺条件为料液比1∶24.79(g/mL)、乙醇体积分数50.43%、提取温度39.63 ℃,在此条件下得到的多酚含量为7.75 mg/g。实际操作中稍作调整确定的最佳工艺条件为料液比1∶25(g/mL)、乙醇体积分数50%、提取温度40 ℃,在此条件下进行验证实验,得到的多酚含量为7.52 mg/g,与理论值非常接近。
2.3 蓝靛果多酚体外抗氧化活性的测定结果
2.3.1 清除超氧阴离子自由基能力
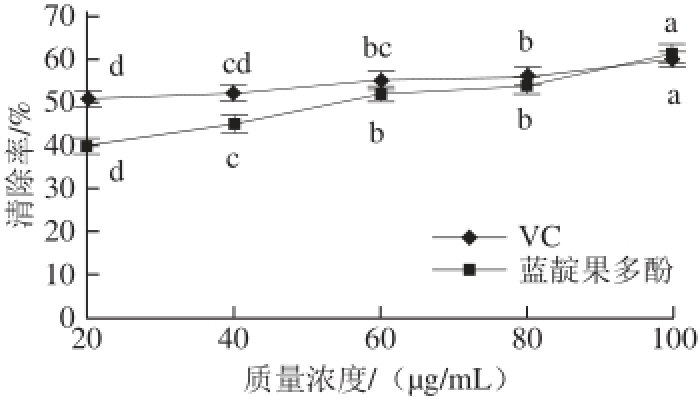
图6 蓝靛果多酚对超氧阴离子自由基的清除能力
Fig.6 Superoxide free radical scavenging capacity of VC and polyphenols from haskap berries
由图6可知,蓝靛果多酚和VC对照组对超氧阴离子自由基均具有较好的清除能力,且清除率随着质量浓度的增加而增强。当质量浓度为100 μg/mL时,蓝靛果多酚和VC对照组清除超氧阴离子自由基的能力最强,清除率分别为61.61%和60.27%。当质量浓度在40 μg/mL和60 μg/mL时,蓝靛果多酚和VC对照组对超氧阴离子自由基的清除能力之间存在差异(P<0.05),而质量浓度在80 μg/mL和100 μg/mL时,两者清除能力非常接近,无显著性差异(P>0.05)。
2.3.2 清除DPPH自由基能力

图7 蓝靛果多酚对DPPH自由基的清除能力
Fig.7 DPPH free radical scavenging capacity of VC and polyphenols from haskap berries
由图7可知,蓝靛果多酚和VC对照组对DPPH自由基的清除能力均较显著(P<0.05),且清除率随着质量浓度的增加而增强,呈现明显的量效关系。当质量浓度在20~68 μg/mL的范围内,蓝靛果多酚对DPPH自由基的清除能力略低于同质量浓度的VC对照组。整体而言,质量浓度在20~100 μg/mL的范围内,两者之间对DPPH自由基清除能力无显著性差异(P>0.05)。
2.3.3 清除ABTS +·能力
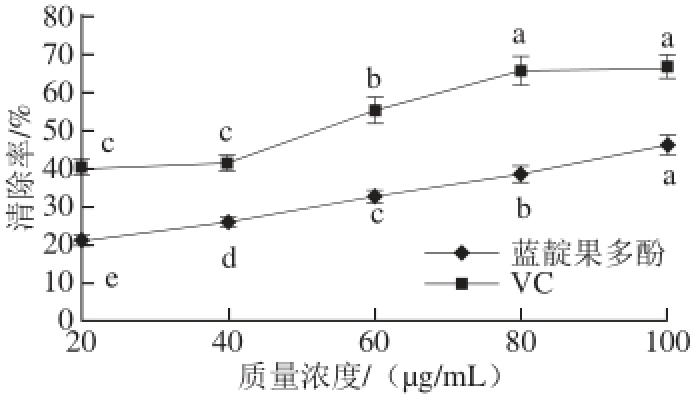
图8 蓝靛果多酚对ABBTTSS
+·的清除能力
Fig.8 ABTS
+· free radical scavenging capacity of VC and polyphenols from haskap berries
由图8可知,蓝靛果多酚和VC对照组对ABTS +·均具有较强的清除能力,且清除率随着质量浓度的增加而增强,尤其当质量浓度在40~80 μg/mL范围内,蓝靛果多酚对ABTS +·的清除能力显著性增强(P<0.05)。当质量浓度为20、40、60、80 μg/mL时,蓝靛果多酚和VC对照组之间对ABTS +·的清除能力存在显著性差异(P<0.05)。在相同质量浓度条件下,蓝靛果多酚的清除率明显高于VC对照组。
2.4 蓝靛果多酚含量与抗氧化活性之间的相关性分析
表4 蓝靛果多酚含量与抗氧化活性的相关性分析
Table4 Correlation analysis between polyphenol content and antioxidant activities of haskap berries

DPPH自由基清除能力多酚含量1.00超氧阴离子自由基清除能力0.991**1.00 ABTS +·清除能力0.958*0.934*1.00 DPPH自由基清除能力0.962**0.923*0.986**1.00指标多酚含量超氧阴离子自由基清除能力ABTS +·清除能力
由表4可知,蓝靛果多酚含量与超氧阴离子自由基清除能力和DPPH自由基清除能力之间均极显著正相关(P<0.01),且相关系数分别为0.991和0.962,同时多酚含量与ABTS +·清除能力之间呈显著正相关(P<0.05),相关系数为0.958。韩爱芝等 [26]研究大花罗布麻各部位提取物多酚含量与抗氧均能力间的关系及尚红梅等 [27]考察菊苣根多酚含量与抗氧化性能比较分析中,均发现受试样品中多酚含量与DPPH自由基、ABTS +·清除能力间呈显著正相关。实验结果表明,蓝靛果多酚含量与超氧阴离子自由基、DPPH自由基及ABTS +·清除能力之间关系密切,呈现明显的量效关系。
在超声波辅助提取蓝靛果多酚的单因素试验基础上,利用Box-Behnken响应面优化试验设计,确定了蓝靛果多酚提取的最优试验工艺条件为料液比1∶25(g/mL)、提取温度40 ℃、提取时间90 min、乙醇体积分数50%、超声功率500 W,在此条件下获得的多酚含量高达7.52 mg/g。通过对蓝靛果多酚进行体外抗氧化活性测定实验发现,蓝靛果多酚对超氧阴离子自由基、DPPH自由基和ABTS +·具有较强的清除能力,且由相关性分析结果可知,蓝靛果多酚含量分别与超氧阴离子自由基清除能力和DPPH自由基清除能力之间呈极显著正相关(P<0.01),与ABTS +·清除能力之间呈显著正相关(P<0.05)。
参考文献:
[1] 吕闻明. 蓝靛果忍冬酚类物质提取及抗氧化性研究[D]. 长春: 吉林大学, 2012.
[2] 刘敬华, 王振宇. 精制及高纯度蓝靛果花色苷的抗氧化性及稳定性研究[J]. 食品工业科技, 2013, 34(19): 87-92.
[3] 张敏, 刘刚, 张雁南, 等. 响应面法优化蓝靛果花色苷提取工艺研究[J].北方园艺, 2014(23): 113-116.
[4] 刘德江, 申健, 田立娟, 等. 野生与栽培蓝靛果果实提取物的体外抗氧化活性[J]. 经济林研究, 2013, 31(3): 103-106.
[5] 刘敬华, 王振宇, 邓心蕊. 响应面分析法优化蓝靛果花色苷纯化工艺研究[J]. 食品工业科技, 2013, 34(18): 280-283.
[6] JURIKOVA T, ROP O, MLCEK J. Phenolic profile of edible honeysuckle berries and their biological effects[J]. Molecules, 2012, 17(1): 61-79.
[7] LEE J H, PARK K H, LEE M H, et al. Identifi cation, characterization, and quantifi cation of phenolic compounds in the antioxidant activitycontatining fraction from the seeds of Korean Perilla (Perilla frutescens) cultivars[J]. Food Chemistry, 2013, 136: 843-852.
[8] 焦岩, 王振宇. 蓝靛果花色苷超声波辅助提取优化及其降血脂作用[J].中国食品学报, 2010, 10(2): 52-59.
[9] 刘希财, 王元舒. 蓝靛果忍冬色素提取工艺的研究[J]. 北方园艺, 2012(6): 16-18.
[10] 张雁南, 刘硕芳, 李皓, 等. 蓝靛果红色素微波提取及抗氧化作用[J].食品科学, 2010, 31(18): 104-107.
[11] 李宁. 蓝靛果中红色素的提取纯化及稳定性研究[D]. 长春: 长春工业大学, 2011.
[12] 程秀玮, 魏玮. 响应面优化超声波辅助提取桑葚花色苷工艺的研究[J].中国酿造, 2014, 33(6): 123-127.
[13] PAN Guangyan, YU Guoyang, ZHU Chuanhe, et al. Optimization of ultrasound-assiste dextraction (UAE) of fl avonoids compounds (PC) from hawthorn seed(HS)[J]. Ultrason Sonochemistry, 2012, 19(3): 486-490.
[14] CHEMAT F, HUMA Z, KHAN M K. Applications of ultrasound in food technology: processing, preservation and extraction[J]. Ultrasonics Sonochemistry, 2011, 18: 813-835.
[15] 岳晓霞, 张根生, 李志. 超声波辅助乙醇法提取蓝靛果色素工艺条件的研究[J]. 食品科学, 2008, 29(11): 287-289.
[16] 冯进, 曾晓雄, 李春阳. 响应面优化蓝莓叶多酚提取工艺[J]. 食品科学, 2013, 34(4): 59-64.
[17] SILVA E M, ROGEZ H, LARONDELLE Y. Optimization of extraction of phenolics from Ingaedulis leaves using response surface methodology[J]. Separation and Purifi cation Technology, 2007, 55(3): 381-387.
[18] 刘奕琳, 王振宇. 蓝靛果中花色苷含量的测定及其体外抗氧化性[J].中国林副特产, 2011(5): 14-17.
[19] LI Xiuxia, HAN Lujia, CHEN Longjian. In vitro antioxidant activity of protein hydrolysates prepared from com glutenmeal[J]. Journal of the Science Food and Agriculture, 2008, 88(9): 1660-1666.
[20] 李颖畅, 李冰心, 孟良玉, 等. 圣云蓝莓花色苷不同组分的体外抗氧化性和稳定性[J]. 食品科学, 2012, 33(9): 105-109.
[21] 唐艳平, 张伟敏, 陈文学, 等. 腰果梨渣多酚提取及抗氧化性研究[J].食品科学, 2010, 31(20): 240-245.
[22] 杜彬, 王同坤, 侯文龙, 等. 板栗花中总多酚提取工艺优化[J]. 食品科学, 2011, 32(16): 121-126.
[23] SUN Yi, WU Wenqing, ZHANG Wenqin, et al. Optimizing the extraction of phenolic antiodants from Kudingcha made from Ilex kudingcha C. J. Tseng by using response surface methodology[J]. Separation and Purifi cation Technology, 2011, 78(3): 311-320.
[24] 陈晨, 胡文忠, 田沛源, 等. 超声辅助提取香蕉皮多酚工艺优化及其抗氧化性的分析[J]. 食品科学, 2014, 35(2): 12-17. doi: 10.7506/spkx 1002-6630-201402003.
[25] 王海燕, 李睿, 曾秀, 等. 响应面优化超声波提取桑叶槲皮素工艺[J].食品科学, 2014, 35(22): 56-62.
[26] 韩爱芝, 黄军海, 孟庆艳, 等. 大花罗布麻不同部位酚类物质含量及其抗氧化活性比较研究[J]. 食品科学, 2014, 35(13): 127-131. doi: 10.7506/spkx1002-6630-201413024.
[27] 尚红梅, 郭玮, 潘丹, 等. 干燥方式对菊苣根多酚含量和抗氧化活性的影响[J]. 食品科学, 2015, 36(1): 84-88.doi: 10.7506/spkx1002-6630-201501016.
Optimization of Ultrasonic-Assisted Extraction of Polyphenols from Haskap Berries (Lonicera caerulea L.) Using Response Surface Methodology and Their Antioxidant Capacity
LI Bin, LEI Yue, MENG Xianjun, JIAO Xinyao, GAO Ningxuan, ZHAO Yue, ZHANG Jiachen
(College of Food Science, Shenyang Agricultural University, Shenyang 110866, China)
Abstract:In this study, the extraction conditions for improved yield of polyphenols from haskap berries (Lonicera caerulea L.) were optimized using single factor experiments and response surface methodology involving three independent variables at three different levels. The optimum conditions for polyphenol extraction were determined as follows: the extraction solvent was 50% ethanol with a solvent to solid ratio of 1:25 (g/mL), and the extraction was performed at 40 ℃ with a microwave power of 500 W for 90 min. Under these conditions, the extraction yield of polyphenols from haskap berries was 7.52 mg/g. In addition, the extracted polyphenols had a strong scavenging capacity against superoxide anion, 1,1-diphenyl-2-picrylhydrazyl (DPPH) and 2,2’-azino-bis(3-ehtylbenzothiazoline-6-sulfonic acid) diammonium salt radical (ABTS +·) free radicals. Highly signifi cant positive correlation was found between total polyphenol content and superoxide anion or DPPH free radical scavenging capacity (P < 0.01) and the correlation with ABTS +· free radical scavenging capacity was positive signifi cantly (P < 0.05).
Key words:Lonicera caerulea L.; polyphenols; ultrasonic-assisted extraction; response surface methodology; antioxidant capacity
中图分类号:TS255.1
文献标志码:A
文章编号:1002-6630(2015)22-0033-07
doi:10.7506/spkx1002-6630-201522006
收稿日期:2015-03-17
基金项目:辽宁省高等学校优秀人才支持计划项目(2014108);沈阳农业大学天柱山英才项目(2014);
公益性行业(农业)科研专项(201303073-04)
作者简介:李斌(1979—),男,副教授,博士,研究方向为浆果深加工及功能食品开发。E-mail:libinsyau@163.com