顶空固相微萃取-气相色谱-质谱法同时检测啤酒酿造大米中16 种风味物质含量
张源麟
1,董建军
2,郝俊光
2,闫 鹏
2,汪东风
1,*
(1.中国海洋大学食品科学与工程学院,山东 青岛 266100;2.啤酒生物发酵工程国家重点实验室,青岛啤酒股份有限公司科研开发中心,山东 青岛 266100)
摘 要:利用顶空固相微萃取-气相色谱-质谱技术,建立了一种同时检测啤酒酿造大米中16 种风味物质的定量分析方法。通过研究不同因素对风味物质萃取效果的影响,最终确定顶空固相微萃取最佳萃取条件为:使用50/30 μm DVB/CAR/PDMS萃取头、40 ℃条件下萃取60 min。质谱的采集使用选择离子监控模式。该方法的线性良好(R
2>0.99),准确性高(16 种物质的加标回收率在85.7%~118.0%之间),稳定性强(相对标准偏差均低于9.98%),操作过程简便,能准确检测啤酒酿造大米中16 种风味物质的含量,对啤酒风味和质量控制具有一定作用。
关键词:顶空固相微萃取;气相色谱-质谱法;啤酒酿造大米;风味物质
我国啤酒酿造普遍采用高浓高辅(高麦汁浓度,高辅料比)的方式,使用大米作为啤酒辅料,不仅可以改善啤酒色泽和风味,还可以降低啤酒企业生产成本,提高企业效益
[1-4]。原则上大米都可用于酿造,但从啤酒风味而言,啤酒酿造大米的品质越好,啤酒风味也越好
[1]。而啤酒风味是啤酒最重要的特性及质量指标之一,其风味物质的种类和数量不仅决定啤酒的类型和风格,而且由于风味物质处于动态变化之中,使得啤酒新鲜度问题变得相当复杂
[5-6]。啤酒的风味物质包含醇类、醛类、酯类、酸类、酮类等,主要来源于3 个途径:一是原料本身含有的风味成分;二是原料中的某些物质在微生物的作用下生成的风味成分;三是生产过程中产生的物质以及这些物质成分转化生成新的风味成分
[7]。
通过仪器分析检测到的大米挥发性物质已有200多种,然而挥发性物质与风味对应关系上只有很少一部分为人所了解
[8-9]。大米中的己醛(具有葡萄酒味)、戊醛(具有果香味)等主要由不饱和脂肪酸(亚麻酸和亚油酸等)氧化产生,因而含量较多,可以用来表征大米新鲜度;2-甲基丁醛具有青香味,糠醛具有焦糖味,戊基呋喃具有花香气味。有些物质尽管含量少,然而阈值低,不容忽视,比如反-2-壬烯醛(具有纸板味)阈值仅为0.1 μg/L,就受到了啤酒酿造者的高度关注
[10-12]。通过对啤酒风味物质长时间的研究,醛类尤其是脂质氧化产生的醛(反-2-壬烯醛、己醛、戊醛)、Maillard热反应产生的醛(糠醛)和氨基酸Strecker降解产生的醛(2-甲基丙醛、2-甲基丁醛、3-甲基丁醛、苯乙醛)已经成为人们公认的啤酒老化风味物质
[5-6,13-14]。
因此,有必要建立大米中相应风味物质的检测方法,为啤酒酿造者筛选原料提供科学的检测手段。传统检测大米风味物质的方法主要为采集、浓缩、分离、定量
[8],随着科学技术的发展,人们运用了一些新技术来检测大米中的风味物质,如气相色谱、气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用、固相 微萃取-GC-MS(solid-phase microextraction-GC-MS,SPME-GC-MS)等
[15-21]。陈玮等
[15]将大米加热、抽取顶空气体、然后使用GC仪分析乙醛、戊醛和己醛的成分和含量;Takashi等
[22]采用内标法用GC对大米挥发物进行定量分析;郝俊光等
[23]利用顶空(headspace-SPME-GCMS,HS-SPME-GC-MS)建立了定量分析大米中9 种醛类物质方法。这些方法存在易产生新的挥发性物质、操作步骤繁琐、所检目标物质种类较少的问题,本研究拟建立HS-SPME-GC-MS定量检测方法,以测定2-甲基丙醛、3-甲基丁醛、2-甲基丁醛、戊醛、戊醇、己醛、糠醛、2-己醇、2-庚酮、庚醛、戊基呋喃、辛醛、苯乙醛、反-2-辛烯醛、反-2壬烯醛、癸醛共16 种啤酒酿造大米风味物质,以期为大米品质评价和贮存管理提供新的技术手段。
1 材料与方法
1.1 材料与试剂
某啤酒厂酿造用大米。
2-甲基丙醛(纯度99%)、3-甲基丁醛(纯度97%)、2-甲基丁醛(纯度95%)、戊醛(纯度97%)、戊醇(纯度99%)、己醛(纯度98%)、糠醛(纯度99%)、2-己醇(纯度99%)、2-庚酮(纯度99%)、庚醛(纯度95%)、戊基呋喃(纯度97%)、辛醛(纯度99%)、苯乙醛(纯度90%)、反-2-辛烯醛(纯度94%)、反-2壬烯醛(纯度97%)、癸醛(纯度98%)美国Sigma公司;无水乙醇为分析纯试剂。
1.2 仪器与设备
7890N/5975 GC-MS联用仪、DB-5MS毛细管色谱柱(60 m×0.32 mm,0.25 μm) 美国Agilent公司;MPS多功能进样器 德国Gerstel公司;50/30 μm二乙基苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/ polydimethylsiloxane,DVB/CAR/PDMS)涂层萃取头、100 μm PDMS涂层萃取头、65 μm PDMS/DVB涂层萃取头 美国Supelco公司;Cyclotec 1093 Sample Mill型旋风磨 瑞士Tecator公司;120 目孔径筛 浙江上虞华美仪器纱筛厂。
1.3 方法
1.3.1 大米粉的制备
取50 g大米,经旋风磨粉碎,为得到颗粒均一性样品,过120 目筛,得到筛下细粉用于上样检测。
1.3.2 标准液溶液配制
准确配制标准物质储备液,以无水乙醇稀释成不同含量的标准物质混合溶液待用。制作标准曲线时,取10 μL标准物质混合溶液至过筛大米粉中,使大米所含各组分终含量分别为含量1、含量2、含量3、含量4、含量5,具体见表1。标准溶液现用现配。
表1 标准溶液含量
Table1 The concentrations of reference standard solutions μg/kg
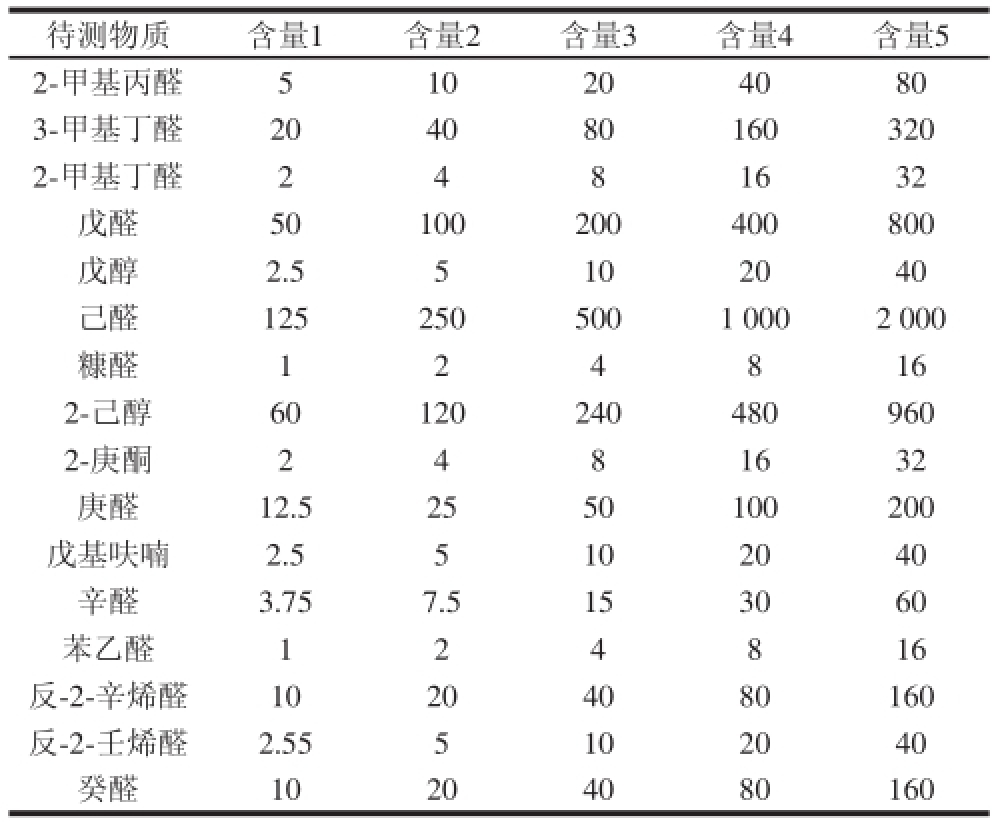
待测物质含量1含量2含量3含量4含量5 2-甲基丙醛510204080 3-甲基丁醛204 080160320 2-甲基丁醛2481632戊醛50100200400800戊醇2.55102040己醛1252505001 0002 000糠醛124816 2-己醇60120240480960 2-庚酮2481632庚醛12.52550100200戊基呋喃2.55102040辛醛3.757.5153060苯乙醛124816反-2-辛烯醛10204080160反-2-壬烯醛2.555102040癸醛10204080160
1.3.3 HS-SPME条件
在20 mL顶空瓶内准确称取0.4 g大米粉,加入10 μL酒精,旋紧顶空瓶盖。SPME借助于Gerstel的MPS多功能进样器完成,自动进样器将样品瓶移动到保温箱内,插入萃取头,使其在400 r/min条件下振荡萃取。萃取完成后,纤维头移入GC进样口在250 ℃条件下解吸2 min。
1.3.4 GC-MS条件
GC条件:DB-5MS毛细管柱(60 m×0.32 mm,0.25 μm);载气为高纯氦气,采用恒流模式;流速1 mL/min;不分流进样。柱子起始温度45 ℃,保持2 min后以2 ℃/min的速率升温至200 ℃,再以30 ℃/min升温至250 ℃。
MS条件:电子电离源;电子能量70 eV;离子源温度230 ℃;四极杆温度180 ℃。定性时采用全扫描模式,扫描范围m/z 40~500;定量时采用选择离子监测模式,每个化合物选择选择1 个定量离子,2~3 个定性离子。
1.4 统计分析
实验均为5 次重复,使用IBM SPSS 20.0分析软件对数据进单因素方差分析和最小显著性分析。
2 结果与分析
2.1 萃取条件优化
2.1.1 萃取头的选择
不同萃取头对不同分析物的萃取效率不同
[24],SPME萃取头的萃取效果受萃取头(膜厚、材质)、分析物的特点(挥发性、极性和分子质量)、萃取条件(萃取温度、萃取时间和纤维头插入深度)等共同影响。本研究探讨了不同萃取头、萃取温度和萃取时间对16 种化合物的萃取效果进行了系统的研究,为了简化,选取16 种分析物中2-甲基丁醛、糠醛、戊基呋喃和反-2-壬烯醛4 种形成机理和特性不同的代表性化合物作为萃取效果的衡量物质。在其他恒定条件下,比较100 μm PDMS、65 μm DVB/PDMS、50/30 μm DVB/CAR/PDMS 3 种不同涂层萃取头对萃取效果的影响,100 μm PDMS萃取头仅由聚二甲基硅氧烷复合材料涂布于石英纤维而成,65 μm PDMS/DVB萃取头是由聚二甲基硅氧烷和二乙烯基苯复合材料涂布于石英纤维而成,50/30 μm DVB/ CAR/PDMS由聚二甲基硅氧烷、二乙烯基苯和碳分子筛复合材料涂布于石英纤维而成。结果见图1。
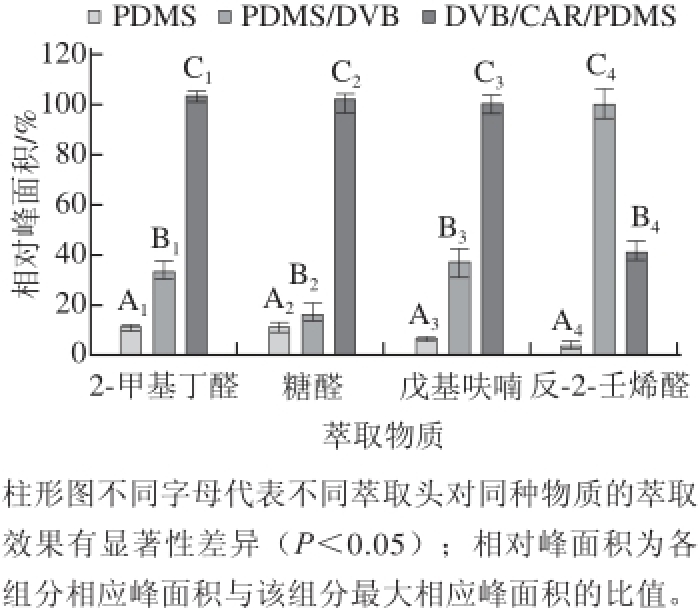
图1 不同涂层萃取头的萃取效果
Fig.1 Extraction effi ciencies of different fi ber coatings
由图1可知,对于2-甲基丁醛、糠醛、戊基呋喃50/30 μm DVB/CAR/PDMS涂层萃取头具有最高显著性差异(P<0.05),萃取效果最好;对于反-2-壬烯醛,65 μm DVB/PDMS涂层萃取头具有最高显著性差异(P<0.05),萃取效果最好。本研究的检测目标物种类较多,各物质间极性差异大,所以必须选择对所有化合物吸附效果都较理想的萃取头即50/30 μm DVB/CAR/ PDMS涂层萃取头进行样品检测。
2.1.2 萃取温度的选择
提高萃取温度有利于样品中的挥发性物质被萃取头萃取,但温度过高可能会造成某些物质发生反应或者改变物质的分配系数等进而导致吸附减少。用50/30 μm DVB/CAR/PDMS涂层萃取头对样品进行30、40、50 ℃,60 min萃取的温度优化实验,结果见图2。
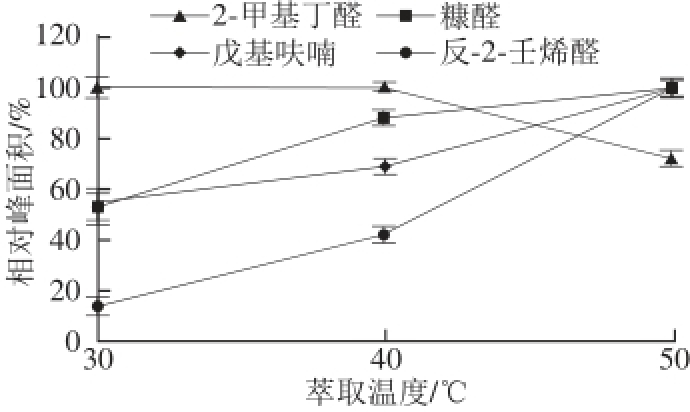
图2 温度对萃取效果的影响
Fig.2 Effect of temperature on extraction effi ciency
由图2可知,随着萃取温度的升高,反-2-壬烯醛的增幅最大,可能由于温度过高导致不饱和脂肪酸的降解
[19];糠醛、戊基呋喃的增幅次之;而2-甲基丁醛呈下降趋势,可能由于时间过长竞争性吸附产生的影响。鉴于40 ℃萃取时各种风味物质的响应值满足检测要求,为避免高温导致检测过程产生目标物质,故选用40 ℃进行以后的样品检测。
2.1.3 萃取时间的选择
萃取时间可显著影响萃取效果
[20]。在确定40 ℃为萃取温度后,用50/30 μm DVB/CAR/PDMS涂层萃取头进行了时间50、60、70 min的萃取效果比较,结果见图3。

图3 时间对萃取效果的影响
Fig.3 Effect of extraction time on extraction effi ciency
由图3可知,待测物质随萃取时间的延长呈现不同的变化规律,2-甲基丁醛随时间的延长峰面积呈先增长再保持不变趋势;糠醛随时间的延长峰面积呈先增长再下降趋势;其余物质均呈增长趋势。由于60 min萃取时间满足风味物质检测要求,故采用萃取60 min作为样品SPME的萃取条件。
因此,样品前处理条件为在20 mL顶空瓶内加入过120 目筛大米粉0.4 g,准确加入10 μL无水乙醇(与制作标准曲线保持一致),旋紧顶空瓶盖并置于盘上。自动进样器将样品瓶移动到40 ℃保温箱内,插入50/30 μm DVB/CAR/PDMS涂层萃取头,使其在400 r/min条件下振荡萃取60 min后,拔出纤维头,插进GC进样口在250 ℃条件下解吸2 min。
2.2 定性和定量
2.2.1 16 种风味物质的GC-MS定性
称取过筛大米粉0.4 g,以上述萃取条件萃取并解析进行老化指示剂的GC-MS定性分析。定性以NIST比对、标准物质保留时间等。风味物质定性采用全扫描模式,质量扫描范围为m/z 40~500,全扫描定性结果见图4,可定性物质见表2。
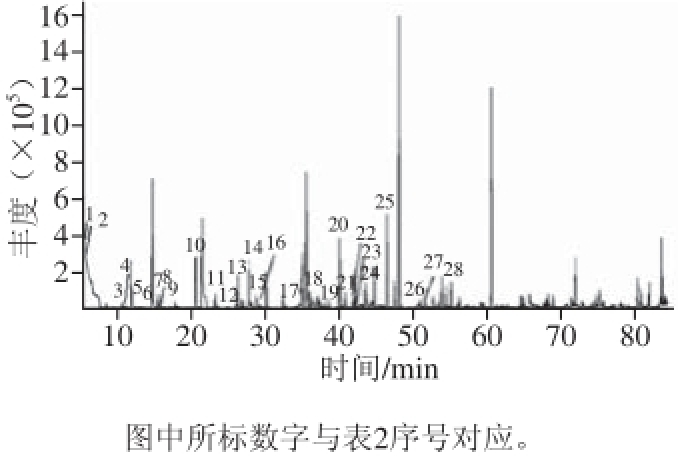
图4 风味物质指示离子扫描图
Fig.4 Selected ion-monitoring chromatogram of fl avor compounds
表2 定性物质汇总表
Table2 Summary of qualifi ed compounds
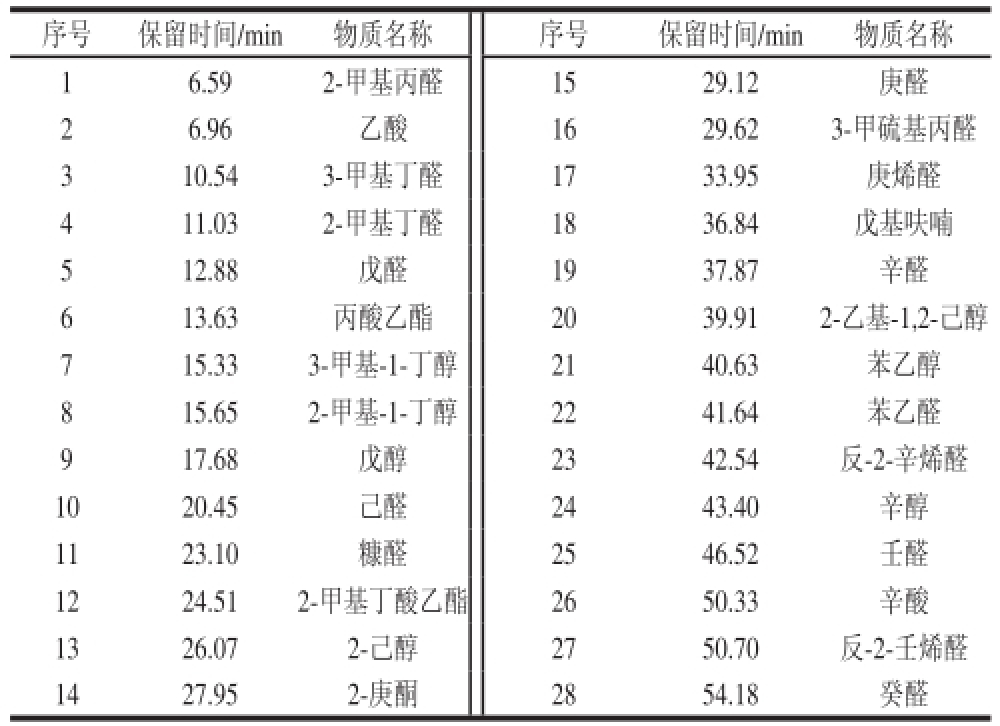
序号保留时间/min物质名称序号保留时间/min物质名称16.592-甲基丙醛1529.12庚醛26.96乙酸1629.623-甲硫基丙醛310.543-甲基丁醛1733.95庚烯醛411.032-甲基丁醛1836.84戊基呋喃512.88戊醛1937.87辛醛613.63丙酸乙酯2039.912-乙基-1,2-己醇715.333-甲基-1-丁醇2140.63苯乙醇815.652-甲基-1-丁醇2241.64苯乙醛917.68戊醇2342.54反-2-辛烯醛1020.45己醛2443.40辛醇1123.10糠醛2546.52壬醛1224.512-甲基丁酸乙酯2650.33辛酸1326.072-己醇2750.70反-2-壬烯醛1427.952-庚酮2854.18癸醛
2.2.2 16 种风味物质的GC-MS定量
16 种风味物质 的GC-MS定量结果见表3。
表316 种目标化合物的保留时间、特征离子及定量离子汇总表
Table3 Retention times, characteristic ions and quantitative ions of 16 target compounds
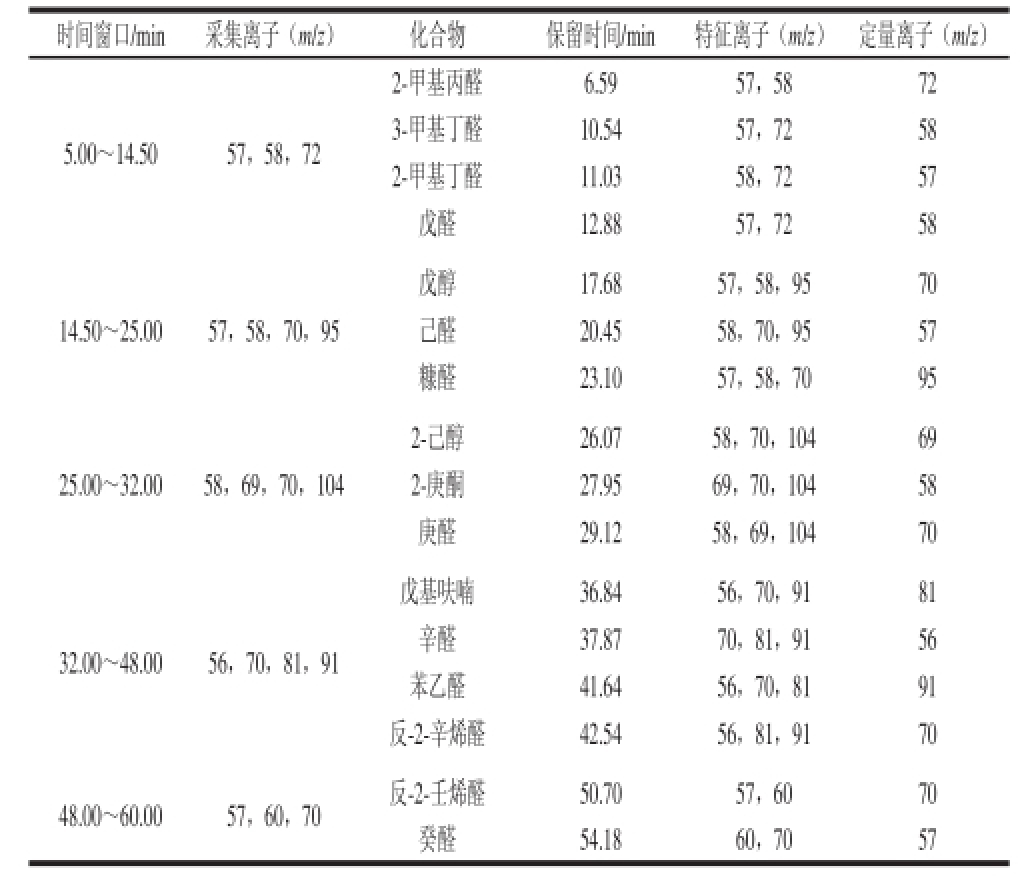
时间窗口/min采集离子(m/z)化合物保留时间/min特征离子(m/z)定量离子(m/z)5.00~14.5057,58,72 2-甲基丙醛6.5957,5872 3-甲基丁醛10.5457,7258 2-甲基丁醛11.0358,7257戊醛12.8857,7258 14.50~25.0057,58,70,95戊醇17.6857,58,9570己醛20.4558,70,9557糠醛23.1057,58,7095 25.00~32.0058,69,70,104 2-己醇26.0758,70,10469 2-庚酮27.9569,70,10458庚醛29.1258,69,10470戊基呋喃36.8456,70,9181辛醛37.8770,81,9156苯乙醛41.6456,70,8191反-2-辛烯醛42.5456,81,9170 48.00~60.0057,60,70反-2-壬烯醛50.7057,6070癸醛54.1860,7057 32.00~48.0056,70,81,91
2.2.3 方法评价
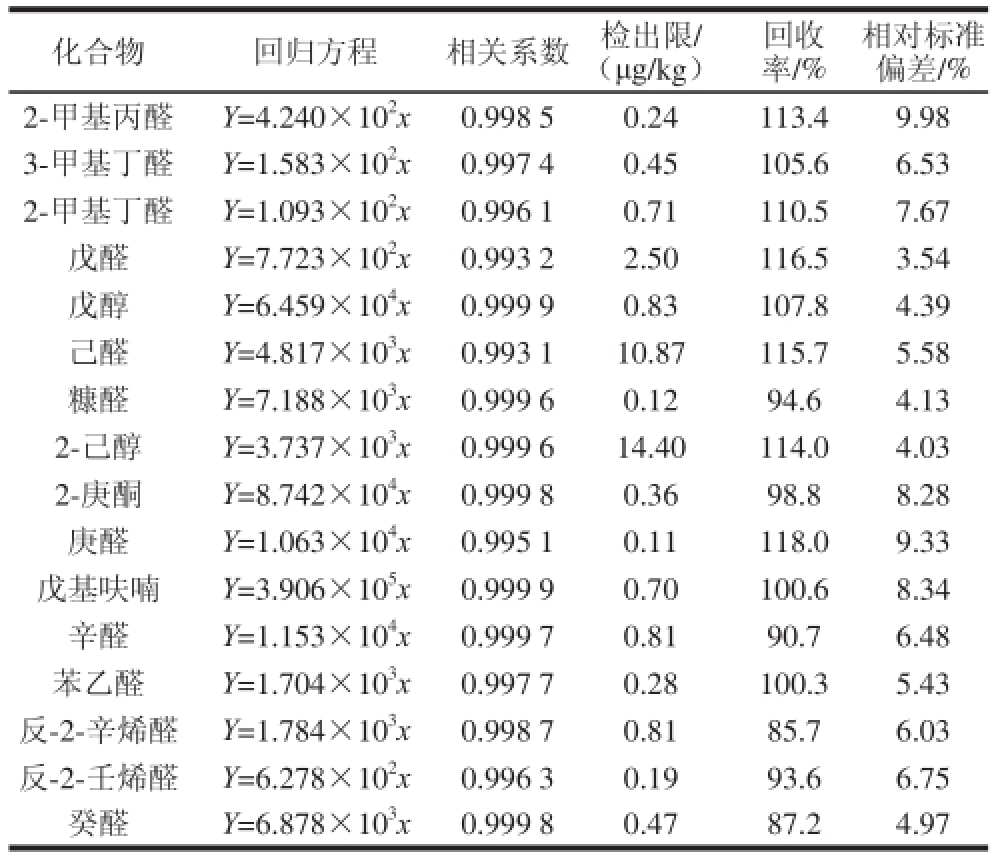
绘制标准曲线时,取10 μL不同梯度的标准溶液至过筛大米粉中。将每个梯度风味物质的峰面积分别扣除空白风味物质的峰面积为Y,加标量为x,绘制强制过原点的标准曲线。选取了某啤酒公司酿造大米样品检测6 次,取3 倍信噪比为检出限,确定方法的 精密度,结果见表4。
表4 检测方法评价指标
Table4 Figures of merit of the proposed method
相对标准偏差/% 2-甲基丙醛Y=4.240×10
2x0.998 50.24113.49.98 3-甲基丁醛Y=1.583×10
2x0.997 40.45105.66.53 2-甲基丁醛Y=1.093×10
2x0.996 10.71110.57.67戊醛Y=7.723×10
2x0.993 22.50116.53.54戊醇Y=6.459×10
4x0.999 90.83107.84.39己醛Y=4.817×10
3x0.993 110.87115.75.58糠醛Y=7.188×10
3x0.999 60.1294.64.13 2-己醇Y=3.737×10
3x0.999 614.40114.04.03 2-庚酮Y=8.742×10
4x0.999 80.3698.88.28庚醛Y=1.063×10
4x0.995 10.11118.09.33戊基呋喃Y=3.906×10
5x0.999 90.70100.68.34辛醛Y=1.153×10
4x0.999 70.8190.76.48苯乙醛Y=1.704×10
3x0.997 70.28100.35.43反-2-辛烯醛Y=1.784×10
3x0.998 70.8185.76.03反-2-壬烯醛Y=6.278×10
2x0.996 30.1993.66.75癸醛Y=6.878×10
3x0.999 80.4787.24.97化合物回归方程相关系数检出限/(μg/kg)回收率/%
本方法各种风味物质标准曲线线性良好,R
2均大于0.99,准确性高(16 种物质的加标回收率在85.7%~118.0%之间),稳定性强(相对标准偏差均低于9.98%),操作过程简便,可满足准确定量分析要求。
3 结 论
本研究采用HS-SPME-GC-MS技术,建立了一种同时检测啤酒酿造原料——大米中16 种风味物质的定量分析方法,HS-SPME最佳萃取条件为:使用50/30 μm DVB/ CAR/PDMS萃取头、40 ℃条件下萃取60 min。该方法线性、重复性及检出限均满足精确定量检测的要求。相对于其他方法,具有以条件下优点:1)该方法简单、快速、准确,可检测啤酒酿造大米中风味物质多达16 种,对啤酒品质的控制具有明显的实用性和推广意义;2)使用非衍生手段,避免衍生反应对目标检测物产生的干扰。
参考文献:
[1] 鲍欣华, 陈云彪. 浅谈大米在啤酒酿造中的使用[J]. 啤酒科技, 2002(4): 27-28.
[2] 陈善峰. 低温挤压加酶大米作啤酒辅料的试验研究[D]. 天津: 河北工业大学, 2012.
[3] 左锋, 申德超. 挤压大米啤酒辅料的糖化工艺参数对麦汁碘值的影响[J]. 中国粮油学报, 2011, 26(4): 94-98.
[4] 张传部. 提高啤酒辅料用量的工艺研究[J]. 酿酒科技, 2001(2): 53-54.
[5] VANDERHAEGEN B, NEVEN H, VERACHTERT H, et al. The chemistry of beer aging: a critical review[J]. Food Chemistry, 2006, 95(3): 357-381.
[6] JEROEN J, JESSIKA D C, PAUL S, et al. On the origin of free and bound staling aldehydes in beer[J]. Journal of Agricultural and Food Chemistry, 2012, 60(46): 11449-11472.
[7] 李颖畅, 李作伟, 吕艳芳. 啤酒风味物质的研究进展[J]. 食品与发酵科技, 2012, 48(6): 85-88.
[8] ELAINE T, CHAMPAGNE. Rice aroma and flavor: a literature review[J]. Cereal Chemistry, 2008, 85(4): 445-454.
[9] BERGMAN C J, DELGADO J T, BRYANT R, et al. Rapid gas chromatographic technique for quantifying 2-acetyl-1-pyrroline and h exanal in rice (Oryza sativa L.)[J]. Cereal Chemistry, 2000, 77: 454-458.
[10] BAMFORTH C W. Beer quality: oxidation[J]. Brew Guard, 2000, 129(4): 31-34.
[11] 赵海峰. 啤酒抗氧化力与风味稳定性的研究: 提高内源性抗氧化力及抑制反-2-壬烯醛形成的研究[D]. 无锡: 江南大学, 2008.
[12] 皮向荣, 郝俊光, 陈华磊. 啤酒中的羰基化合物来源及形成机理[J].酿酒科技, 2010(8): 68-73.
[13] FRANK J M, HELGE F, ANDREAS S. Influence of storage conditions, raw material and brewing technology on the formation of Strecker aldehydes during beer aging[C]//Proceedings of the 29
thEBC Congress. Dublin, 2003: 732-739.
[14] SVOBODA Z, MIKULIKOVA R, IVANA M Z. Optimization of modern analytical SPME and SPDE methods for determination of trans-2-nonenal in barley, malt and beer[J]. Chromatographia, 2011, 73(1): 157-161.
[15] 陈玮, 李喜宏, 郭红莲, 等. 天津大米超长期贮藏的醛系物积累与调控研究[J]. 中国粮油学报, 2007, 22(6): 139-141.
[16] JEZUSSEK M, JULIANO B O, SCHIEBERLE P. Comparison of key aroma compounds in cooked brown rice varieties based on aroma extract dilution analyses[J]. Journal of Agricultural Food Chemistry, 2002, 50: 1101-1105.
[17] RIANA W, JOHN D C, MICHAEL W. Changes in volatile components of paddy, brown and white fragrant rice during storage[J]. Journal of the Science of Food and Agriculture, 1996, 71: 218-224.
[18] ZENG Zhi, ZHANG Han, CHEN Jieyu, et al. Flavor volatiles of rice during cooking analyzed by modified headspace SPME/GC-MS[J]. Cereal Chemistry, 2008, 85: 140-145.
[19] LAM H S, PROCTOR A. Milled rice oxidation volatiles and odor development[J]. Journal of Food Science, 2003, 68: 2676-2681.
[20] KANITHA T, SITTIWAT L. Changes in volatile aroma compound s of organic fragrant rice during storage under different conditions[J]. Journal of the Science of Food and Agriculture, 2010, 90: 1590-1596.
[21] BRYANT R J, MCCLUNG A M. Volatile profiles of aromatic and non-aromatic rice cultivars using SPME/GC-MS[J]. Food Chenistry, 2011, 124: 501-513.
[22] TSUGITA T, OHTA T, KATO H. Cooking flavor and texture of rice stored under different conditions[J]. Agricultural and Biological Chemistry, 1983, 47(3): 543-549.
[23] 郝俊光, 杨理章, 樊伟, 等. 顶空衍生固相微萃取测定大米中醛类物质[J]. 食品工业科技, 2014, 35(9): 269-274.
[24] MA Jiping, XIAO Ronghui, LI Jinhua, et al. Headspace solid-phase microextraction with on-fiber derivatization for the determination of aldehydes in algae by gas chromatography-mass spectrometry[J]. Journal of Separation Science, 2011, 34(12): 1477-1483.
[25] 张玉荣, 高艳娜, 林家勇, 等. 顶空固相微萃取-气质联用分析小麦储藏过程中挥发性成分变化[J]. 分析化学, 2010, 38(7): 953-957.
Simultaneous Detection of the Contents of 16 Flavor Compounds in Rice Used for Beer Production Using HS-SPME-GC-MS
ZHANG Yuanlin
1, DONG Jianjun
2, HAO Junguang
2, YAN Peng
2, WANG Dongfeng
1,*
(1. College of Food Science and Engineering, Ocean University of China, Qingdao 266100, China; 2. State Key Laboratory of Biological Fermentation Engineering of Beer, Technical Center of Tsingtao Brewery Co. Ltd., Qingdao 266100, China)
Abstract:A gas chromatography-mass spectrometry (GC-MS) method coupled with headspace solid-phase microextraction (HS-SPME) was developed for the determination of 16 flavor compounds in rice used for beer production. Through investigation of various factors affecting the extraction and purification of flavor compounds, the optimum extraction parameters were determin ed as extraction using a 50/30 μm DVB/CAR/PDMS-coated SPME fi ber at 40 ℃ for 60 min. The fl avor compounds were quantifi ed under selected ion monitoring mo de (SIM). The recovery rates of 16 fl avor compounds were found to be in the range of 85.7%-118.0%, with relative standard deviation (RSD) less than 9.98%. The responses of 16 fl avor compounds were found to be linear in the validated ranges (R
2> 0.99). This approach proved to be easy, simple and accurate for determining 16 fl avor compounds in rice. It provided a promising method for the evaluation and quality control of beer fl avor.
Key words:headspace solid-phase microextraction (HS-SPME); gas chromatography-mass spectrometry (G C-MS); rice used for beer production; fl avor compounds
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2015)22-0075-05
doi:10.7506/spkx1002-6630-201522013
收稿日期:2015-03-14
基金项目:国家自然科学基金面上项目(31371731);国家高技术研究发展计划(863计划)项目(2013AA102109)
作者简介:张源麟(1990—),男,硕士研究生,研究方向为食品化学与营养支持。E-mail:910937019@qq.com
*通信作者:汪东风(1956—),男,教授,博士,研究方向为食品化学与营养支持。E-mail:wangdf@ouc.edu.cn







