乔立新,刘婷婷,庞广昌*
(天津商业大学生物技术与食品科学学院,天津市食品与生物技术重点实验室,天津 300134)
摘 要:用海藻酸钠-淀粉凝胶作固定剂,将猪的味蕾组织固定到两片核微孔膜中间制成“三明治”式味觉传感膜,然后将其固定到玻碳电极上制成味觉生物传感电极,通过电化学工作站测定出蔗糖八乙酸酯、苯甲地那铵和槲皮素刺激其相应受体后的响应电流,结果表明:该传感器对蔗糖八乙酸酯、苯甲地那铵和槲皮素的最低检测限分别为1×10 -14、1×10 -13mol/L和1×10 -14mol/L,在浓度分别为1×10 -8、1×10 -6mol/L和1×10 -9mol/L时其电流变化率都相应的达到最大值,说明此时它们的受体已经被饱和。蔗糖八乙酸酯在其浓度为1×10 -14~1×10 -11mol/L有较好的对数关系(R 2=0.957 3),苯甲地那铵在其浓度为1×10 -13~1×10 -7mol/L有很好的对数关系(R 2=0.987 3),而槲皮素在其浓度为1×10 -14~1×10 -9mol/L时对数关系比较好(R 2=0.996 4)。该传感器不仅可以定量化地测定味觉受体与苦味物质的作用,而且将为以后研究配体受体作用规律提供新的方法。
关键词:味觉传感器;蔗糖八乙酸酯;苯甲地那铵;槲皮素
“苦”作为五味之一,最显著的特点就是阈值极低,苦在医学上的功能被总结为苦能泄、能燥、能坚阴。而且许多苦味物质不仅可以赋予食品苦味,还有降血压、抗肿瘤、调节免疫等功能 [1]。生活中苦味也是不可或缺的,当它与其他味感调节得当时,能起到改善食品风味的作用。膳食中的苦味成分特别是植物性多酚、黄酮类化合物,都有抗氧化、降低心血管疾病和肿瘤发病率的作用,所以常常被称作“植物性营养素”,而且随着大家对苦味物质的认识,苦味食品也开始受到大家的关注 [1-2]。传统上评定苦味的方法是通过人群口感实验,虽然有一定的成效,且在国内也已形成一定的规模,但是实验者的身体状况及描述准确性等因素都会影响品评结果 [3]。目前国内外最常用于测定味觉的仪器是电子舌,这些电子舌按构建方式主要分为:1)离子选择电极:它是一种对特定的离子具有选择性的指示电极,可通过电极间膜电势的大小来反映样品离子的浓度信息 [4],其优点是分析时间短、操作方便、易于实现自动检测,但是容易被某些相关的离子干扰;2)多通道类脂膜传感器:它是国外研究掩味最常用的系统,当类脂膜与苦味物质反应时,膜表面附近的离子分布改变或类脂聚合物表面的电荷密度改变,会在传感器上得到响应值,再经过放大作用后,用统计学和化学计量学进行数据分析 [5-6],由于该传感器膜的成分和电势起伏现象的影响,经常会出现长期漂移现象;3)伏安法式电子舌:这种电子舌线性范围广、灵敏度高,可用于医药、食品、环境方面的监测 [7-9];4)Astree电子舌:该电子舌可用于分析有毒样品或成分,还可用来建立校准曲线,拟合人工评分和仪器评分,测试新样品的苦度值 [10-11],但是由于便携性差、价格昂贵等缺点使得其推广受到了一定的限制。而且虽然它们都可以对不同浓度的味觉物质做出响应,但是都只能通过物理信号的变化分辨不同的味觉感受,并不能真正反映味蕾组织对味觉的感受。
现在对苦味物质传导信号的途径已经比较明确,目前证实依赖a-gustducin传导的通路有两条:一条是苦味物质刺激T2Rs/TRBs受体后,激活a-gustducin及效应酶(磷酸二酯酶)使细胞内第二信使环核甘酸的浓度降低,进而使胞膜上的钙通道被打开,胞外Ca 2+内流,细胞内钙浓度升高,细胞膜去极化,释放神经递质 [12-13]。另一条a-gustducin介导的苦味传导通路是G蛋白偶联受体激活a-gustducin-Gβ 1-Gγ 13三聚体,进而活化附着在细胞膜上的磷脂酶C,而活化的磷脂酶C会提高三磷酸肌醇水平。三磷酸肌醇是一种水溶性小分子物质,当它与内质网膜上的特异Ca 2+通道结合后,会使储存在内质网中的Ca 2+释放到胞浆中,胞内Ca 2+浓度的升高会激活Ca 2+依赖的K +和Cl -电流,进而引起细胞膜的超极化 [14-16]。第三条途径不依赖 GPCR/G蛋白机制,一些苦味化合物通过直接作用于味觉受体的离子通道而产生信号转导,比如,三乙醇胺和奎宁使K +通道关闭,从而导致味觉受体细胞极化 [17-18]。
因为在味觉感受系统中,剥离的味觉上皮黏膜组织能够很好地保持味觉感受单元-味蕾中固有的味觉受体细胞群落及其生物微环境,并能有效被味觉物质激活,所以本研究通过模拟味觉的神经传导机制,研制出以猪的味蕾组织为敏感元件,即味蕾组织固定到两片核微孔膜间制成味觉测定膜,然后与玻碳电极相连接(玻碳电极与电脑连接)的味觉生物传感器,当味觉物质与味蕾组织接触后,会引起味觉细胞超极化产生生物电流,然后通过电化学工作站可以检测到 [19]。该传感器不仅能够真实地反映出猪味蕾感受味觉物质的过程,而且还可以模拟味觉神经信号传导作用,所以更准确地模拟味觉形成的整个过程。味觉细胞传感器的特异性辨识响应不仅可以使人体避免有毒有害物质的毒害作用,还可以解决感官品评过程中品评人员的味觉疲劳,因此,味觉细胞传感器特别适用于单一味觉化学成分的绿色、实时和快速检测。
1.1 材料与试剂
可溶性淀粉 天津市赢达稀贵化学试剂厂;海藻酸钠 天津市光复精细化工研究所;戊二醛 天津博迪化工股份有限公司;核微孔膜 英国Whatman公司;CaCl 2、CollagenaseⅡ、DispaseⅡ、蔗糖八乙酸酯、苯甲地那铵、槲皮素 美国Sigma公司;所有试剂均为分析纯;水为超纯水。
1.2 仪器与设备
分析天平 上海精密科学仪器有限公司;Millipore Milli-Q纯水 上海雅荣生化设备仪器有限公司;KQ 3200B型超声波清洗器 昆山市超声仪器有限公司;LRH-70生化培养箱 上海一恒科技有限公司;CHI600E电化学工作站、三电极系统(玻碳电极(GCE Φ=3 mm)、参比电极-Ag/AgCl电极、对电极-铂丝电极) 上海辰华仪器有限公司。
1.3 方法
1.3.1 味蕾组织的剥离
将用于分离猪舌上皮的混合酶液(CollagenaseⅡ(1 mg/mL)、DispaseⅡ(3 mg/mL))放入37 ℃培养箱中预热15 min,以便使酶的活性达到最高。然后将猪舌剪至叶状乳头边缘处,并用解剖液清洗舌头表面的血迹,用注射器取0.3~0.5 mL提前预热的混合酶液注入猪的舌上皮与肌肉层之间,将注射器的针头从舌根一直伸至舌尖部位,注射时将注射器要慢慢向后抽出,尽量保证匀速,注射完成后放入解剖液中,并在室温条件下孵育6~8 min。然后用眼科镊将舌上皮层与肌肉层轻轻剥离,并立即放入冰浴的解剖液中备用 [20]。
1.3.2 味觉组织传感器的制备
将可溶性淀粉溶解于1 g/100 mL的戊二醛溶液中,80 ℃水浴加热并搅拌30 min,配成一定质量浓度的淀粉溶液室温条件下放置过夜,使淀粉与戊二醛得到充分的交联获到醛基化淀粉胶溶液。醛基化淀粉胶溶液再与一定质量浓度的海藻酸钠溶液以1∶1混合 [21-23]。取上述溶液10 μL均匀涂抹于2 张直径为25 mm、孔径为0.22 μm的聚碳酸酯微孔膜上,将准备好的9 mm 2的味蕾上皮组织放置于一张微孔膜的圆心上,然后将另一张覆盖上制成三明治结构的味觉测定膜。
将制成的味蕾组织膜浸入5 g/100 mL的CaCl 2溶液中10 s后取出,使海藻酸钠与CaCl 2发生离子交换反应形成稳定的螯合物,使海藻酸钠溶液凝胶化成良好的固定剂 [24-26]。然后用生理盐水冲洗(去除膜上存留的Cl -、Ca 2+等)味觉测定膜。最后,用皮套将膜固定在玻碳电极头的表面使得味蕾组织与表征完的电极芯重合,则苦味生物传感器便已制成。该传感器的制作原理就是当苦味物质与其受体结合之后,会引发味觉细胞去极化和Ca 2+释放并产生动作电位,生物自身通过神经传导将电信号传到大脑的味觉中枢系统产生味觉,而苦味生物传感器则是模拟生物体通过电极将电信号传到电脑中,来显示苦味配体与受体的作用规律。
1.3.3 苦味生物传感器对苦味物质的测定方法
采用三电极系统,将固定好味觉测定膜的玻碳电极作为工作电极,Ag/AgCl电极作为参比电极,铂丝电极作为对电极,以生理盐水为测试底液,在一定的电压下通过电流-时间测定法测定不同浓度的蔗糖八乙酸酯、苯甲地那铵和槲皮素的响应电流,以响应电流的变化率作为检测指标,当测试底液的响应电流值与被测溶液的响应电流值之差接近于零时,此时的被测物质浓度为它的最低检测限,计算响应电流的变化率(ΔI)见公式(1)。
式中:I 1及I 2分别为苦味物质被测定前后(即空白和响应)同一时间点的稳态电流值。
2.1 苦味生物传感器的稳定性及重复性
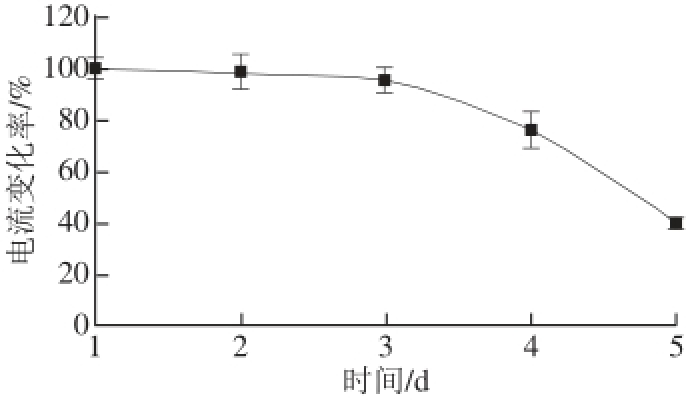
图1 稳定性检验
Fig.1 Storage stability test
将制成的味觉组织传感器在同一浓度的蔗糖八乙酸酯溶液中连续测定10次,结果相对标准偏差为 5.34%,表明该味觉组织传感器稳定性能良好,将该味觉传感器保存在4 ℃生理盐水中,每天对同一浓度的蔗糖八乙酸酯溶液进行测定,前2 d该传感器响应电流变化率基本恒定,第3天其电流变化率是初始电流变化率的95.1%,第4天其电流变化率仅为初始电流变化率的75.9%。表明该味觉组织传感器至少可稳定保存3 d,如图1所示。
取不同批次制备的电化学型组织传感器5 支,对同一浓度的蔗糖八乙酸酯溶液进行检测,电流响应结果如表1所示,响应电流的相对标准偏差为6.143%,表明该味觉组织传感器重复性能良好。
表1 传感器重复性实验结果
Table1 Repeatability of the sensors
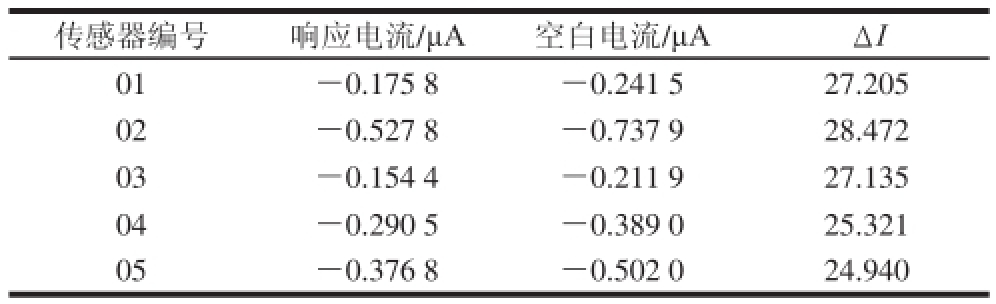
传感器编号响应电流/μA空白电流/μAΔI 01-0.175 8-0.241 527.205 02-0.527 8-0.737 928.472 03-0.154 4-0.211 927.135 04-0.290 5-0.389 025.321 05-0.376 8-0.502 024.940
2.2 电流-时间测定法的电位优化
制备好的传感器在不同电位条件下(测试底液为生理盐水)用电流-时间法进行测定,以加入10 -5mol/L的蔗糖八乙酸酯前后稳态电流差来衡量不同电位对传感器电化学响应效果的影响,结果表明在-0.38 V条件下电流的变化值最大,如图2所示,故选定-0.38 V为恒电位进行苦味生物传感器对蔗糖八乙酸酯、苯甲地那铵和槲皮素响应特性的研究。

图2 电位对该微生物传感器响应效果的影响
Fig.2 Effect of response potential on the microorganism sensors
2.3 蔗糖八乙酸酯与其受体的作用规律
用1.3.2节的方式组装电极并进行测定,因为蔗糖八乙酸酯的检测浓度范围很宽,不易作图,所以将其浓度重新定义,见公式(2)。
式中:pC a为重新定义后的蔗糖八乙酸酯浓度;C为定义前的浓度。此式表示当pC a=1时,蔗糖八乙酸酯的检测浓度最小为1×10 -14mol/L。以蔗糖八乙酸酯浓度的对数值为横坐标,其响应电流的电流变化率为纵坐标作图如图3所示,当其浓度为1×10 -8mol/L时电流变化率达到最大值,说明此时受体已经被配体饱和,当浓度再增大时电流变化率明显下降,说明味觉组织受到反馈抑制。在蔗糖八乙酸酯浓度为10 -14~10 -11mol/L的范围内,对其进行对数曲线拟合,如图4所示,y=15.209 lnx+28.472,R 2=0.957 3,证明其在此范围内有较好的对数关系。
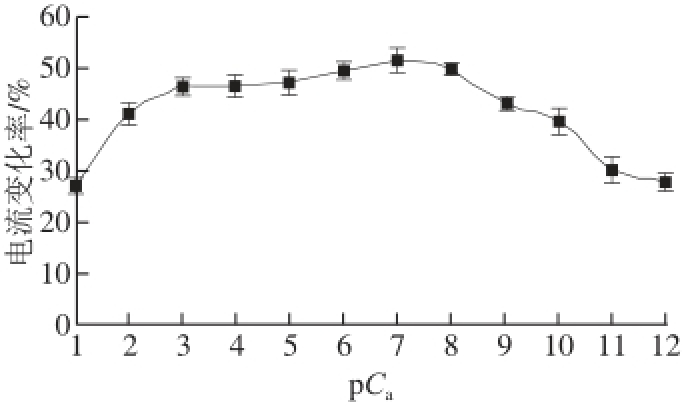
图3 对蔗糖八乙酸酯的检测范围
Fig.3 The detection range of sucrose octaacetate
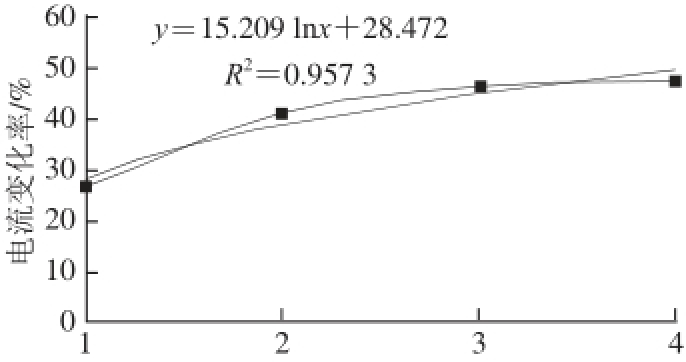
图4 蔗糖八乙酸酯在浓度为1×1100
-1144~11×1100
-1111mol/L的对数关系
Fig.4 Logarithmic relationship between sucrose octaacetate and its receptor in the range of 1 × 10
-14-1 × 10
-11mol/L
2.4 苯甲地那铵与其受体的作用规律
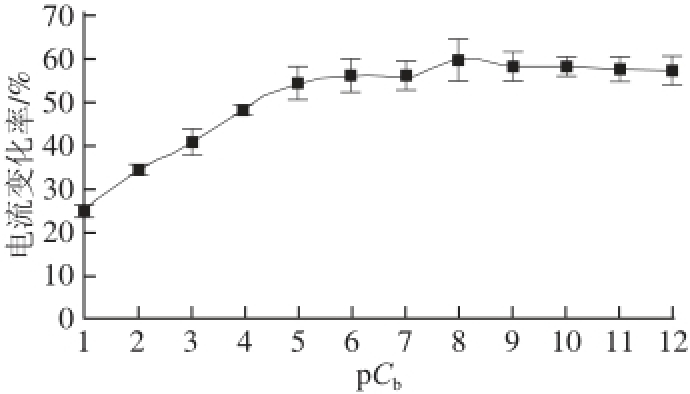
图5 对苯甲地那铵的检测范围
Fig.5 The detection range of denatonium

图6 苯甲地那铵在浓度为1×1100
-1133~11×1100
-77mol/L的对数关系
Fig. 6 Logarithmic relationship between denatonium and its receptor in the range of 1 × 10
-13-1 × 10
-7mol/L
依照1.3.2节的方法组装电极并进行测定,同样将苯甲地那铵的浓度重新定义。令
式中:pC b为重新定义后的苯甲地那铵浓度;C为定义前的浓度。此式表示当pC b=1时,苯甲地那铵的浓度为1×10 -13mol/L。以苯甲地那铵为横坐标,其响应电流的电流变化率为纵坐标作图,由图5可知,在其浓度为1×10 -6mol/L时电流变化率达到最大值,说明此时其受体已经被饱和。在10 -13~10 -7mol/L的浓度范围内对其进行对数曲线性拟合如图6所示,y=22.988 lnx+10.702,R 2=0.987 3,说明在此范围内有较好的对数关系。
2.5 槲皮素与其受体的作用规律
依照1.3.2节的方法组装电极并进行测定,同样将槲皮素的浓度重新定义,见公式(4)。
式中:pC c为重新定义后的槲皮素浓度;C为定义前的浓度。此式表示当pC c=1时,槲皮素的检测浓度最小为1×10 -14mol/L。以槲皮素为横坐标,它的响应电流的电流变化率为纵坐标作图,由图7可知,在1×10 -9mol/L浓度时槲皮素的电流变化率达到最大值,说明此时槲皮素的受体已经被饱和。在10 -14~10 -9mol/L的浓度范围内对其进行对数曲线性拟合如图8所示,y=25.296 lnx+25.37,R 2=0.996 4,说明在此范围内呈现良好的对数关系。

图7 对槲皮素的检测范围
Fig.7 The detection range of quercetin

图8 槲皮素在浓度为1×1100
-1144~11×1100
-99mol/L的对数关系
Fig.8 Logarithmic relationship between quercetin and its receptor in the range of 1 × 10
-14-1 × 10
-9mol/L
通过固定化猪味蕾组织制备的苦味生物传感器定量化测定了味觉受体与蔗糖八乙酸酯、苯甲地那铵和槲皮素的作用规律,其检测限分别为1×10 -14、1×10 -13mol/L和1×10 -14mol/L,说明猪对蔗糖八乙酸酯和槲皮素更敏感。
该传感器通过固定化猪味蕾组织,模拟味蕾组织的神经生理传导过程,成功地实现了蔗糖八乙酸酯、苯甲地那铵和槲皮素的定量化测定以及分辨出了猪对这些苦味物质的味觉感受,探讨了它们与其受体的相互作用规律,为味觉传感器的研究与开发,特别是为受体与配体(配基)的作用规律研究提供了一条新的思路。但是,味蕾组织的固定化是否对受体和配体(配基)相互作用有影响,味蕾组织经过固定化以后的信号传导过程是否仍能真实反映神经生理过程尚需进一步的深入研究。
苦味常常作为抗营养的成分在营养普遍过剩的今天,可以有效防止现代代谢综合症的发生和发展,所以对于苦味物质的定量化测定可能在药物及食品的功能性成分筛选与研究,以及其与GPCRs受体的互作规律等方面具有广阔的应用前景;另外,该研究在猪饲料的配方,特别是适口性研究方面也具有一定的参考意义。
参考文献:
[1] 刘晶晶. 苦味机理及苦味物质的研究概况[J]. 食品科技, 2006, 31(8): 21-23.
[2] 郝晓霞. 苦味物质研究概况[J]. 黄冈师范学院学报, 2008, 28(增刊1): 90-92.
[3] 唐慧敏, 任麒, 沈慧凤. 苦味评价方法的国内外研究进展[J]. 2009, 18(2): 127-131.
[4] NORIAK I F, IKUM I U, TAKASH I O, et al. Masking mechanism of bitter taste of drugs studied with ion selective electrodes[J]. Chemical and Pharmaceutical Bulletin, 2006, 54(8): 1155-1161.
[5] KIYOSH I T. Taste sensor with global selectivity[J]. Materials Science and Engineering: reports, 1996, 4(2): 69-82.
[6] SOU T, KIYOSH I T, KOICH I W, et al. Quantifi cation of suppression of bitterness using an electronic tongue[J]. Journal of Pharmaceutical Sciences, 2001, 90(12): 2042-2048.
[7] PATRIK I, CHRISTINA K, FREDRI K W, et al. Avoltammetric electronic tongue[J]. Chemical Senses, 2005, 30(1): 1258-1259.
[8] WINQUIST F, HOLMIN S, KRANTA-RULCHER C, et al. Ahybrid electronic tongue[J]. Analytica Chimica Acta, 2000, 406(2): 147-157.
[9] WINQUIS T F, WIDE P, LUNDSTROM I. Combination of an electronic tongue and an electronic nose[J]. Sensors and Actuators B: Chemical , 1999, 58(1/2/3): 512-517.
[10] KAYUMBA P C, HUYGHEBAERT N, CORDELLA C, et al. Quinine sulphate pellets for flexible pediatric drug dosing: Formulation development and evaluation of taste-masking efficiency using the electronic tongue[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2007, 66(3): 460-465.
[11] JACK Y Z, MELISSA P K, Taste masking analysis in pharmaceutical formulation development using an electronic tongue[J]. International Journal of Pharmaceutics, 2006, 310(1/2): 118-124.
[12] LINDEMANN B. Receptors and transduction in taste[J]. Nature, 2001, 413: 219-225.
[13] GILBERTSON T A, DAMAK S, MARGOLSKEE R F. The molecular physiology of taste transduction[J]. Current Opinion in Neurobiology, 2000, 10(4): 519-527.
[14] 李芹, 孟杨. 味导素在味觉转导中的作用[J]. 国外医学: 口腔医学分册, 2006, 33(1): 53-55.
[15] MARGOLSKEE R F. Molecular mechanisms of bitter and sweet taste transduction[J]. The Journal of Biological Chemistry, 2002, 277(1): 1-4.
[16] SPIELMAN A L. Gustducin and its role in taste[J]. Journal of Dental Research, 1998, 77(4): 539-544.
[17] PEREZ C A, HUANG L, RONG M, et al. A transient receptor Potential channel expressed in taste receptor cells[J]. Nature Neuroscience, 2002, 5(11): 1169-1176.
[18] ZHANG Y, HOON M A, CHANDRASHEKAR J, et al. Coding of sweet, bitter, and umami tastes: different receptor cells sharing similar signaling pathways[J]. Cell, 2003, 112(3): 293-301.
[19] QIAO Lixin, JIAO Lihua, PANG Guangchang, et al. A novel pungency biosensor prepared with fixing taste-bud tissue of rats[J]. Biosensors and Bioelectronics, 2015, 68: 454-461.
[20] 秦玉梅, 张根华, 石锦芹, 等. 小鼠味蕾细胞分离及体外培养方法[J].细胞生物学杂志, 2009, 31(1): 119-122.
[21] GOMBOTZ W R, WEE S F. Protein release from alginate matrices[J]. Advanced Drug Delivery Rcviews, 1998, 31: 267-285.
[22] ZACTITI E M, KIECKBUSCH T G. Release of potassium sorbate from active films of sodium alginate crosslinked with calcium chloride[J]. Packaging Technology and Science, 2009, 22(6): 349-358.
[23] REISS M, HEIBGES A, METZGER J, et al. Determination of BOD-values of starch-containing waste water by a BOD-biosensor[J]. Biosensors and Bioelectronics, 1998, 13: 1083-1090.
[24] BIERHALZ A C K, da SILVA M A, BRAGA M E M, et al. Effect of calcium and/or barium crosslinking on the physical and antimicrobial properties of natamycin-loaded alginate fi lms[J]. LWT-Food Science and Technology, 2014, 57: 494-501.
[25] RHIM J W. Physical and mechanical properties of water resistant sodium alginate fi lms[J]. Lebensmittel-Wissenschaft und-Technologie-Food Science and Technology, 2004, 37: 323-330.
[26] 曾庆祝, 许庆陵. 褐藻酸钠涂膜剂的特性研究[J]. 大连水产学院学报, 1996, 11(1): 65-69.
Immobilizing Taste-Bud Tissues of Pigs to Prepare Bitterness Biosensor
QΙAO Lixin, LΙU Tingting, PANG Guangchang*
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300314, China)
Abstract:Using sodium alginate-starch gel as a fixing agent, taste-bud tissues of pigs were fixed between two nuclear microporous membranes to make a sandwich-type sensing membrane, which was then fi xed to a glassy carbon electrode to make a biosensor electrode. By using electrochemical workstation, the current produced when sucrose octaacetate, denatonium and quercetin stimulated their corresponding receptors were tested. The results showed that the lowest limit of detection of this biosensor for sucrose octaacetate, denatonium and quercetin were 1 × 10 -14, 1 × 10 -13and 1 × 10 -14mol/L and the maximum rate of change of the current was found at concentration levels of 1 × 10 -8, 1 × 10 -6and 1 × 10 -9mol/L, respectively, indicating that their receptors are saturated. It was demonstrated that the interaction curves of sucrose octaacetate, denatonium and quercetin with their respective receptors exhibited high correlation (R 2= 0.957 3, 0.987 3 and 0.996 4) in the concentration ranges of 1 × 10 -14-1 × 10 -11mol/L, 1 × 10 -13-1 × 10 -7mol/L and 1 × 10 -14-1 × 10 -9mol/L, respectively. This study not only quantitatively determined the interaction of the taste receptor and bitter substances with a new biosensor, but also provided a simple approach for monitoring bitter substances and investigating the mechanism of ligand-receptor interaction.
Key words:taste biosensor; sucrose octaacetate; denatonium; quercetin
中图分类号:TS202.3
文献标志码:A
文章编号:1002-6630(2015)22-0090-05
doi:10.7506/spkx1002-6630-201522016
收稿日期:2015-05-18
基金项目:国家自然科学基金面上项目(31371773)
作者简介:乔立新(1990—),男,硕士研究生,研究方向为发酵工程。E-mail:1151665754@qq.com
*通信作者:庞广昌(1956—),男,教授,博士,研究方向为食品生物技术。E-mail:pgc@tjcu.edu.cn