刘玲玲,申明月,聂少平*,贾寒冰,蒋玉洁,刘 倩,王玉婷,谢明勇
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
摘 要:研究动态监测中式菜肴红烧肉烹饪过程中丙烯酰胺含量的变化情况。样品经水提取、液液萃取脱脂和固相萃取柱净化处理后,采用高效液相色谱-串联四极杆质谱方法,以内标法定量,在多重反应监测模式测定目标化合物。方法的线性范围为10~1 000 ng/mL,线性相关系数为0.999 9。方法的定性检出限和定量限分别为0.1 μg/kg和1 μg/kg,回收率为91.4%~105.8%,相对标准偏差小于8%。采用该方法测得红烧肉在烹饪过程中丙烯酰胺含量呈倒V形走势,在加入糖、酱油等调味料后丙烯酰胺的平均含量达到顶点值42.4 μg/kg。
关键词:红烧肉;动态监测;丙烯酰胺;高效液相色谱-串联四极杆质谱
丙烯酰胺是一种白色晶体化学物质,是生产聚丙烯酰胺的原料,主要用在造纸、燃料、塑料和水处理等一些工业中 [1-2]。2002年瑞典研究人员首次在食品中发现丙烯酰胺,在炸薯条中丙烯酰胺可高达1 000 μg/kg [3-4]。经大鼠、兔等动物急性毒性实验表明,丙烯酰胺经口半数致死量(median lethal dose,LD 50)为150~180 mg/kg,属中等毒性物质,可经皮肤、呼吸道和消化道吸收,其中消化道吸收最快,在体内各组织广泛分布,包括母乳,因此存在母婴间传递的可能 [5-8]。丙烯酰胺被人体吸收后大约90%被代谢,仅少量以原型的形式排出体外 [9]。丙烯酰胺在人体细胞色素氧化酶的作用下,生成环氧丙烯酰胺,其更容易与DNA上的鸟嘌呤结合形成加合物,导致遗传物质损伤和基因突变 [10-13]。1994年国际癌症研究机构对丙烯酰胺的致癌性进行了评价,将其列为人类可能致癌物 [14]。虽然目前还没有充足的流行病学证据证明饮食摄入丙烯酰胺与人类某种肿瘤的发生有明显的相关性 [15],但是鉴于动物慢性神经中毒无作用剂量为500 μg/(kg·d),最小有作用剂量为2 000 μg/(kg·d),因此目前认为饮食接触水平不会对人造成神经损伤,但对远期致癌的可能性比较值得忧虑 [9]。2002年欧洲的研究人员在《Nature》首次发表了丙烯酰胺产生机理的文章,证明了热加工食品中丙烯酰胺的产生主要源自于美拉德反应 [16-17]。丙烯酰胺在食品中生成的其他途径有:某些氨基酸的热降解反应;油脂分解形成;加热肉中的肌肽水解产生的β-丙氨酸进一步与氨基酸的氨基反应会导致其发生Strecker降解,从而产生丙烯酰胺 [17-18]。丙烯酰胺潜在的致癌性神经毒性和遗传毒性,引起了全球研究人员的注意 [19-22]。
我国人民喜食热食,中式传统菜肴都需要经过高温处理,讲究色香味形俱全,因此在烹饪过程中会加入各种调味品。食材和调味品在高温条件下处理,成为丙烯酰胺生成的基础。2013年7月,香港发布了首份关于香港食品中丙烯酰胺含量的总膳食研究报告 [23]。但是目前我国内地对中式菜肴中丙烯酰胺含量检测的研究比较匮乏。中式菜肴中红烧肉是一道比较具有代表性的菜肴,需将五花肉在水焯、油煎后加入配料长时间炖煮制成。糖和酱油一般是红烧肉烹制过程中必不可少的配料,这就为丙烯酰胺的生成提供了基础。因此本研究选择中式红烧肉为研究对象,根据中式传统菜肴的烹饪方法,将制作过程分为水焯、油煎、加料和炖煮4 个阶段,采用高效液相色谱-串联四极杆质谱(high performance liquid chormatography-tandem quadrupole mass spectrometry,HPLC-MS-MS)进行检测,旨在研究红烧肉烹饪过程中丙烯酰胺生成含量的变化。
1.1 材料与试剂
精选五花肉(现购现用)、大葱、生姜、康力源牌加碘食用盐、厨大妈牌绵白糖、黄中皇牌花雕酒、淘大牌老抽 市购。
丙烯酰胺标准品(GC,纯度≥99.8%)、甲酸(色谱级,纯度≥98%)、甲醇(质谱级,纯度≥99.9%)美国阿拉丁公司; 13C 3-丙烯酰胺标准品(LC-MS,纯度≥99.9%) 英国剑桥同位素实验室;蒸馏水 屈臣氏公司;Hydro-RP 80 A HPLC柱(2 mm×250 mm,4 μm)美国Phenomenex公司;OasisHLB SPE柱(3 cm 3、 60 mg;6 cm 3、200 mg) 美国Waters公司;Bond Elut-Accucat SPE柱(3 mL、200 mg) 美国Varian公司;其他化学试剂均为分析纯。
1.2 仪器与设备
1290/6460 A高效液相色谱-三重四极杆串联质谱仪美国Agilent公司;电磁炉 九阳股份有限公司;高速离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 样品制备
自制红烧肉:将洗净沥干的五花肉块切成约4 cm×3 cm×3 cm的小块,将切块五花肉新鲜肉块留样1 份。参考纪有华等 [24]的红烧肉烹饪工艺研究中的最佳配比:五花肉1 000 g、盐6 g、葱20 g、姜20 g、色拉油100 g、老抽王40 g、黄酒100 g、白砂糖40 g。
红烧肉制作工艺根据中式传统家庭烹饪方法,将切好的肉块称质量后冷水下锅(电磁炉温度设为150 ℃)水焯10 min(测得水温为(75±2) ℃,肉中心温度为(60±1) ℃)捞出,用温水洗净后沥干、称质量。将锅底温度调为180 ℃,放油,油温低时(测得油温为(135±5) ℃)煸炒葱姜1 min,放五花肉,翻炒20 min(测得油温为(180±1) ℃,肉中心温度为(90±1) ℃)肉块成金黄色后沥出油脂,留样1 份。在剩余部分加老抽、糖以及黄酒继续翻炒5 min上色、出香,留样1 份。加水没过剩余部分肉块,加盖烧至汤汁沸腾,加热方式调为锅底温度120 ℃,炖煮60 min后,加热方式调为锅底温度200 ℃大火收干汤汁,留样1 份。肉样室温冷却后用绞肉机绞碎均匀,-20 ℃冷藏用于丙烯酰胺含量的检测。
1.3.2 检测方法 [25]
1.3.2.1 标准溶液的配制
准确称取0.010 g丙烯酰胺标准品,用甲醇定容于10 mL棕色容量瓶中,制成质量浓度为1 mg/mL的丙烯酰胺-甲醇储备液。从丙烯酰胺储备液中取1 mL,用甲醇定容于10 mL棕色容量瓶中,制成质量浓度为0.1 mg/mL的丙烯酰胺-甲醇中间液。 13C 3-丙烯酰胺标准品溶液用甲醇配制成质量浓度为10 μg/mL的内标储备液。3 种储备液均存放于-20 ℃条件下冷藏备用。从丙烯酰胺中间液中取1 mL,用体积分数0.1%甲酸溶液定容至10 mL,制成质量浓度为0.01 mg/mL的丙烯酰胺工作液A。从工作液A中取1 mL,用体积分数0.1%甲酸溶液定容至10 mL,制成质量浓度为0.001 mg/mL的丙烯酰胺工作液B。2 种工作液现用现配。
1.3.2.2 标准曲线工作溶液
配制标准系列溶液,丙烯酰胺的质量浓度分别为10、50、100、500、1 000 ng/mL,内标质量浓度为100 ng/mL。依次测定不同质量浓度丙烯酰胺及其内标的峰面积,以丙烯酰胺和 13C 3-丙烯酰胺的质量浓度比为横坐标,以丙烯酰胺(m/z 55)和 13C 3-丙烯酰胺(m/z 58)的峰面积比为纵坐标,绘制标准曲线,计算丙烯酰胺含量。
1.3.2.3 色谱条件
H P L C条件:H y d r o-R P 8 0 A H P L C柱(2 mm×250 mm,4 μm);流动相:甲醇-0.1%甲酸溶液(0.5∶99.5,V/V);流速0.2 mL/min;柱温26 ℃;进样量10 μL。
MS条件:仪器模式:正离子模式;电喷雾离子源;干燥气温度350 ℃;干燥气流速7 L/min;喷雾器压力45 psi;鞘气温度400 ℃;鞘气流速11 L/min;喷嘴电压500 V;毛细管电压3 000 V;MS1四极杆温度100 ℃;MS2四极杆温度100 ℃;扫描时间300(0.3 s/次);裂解电压20 V;扫描方式:多重反应离子监测模式。
1.3.2.4 样品处理和净化
提取:准确称取0.5 g搅拌好的样品于10 mL离心管中,加入5 μL的同位素内标 13C 3-丙烯酰胺标准溶液(10 μg/mL),加入2 mL体积分数0.1%甲酸溶液提取样品中的丙烯酰胺以及4 mL氯仿-甲醇(2∶1,V/V)溶液进行脱脂处理,振摇提取30 min后,于5 000 r/min离心10 min,取上清液,重复此步骤1 次,合并上清液。
净化:依次用3.5 mL甲醇和3.5 mL超纯水活化平衡HLB柱,弃去活化液。将提取上清液全部上样,弃除流出液。然后用0.5 mL超纯水淋洗,弃除淋洗液。最后用1.5 mL超纯水洗脱,收集全部洗脱液。
依次用2.5 mL甲醇和2.5 mL超纯水活化平衡Bond Elut-Accucat柱,弃去活化液。将HLB的净化液全部上样,收集流出液。
取1 mL上述Bond Elut-Accucat 柱净化液过0.45 μm水系滤膜于2 mL棕色进样瓶中,-4 ℃保存待进样分析。
1.3.3 计算
按照下式计算试样中丙烯酰胺含量。
式中:X为样品中丙烯酰胺含量/(μg/kg);A为待测物色谱峰与内标物色谱峰的峰面积比值对应的丙烯酰胺质量/ng;m 1为试样中 13C 3-丙烯酰胺内标质量/ng;m 2为标准溶液中 13C 3-丙烯酰胺内标质量/ng;m 0为样品的质量/g。最后结果保留3 位有效数字。
2.1 MS条件的优化
丙烯酰胺相对分子质量比较小,仅为71.09,在测定的过程中受到其他物质的干扰的可能性比较大,为确保检测结果的准确性,采用多重反应离子监测模式进行检测。[M+H] +=72是丙烯酰胺的离子前体,[H 2C-HC-C-O] += 55是其产物离子;[M+H] +=75是内标 13C 3-丙烯酰胺的离子前体,[ 13C 3H 3O] +=58是其产物离子。为了得到最大的母离子响应应选择最佳的碎裂电压,为了得到每个子离子响应应选择最佳的碰撞能。在MS2 SCAN模式下优化碎裂电压,二者的碎裂电压值设定在20 V时丙烯酰胺及内标的峰形及响应比较好。在子离子模式下优化碰撞能,碰撞能在7~9 V之间时,m/z 55和m/z 58碎片离子的强度比较大,因此选择这2 个离子作为定量检测离子。碰撞电压大于10 V时,m/z 44、27和m/z 29、45的离子强度有所增加,但m/z 55和m/z 58的离子强度减弱,因此定量离子的碰撞能分别选择9 V和7 V为宜(图1)。确定丙烯酰胺定量离子为m/z 72、55,定性离子为m/z 72、27;内标定量离子为m/z 75、58,定性离子为m/z 75、29。

图1 碰撞能为9 V时丙烯酰胺(a)及碰撞能为7 V时
1133C
3--丙烯酰胺内标物(b)质谱图
Fig.1 Mass spectra of acrylamide (a) and
13C
3- acrylamide as internal standard (b) at the collision energy of 9 and 7 V
MS的参数如离子源温度、干燥气流速、鞘气温度、鞘气流速以及喷嘴电压等对检测均有一定的影响。鞘气温度、流速和喷嘴电压对化合物响应有较大的影响,优化后确定鞘气温度为400 ℃,鞘气流速为11 L/min,喷嘴电压为300 V。丙烯酰胺为小分子化合物,因此毛细管电压设为3 000 V。最后优化确定雾化器压力小于300 V,干燥器温度为350 ℃,干燥气流速为7 L/min。图2为丙烯酰胺的标准样品和 13C 3-丙烯酰胺内标物的HPLC-MS-MS色谱图。

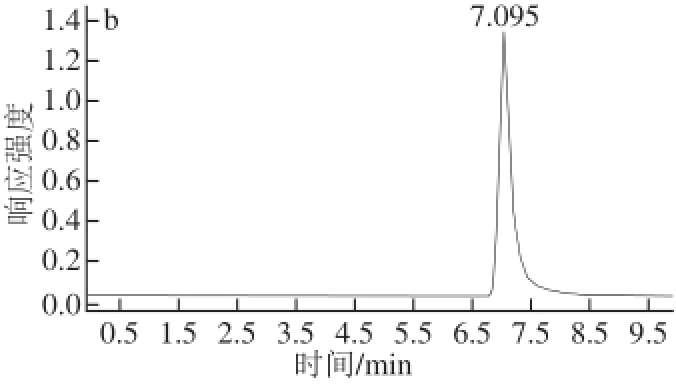
图2 丙烯酰胺(a)和
133C
3-丙烯酰胺内标物(b)的LC-MS--MMSS谱 图
Fig.2 LC-MS-MS spectra of acrylamide (a) and
13C
3-acrylamide (b)
2.2 提取方法和固相萃取(solid phase extraction,SPE)柱的确定
实验样品为红烧肉,食品基质相对比较复杂,本研究欲建立一种适用于此类样品的比较简单的前处理方法。丙烯酰胺极易溶于水,实验过程中比较了用纯水、体积分数0.1%甲酸溶液以及2 mol/L NaCl溶液分别作为提取溶剂的提取方式。结果表明,2 mol/L NaCl溶液的提取液若直接过SPE柱结果不理想,而且萃取及氮吹过程比较繁琐,且方法的回收率以及重复性不高,而纯水、体积分数0.1%甲酸溶液的提取液直接过SPE柱可以达到比较好的净化和富集效果,由于丙烯酰胺在酸性条件下更加稳定,因而体积分数0.1%甲酸溶液更适合作为提取剂。另外红烧肉中脂肪的含量比较高,因而需要选择出合适的脱脂溶剂。Folch等 [26]的方法比较适用于肉类脂肪的提取,即采用氯仿和甲醇以2∶1的配比进行提取,氯仿可将所有脂类溶于其中。经实验表明用这种方法能够较好的除去脂肪,同时后续操作比较简单、方便,且丙烯酰胺的提取率也较高。为了提取充分,提取时要充分振荡,并采用高速离心的方式。
样品经提取后还需要配合使用SPE小柱进行净化、富集,常用的萃取柱为高分子聚合物填料,其保留机制为反相,如Oasis HLB SPE柱。本研究比较了Oasis HLB(3 cm 3、60 mg和6 cm 3、200 mg)SPE柱,Varian Bond Elut-Accucat SPE柱(3 mL、200 mg),MCX(6 cm 3、 200 mg)。结果表明Oasis HLB(3 cm 3、60 mg)小规格柱填料量少,丙烯酰胺难以全部保留而易被洗脱,很难提高预处理的回收率;MCX(6 cm 3、200 mg)为阳离子交换柱,也不适合用于丙烯酰胺的富集纯化。采用Oasis HLB SPE(6 cm 3、200 mg)和Varian Bond Elut-Accucat 柱结合使用可以达到比较好的效果。
2.3 方法评价
2.3.1 线性关系与最低检测限
丙烯酰胺在10~1 000 ng/mL之间,峰面积比和质量浓度呈良好的线性关系,回归方程为Y=1.012 681x+0.029 021,线性相关系数为R 2=0.999 9。以3 倍信噪比计算得出丙烯酰胺的检出限(定性检出限)为0.1 μg/kg,以10 倍信噪比计算得出丙烯酰胺的定量限为1 μg/kg。
2.3.2 精密度与回收率
回收率可以反映待测物质在样品前处理过程中的损失程度,回收率越高说明损失越少,其方法的准确度也就越高,分别按照低、中、高的加标水平向样品中加入丙烯酰胺标准品,计算平均回收率(表1)。结果表明,丙烯酰胺的回收率在91.4%~105.8%之间,相对标准偏差(relative standard deviation,RSD)小于8%。
表1 HPLC-MS-MS方法检测红烧肉中丙烯酰胺的加标回收率(n=5)
Table1 Spiked recovery of acrylamide in braise in soy sauce meat by HPLC-MS-MS method (n=5)
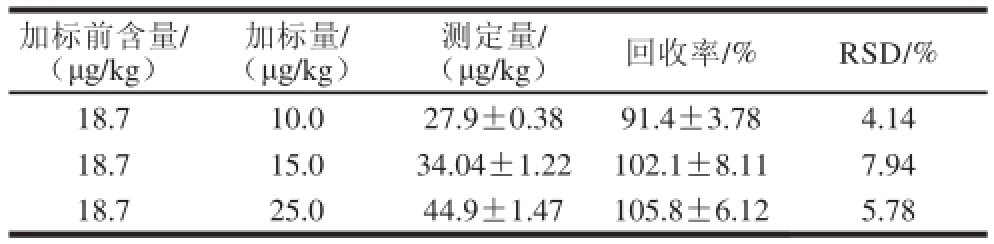
加标前含量/(μg/kg)加标量/(μg/kg)测定量/(μg/kg)回收率/%RSD/% 18.710.027.9±0.3891.4±3.784.14 18.715.034.04±1.22102.1±8.117.94 18.725.044.9±1.47105.8±6.125.78
2.4 实际样品的测定
应用上述方法对五花肉在未处理前与制作成红烧肉的过程中丙烯酰胺生成量的变化进行检测分析,所测样品色谱图见图3,每个阶段的样品取5 份,取平均值,测得红烧肉在烹饪过程中丙烯酰胺含量的变化情况见图4。
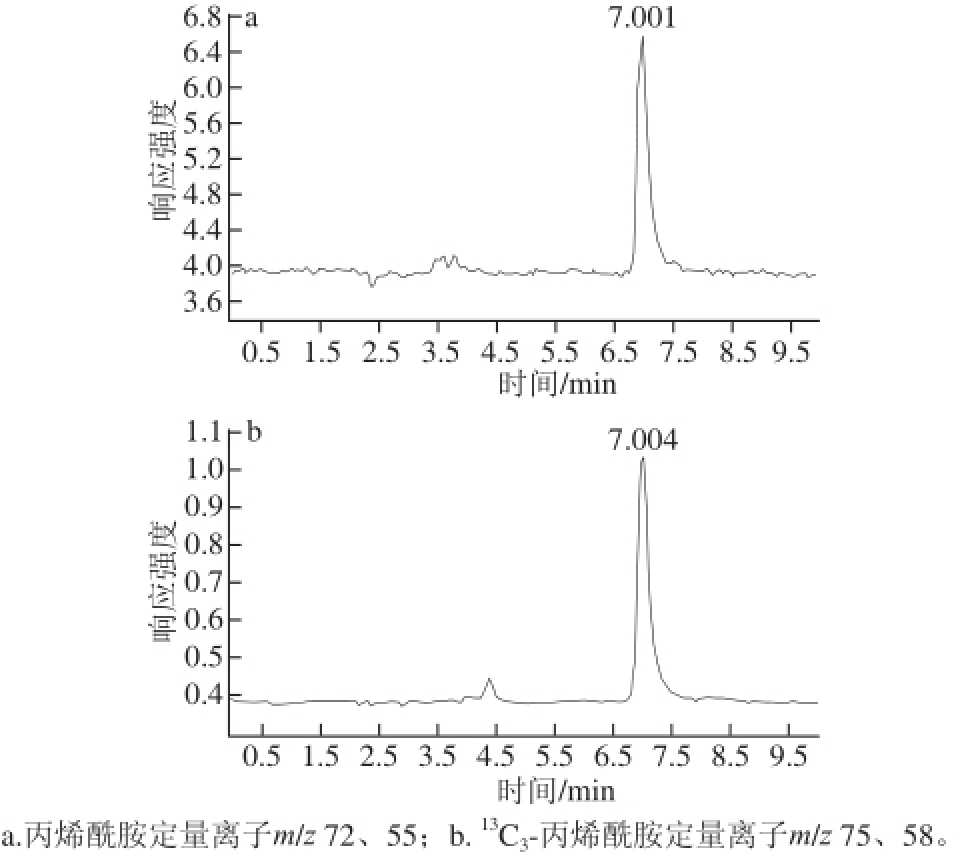
图3 检测样品色谱图
Fig.3 Chromatogra m of food samples
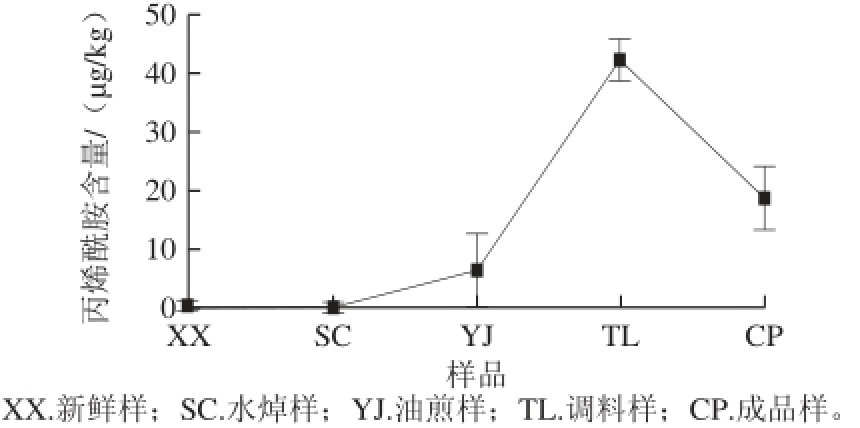
图4 红烧肉烹饪过程中丙烯酰胺含量的变化(n=5)=5
Fig.4 Change in acrylamide content in braise in soy sauce meat during the cooking process (n = 5)
由图4可知,在原料肉和水焯肉中未检测到丙烯酰胺,这个结果与丙烯酰胺的生成需要高温处理相吻合;在油煎处理时,温度达到了丙烯酰胺生成的温度,检测到丙烯酰胺的平均含量为6.45 μg/kg;在加入糖、酱油和黄酒这些调味料之后肉中丙烯酰胺的平均含量为42.4 μg/kg,可能是因为在烹饪过程中加入了丙烯酰胺生成的前体物质糖和氨基酸的原因,所以在高温处理后丙烯酰胺的含量迅速升高;在长时间炖煮之后肉中的丙烯酰胺的平均含量为18.7 μg/kg,比加入调味料处理时含量降低,可能与炖肉时的水分含量等有关。上述结果表明,本研究采取的红烧肉烹饪方法制作的红烧肉中丙烯酰胺的生成量最高为42.4 μg/kg,这个含量大大低于炸薯条类食品。Shaw等 [27]计算了消费者经常食用可能产生丙烯酰胺最多的食品,其中每日平均食用的丙烯酰胺的剂量在0.3 μg/kg体质量,这一数量是无作用剂量所规定0.l mg/kg体质量 [28]的3‰,因此即使消费者每天食用薯条、薯片等食品,致癌的危险也是很低的 [27],鉴于此日常食用红烧肉的危害也是可以忽略不计的。
本实验采用SPE-HPLC-MS-MS的方法测定红烧肉烹饪过程中丙烯酰胺含量的变化。该方法通过2 mL体积分数0.1%甲酸溶液提取,经氯仿-甲醇(2∶1,V/V)溶液脱去样品中的脂肪后,采用SPE柱进行净化、富集,可较好的除去干扰杂质,大大提高样品的净化程度。该方法的线性范围为10~1 000 ng/mL,线性相关系数为0.999 9。方法的定性检出限和定量限分别为0.1 μg/kg和1 μg/kg,加标回收率为91.4%~105.8%,RSD小于8%。本实验测得红烧肉制作过程中丙烯酰胺的含量呈倒V形走势,在加入糖、酱油等调味料后丙烯酰胺的含量达到顶点值42.4 μg/kg,这个含量不足以对人体造成危害,所以日常适量食用红烧肉不必过于担心。
参考文献:
[1] BLANK I. Current status of acrylamide research in food: measurement, safety assessment, and formation[J]. Annals of the New York Academy of Sciences, 2005, 1043(1): 30-40.
[2] PEDRESCHI F, MARIOTTI M S, GRANBY K. Current issues in dietary acrylamide: formation, mitigation and risk assessment[J]. Journal of the Science of Food and Agriculture, 2014, 94(1): 9-20.
[3] AHN J S, CASTLE L, CLARKE D B, et al. Verification of the findings of acrylamide in heated foods[J]. Food Additives and Contaminants, 2002, 19(12): 1116-1124.
[4] TAREKE E, RYDBERG P, KARLSSON P, et al. Analysis of acrylamide, a carcinogen formed in heated foodstuffs[J]. Journal of Agricultural and Food Chemistry, 2002, 50(17): 4998-5006.
[5] 于素芳, 谢克勤. 丙烯酰胺的神经毒性研究概况[J]. 毒理学杂志, 2005, 19(3): 242-244.
[6] 张志荣. 丙烯酰胺的生物标志物研究概况[J]. 毒理学杂志, 2011, 25(2): 149-152.
[7] 马红莲. 丙烯酰胺遗传毒性研究进展[J]. 山西医科大学学报, 2007, 38(8): 754-756.
[8] SORGEL F, WEISSENBACHER R, KINZIG-SCHIPPERS M, et al. Acrylamide: increased concentrations in homemade food and fi rst evidence of its variable absorption from food, variable metabolism and placental and breast milk transfer in humans[J]. Chemotherapy, 2002, 48(6): 267-274.
[9] 丁茂柏. 科学评估丙烯酰胺危害[J]. 中国职业医学, 2007, 34(1): 61-64.
[10] MELANIEL B, HERMANNM B, HANS D, et al. Excretion of mercapturic acids of acrylamide and glycidamide in human urine after single oral administration of deuterium-labelled acrylamide[J]. Archives of Toxicology, 2006, 80(2): 55-61.
[11] CALLEMAN C J, BERGMARK E, COSTA L G. Acrylamide is metabolized to glycidamide in the rat: evidence from hemoglobin adduct formation[J]. Chemical Research in Toxicology, 1990, 5(3): 406-412.
[12] PAULSSON B, GRANATH F, GRAWE J, et al. The multiplicative model for cancer risk assessment: applicability to acrylamide[J]. Carcinogenesis, 2001, 22(5): 817-819.
[13] MEIKE R, TAMARA B, GERHARD E. Monitoring urinary mercapturic acids as biomarkers of human dietary exposure to acrylamide in combination with acrylamide uptake assessment based on duplicate diets[J/OL]. Archives of Toxicology, 2015. http://link. springer.com/article/10.1007/s00204-015-1494-9.
[14] International Agency for Research on Cancer. IARC monographs on the evaluation of carcinogenic risks to humans[M]. International Agency for Research on Cancer, 1994: 389-433.
[15] XU Yi, CUI Bo, RAN Ran, et al. Risk assessment, f ormation, and mitigation of dietary acrylamide: current status and future prospects[J]. Food and Chemical Toxicology, 2014, 69: 1-12.
[16] STADLER R H, BLANK I, VARGA N, et al. Food chemistry: ac rylamide from Maillard reaction products[J]. Nature, 2002, 419: 449-450.
[17] MOTTRAM D S, WEDZICHA B L, DODSON A T. Food chemistry: acrylamide is formed in the Maillar d reaction[J]. Nature, 2002, 419: 448-449.
[18] YAYLAYAN V A, WNOROWSKI A, PEREZ L C. Why asparagine needs carbohydrates to generate acrylamide[J]. Journal of Agricultural and Food Chemistry, 2003, 51(6): 1753-1757.
[19] TARDIFF R G, GARGAS M L, KIRMAN C R, et al. Estimation of safe dietary intake levels of acrylamide for humans[J]. Food and Chemical Toxicology, 2010, 48(2): 658-667.
[20] RICHARD M, LOPACHIN. Acrylamide neurotoxicity: neurological, morhological and molec ular endpoints in animal models[J]. Chemistry and Safety of Acrylamide in Food, 2005, 561: 21-37.
[21] JANNEKE G F, HOGERVORST J G, BAARS B J, et al. The carcinogenicity of dietary acrylam ide intake: a comparative discussion of epidemiological and experimental animal research[J]. Critical Reviews in Toxicology, 2010, 40(6): 485-512.
[22] DYBING E, RENWICK A G, SANNER T, et al. Risk assessment of dietary exposures to compounds that are genotoxic and carcinog enican overview[J]. Toxicol Letters, 2008, 180(2): 110-117.
[23] WONG W W K, CHUNG S W C, LAM C, et al. Dietary exposure of Hong Kong adults to acrylamide: results of the fi rst Hong Kong total diet study[J]. Food Additives and Contaminants: Part A, 2014, 31(5): 799-805.
[24] 纪有华, 路新国. 红烧肉烹饪工艺及其影响因素研究[J]. 扬州大学烹饪学报, 2010, 27(2): 31-36.
[25] US Food and Drug Administration. Detection and quantitation of acrylamide in foods[EB/OL]. http://www.fda.gov/food/ foodborneillnesscontaminants/chemicalcontaminants/ucm053537.htm.
[26] FOLCH J, LEES M, SLOANE-STANLEY G H. A simple method for the isolation and purification of total lipides from animal tissues[J]. The Journal of Biological Chemistry, 1957, 226(1): 497-509.
[27] SHAW I, THOMSON B. Acrylamide food risk[J]. The Lancet, 2003, 361: 434.
[28] ANDERSON D. IPCS international programme on chemical safety environmental health criteria 46[J]. British Journal of Industrial Medicine, 1986, 43(9): 647.
Dynamic Monitoring of the Changes in Acrylamide Content in Chinese Braised Pork in Brown Sauce during Cooking
LIU Lingling, SHEN Mingyue, NIE Shaoping*, JIA Hanbing, JIANG Yujie, LIU Qian, WANG Yuting, XIE Mingyong
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
Abstract:The dynamic changes in acrylamide content in Chinese braised pork in brown sauce during cooking were monitored. The sample was extracted with water, defatted by liquid-liquid extraction, and cleaned-up by solid phase extraction column. The target compounds were determined by high performance liquid chormatography-tandem quadrupole mass spectrometry (HPLC-MS-MS) with multiple reaction monitoring mode (MRM), and quantifi ed by an internal standard method. The linear range was 10-1 000 ng/mL with a linear correlation coeffi cient of 0.999 9. The limit of detection (LOD) and limit of quantification (LOQ) were 0.1 and 1 μg/kg, respectively. The recoveries were 91.4%-105.8% with relative standard deviation (RSD) of less than 8%. The acrylamide levels in Chinese braised pork in brown sauce were found to follow an inverted V-shaped trend. The average content of acrylamide reached its peak (42.4 μg/kg) after addition of sugar, soy sauce and other seasonings.
Key words:braised pork in brown sauce; dynamic monitoring; acrylamide; high performance liquid chromatographytandem quadrupole mass spectrometry
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2015)22-0147-05
doi:10.7506/spkx1002-6630-201522027
收稿日期:2015-05-28
基金项目:“十二五”国家科技支撑计划项目(2014BAD04B03);国家重点基础研究发展计划(973计划)项目(2012CB720805);教育部“新世纪优秀人才支持计划”项目(NCET-12-0749)
作者简介:刘玲玲(1991—),女,硕士研究生,研究方向为食品质量安全。E-mail:ncs19920310@163.com
*通信作者:聂少平(1978—),男,教授,博士,研究方向为食品化学与分析、食品营养与安全、食品复杂碳水化合物。E-mail:spnie@ncu.edu.cn