高效液相色谱光化学在线衍生荧光法检测鸡肉中16 种磺胺类药物残留
许 旭
1,2,耿丹丹
1,2,迟晓峰
1,董 琦
1,胡风祖
1,*,肖远灿
1,*
(1.中国科学院西北高原生物研究所,青海 西宁 810008;2.中国科学院大学生命科学院,北京 100049)
摘 要:采用高效液相色谱-光化学柱后在线衍生-荧光检测法检测鸡肉中16 种磺胺类药物残留量。鸡肉样品经过乙腈提取并脱脂净化,色谱柱分离,光化学在线衍生并直接用荧光检测器检测。流动相为0.3%的冰乙酸和甲醇溶液梯度洗脱,流速0.7 mL/min、柱温36 ℃,激发波长320 nm、发射波长450 nm,16 种磺胺类药物得到良好分离。16 种磺胺药物在0.13~67.89 μg/mL质量度范围内,线性良好(R≥0.994 0),回收率在61.2%~106.6%之间,相对标准偏差为0.3%~13.9%,检出限为1.0~67.4 μg/kg。该方法灵敏、准确、快速,可满足鸡肉中磺胺类残留的检测。
关键词:鸡肉;磺胺类药物;光化学在线衍生;高效液相色谱-荧光检测
磺胺类药物是具有对氨基苯磺酰胺结构的一类人工抗菌药的总称
[1],因其在动物养殖以及人类细菌性疾病的预防和治疗中广泛应用
[2-3],可能导致磺胺类药物会在人体累积,对人体健康形成潜在危险
[4-6]。美国、欧盟等大多数国家规定动物源性食品中磺胺类药物的最大残留量为100 μg/kg
[7-8],我国规定动物源性食品中磺胺类药物的最大残留量为50~100 μg/kg
[9]。
磺胺类药物的检测方法主要有微生物法
[10-11]、分光光度法
[11-12]、分子印记分析法
[12]、免疫分析法
[13]、毛细管电泳法
[14-15]、高效液相色谱法
[16-18]及其联用技术
[19-21]等。磺胺类药物本身不发荧光,但其含有光化学活性基团,能发生光化学反应,产生荧光物质,从而可用荧光检测器直接检测
[22]。光化学在线衍生不需要额外的衍生试剂,同时弥补了紫外法灵敏度低及质谱法仪器昂贵的不足,更加绿色、环保、快捷、灵敏。目前,关于高效液相色谱-光化学在线衍生-荧光检测法在检测鸡肉中磺胺类残留的应用尚未见报道,本研究采用光化学衍生技术,建立了准确、灵敏、简便的鸡肉中磺胺类残留的检测方法。
1 材料与方法
1.1 材料与试剂
磺胺醋酰(纯度≥99.5%)、磺胺噻唑(纯度≥99.5%)、磺胺吡啶(纯度≥99.0%)、磺胺甲基嘧啶(纯度≥99.2%)、磺胺二甲恶唑(纯度≥98.0%)、磺胺二甲嘧啶(纯度≥99.0%)、磺胺甲氧哒嗪(纯度≥98.7%)、磺胺氯哒嗪(纯度≥99.0%)、磺胺甲恶唑(纯度≥99.0%)、磺胺间甲氧嘧啶钠(纯度≥98.5%)、磺胺二甲异恶唑(纯度≥98.7%)、磺胺苯吡唑(纯度≥99.0%)、磺胺氯吡嗪(纯度≥99.0%)、磺胺间二甲氧嘧啶(纯度≥99.0%)、磺胺喹恶啉(纯度≥98.0%)、磺胺硝苯(纯度≥99.0%) 德国Dr. Ehrenstorfer GmbH公司;实验用水超纯水;甲醇、乙腈为色谱纯,其余试剂为分析纯。
1.2 仪器与设备
525高效液相色谱仪(配2475荧光检测器) 美国Waters公司;光化学柱后衍生反应器(紫外灯8 W、反应管15 m) 新加坡Pribolab公司;IKAT25高速匀浆机、RV-10旋转蒸发仪 德国IKA公司;离心机 上海安亭科学仪器厂;XK80-A快速混匀器 江苏新康医疗器械有限公司;AG135型精密电子天平 瑞士Mettler Toledo公司;优普UPE-II-40L型超纯水机 成都优普超纯科技有限公司。
1.3 方法
1.3.1 标准溶液配制
分别称取磺胺醋酰6.03 mg、磺胺噻唑6.00 mg、磺胺吡啶6.14 mg、磺胺甲基嘧啶6.13 mg、磺胺二甲恶唑6.05 mg、磺胺二甲嘧啶6.00 mg、磺胺甲氧哒嗪6.07 mg、磺胺氯哒嗪6.04 mg、磺胺甲恶唑6.07 mg、磺胺间甲氧嘧啶钠6.01 mg、磺胺二甲异恶唑6.11 mg、磺胺苯吡唑6.05 mg、磺胺氯吡嗪6.07 mg、磺胺间二甲氧嘧啶6.03 mg、磺胺喹恶啉6.08 mg、磺胺硝苯6.04 mg于10 mL容量瓶中,用甲醇定容,配制成磺胺醋酰603 μg/mL、磺胺噻唑600 μg/mL、磺胺吡啶614 μg/mL、磺胺甲基嘧啶613 μg/mL、磺胺二甲恶唑605 μg/mL、磺胺二甲嘧啶600 μg/mL、磺胺甲氧哒嗪607 μg/mL、磺胺氯哒嗪604 μg/mL、磺胺甲恶唑607 μg/mL、磺胺间甲氧嘧啶钠601 μg/mL、磺胺二甲异恶唑611 μg/mL、磺胺苯吡唑605 μg/mL、磺胺氯吡嗪607 μg/mL、磺胺间二甲氧嘧啶603 μg/mL、磺胺喹恶啉608 μg/mL、磺胺硝苯604 μg/mL的标准溶液。分别吸取上述标准溶液各100 mL配成标准混合液,用时用甲醇稀释成一系列质量浓度的标准溶液。
1.3.2 色谱条件
色谱柱:Platisil ODS(4.6 mm×250 mm, 5 μm);流动相:0.3%冰乙酸(A)-甲醇(B);梯度洗脱(0~32 min,8%~40% B;32~39 min,40%~50% B;39~41 min,50%~60% B;41~48 min,60%~60% B;48~55 min,60%~8% B);流速0.7 mL/min;柱温36 ℃;进样量10 μL;荧光检测器:激发波长320 nm,发射波长450 nm。
1.3.3 样品前处理
称取5.0 g(精确至0.01 g)鸡肉,置于50 mL离心管中,加入5 g无水硫酸钠和20 mL乙腈,匀质2 min,以4 000 r/min离心5 min,上清液倒入100 mL烧瓶中,残渣再加入20 mL乙腈,重复上述操作一次。合并提取液,加入10 mL异丙醇,用旋转蒸发器于50 ℃水浴蒸干,准确加入1 mL甲醇和1 mL正己烷溶解残渣,转移至5 mL离心管中,涡旋1 min,以3 000 r/min离心5 min,吸取上层正己烷弃去,再加入1 mL正己烷,重复上述步骤,直至下层水相变成透明液体,过0.45 μm滤膜,滤液进行高效液相色谱分析。
2 结果与分析
2.1 光化学在线衍生反应
磺胺类药物本身并不发荧光,不能用荧光检测器直接检测,通常需要与荧光试剂进行柱前或柱后反应衍生上荧光基团从而被检测
[23-26]。光化学在线衍生反应与之相比不需要额外的衍生试剂,没有引入其他杂质,显现出更好的发展前景。不同取代基的磺胺类药物对光化学反应的反应不同
[26],因此其荧光强度也不同,综合比较磺胺类药物在不同波长条件下的谱图确定激发波长为320 nm,激发波长为450 nm。
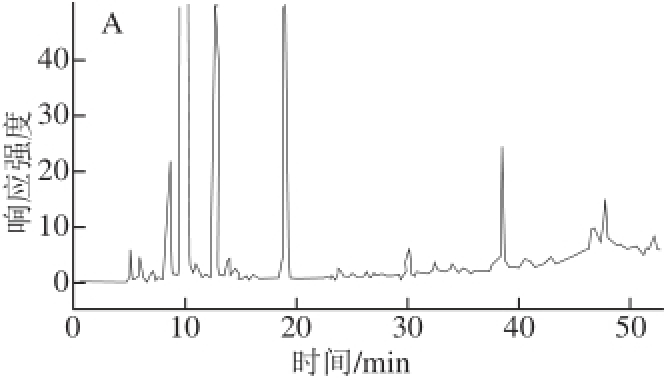
不同磺胺类药物在同一浓度时发生光化学反应后荧光强度差别较大,根据其检出限的不同将之前配好的16 种标准溶液配制成荧光强度大概相同的标准混合液,即磺胺醋酰110.28 μg/mL、磺胺噻唑51.38 μg/mL、磺胺吡啶8.20 μg/mL、磺胺甲基嘧啶9.66 μg/mL、磺胺二甲恶唑17.1 μg/mL、磺胺二甲嘧啶9.64 μg/mL、磺胺甲氧哒嗪3.68 μg/mL、磺胺氯哒嗪2.12 μg/mL、磺胺甲恶唑18.62 μg/mL、磺胺间甲氧嘧啶钠20.22 μg/mL、磺胺二甲异恶唑39.28 μg/mL、磺胺苯吡唑23.4 μg/mL、磺胺氯吡嗪2.40 μg/mL、磺胺间二甲氧嘧啶13.12 μg/mL、磺胺喹恶啉1.14 μg/mL、磺胺硝苯8.98 μg/mL,标准混合液在光化学反应前后的比较见图1,在光化学反应器未开启时,只有磺胺甲氧哒嗪有较弱的荧光响应信号;光化学反应器开启后,各种药物均有荧光信号且信号强度明显增强。
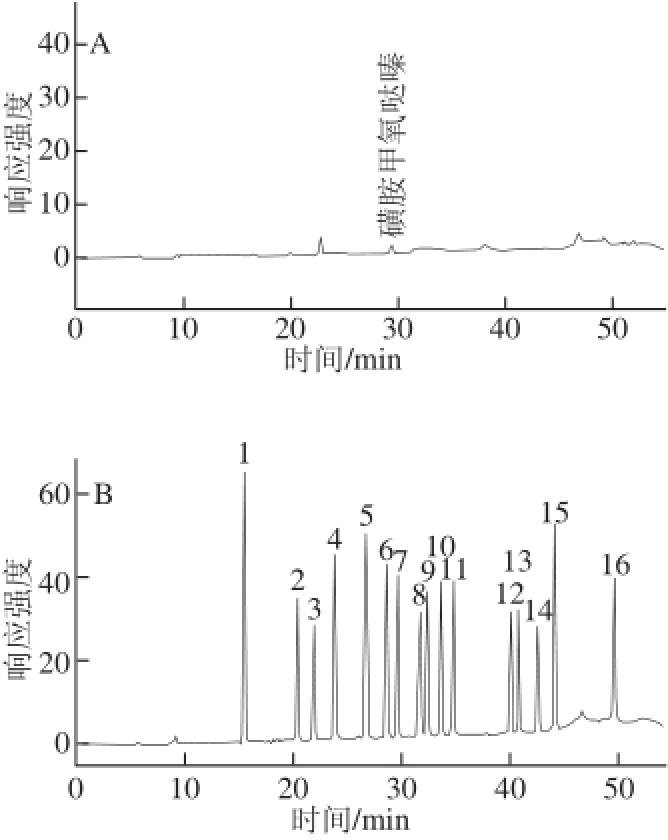
图1 光化学反应前(A)、后(B)16 种磺胺的高效液相色谱图
Fig.1 HPLC chromatograms of 16 sulfonamides before (A) and after (B) on-line photochemical derivatization
1.磺胺醋酰;2.磺胺噻唑;3.磺胺吡啶;4.磺胺甲基嘧啶;5.磺胺二甲恶唑;6.磺胺二甲嘧啶;7.磺胺甲氧哒嗪;8.磺胺氯哒嗪;9.磺胺甲恶唑;10.磺胺间甲氧嘧啶钠;11.磺胺二甲异恶唑;12.磺胺苯吡唑;13.磺胺氯吡嗪钠;14.磺胺间二甲氧嘧啶;15.磺胺喹恶啉;16.磺胺硝苯。
2.2 色谱分离条件选择
磺胺类药物含有碱基,具有弱碱性,流动相的酸碱度对分离度具有较大影响。本实验考察了水溶液和不同体积分数乙酸溶液做流动相时对16 种化合物分离效果的影响。结果表明,当水-甲醇溶液为流动相体系时,只有极少数化合物能够分开且峰形基本拖尾;流动相酸度过高时,16 种化合物不能完全分开;酸度过低时,会呈现明显的峰拖尾,展宽现象。综合考虑,选择0.3%乙酸-甲醇溶液做流动相,通过梯度洗脱可使16种化合物完全分离,且峰形尖锐对称。
2.3 精密度实验结果
将配制的混合标准溶液稀释5 倍后连续进样6 次,根据所得峰面积和保留时间分别计算精密度,16种磺胺药物峰面积的相对标准偏差(relative standard deviation,RSD)范围在1.60%~4.56%之间,保留时间的RSD在0.02%~0.55%之间,表明该方法精密度良好。
2.4 线性范围、检出限、定量限
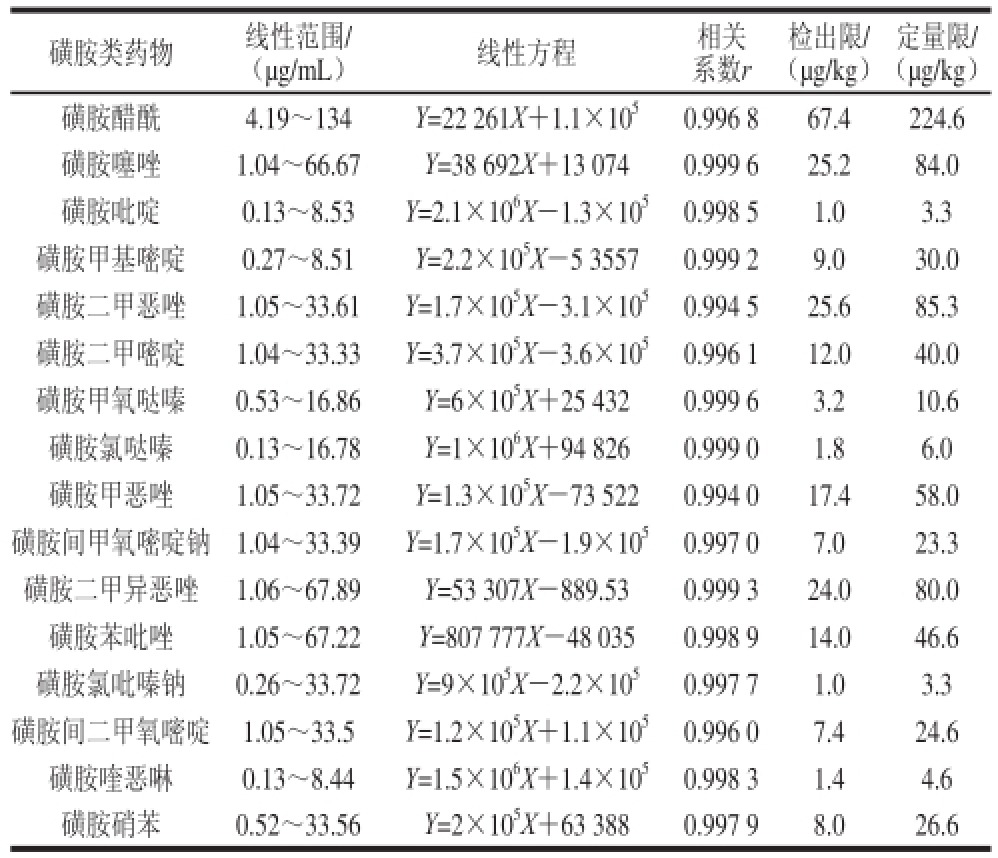
表1 16种磺胺类药物的线性范围、回归方程、相关系数和检出限
Table1 Linear ranges, regression equations,correlation coeffi cients, LOD and LOQ of 16 sulfonamides
(μg/mL)线性方程相关系数r磺胺类药物线性范围/检出限/(μg/kg)定量限/(μg/kg)磺胺醋酰4.19~134Y=22 261X+1.1×10
50.996 867.4224.6磺胺噻唑1.04~66.67Y=38 692X+13 0740.999 625.284.0磺胺吡啶0.13~8.53Y=2.1×10
6X-1.3×10
50.998 51.03.3磺胺甲基嘧啶0.27~8.51Y=2.2×10
5X-5 35570.999 29.030.0磺胺二甲恶唑1.05~33.61Y=1.7×10
5X-3.1×10
50.994 525.685.3磺胺二甲嘧啶1.04~33.33Y=3.7×10
5X-3.6×10
50.996 112.040.0磺胺甲氧哒嗪0.53~16.86Y=6×10
5X+25 4320.999 63.210.6磺胺氯哒嗪0.13~16.78Y=1×10
6X+94 8260.999 01.86.0磺胺甲恶唑1.05~33.72Y=1.3×10
5X-73 5220.994 017.458.0磺胺间甲氧嘧啶钠1.04~33.39Y=1.7×10
5X-1.9×10
50.997 07.023.3磺胺二甲异恶唑1.06~67.89Y=53 307X-889.530.999 324.080.0磺胺苯吡唑1.05~67.22Y=807 777X-48 0350.998 914.046.6磺胺氯吡嗪钠0.26~33.72Y=9×10
5X-2.2×10
50.997 71.03.3磺胺间二甲氧嘧啶1.05~33.5Y=1.2×10
5X+1.1×10
50.996 07.424.6磺胺喹恶啉0.13~8.44Y=1.5×10
6X+1.4×10
50.998 31.44.6磺胺硝苯0.52~33.56Y=2×10
5X+63 3880.997 98.026.6
准确移取不同质量浓度的磺胺标准混合溶液,在选定的最佳色谱分离条件下分离测定,对各测得值进行相关系数分析和线性回归分析,结果见表1。结果表明:16 种磺胺药物在0.13~67.89 μg/mL质量浓度范围内,线性良好(R≥0.994 0)。以3 倍信噪比(R
SN= 3)计算方法的检出限,以10 倍信噪比(R
SN= 10)计算方法的定量限,同时参照国标常用的紫外检测法按上述方法计算方法的检出限,结果发现,16 种磺胺类药物的定量限在3.3~224.6 μg/kg范围内,虽然磺胺醋酰的灵敏度不能满足磺胺类药物残留的检测要求,但是其他大部分均集中在10~60 μg/kg范围内,检出限为1.0~67.4 μg/kg,可以看出,本实验采用的方法明显的提高了方法的灵敏度。
2.5 回收率实验结果
取阴性鸡肉样品进行加标回收率实验,空白样品与加标样品见图2,其结果见表3。从表3可知,本方法中磺胺类药物在各自的添加水平0.03~4.49 μg/mL范围内,每个添加水平重复3次,其平均回收率在61.2%~106.6%之间,RSD为0.3%~13.9%。
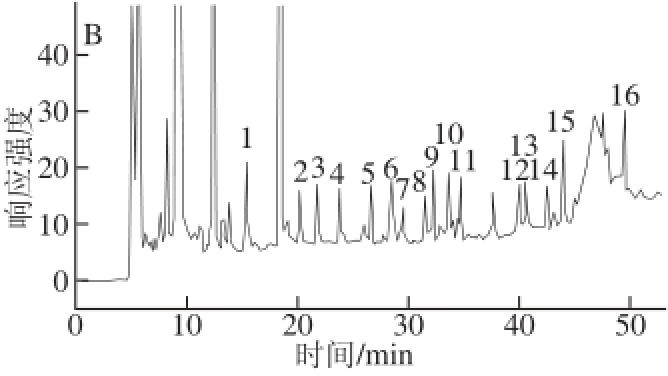
图2 空白鸡肉样品(A)和加标样品(B)高效液相色谱图
Fig.2 High performance liquid chromatograms of blank and spiked samples
1.醋酰;2.磺胺噻唑;3.磺胺吡啶;4.磺胺甲基嘧啶;5.磺胺二甲恶唑;6.磺胺二甲嘧啶;7.磺胺甲氧哒嗪;8.磺胺氯哒嗪;9.磺胺甲恶唑;10.磺胺间甲氧嘧啶钠;11.磺胺二甲异恶唑;12.磺胺苯吡唑;13.磺胺氯吡嗪钠;14.磺胺间二甲氧嘧啶;15.磺胺喹恶啉;16.磺胺硝苯。A.空白鸡肉样品;B.加标样品。
表3 肉中16 种磺胺的加标回收率结果
Table3 Recoveries for the 16 sulfonamides in chicken
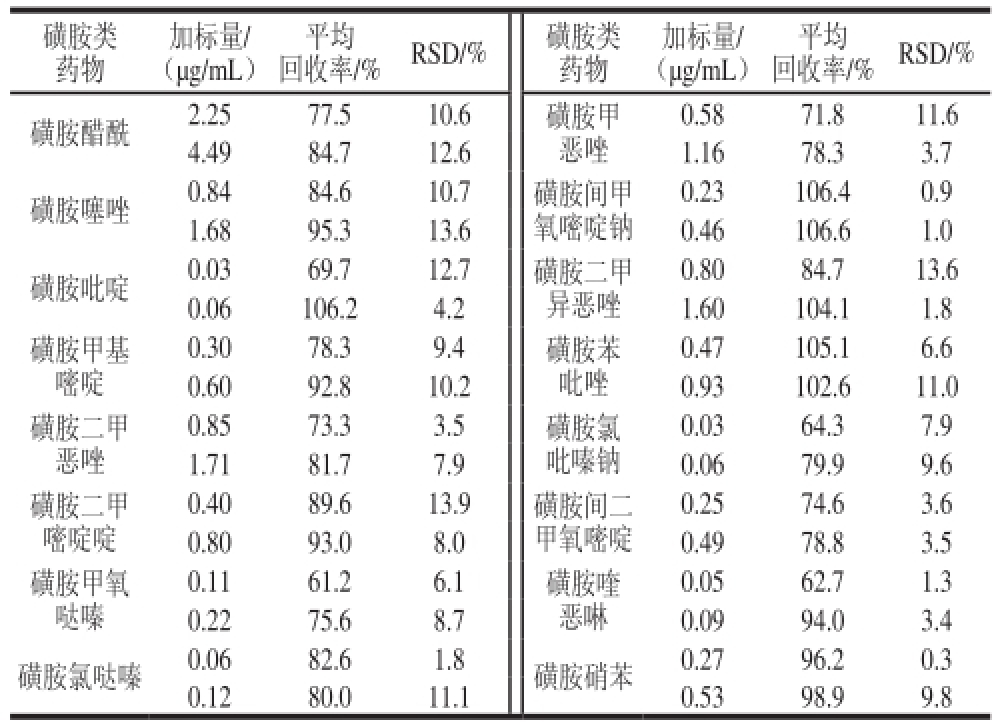
磺胺类药物加标量/(μg/mL)回收率/%RSD/%磺胺类药物平均加标量/(μg/mL)平均回收率/%RSD/%磺胺醋酰2.2577.510.6磺胺甲恶唑0.5871.811.6 4.4984.712.61.1678.33.7磺胺噻唑0.8484.610.7磺胺间甲氧嘧啶钠0.23106.40.9 1.6895.313.60.46106.61.0磺胺吡啶0.0369.712.7磺胺二甲异恶唑0.8084.713.6 0.06106.24.21.60104.11.8磺胺甲基嘧啶0.47105.16.6 0.6092.810.20.93102.611.0磺胺二甲恶唑0.3078.39.4磺胺苯吡唑0.0364.37.9 1.7181.77.90.0679.99.6磺胺二甲嘧啶啶0.8573.33.5磺胺氯吡嗪钠0.0562.71.3 0.2275.68.70.0994.03.4磺胺氯哒嗪0.0682.61.8磺胺硝苯0.2796.20.3 0.1280.011.10.5398.99.8 0.2574.63.6 0.8093.08.00.4978.83.5磺胺甲氧哒嗪0.4089.613.9磺胺间二甲氧嘧啶0.1161.26.1磺胺喹恶啉
2.6 实际样品分析
取购于本地超市的10 个鸡肉样品用本方法进行16 种磺胺类药物的残留检测。在10 个样品中均未检测到磺胺类药物残留,鸡肉样品典型色谱图见图3。
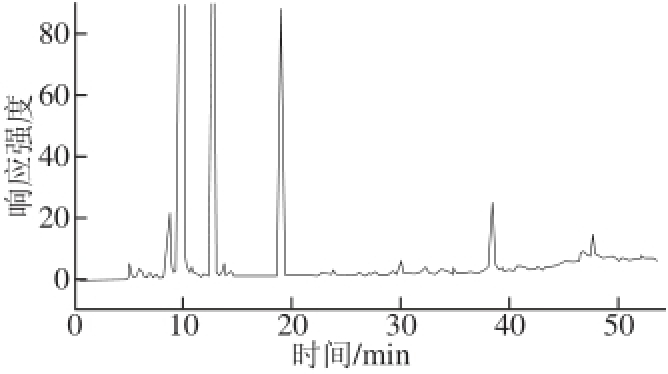
图3 鸡肉样品高效液相色谱图
Fig.3 High performance liquid chromatogram of real sample
3 结 论
本实验通过色谱条件的优化,并经过检出限、精密度、回收率等方法学的考察,建立了一种高效液相色谱-光化学在线衍生-荧光检测法测定鸡肉中16 种磺胺类药物残留的分析方法。该方法采用柱后光化学衍生反应器实现了在线检测,提高了方法的灵敏度,相比于其他化学试剂衍生法,绿色、环保、不引入其他的杂质,操作简便、精密度好,与通常检测磺胺类药物的国标方法进行对比,本实验大大的提高了磺胺类药物的检测灵敏度,适用于鸡肉产品中磺胺类药物残留的检测,但是本实验所检测的16 种磺胺类药物并不是所有的都能达到较高的灵敏度,其中磺胺醋酰的定量限为224.6 μg/kg,并不能满足磺胺类残留检测的限定,且因不同的磺胺类药物其荧光强度不同,这也就导致本实验所检测的16 种磺胺类药物间适用线性范围差别较大,对今后的检测应用存在一定程度的影响,有待于进一步优化实验过程提高其方法的灵敏度,减少对因药物种类的差别对实际应用的影响。
参考文献:
[1] BARAN W, ADAMEK E, ZIEMIAN’SKA J, et al. Effects of the presence of sulfonamides in the environment and their influence on human health[J]. Journal of Hazardous Materials, 2011, 196: 1-15.
[2] 郭时金. 水产品中磺胺类药物残留检测方法的研究进展[J]. 黑龙江畜牧兽医, 2011(5): 29-30.
[3] 王翔, 邓晓军, 宋国新, 等. 食品中磺胺类兽药残留前处理技术的研究进展[J]. 食品科学, 2009, 30(7): 254-257.
[4] 王俊菊, 高木珍, 包建民. 高效液相色谱串联质谱技术在兽药残留检测中的应用进展[J]. 中国兽药杂志, 2011, 45(7): 45-51.
[5] REIG M, TOLDRA F. Veterinary drug residues in meat: Concerns and rapid methods for detection[J]. Meat Science, 2008, 78: 60-67.
[6] 吴黎明, 张金振, 李桂芬, 等. 蜂王浆中八种磺胺类药物残留测定方法[J]. 食品科学, 2008, 29(11): 535-537.
[7] DELAUNAY-BERTONCINI N, HENNION M C. Immunoaffinity solid-phase extraction for pharmaceutical and biomedical traceanalysis-coupling with HPLC and CE-perspectives[J]. Journal of Pharmaceutical and Biomedical Analysis, 2004, 34(4): 717-736.
[8] ZOU Qionghui, XIE Mengjia, WANG Xiangfeng, et al. Determination of sulphonamides in animal tissues by high performance liquid chromatography with pre-column derivatization of 9-fluorenylmethyl chloroformate[J]. Journal of Separation Science, 2007, 30(16): 2547-2655.
[9] SENYUVA H Z, GILBERET J. Immunoaffinity column clean-up techniques in food analysis: a review[J]. Journal of Chromatography B, 2010, 878(2): 115-132.
[10] 黄华, 陈君慧, 冯楠, 等. 动物源性食品中磺胺类药物残留前处理和检测方法研究进展[J]. 食品工业科技, 2013, 34(4): 378-381.
[11] 赵旭壮, 李明元. 动物性食品中磺胺类药物残留检测研究进展[J].中国食品卫生杂志, 2012, 24(3): 292-296.
[12] 张鸿雁, 崔小军, 耿金培, 等. 动物源性食品中磺胺类药物的多残留酶联免疫测定方法研究进展[J]. 食品研究与开发, 2008, 29(9): 181-183.
[13] 何丛薇, 王姣姣, 高文惠. 饲料及动物源性食品中磺胺类药物残留检测研究进展[J]. 饲料博览, 2014(3): 39-43.
[14] 郭浩, 王燕飞, 邹明强. 农兽药多残留检测方法的研究进展[J]. 中国畜牧兽医, 2012, 39(1): 50-55.
[15] 段振娟, 张鸿雁, 王硕. 动物性食品中磺胺类药物残留分析研究进展[J]. 食品研究与开发, 2007, 28(6): 149-152.
[16] 罗成江, 陈慧华, 林仙军, 等. UPLC 和HPLC法检测猪肉中磺胺类药物残留的比较[J]. 中国兽药杂志, 2012, 46(4): 25-28.
[17] 傅宏庆, 王颖, 张丹, 等. 高效液相色谱-紫外法对13 种磺胺类药物的同步检测[J]. 中国畜牧兽医, 2012, 39(4): 233-237.
[18] 洪蕾洁, 石璐, 张亚雷, 等. 固相萃取-高效液相色谱法同时测定水体中的10 种磺胺类抗生素[J]. 环境科学, 2012, 33(2): 652-657.
[19] 何红春. 食品中磺胺类药物残留检测方法研究进展[J]. 绿色科技, 2013(2): 153-155.
[20] 张煌涛, 李雪红, 占秀梅. 兽肉中磺胺类药物残留检测研究进展[J].草食家畜, 2006(4): 14-16.
[21] 田艳玲, 王浩, 刘艳琴, 等. 液相色谱-串联质谱同时测定婴幼儿奶粉中磺胺类药物残留[J]. 中国食物与营养, 2009(12): 40-43.
[22] JOSHUA H. Determination of aflatoxins by reversed-phase high performance liquid chromatography with post-column in-line photochemical derivatization and fl uorescence detection[J]. Journal of Chromatography A, 1993, 654: 247-254.
[23] 郑斌, 余海霞, 杨会成, 等. 高效液相色谱-在线柱后衍生荧光检测法同时测定水产品中14 种磺胺类药物残留[J]. 食品科学, 2012, 33(4): 230-233.
[24] 高恩泽, 于小涵, 刘婷, 等. 柱后衍生化技术及其在药物与食品分析中的应用与进展[J]. 药物分析杂志, 2014, 34(5): 747-759.
[25] 黄冬梅, 黄宣运, 顾润润, 等. 柱后衍生高效液相色谱法测定虾中14种磺胺类药物残留量[J]. 色谱, 2014, 32(8): 874-879.
[26] 陈万勤, 黄丽英, 陈小珍, 等. 高效液相色谱光化学在线衍生技术在11 种磺胺药物残留检测中的应用[J]. 分析化学, 2014, 42(4): 573-578.
Determination of 16 Sulfonamide Residues in Chicken by High Performance Liquid Chromatography with Online Photochemical Derivatization and Fluorescence Detection
XU Xu
1,2, GENG Dandan
1,2, CHI Xiaofeng
1, DONG Qi
1, HU Fengzu
1,*, XIAO Yuancan
1,*
(1. Northwest Institute of Plateau Biology, Chinese Academy of Sciences, Xining 810008, China; 2. College of Life Science, University of Chinese Academy of Science, Beijing 100049, China)
Abstract:A high performance liquid chromatography (HPLC) with online postcolumn photochemical derivatization and fl uorescence detection (FLD) method was established for the determination of 16 sulfonamide residues in chicken. Chicken samples were extracted with acetonitrile and the extract was defatted, separated by column chromatography, treated by online photochemical derivatization and detected using a fl uorescence detector. The mobile phase was a mixture of 0.3% glacial acetic acid and methanol solution at a fl ow rate of 0.7 mL/min. The column temperature was set as 36 ℃, and the excitation and emission wavelengths were set as 320 and 450 nm, respectively. The 16 sulfonamide residues were successfully separated and determined under chosen experimental conditions. The calibration curves showed good linearity in the range of 0.13-67.89 μg/mL (R ≥ 0.994 0). The recovery rates of the 16 sulfonamide residues were in the range of 64.3%-106.6% with relative standard deviation (RSD) of 0.3%-13.9%.The limits of detection (LOD) for the sulfonamides were 1-67.4 μg/kg. The established method is sensitive, accurate, rapid, and suitable for the determination of sulfonamide residues in chicken.
Key words:chicken; sulfonamides; online photochemical derivatization; HPLC-FLD
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2015)22-0165-04
doi:10.7506/spkx1002-6630-201522031
收稿日期:2015-01-19
基金项目:中国科学院仪器功能开发技术创新项目(Ig201308);中国科学院知识创新工程重要方向项目(KSCX2-EW-J-26);
青海省科技平台建设项目(2012-T-Y19)
作者简介:许旭(1990—),女,硕士研究生,研究方向为食品安全检测。E-mail:xuxu5286@126.com
*通信作者:胡风祖(1955—),女,研究员,本科,研究方向为应用化学。E-mail:hufz@nwipb.cas.cn
肖远灿(1980—),男,工程师,硕士,研究方向为食品及药品分析。E-mail:ycxiao@nwipb.cas.cn