李树红,蒋然然,杨 娟,刘 玲,钟海霞,陈志光,李美良,李 冉
(四川农业大学食品学院,四川 雅安 625014)
摘 要:以鲢鱼卵为材料,通过匀浆、酸处理和超滤制备半胱氨酸蛋白酶抑制因子(cystine proteinase inhibitors,CPIs)粗提液,进而经Sephacryl S-100分子筛层析、Blue Sepharose 6 Fast Flow染料亲和层析、SP-Sepharose Fast Flow阳离子交换层析、ConA Sepharose 4B亲和层析,获得两种纯化的高分子CPIs,即ConA不吸附部分a-1和吸附部分的糖蛋白a-2。二者分别被纯化了102.62 倍和274.28 倍,酶活回收率分别为2.02%和1.42%。通过TSK G2000 SWXL凝胶过滤高效液相色谱结合十二烷基硫酸钠-聚丙烯酰胺凝胶电泳及其反相酶谱法分析,表明a-2及再次经高效液相色谱法回收的a-1在 电泳图上均呈单一带,a-2为单一峰,且a-1的分子质量为139 ku,a-2的分子质量为92 ku。二 者均能抑制半胱氨酸蛋白酶(木瓜蛋白酶和鲢鱼组织蛋白酶L)但不抑制丝氨酸蛋白酶(胰蛋白酶和胰凝乳蛋白酶)。根据a-1 和a-2的分子质量及抑制活性特征和糖蛋白特性,推测二者可能为鲢鱼卵Kininogens的不同形式。
关键词:鲢鱼卵;半胱氨酸蛋白酶抑制因子;Kininogen;纯化;鉴定
半胱氨酸蛋白酶抑制因子(cysteine proteinase inhibitors,CPIs)是一类专门抑制活性中心含有半胱氨酸残基的蛋白酶的抑制因子,广泛分布于动植物组织、体液及分泌液中 [1]。Cystatins超家族是动物源CPIs的最主要类群,其根据分子质量和结构划分为3 个家族即Stefin(家族Ⅰ,约11 ku),Cystatin(家族Ⅱ,约13 ku),以及Kininogen(家族Ⅲ,50~120 ku) [1-2]。近几年研究发现,Cystatins超家族成员在骨生长调节 [3]、感染与免疫 [4-5]、抗菌 [6]、精子成熟与胚胎发育 [7]、细胞凋亡 [8]、肿瘤的侵袭和转移抑制 [9-10]等机体的多种生理和病理过程发挥重要作用。此外,在食品领域的相关研究表明,CPIs能抑制引起鱼糜凝胶劣变的相关内源性热稳定半胱氨酸蛋白酶,改善鱼糜凝胶的质构 [11-12],因此还有望开发鱼糜制品弹性改良剂。目前,对陆生哺乳动物来源CPIs的研究相对较深入。但对于进化地位和生存环境明显不同的鱼类,其CPIs在结构、活性特征、生理功能等方面的研究尚存在较多空白。
我国鲢鱼(Hypophthalmichthys molitrix)资源十分丰富,产量位居淡水养殖的第二位 [13],在其加工中会产生大量废弃下脚料,有研究表明在鱼类卵巢、鱼皮、血浆、心脏、肠、腮等下脚料中均存在CPIs活性 [14-18]。本课题组前期报道了鲢鱼卵、皮等废弃组织中几种高低不同分子质量CPIs的部分生化特性 [19-21]和抑菌活性 [22],并且从鲢鱼卵中部分纯化了一种约89 ku的糖基化高分子质量CPI [23]。而本实验在前期工作基础上,采用高效合理的蛋白层析分离方法,同时从鲢鱼卵中获得两种高度纯化的高分子质量CPIs。通过凝胶过滤高效液相色谱、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)和反相酶谱法,鉴定了两种高分子CPIs的纯度和分子质量。此外,测定了其抑制活性类型,并讨论了其可能的糖侧链结构。本实验结果为后续进一步充分研究鲢鱼高分子CPIs的活性和功能提供实验基础。
1.1 材料与试剂
怀卵期(Ⅳ期)鲢鱼于四川崇州通威养殖中心采集,宰杀后立即采卵,液氮速冻后于-80 ℃超低温冰箱冻藏,使用前4 ℃解冻。
荧光合成肽(Z-Phe-Arg-MCA)、偶氮酪蛋白(azocasein)、木瓜蛋白酶(papain)、胰蛋白酶(trypsin)、胰凝乳蛋白酶(chymotrypsin)、荧光标准品7-氨基-4-甲基香豆素(7-amino-4-methylcoumarin,AMC)、苯甲基 磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、明胶、牛血清白蛋白(bovine serum albumin,BSA)、α-甲基-D-甘露糖苷 美国Sigma公司;Sephacryl S-100、Blue Sepharose 6 Fast Flow、SP-Sepharose Fast Flow、Con A Sepharose 4B 美国GE公司;宽分子质量蛋白标准品(6.5~200 ku) 日本TaKaRa公司;BCA蛋白检测试剂盒 江苏碧云天生物技术研究院;鲢鱼组织蛋白酶L由本实验纯化制备。
1.2 仪器与设备
Biologic Duo Flow全自动中高压层析系统、Mini Protein电泳槽及PowerPac 3000电泳电源 美国Bio-Rad公司;B4i-BR4i大容量高速离心机 法国Jouan公司;TSK G2000 SWXL凝胶过滤高效液相柱 日本Tosoh公司;LC-2010C HT高效液相色谱仪 日本Shimadzu公司;Varioskan Flash全波长多功能酶标仪 美国Thermo公司;Ultra-8050/03超滤杯 美国Millipore公司;V-1100D分光光度计 上海美谱达公司。
1.3 方法
1.3.1 鲢鱼卵中CPIs的粗提取
鲢鱼卵(Ⅳ期)65 g于4 ℃解冻后,用4 倍体积的提取液(含0.1 mmol/L PMSF的20 mmol/L磷酸盐缓冲液,pH 6.0)匀浆,离心(10 000×g,20 m in),取上清液60 ℃静置1 h,用4 层纱布过滤,滤液经1 mol/L HCl调节pH值至3.0,静置10 min后再用1 mol/L NaOH回调至pH 6.0。随后离心(10 000×g,10 min)取上清,样液经Vivafl ow 200膜包(截留分子质量为10 ku)超滤浓缩至适当体积,得鲢鱼卵CPIs粗提液。以上步骤除特殊说明外均在4 ℃条件下操作,以Azocasein为底物,测定每一步骤后的CPIs粗提液的总抑制活力和酶比活力。
1.3.2 蛋白质质量浓度测定
采用Bradford [24]方法测定各步骤提取液的蛋白质质量浓度。
1.3.3 CPIs抑制活性的测定
参考Li等 [18]所用Azocasein法。调节反应体系中CPIs的加入量,使测得对木瓜蛋白酶的抑制率在30%~70%之间 [25]。CPIs抑制活性单位定义为:在一定反应条件下,440 nm波长处的吸光度降低0.01即为一个单位。利用Azocasein法监测粗提及层析各步骤的总酶活力和酶比活力。
荧光合成肽(Z-Phe-Arg-MCA)法:层析过程中,以利用灵敏度更高的荧光合成肽Z-Phe-Arg-MCA为底物,于激发波长360 nm,发射波长440 nm条件下监测洗脱物对木瓜蛋白酶活性的抑制情况,具体参照Anastasi等 [26]方法。调节反应体系中CPIs的加入量,使测定的抑制率在30%~70%之间 [25]。酶活力单位定义为:在反应条件(40 ℃、pH 6.8)下,能够在1 min内水解底物并释放出1 nmol AMC产物的酶活性量(1 nmol AMC/min),为一个酶活力单位。一个抑制活性单位定义为:抑制1 个单位的酶活力。
1.3.4 鲢鱼卵CPIs的层析纯化
取上述卵的浓缩粗提液,4 ℃条件下进行层析纯化,具体步骤如下:样品经微滤后上预先平衡的Sephacryl S-100分子筛柱(2.6 cm×90 cm)层析。用含0.2 mol/L NaCl的20mmol/L磷酸盐缓冲液(pH 6.0)洗脱,流速0.5 mL/min,每管收集1.0 mL。收集高分子质量部分的活性洗脱物。经A液(50 mmol/L的磷酸盐缓冲液,pH 6.0)透析后上已平 衡的Blue Sepharose 6 Fast Flow染料亲和柱(1.5 cm×9 cm)层析。上样后用含0~1 mol/L NaCl的A液进行梯度洗脱,流速2.0 mL/min,每管收集2 mL。收集目的蛋白。用B液(20 mmol/L的磷酸盐缓冲液,pH 6.5)透析后进行SP-Sepharose Fast Flow阳离子交换柱(1.0 cm×6 cm)层析。上样后用含0~1 mol/L NaCl的B液进行梯度洗脱,流速0.90 mL/min,每管收集0.45 mL。将阳离子层析收集到的活性部分透析(C液:含0.2 mol/L NaCl、1 mmol/L CaC1 2、l mmol/L MnCl 2的20 mmol/L磷酸盐缓冲液,pH 6.0)后,上预先平衡的ConA Sepharose 4B亲和柱(0.5 cm×5 cm)层析。上样后用含1 mol/L的α-甲基甘露糖苷的A液洗脱,流速0.1 mL/min,每管收集0.2 mL。所得的活性部分,浓缩作为最终纯化物。
1.3.5 TSK G2000 SWXL凝胶过滤高效液相色谱分析
TSK G2000 SWXL凝胶过滤高效液相柱(7.8 mm×30 cm)预先用D液 (含0.1 mol/L Na 2SO 4和0.05 g/100 mL NaN 3的0.1 mol/L的磷酸盐缓冲液,pH 6.7)平衡。收集ConA Sepharose 4B亲和层析所得活性部分b-1和b-2,经透析(截留分子质量14 ku的透析袋)、浓缩(截留分子质量30 ku的超滤膜)、微滤(0.22 μm的微滤膜)后上TSK G2000 SWXL分析。用D液以0.5 mL/min的流速进行洗脱,并回收目的蛋白。
1.3.6 鲢鱼卵高分子CPIs的SDS-PAGE鉴定
参考Laemmli [27]的方法。采用4%浓缩胶和12%分离胶。每泳道上样20 μL。考马斯亮蓝R-250染色,脱色液(V(95%乙醇)∶V(冰醋酸)∶V(蒸馏水)= 4.5∶0.5∶5)脱色至电泳条带清晰可见。
1.3.7 鲢鱼卵高分子CPIs的反相酶谱分析
反相酶谱SDS电泳基本参照Li等 [18]的方法。上样前样品不煮沸。电泳结束后用含体积分数2.5%的Triton X-100复性,超纯水漂洗数次,胶放入含0.4 mg/mL木瓜蛋白酶的50 mmol/L磷酸盐缓冲液(pH 7.0)中4 ℃反应1 h,随后置于含1%明胶的50 mmol/L的磷酸盐缓冲液(pH 7.0)中37 ℃反应12 h,染色脱色同SDS-PAGE分析。
1.3.8 鲢鱼卵高分子CPI的抑制活性类型鉴定
为鉴定抑制类型,参考Anastasi [26]、Barrett [28]、Schwert [29]、Hummel [30]等的方法,分别以Z-Phe-Arg-MCA、N-苯甲酰-L-精氨酸乙酯(N-benzoyl-L-arginine ethyl ether,BAEE)和N-苯甲酰-L-酪氨酸乙酯(N-benzoyl-L-tyrosine ethyl ether,BTEE)为底物,作高分子CPIs对半胱氨酸蛋白酶(木瓜蛋白酶和鲢鱼组织蛋白酶L)以及丝氨酸蛋白酶(胰蛋白酶和胰凝乳蛋白酶)的抑制曲线,纵坐标以残余酶活力表示。
2.1 鲢鱼卵高分子CPIs层析纯化
鲢鱼卵匀浆液经酸处理、超滤、浓缩三步骤,共制得总活力为20 446.75 U的CPIs粗提液,并用于后续的层析纯化。由图1可知,粗提浓缩液经Sephacryl S-100分子筛层析后得到分子质量高低不同的两个活性部分,即活性峰Ⅰ和活性峰Ⅱ,虽然低分子质量峰Ⅱ的活性量稍低于峰Ⅰ部分,但由于其蛋白吸附峰值低,酶比活力则更高,因此当只取其中高分子质量活性峰Ⅰ用于下步层析时,酶活回收率从51.16%锐减至22.53%,酶比活力也略有降低(表1)。进一步对活性峰Ⅰ部分进行Blue Sepharose 6 Fast Flow染料亲和层析(图2),当盐浓度升至1 mol/L时可将目的蛋白峰特异地洗脱下来。该步骤有效去除了杂蛋白,纯化倍数显著提高到11.92 倍(表1)。收集染料亲和层析吸附部分的活性部分Ⅰ-2,经SP-Sepharose Fast Flow阳离子交换层析(图3)将目的蛋白进一步纯化,将得到的活性峰Ⅰ-2-a部分,透析浓缩后上ConA Sepharose 4B亲和层析,在不吸附部分得到活性峰a-1,而吸附部分得到糖基化活性蛋白峰a-2(图4)。经粗提、分子筛、染料亲和、阳离子、ConA亲和层析后,鲢鱼卵CPI a-1和a-2分别纯化了约102.62 倍和274.28倍,酶活回收率分别为2.02%和1.42%(表1)。

图1 鲢鱼卵CPIs的Sephacryl S-100分子筛层析
Fig.1 Sieve chromatography of CPIs from silver carp egg on Sephacryl S-100

图2 鲢鱼卵高分子CPIs的Blue Sepharose 6 Fast Flow染料亲和层析
Fig.2 Dye affinity chromatography of high-molecular-weight CPIs from silver carp egg on Blue Sepharose 6 Fast Flow column

图3 鲢鱼卵高分子CPIs的SP-Sepharose Fast Flow阳离子交换层析
Fig.3 Cation exchange chromatography of high-molecular-weight CPIs from silver carp eggs on SP-Sepharose Fast Flow column
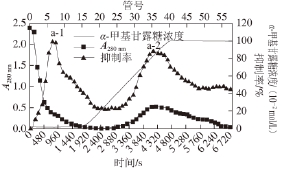
图4 鲢鱼卵高分子CPIs的ConA Sepharose 4B亲和层析
Fig.4 Affinity chromatography of high-molecular-weight CPIs from
silver carp eggs on ConA Sepharose 4B column
表1 鲢鱼卵高分子CPIs组分a-1和a-2纯化结果
Table 1 Purification of a-1 and a-2 from silver carp eggs

酶活回收率/%匀浆 33.21 8 522.00 39 968.18 4.69 1.00 100.00酸处理 6.48 2 245.01 25 031.86 11.15 2.38 62.63超滤浓缩10 ku上清 33.46 1 673.22 20 446.75 12.22 2.61 51.16 Sephacryl S-100 22.92 866.37 9 003.63 10.39 2.21 22.53 Blue Sepharose 6 Fast Flow 6.45 108.44 6 059.91 55.88 11.92 15.16 SP-Sepharose Fast Flow 4.09 14.72 2 750.72 186.87 39.84 6.88 ConA Sepharose 4B(a-1) 0.84 1.68 808.54 481.27 102.62 2.02 ConA Sepharose 4B(a-2) 0.44 0.44 566.01 1 286.39 274.28 1.42步骤 蛋白质量浓度/(mg/mL)总蛋白质量/ mg总抑制活力/U酶比活力/(U/mg pro)纯化倍数
2.2 鲢鱼卵CPIs的TSK G2000 SWXL凝胶过滤高效液相色谱分析

图5 TSK-GEL G2000 SW凝胶过滤高效液相色谱分析CPIs组分a-1
Fig.5 Analysis of a-1 by HPLC on TSK-GEL G2000 SW

图6 TSK-GEL G2000 SW凝胶过滤高效液相色谱分析CPIs组分a-2
Fig.6 Analysis of a-2 by HPLC on TSK-GEL G2000 SW
ConA Sepharose 4B亲和层析收集的活性峰a-1和a-2,分别上TSK G2000 SWXL(图5和图6),由图可知,尽管a-1主要在12.20 min出现目的峰,但是仍存在少量杂蛋白峰。因此进一步回收12.20 min的目的峰,冷干复溶后进行电泳分析。活性峰a-2部分上TSK G2000 SWXL后,仅在14.62 min呈现了单一峰,峰面积达到94.7%。
2.3 鲢鱼卵CPIs的SDS-PAGE及反相酶谱分析

图7 鲢鱼卵高分子CPIs的SDS-PAGE及反相酶谱分析
Fig.7 SDS-PAGE and reversed-phase enzyme zymogram of CPIs from silver carp eggs
A图:纯化各步骤收集目的蛋白的SDS-PAGE;B、C图:a-1及a-2的反相酶谱;M、M1、M2.标准蛋白Marker;泳道1.分子筛收集的Ⅰ;泳道2.染料亲和收集的Ⅰ-2;泳道3.阳离子交换收集的Ⅰ-2-a;泳道4. ConA亲和收集的a-1;泳道5. TSK G2000 SWXL回收的a-1;泳道6. a-1的反相酶谱;泳道7. ConA亲和收集的a-2;泳道8. a-2的反相酶谱。
由图7可知,分子筛层析收集的高分子部分(图7A中泳道1),主要在29 ku以上呈现蛋白条带,说明分子筛层析能去除粗提液中存在的<20 ku的低分子质量CPIs,有利于正确计算后续纯化过程高分子质量CPIs比活性变化及纯化倍数。而经过Blue染料亲和层析后(图7A中泳道2),可能是层析过程中发生了非限制性水解导致在29 ku以下及50 ku附近出现了蛋白条带,尽管如此,该步骤非常有效地去除了116~97 ku及66 ku附近的部分杂蛋白,与层析图结果一致,即目的蛋白高度富集,比活性和纯化倍数明显升高。继而在阳离子交换和ConA亲和层析的逐步纯化后,a-1部分的高分子质量CPI纯度显著提高,但是尚存在少量杂蛋白(图7A中泳道4)。而a-2部分的高分子质量CPI则得到充分纯化,呈现单一条带(图7C中泳道7),这分别与a-1和a-2的TSK-GEL G2000SW凝胶过滤高效液相色谱分析结果一致(图5和图6)。TSK-GEL G2000SW上回收的a-1(图7B中泳道5)及ConA亲和层析得到的a-2经反相酶谱鉴定,均为高分子质量CPI(图7B中泳道6,图7C中泳道8),分子质量分别约为139 ku和92 ku。
2.4 鲢鱼卵高分子CPIs抑制活性类型的鉴定

图8 鲢鱼卵高分子CPIs组分a-1对几种蛋白酶的抑制曲线
Fig.8 Inhibitory curves of a-1 to some proteinases
a-1对所选半胱氨酸蛋白酶和丝氨酸蛋白酶的抑制曲线结果见图8。随着a-1加量逐渐增加,木瓜蛋白酶、组织蛋白酶L残余酶活力逐渐下降,但是胰蛋白酶和胰凝乳蛋白酶活力基本保持不变,说明a-1对木瓜蛋白酶、组织蛋白酶L均具有明显的抑制活性;而对胰蛋白酶和胰凝乳蛋白酶不具有抑制活性。a-2的结果与此相同(抑制曲线图省略)。因此,a-1和a-2均属于半胱氨酸蛋白酶抑制因子。
已知动物源CPIs的Cystatins超家族中,Kininogen(家族Ⅲ)是一种单链糖蛋白,由二硫键连接的重链和轻链两部分之间为血管舒缓激肽(bradykinin),其分子质量约50~120 ku,是超家族中分子质量最高的抑制剂 [1-2]。
目前对鱼类高分子Kininogen进行明确鉴定的相关报道较少。仅Ylonen等 [31]从大西洋鲑鱼Atlantic salmon(Salmo salar L.)鱼皮中纯化出表观分子质量为76 ku的高分子糖基化CPIs,从花狼鳚Spotted wolffish(Anarhichas minor)和大西洋鳕鱼Atlantic cod(Gadus morhua L.)中纯化出表观分子质量分别为67 ku和78 ku的CPIs [16],由于含有鱼类血管舒缓激肽序列RRPPGWSPLR,且有效抑制半胱氨酸蛋白酶,但对丝氨酸蛋白酶无抑制作用,因此被明确鉴定为鱼类Kininogens。其他多数研究则根据纯化的高分子CPIs的分子质量、抑制活性类型和糖蛋白本质,推测为鱼类Kininogen。如大麻哈鱼Chum salmon(Oncorhynchus keta)血浆中70 ku [18,32]和卵中72.6 ku [33]的高分子质量CPIs以及Ustadi等 [34]从阿拉斯加鳕鱼Alaska pollock(Theragra chalcogramma)卵、玻璃鱼Glassfish(Lipari tanakai)卵、胡瓜鱼Pond smelt(Osmerus mordax)卵、大麻哈鱼Chum salmon(Oncorhynchus keta)卵、太平洋鲱鱼Pacifi c herring(Clupea pallasi)卵中分别纯化的分子质量为66.7、67、84.4、89、120 ku的高分子CPIs,均被推测为Kininogen。
本实验经过粗提取和多步层析后,最终在ConA亲和层析的不吸附和吸附部分,分别得到高度纯化的鲢鱼卵高分子CPIs,即139 ku的a-1和92 ku的a-2。根据分子质量及抑制活性特征,初步推测二者可能为鲢鱼卵Kininogens的不同形式。亲和填料配基ConA,主要吸附含有甘露糖苷或葡萄糖苷的糖蛋白,因此可以确定纯化的a-2为糖蛋白,其可能与团队前期报道的部分纯化的约89 ku [23]的糖蛋白CPI-1相似。尽管a-1没有与ConA结合,但尚不能因此判断a-1为非糖基化蛋白。糖基化是蛋白质的一种重要的翻译后修饰,一些聚糖结构决定的蛋白质的结构和功能。糖蛋白中,糖的组成成分比较复杂,含多种类型的糖类。根据报道,鱼类Kininogen的糖基化结构中即包括N-聚糖也包括O-聚糖 [31]。尽管N-聚糖的五糖核心中包括甘露糖苷或葡萄糖苷键,但除高甘露糖型的简单性糖链外,N-聚糖还包括复杂型、混合型,而O-聚糖的4 种类型中与糖基化位点上羟基氨基酸的羟基O原子共价结合的糖类,均非甘露糖和葡萄糖。 因此,可能由于ConA与某些N-聚糖,尤其是O-聚糖的结合可能不够紧密,导致a-1在不吸附部分洗脱下来,此外层析过程中糖侧链的丢失也可能是原因之一。因此,a-1是否为糖蛋白,a-1、a-2的糖基化位点和糖苷键类型,还有待进一步深入研究。
参考文献:
[1] OTTO H H, SCHIRMEISTER T. Cysteine proteases and their inhibitors[J]. Chemical Reviews, 1997, 97(3): 133-172.
[2] OCHIENG J, CHAUDHURI G. Cystatin superfamily[J]. Journal of Health Care for Poor and Underserved, 2010, 21(1): 51-70.
[3] STRALBERG F, HENNING P, GJERTSSON I, et al. Cysteine proteinase inhibitors regulate human and mouse osteoclastogenesis by interfering with RANK signaling[J]. FASEB Journal, 2013, 27(7):2687-2701.
[4] VRAY B, HARTMANN S, HOEBEKE J. Immunomodulatory properties of cystatins[J]. Cellular & Molecular Life Sciences, 2002,59(9): 1503-1512.
[5] ABOUD L, BALL T B, TJERNLUND A, et al. The role of serpin and cystatin antiproteases in mucosal innate immunity and their defense against HIV[J]. American Journal of Reproductive Immunology, 2014,71(1): 12-23.
[6] KOLACZKOWSKA A, KOLACZKOWSKI M, SOKOLOWSKA A,et al. The antifungal properties of chicken egg cystatin against Candida yeast isolates showing different levels of azole resistance[J]. Mycoses,2010, 53(4): 314-320.
[7] FERRER M, CORNWALL G, OKO R. A population of CRES resides in the outer dense fi bers of spermatozoa[J]. Biology of Reproduction,2013, 88(3): 1-9.
[8] LIANG Xueyun, NAGAI A, TERASHIMA M, et al. Cystatin C induces apoptosis and tyrosine hydroxylase gene expression through JNK-dependent pathway in neuronal cells[J]. Neuroscience Letters,2011, 496(2): 100-105.
[9] HAN Xiao, AN Liping, XU Guangyu, et al. Impact of amino acid substitutions in Domain 5 of high molecular weight Kininogen on suppression of breast cancer cells invasion[J]. International Conference on Human Health and Biomedical Engineering, 2011, 19(22): 395-398.
[10] JIN Lei, ZHANG Yan, LI Hui, et al. Differential secretome analysis reveals CST6 as a suppressor of breast cancer bone metastasis[J]. Cell Research, 2012, 22(9): 1356-1373.
[11] LI D K, LIN H, KIM S M. Application of recombinant chum salmon cystatin to Alaska Pollock (Theragra chalcogramma) Surimi to prevent gel weakening[J]. Journal of Food Science, 2007, 72(5): C294-C299.
[12] RAWDKUEN S, BENJAKUL S, VISESSANGUAN W, et al. Effect of cysteine proteinase inhibitor containing fraction from chicken plasma on autolysis and gelation of Pacific whiting surimi[J]. Food Hydrocolloids, 2007, 21(7): 1209-1216.
[13] 农业部渔业局. 2013年中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2013: 36-39.
[14] YAMASHITA M, KONAGAYA S. A comparison of cystatin activity in the various tissues of chum salmon Oncorhynchus keta between feeding and spawning migrations[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1991, 100(3): 749-751.
[15] TZENG S S, WU H C, SUNG W C, et al. Purification and characterization of cysteine proteinase inhibitors from crucian carp Carassius auratus eggs[J]. Fishers Science, 2009, 75(6): 1453-1460.
[16] YLÖNEN A, HELIN J, BØGWALD J, et al. Purification and characterization of novel kininogens from spotted wolffi sh and Atlantic cod[J]. European Journal of Biochemistry, 2002, 269(11): 2639-2646.
[17] OKAMOTO E, KASAHARA H, CHIBA A, et al. Purification and characterization of two novel cysteine protease inhibitors, Eel-CPI-2 and Eel-CPI-3, in the skin mucus of the Japanese eel Anguilla japonica[J]. Fisheries Science, 2009, 75(2): 463-471.
[18] LI D K, LIN H, KIM S M. Purification and characterization of a cysteine protease inhibitor from chum salmon (Oncorhynchus keta)plasma[J]. Journal of Agricultural and Food Chemistry, 2008, 56(1):106-111.
[19] 刘玲, 蒋然然, 彭海鑫, 等. 鲢鱼卵中低分子CPIs的纯化鉴定及改善鱼糜凝胶强度的效果研究[J]. 食品科学, 2014, 35(13): 37-42. doi:10.7506/spkx1002-6630-201413007.
[20] 李树红, 任阳阳, 李艳芳, 等. 鲢鱼CPIs的三种电泳鉴定方法的比较研究[J]. 食品工业科技, 2013, 34(21): 56-64.
[21] 李树红, 陈海, 蒋然然, 等. 鲢鱼和草鱼下脚料中CPIs抑制活性比较及其分子量分布的鉴定[J]. 食品工业科技, 2014, 35(21): 63-68.
[22] 陈海, 姜海洋, 吴睿, 等. 鲢鱼重组Cystatin的原核表达、鉴定及对铜绿假单胞菌的抑制作用[J]. 食品科学, 2014, 35(21): 133-138. doi:10.7506/spkx1002-6630-201421026.
[23] 宋川, 李艳芳, 任阳阳, 等. 鲢鱼卵高分子质量CPI-I的纯化与鉴定[J].食品科学, 2012, 33(13): 100-103.
[24] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254.
[25] WU J, HAARD N F. Purification and characterization of a cystatin from the leaves of methyl jasmonate treated tomato plants[J]. Comparative Biochemistry and Physiology, 2000, 127(2): 209-220.
[26] ANASTASI A, BROWN M A, KEMBHAVI A A, et al. Cystatin,a protein inhibitor of cysteine proteinases. Improved purification from egg white, characterization, and detection in chicken serum[J]. Biochemical Journal, 1983, 211(1): 129-138.
[27] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[28] BARRETT A J, KIRSCHKE H. Cathepsin B, cathepsin H and cathepsin L[J]. Methods in Enzymology, 1981, 80(41): 535-561.
[29] SCHWERT G W, TAKENAKA Y. A spectrophotometric determination of trypsin and chymotrypsin[J]. Biochimica et Biophysica Acta, 1955,16(4): 570-575.
[30] HUMMEL B C. A modified spectrophotometric determination of chymotrypsin, trypsin, and thrombin[J]. Canadian Journal of Biochemistry and Physiology, 1959, 37: 1393-1399.
[31] YLONEN A, KALKKINEN N, SAARINEN J, et al. Glycosylation analysis of two cysteine proteinase inhibitors from Atlantic salmon skin: di-O-acetylated sialic acids are the major sialic acid species on N-glycans[J]. Glycobiology, 2001, 11(7): 523-531.
[32] 李德昆. 蛋白酶抑制剂的制备及其抑制鳕鱼糜凝胶劣化的研究[D].青岛: 中国海洋大学, 2008.
[33] KIM K Y, USTADI, KIM S M. Characteristics of the protease inhibitor purified from chum salmon (Oncorhynchus keta) eggs[J]. Food Science and Biotechnology, 2006, 15(1): 28-32.
[34] USTADI, KIM K Y, KIM S M. Comparative study on the protease inhibitors from fish eggs[J]. Journal of Ocean University of China,2005, 4(3): 198-204.
Purification and Characterization of Two High-Molecular-Weight Cystine Proteinase Inhibitors (CPIs)from Silver Carp Eggs
LI Shuhong, JIANG Ranran, YANG Juan, LIU Ling, ZHONG Haixia, CHEN Zhiguang, LI Meiliang, LI Ran
(College of Food Science, Sichuan Agricultural University, Ya'an 625014, China)
Abstract:In this study, crude extract rich in cystine proteinase inhibitor s (CPIs) from silver carp eggs was prepared by homogenization, acidification and ultrafiltration. After purification by an array of chromatography on Sephacryl S-100,SP-Sepharose Fast Flow, Blue Sepharose 6 Fast Flow and ConA Sepharose 4B, two high-molecular-weight (HMW) CPIs, a-2 and a-1 with or without absorption on ConA, were obtained. They were purified by 102.62 and 274.28 folds, with recoveries of 2.02% and 1.42% respectively. Through analysis by TSK G2000 SWXL gel filtration HPLC and identification by SDS-PAGE and reverse zymography, both part of a-1 recovered by HPLC and a-2 showed a single band on electrophoresis with molecular weight of 139 and 92 ku, respectively. Both of them could inhibit cysteine protease (papain and silver carp cathepsin L) but not serine protease (trypsin and chymotrypsin). From the characteristics, inhibitory activity and glycoprotein features, a-1 and a-2 may be the different forms of kininogens in silver carp eggs.
Key words:silver carp egg; cysteine protease inhibitors; kininogen; purification; identification
中图分类号:TS254.1
文献标志码:A
文章编号:1002-6630(2015)23-0006-06
doi:10.7506/spkx1002-6630-201523002
收稿日期:2015-01-06
基金项目:国家自然科学基金青年科学基金项目(31101249);四川省教育厅自然科学重点基金项目(10ZA052)
作者简介:李树红(1975—),女,副教授,博士后,研究方向为水产品加工理论与技术。E-mail:xiaoshu928@126.com