刘 平,胡志和*,吴子健,薛 璐,王凤玲
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
摘 要:为研究超高压对木瓜蛋白酶构象变化与酶活力的影响,本研究利用红外光谱法和荧光光谱法对木瓜蛋白酶经超高压处理后的结构变化及特定氨基酸微环境变化进行了分析。结果表明:与常压相比,超高压处理对木瓜蛋白酶活力均有显著影响(P<0.05)。其中,200 MPa、37 ℃、20 min处理时,酶活力在所选处理范围内 达到最大,较常压下的酶活力提高了6.8%;红外光谱结果表明:超高压处理后,木瓜蛋白酶二级结构变化与酶活力变化相关性较差;荧光光谱结果显示:200 MPa、37 ℃处理木瓜蛋白酶20 min,228 nm波长激发后木瓜蛋白酶的外源性荧光强度达到最低(2 023),荧光强度变化与酶活力变化规律有良好的相关性。因此,木瓜蛋白酶活性变化与疏水性氨基酸的暴露程度有关,暴露程度越小,酶活力越大。
关键词:高压技术;木瓜蛋白酶;酶活力;空间构象;红外光谱;荧光光谱
木瓜蛋白酶是半胱氨酸蛋白酶家族中具有广泛特异性的肽链内切酶。目前,关于木瓜蛋白酶的应用 [1-2],提取 [3-4]以及其他方面 [5-11]的研究不少。其活性部位存在于两个结构域之间的裂缝。其中Cys25和His159分别在活性中心的两边,His159咪唑基一部分与Trp177形成疏水性区域,靠氢键与Asn175相连。根据其二级结构,两个结构域分别主要由α-螺旋和β-折叠构成 [12-14]。刘伟等 [15]用动态高压微射流处理木瓜蛋白酶,荧光光谱分析结果发现,木瓜蛋白酶中色氨酸残基暴露出来,形成了较为稳定的新分子构象。王公轲等 [16]研究了乙硫异烟胺与木瓜蛋白酶的分子作用机制,发现乙硫异烟胺与木瓜蛋白酶的相互作用不仅存在疏水作用,而且有氢键作用。张存滢等 [17]研究Hg 2+和Cu 2+对木瓜蛋白酶活性与构象的影响,发现木瓜蛋白酶分子构象的有序度与其活性成正相关。有关超高压处理木瓜蛋白酶引发结构变化与酶活性之间关系研究鲜有报道。对于木瓜蛋白酶空间结构与酶活性关系的研究也不多。本实验采用超高压技术处理木瓜蛋白酶,用红外光谱和荧光光谱分析处理后木瓜蛋白酶的空间结构变化,探讨木瓜蛋白酶空间结构变化与酶活力之间的关系。为探究通过改变空间结构来提高木瓜蛋白酶活力提供一定的理论依据。
1.1 试剂
木瓜蛋白酶、8-苯胺基-1-萘磺酸(8-anilinolnaphthalenesulfonic acid,ANS) 美国Sigma公司;KBr(光谱级) 上海化学试剂有限公司。
1.2 仪器与设备
HPP.L2-800/2.5超高压设备 天津市华泰森淼生物工程技术有限公司;DC-2030节能型智能恒温槽、Scientz-50N冷冻干燥机 宁波新芝生物科技股份有限公司;Nicolet5700傅里叶红外光谱仪 美国尼高力仪器公司;F-4600荧光光度计 日立高新技术公司;VELP漩涡振荡器 德祥科技有限公司;PB-10 pH计 德国赛多利斯(北京)有限公司;TU-1810型紫外-可见分光光度计 北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 超高压处理木瓜蛋白酶
将木瓜蛋白酶溶液(质量浓度为2.5 mg/mL,磷酸盐缓冲液pH值为6.5)真空密封后,进行超高压处理。选择保压时间20 min、温度37 ℃,压力分别为0.1、100、200、300、400、500、600 MPa,以常压(0.1 MPa)条件下的酶溶液作为对照组。
1.3.2 木瓜蛋白酶活力的测定 [18]
超高压处理后的木瓜蛋白酶溶液立即进行Folin-酚法检测,每组3 个平行。酶活力计算如下。
式中:X为样品的酶活力/(U/g);A为由标准曲线得出的样品最终稀释液的酶活力/(U/mL);V为溶解样品所使用的容量瓶的体积/mL;4为反应试剂的总体积/mL;n为样品的稀释倍数;m为样品的质量/g;10为反应时间/min。
1.3.3 木瓜蛋白酶的红外光谱扫描
取100 mg KBr压片,采用傅里叶红外光谱仪扫描,扣除背景后,取2 mg高压处理后冻干样品与100 mg KBr混合,压片,扫描波长范围为4 000~400 cm -1。
1.3.4 木瓜蛋白酶的荧光光谱扫描
1.3.4.1 木瓜蛋白酶的内源性荧光光谱
超高压处理的木瓜蛋白酶缓冲溶液(0.1 mg/mL)分别在295 nm和280 nm波长处激发,扫描300~400 nm波长范围内的发射光谱。狭缝宽度5 nm。
1.3.4.2 木瓜蛋白酶的外源性荧光光谱
取超高压处理的木瓜蛋白酶缓冲溶液(0.1 mg/mL) 4 mL,加入20 μL的ANS(5.0 mmol/L)。避光反应1 h后,228 nm波长激发,扫描310~420 nm波长范围的发射光谱。狭缝宽度5 nm。
1.4 数据统计分析
采用EZ OMNIC软件分析红外光谱的变化,实验数据采用Origin 8.0作图,SPSS 17.0软件对实验数据进行相关性分析。
2.1 超高压处理对木瓜蛋白酶活性的影响
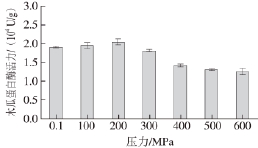
图1 37 ℃、20 min不同压力处理对木瓜蛋白酶活力的影响
Fig.1 Effect of different pressure treatments at 37 ℃ for 20 min on papain activity
由图1可知,压力对木瓜蛋白酶活力的影响较对照组(0.1 MPa)相比,变化显著(P<0.05)。在所选压力范围内(100~600 MPa)处理,酶活力逐渐增加随后又降低。酶活力达到最大的压力处理条件为200 MPa,37 ℃,20 min时,比常压下提高了6.8%。这可能是因为超高压改变了木瓜蛋白酶的部分空间构象,而这些空间构象影响木瓜蛋白酶的活力 [19]。所以改变了木瓜蛋白酶的空间构象,也间接地影响了酶的活力大小。
2.2 超高压处理引发木瓜蛋白酶二级结构的变化与酶活力的关系
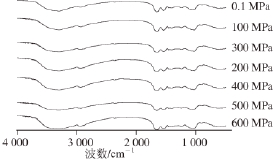
图2 37 ℃、20 min不同压力处理后木瓜蛋白酶的红外光谱图
Fig.2 Infrared spectra of papain treated by different pressures at 37 ℃for 20 min
目前,红外光谱是研究蛋白质二级结构的常用方法之一 [20-21]。其中酰氨Ⅰ带(1 600~1 700 cm -1)是对蛋白质结构变化很敏锐的一个谱带。1 600~1 639 cm -1被认为β-折叠结构,1 661~1 700 cm -1被指认为β-转角结构,1 651~1 660 cm -1被认为α-螺旋结构;1 640~1 650 cm -1被指认为无规卷曲结构 [22]。图2是不同压力处理后木瓜蛋白酶的红外光谱图;经EZ OMNIC软件去卷积处理红外图谱后其二级结构的变化分析见表1。
表1 木瓜蛋白酶二级结构中-螺旋、-折叠、-转角的峰面积x± 3)
Table 1 Peak areas of -helix, -turn and -sheet in secondary structure of papain (x , 3)
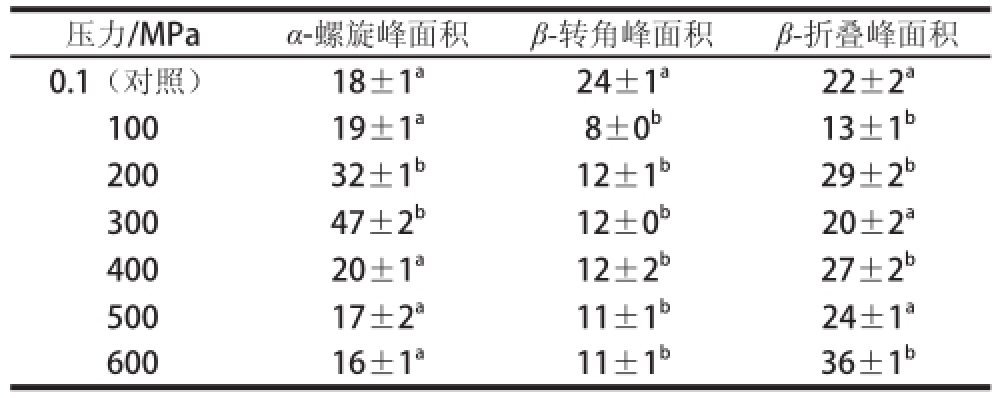
注:同列小写字母不同表示与对照组相比差异显著(P<0.05)。下同。
压力/MPa α-螺旋峰面积 β-转角峰面积 β-折叠峰面积0.1(对照) 18±1 a 24±1 a 22±2 a100 19±1 a 8±0 b 13±1 b200 32±1 b 12±1 b 29±2 b300 47±2 b 12±0 b 20±2 a400 20±1 a 12±2 b 27±2 b500 17±2 a 11±1 b 24±1 a600 16±1 a 11±1 b 36±1 b
经SPSS分析,100~600 MPa处理后,木瓜蛋白酶二级结构(α-螺旋、β-转角、β-折叠)部分峰面积变化较未处理的二级结构变化显著(P<0.05)。其中,α-螺旋峰面积大小呈先增大后减小的趋势,并在300 MPa时峰面积达到最大值。低于或高于300 MPa,α-螺旋峰面积与酶活力大小成正相关(图3)。说明α-螺旋峰面积在一定的压力范围内与木瓜蛋白酶酶活力有关。β-转角峰面积先减小后增大,之后随着压力的持续增加趋于平稳;β-折叠的峰面积随压力的增加出现了波动;但从100~600 MPa整个压力范围来分析,β-转角和β-折叠的变化趋势与酶活力的变化趋势相关性较差。由此说明,木瓜蛋白酶经过超高压处理后,虽然不同的二级结构含量发生一定变化,但与酶活力的变化关系不大。
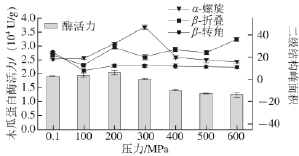
图3 3 α-螺旋、- β-折叠和- β-转角的峰面积与酶活力之间的关系
Fig.3 Relationship between papain activity and peak areas of α-helix,β-turn and β-sheet
2.3 高压处理木瓜蛋白酶引发氨基酸微环境的变化与酶活力的关系
2.3.1 木瓜蛋白酶的内源性荧光光谱分析
2.3.1.1 295 nm波长处激发时木瓜蛋白酶的荧光光谱分析295 nm波长处激发时木瓜蛋白酶的荧光光谱见图4。结合木瓜蛋白酶一级氨基酸序列 [14](表2)分析推测其有可能发生变化的氨基酸的位置。
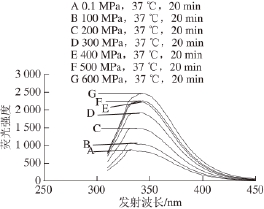
图4 295 nm激发波长不同高压条件处理后木瓜蛋白酶的荧光光谱图
Fig.4 Fluorescence spectra of papain treated by different pressures at
37 ℃ for 20 min at excitement wavelength of 295 nm
表2 木瓜蛋白酶序列
Table 2 Amino acid sequence of papain

氨基酸序列 位置IPEYVDWRQK GAVTPVKNQG SCGSCWAFSA VVTIEGIIKI 1~40 RTGNLNQYSE QELLDCDRRS YGCNGGYPWS ALQLVAQYGI 41~80 HYRNTYPYEG VQRYCRSREK GPYAAKTDGV RQVQPYNQGA 81~120 LLYSIANQPV SVVLQAAGKD FQLYRGGIFV GPCGNKVDHA 121~160 VAAVGYGPNY ILIKNSWGTG WGENGYIRIK RGTGNSYGVC 161~200 GLYTSSFYPV KN 201~212
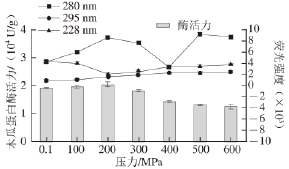
图5 不同高压条件处理后木瓜蛋白酶荧光强度与酶活力的关系
Fig.5 Relationship between fluorescence intensity and papain activity
treated by different pressures at 37 ℃ for 20 min
由图4可知,不同压力(0.1~600 MPa)处理的木瓜蛋白酶,295 nm波长处激发后,其发射波长位移变化均在330~332 nm内。结合Burstern提出的色氨酸残基微环境的特点 [23]分析:即1)λ max=330~332 nm,埋藏在非极性区域内,2)λ max=340~342 nm,固定于蛋白质分子表面,且与水的接触受到限制,3)λ max=350~352 nm,彻底暴露于水中(其中λ max为荧光发射光谱的峰位),所以处理前后的木瓜蛋白酶结构中色氨酸残基埋藏在非极性区域内。在200~600 MPa处理后,与对照组(0.1 MPa)相比荧光强度变化显著(P<0.05),且荧光强度在逐渐变大。说明色氨酸的暴露程度随压力增加而增大。由其一级结构(表2),木瓜蛋白酶内部色氨酸共有5 个,分别位于第7、36、69、177和181位。极有可能是上述位置的色氨酸残基的微环境发生了变化,分析其荧光强度变化与酶活力的关系(图5),发现相关性较小。
2.3.1.2 280 nm波长处激发时不同压力处理的木瓜蛋白酶荧光光谱分析
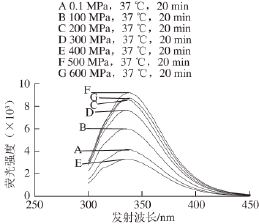
图6 280 nm激发波长不同高压条件处理后木瓜蛋白酶的荧光光谱图
Fig.6 Fluorescence spectra of papain treated by different pressures at
37 ℃ for 20 min at excitement wavelength of 280 nm
280 nm波长处激发时,不同压力处理的木瓜蛋白酶荧光光谱见图6。100~600 MPa处理的木瓜蛋白酶荧光强度与对照组(0.1 MPa)相比变化显著(P<0.05)。说明随压力渐变,木瓜蛋白酶内部Trp和Tyr微环境也处于渐变的状态。但随压力变化,木瓜蛋白酶荧光强度呈现先升高又降低的反复性变化,可见随着压力不同程度的改变,Trp和Tyr二者或各自暴露,掩埋或同时暴露掩埋,亦或一种暴露另外一种掩埋。但二者所表现出来的总的荧光强度变化没有呈现良好的规律性,且其变化与酶活力的相关性较小(图5)。根据其一级结构分析,在其结构中的212 个氨基酸内,共有5 个Trp和18 个Tyr,共占氨基酸总数的10%,但其表现出来的最大荧光强度比未经高压处理的荧光强度提高122%。
2.3.2 木瓜蛋白酶的外源性荧光光谱分析

图7 228 nm波长激发不同高压条件处理后木瓜蛋白酶的荧光光谱图
Fig.7 Fluorescence spectra of papain treated by different pressures at 37 ℃ for 20 min at excitement wavelength of 228 nm
木瓜蛋白酶经不同压力处理后,加入荧光探针ANS [24],研究高压对木瓜蛋白酶表面疏水性的影响。选择228 nm波长处激发,其荧光光谱见图7。228 nm波长处激发,不同超高压处理的木瓜蛋白酶荧光强度与对照组(0.1 MPa)相比变化显著(P<0.05),说明高压处理后木瓜蛋白酶内疏水氨基酸的微环境发生了显著变化。100~600 MPa处理后,其荧光强度呈先下降后增加的趋势,说明在超高压处理的过程中,疏水氨基酸有部分掩埋和暴露。在200 MPa时,疏水氨基酸荧光强度最小(2 023),比对照组(0.1 MPa)的荧光强度降低了52%。根据木瓜蛋白酶一级结构,其中疏水性氨基酸共74 个,占所有氨基酸总数的34.9%。根据Lim [25]规则,在一级结构中的第1~5,12~16,26~30,27~31,28~32,30~34,34~38,68~72,71~75,72~76,130~134,132~136,133~137,134~138,148~152,157~161,160~164和168~172位置极易在空间形成疏水结构。推测不同高压条件处理后,可能是上述位置的氨基酸微环境发生变化。研究其变化与酶活力的关系(图5)发现,疏水性氨基酸的暴露程度与酶活力有很好的相关性,二者同时在200 MPa时达到极值,酶活力最大为20 411 U/g;荧光强度最小为2 023。因此,疏水氨基酸的暴露程度与酶活力大小有关。疏水氨基酸残基的暴露程度越小,酶活力越大。
高压会改变木瓜蛋白酶的二三级结构,并影响其酶活力大小。其中,高压后木瓜蛋白酶的二级结构呈波动性变化,但其变化与木瓜蛋白酶酶活力大小之间没有显著的相关性。对于木瓜蛋白酶的三级结构,其表面疏水性氨基酸的暴露程度与木瓜蛋白酶酶活力大小具有一定的相关性,可能高压处理所改变的疏水氨基酸的空间位置与酶活性中心的构象有关,高压后疏水氨基酸的暴露程度越小,酶活力越大。
参考文献:
[1] 朱琳, 张裕平, 崔震昆, 等. 木瓜蛋白酶对鸭腿肉致嫩工艺研究[J].河南科技学院学报: 自然科学版, 2015, 43(2): 33-37.
[2] SU Sainan, NIE Huali, ZHU Limin, et al. Optimization of adsorptionconditions of papain on dye affinity membrane using responsesurface methodology[J]. Bioresource Technology, 2009,100(8): 2336-2340.
[3] 王伟涛. 木瓜蛋白酶的双水相萃取研究[D]. 海口: 海南大学, 2014.
[4] 王伟涛, 张海德, 蒋志国, 等. 离子液体双水相提取木瓜蛋白酶及条件优化[J]. 现代食品科技, 2014, 30(9): 210-216.
[5] 蒋雷, 费鲜明, 苗成霖, 等. 木瓜蛋白酶对MPA形成及其诱导的单核细胞活化的影响[J]. 中国临床药理学与治疗学, 2015, 20(3): 289-292; 360.
[6] 费鲜明, 周永列, 祁金文, 等. 木瓜蛋白酶体外对血小板聚集的抑制作用[J]. 中国临床药理学与治疗学, 2009, 14(8): 906-911.
[7] 唐思远, 林东强, 童红飞, 等. 人免疫球蛋白G酶解制备Fab和Fc片段及其分离纯化[J]. 化工学报, 2013, 64(5): 1750-1756.
[8] 欧英杰, 曾暖茜, 冯志强, 等. 紫外分光光度法对嫩肉粉中木瓜蛋白酶活力的测定方法研究[J]. 中国食品添加剂, 2010(2): 214-216.
[9] 刘凤瑶, 廖劲松, 齐军茹, 等. 木瓜蛋白酶和菠萝蛋白酶的产业开发[J].食品工业科技, 2008, 29(7): 289-293.
[10] 王伟涛, 蒋志国, 张海德, 等. 木瓜蛋白酶在离子液体双水相中的分配行为[J]. 化工学报, 2015(1): 179-185.
[11] 郑秋生, 李龙, 贾桂芹, 等. 高锰酸钾-木瓜蛋白酶用于山羊绒纤维防毡缩整理研究[J]. 毛纺科技, 2012, 40(3): 33-37.
[12] DRENTH J, KALK K H, SWEN H M. Evidence for multiple reactive forms of papain[J]. Biochemistry, 1976, 15(17): 3731-3738.
[13] KAMPHUIS I G, KALK K H, SWARTE M B A, et al. Study on in situ immobilization and characterization of papain[J]. Journal of Molecular Biology, 1984, 179(2): 233-256.
[14] 芮琪, 徐朗莱. 用凝胶电泳法研究小麦叶片衰老期间的内肽酶同工酶[J]. 南京农业大学学报, 2002, 2(3): 85-88.
[15] 刘伟, 谢明勇, 钟业俊, 等. 低压段DHPM作用对木瓜蛋白酶结构影响的荧光光谱分析[J]. 光谱学与光谱分析, 2010, 30(2): 387-390.
[16] 王公轲, 席辉, 田芳, 等, 光谱和分子模拟法研究乙硫异烟胺与木瓜蛋白酶的分子作用机制[J]. 化学学报, 2011, 69(1): 95-100.
[17] 张存滢, 曾虹燕, 熊龙斌, 等. 双金属Hg~(2+)和Cu~(2+)对木瓜蛋白酶活性与构象的影响[J]. 中南大学学报: 自然科学版, 2013, 44(6):2207-2213.
[18] 陶敏, 潘见, 张文成, 等. 超高压处理对菠萝汁中菠萝蛋白酶活性的影响[J]. 食品科学, 2013, 34(15): 162-165. doi: 10.7506/spkx1002-6630-201315033.
[19] SOMKUTI J, SMELLER L. High pressure effects on allergen food proteins[J]. Biophysical Chemistry, 2013, 183(6): 19-29.
[20] MICHAEL F P, PASCALE C, MICHAEL F. et al. Quantitative determination of cellulose dissolved in 1-ethyl-3-methylimidazolium acetate using partial least squares regression on FTIR spectra[J]. Carbohydrate Polymers, 2012, 87(2): 1124-1130.
[21] 刘斌, 马海乐, 李树君, 等. 应用FTIR研究超声对牛血清白蛋白二级结构的影响[J]. 光谱学与光谱分析, 2010, 30(8): 2072-2076.
[22] 章银良, 夏文水. 海藻糖对盐渍海鳗肌动球蛋白影响的研究[J]. 食品科学, 2007, 28(7): 39-43.
[23] BURSTEIN E A, VEDENKINA N S, IVKOVA M N. Fluorescence and the location of tryptophan residues in protein molecules[J]. Photochemistry and Photobiology, 1973, 18(4): 263-279.
[24] 乌云娜, 莎丽娜, 格日勒图. 高压处理对牛骨骼肌原肌球蛋白结构的影响[J]. 食品工业科技, 2012, 33(3): 52-55; 59.
[25] LIM V I. Structural principles of the globular organization of protein chains. A stereochemical theory of globular protein secondary structure[J]. Journal of Molecular Biology, 1974, 88(4): 857-872.
Effect of Ultra High Pressure Treatment on the Conformation and Enzyme Activity of Papain
LIU Ping, HU Zhihe*, WU Zijian, XUE Lu, WANG Fengling
(Tianjin Key Laboratory of Food Biotechnology, School of Biotechnology and Food Science,Tianjin University of Commerce, Tianjin 300134, China)
Abstract:In order to examine the impact of ultra high pressure (UHP) on the enzyme activity and conformational change of papain, infrared spectroscopy and fluorescence spectroscopy were used to analyze structural and specific amino acid changes in UHP-treated papain. The results showed that compared with untreated sample, UHP treatments at various pressure had a significant effect on papain activity (P < 0.05). After being treated with 200 MPa, at 37 ℃ for 20 min, the activity of papain reached the maximum level, indicating a 6.8% increase compared with the untreated one. The infrared spectroscopic showed that there was a poor relationship between papain activity and conformation. The fluorescence spectroscopic analysis suggested that the exogenous fluorescence intensity of papain treated with 200 MPa at 37 ℃ for 20 min reached the minimum level (2 023) at an excitation wavelength of 228 nm. There was an excellent correlation between papain activity and fluorescence intensity. Therefore, papain activity was negatively related to the exposure degree of hydrophobic amino acids.
Key words:high-pressure technology; papain; enzyme activity; spatial conformation; infrared spectroscopy; fluorescence spectroscopy
中图分类号:Q71
文献标志码:A
文章编号:1002-6630(2015)23-0023-05
doi:10.7506/spkx1002-6630-201523005
收稿日期:2015-03-18
基金项目:国家自然科学基金面上项目(31271841);天津市高等学校创新团队项目(TD12-5049)
作者简介:刘平(1987—),女,硕士研究生,研究方向为食品生物技术。E-mail:liuping0402@126.com
*通信作者:胡志和(1962—),男,教授,硕士,研究方向为专用功能食品。E-mail:hzhihe@tjcu.edu.cn