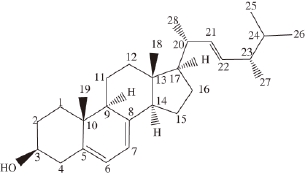
图1 麦角甾醇分子的构型
Fig.1 Molecular structure of ergosterol
张 蕊 1,吴超仪 2,刘 宇 1,杨树德 1,程显好 1
(1.山东省食用菌技术重点实验室,鲁东大学农学院,山东 烟台 264025;2.湖南大学化学化工学院,湖南 长沙 410012)
摘 要:用分子荧光光谱实验法和分子对接理论研究麦角甾醇与牛血清白蛋白(bovine serum albumin,BSA)的相互作用。荧光光谱实验结果表明:麦角甾醇能猝灭BSA的内源性荧光,其猝灭类型为静态猝灭;通过考察猝灭过程中热力学函数的变化初步推断麦角甾醇与BSA的结合是自发的熵增过程,驱动力主要为疏水相互作用。运用分子对接技术研究了麦角甾醇与BSA的相互作用,结果表明:麦角甾醇与BSA相结合,主要的作用力类型为疏水相互作用;并获得了麦角甾醇在BSA中的作用位点,麦角甾醇处在一个疏水性的结合口袋中,结合稳定性强。荧光光谱的实验结果与分子对接的理论结果总体上一致,说明结合过程是一个自发的过程,BSA可以携带和运输麦角甾醇,同时从分子对接中获得了麦角甾醇在BSA中详细的结合位点和结合模式。
关键词:麦角甾醇;牛血清白蛋白;荧光猝灭;分子对接;结合位点
麦角甾醇是大型真菌中普遍存在的甾体类化合物,分子式C 28H 44O,其分子结构如图1所示。实验证实食药用菌中的麦角甾醇及其衍生物具有较好的抗肿瘤活性。国外学者早在1994年就从真姬菇子实体中分离出麦角甾醇,并发现它对小鼠皮肤癌有显著抑制作用 [1];2000年,Yazawa等 [2]指出猪苓醇提物中的麦角甾醇对大鼠膀胱癌有很好的治疗作用;此后,Zhang等 [3]的研究小组相继从灰树花菌丝体和杨树菇子实体中分离出麦角甾醇,证实其对环氧合酶ⅡCOX-2 (在多种恶性肿瘤中高表达的酶)有抑制作用。国内学者也开展了一系列的研究 [4-9],其中包海鹰课题组系统地研究了蒙古口蘑、簇生沿丝伞等食药用菌中的麦角甾醇的抗肿瘤活性 [10-12]。然而,以上的研究主要集中在麦角甾醇生物活性方面,但其在体内的传输机制以及与相关蛋白的相互作用方面的探讨很少。
牛血清白蛋白(bovine serum albumin,BSA)是血液中的主要成分,能够携带药物运送到身体需要的部位。BSA与人血清白蛋白(human serum albumin,HSA)的氨基酸序列非常类似,两者具有高度同源性(80%) [13]。因此实验研究经常用BSA代替HAS来研究血清白蛋白与药物的相互作用。BSA的三维晶体结构如图2所示,有3 个结构域:siteⅠ、siteⅡ、siteⅢ,每个结构域有两个亚结构域A和B,以槽口相对的方式形成圆筒状结构,内部包含有几乎所有的疏水性氨基酸,通过疏水作用构成疏水性口袋。在图2中,BSA的结构用灰色带状来显示,其中方框内区域是由分子对接所确定的麦角甾醇的结合口袋 [14]。

图1 麦角甾醇分子的构型
Fig.1 Molecular structure of ergosterol
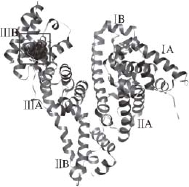
图2 BSA的三维晶体结构Fig.2 Crystal structure of BSA
当药物进入人体后,通过血浆中蛋白的存储和运输才能到达受体部位发挥其药理作用,因此,研究药物与蛋白的相互作用,有助于了解药物在人体内的运输和分布情况,对于阐明药物的作用机制、药代动力学以及药物的毒性等有非常重要的意义 [15-16]。本实验运用分子荧光光谱和分子对接技术研究了它们的相互作用机制,为麦角甾醇的进一步开发和应用提供参考。
1.1 试剂与仪器
牛血清白蛋白 美国Sigma公司;麦角甾醇标准品(纯度大于99%) 生工生物工程(上海)股份有限公司;Tris 上海善普化工科技有限公司;无水乙醇(分析纯) 天津市科密欧化学试剂有限公司;盐酸(分析纯) 上海拜力生物科技有限公司;氯化钠(分析纯)济南百博生物技术有限责任公司。
Perkin-Elmer LS55型荧光光谱仪 美国PerkinElmer公司;CP214电子天平 上海奥豪斯仪器有限公司;PH计 上海梅特勒-托利多仪器有限公司;DK-S24型电热恒温水浴锅 上海精宏实验设备有限公司;Merck Millipore超纯水系统 德国Merck公司。
1.2 方法
1.2.1 麦角甾醇与BSA相互作用的荧光光谱测定
荧光光谱测定:准确移取2 mL 1.0×10 -7mol/L(以Tris-HCl缓冲液(pH 7.2)为溶剂,用无水乙醇配制)的BSA标准溶液于1 cm的石英比色皿中,在250~500 nm波长范围内进行光谱扫描,在280 nm波长处荧光强度最大,因此选择280 nm作为激发波长。
准确移取2 mL 1.0×10 -7mol/L的BSA溶液于1 cm的石英比色皿中,置于恒温水浴锅中,用微量进样器逐次加入浓度为1.0×10 -7mol/L的麦角甾醇溶液,每次加入的体积为5 μL,累计加入体积小于60 μL,因此可忽略体积效应。每次加入麦角甾醇溶液后恒温5 min(293 K),测定各个样品300~500 nm的荧光发射光谱,入射和出射狭缝为10 nm。重复上述步骤,分别测定303、310 K情况下各样品300~500 nm的荧光发射光谱并记录结果。
1.2.2 麦角甾醇与BSA相互作用的分子对接研究
1.2.2.1 麦角甾醇及BSA结构的预处理
将麦角甾醇的结构通过Gaussian03软件进行优化,应用Becke three-parameter Lee-Yang-Parr密度泛函理论在6-31g(d)水平上(表明在6-31G分裂基组基础上给重原子(C,N,S)添加d函数)进行,以得到最低能量的构型,将优化好的构型用于分子对接操作。BSA的晶体结构从PDB数据库中下载(PDB ID CODE:4F5S),选择其中的A亚基,将这一简化后的结构用Chimera程序检查体系的结构及氨基酸残基的质子化状态 [17];最后运用GROMACS 3.3.1软件(www.gromacs.org)进行1 000 步的共轭梯度下降法进行能量最小化,这一过程中非键截取参数设置为10 .,能量梯度收敛标准设置为0.01 kcal/mol [18];将这一结构作为初始结构(图2)进行分子对接操作。
1.2.2.2 分子对接方法研究麦角甾醇与BSA相互作用
采用分子对接软件AutoDock 4.2(http://autodock. scripps.edu/)来研究麦角甾醇与BSA的相互作用机制 [19]。能量优化后的麦角甾醇与BSA的结构应用于分子对接操作。计算时选择经验自由能函数和遗传算法。在分子对接过程中保持蛋白分子的刚性结构,麦角甾醇为全柔性,即设定所有可旋转键自由旋转。选取BSA中可能的结合位点附近适当的区域,本实验中根据文献选取了7 个可能的结合位置 [14],用AutoDock 4.2程序进行结合位点的扫描,分子对接的格点为72×72×72,格点间距为0.375 .,形成的空间体积为19 683 . 3,每次扫描进行50 次独立的对接操作,对接结果在0.1 nm的均方根偏差(root-mean-square deviation,RMSD)标准下分组;然后选取对接操作次数最多的分组中结合能最低的构象,分析这一构象的合理性,得到麦角甾醇与BSA相互作用的结合模式。
2.1 麦角甾醇与BSA相互作用的荧光光谱
2.1.1 麦角甾醇与BSA相互作用的荧光光谱的类型及机制BSA为内源荧光物质, 其分子中的色氨酸、酪氨酸、苯丙氨酸残基都能发射荧光,主要体现为色氨酸的荧光。图3为20 ℃时麦角甾醇对BSA内源性荧光猝灭图,固定激发波长280 nm,固定BSA的浓度,其发射荧光的强度随麦角甾醇浓度的增大而有规律地降低,表明麦角甾醇与BSA发生了相互作用并能猝灭BSA的内源性荧光,即产生了荧光猝灭。

图3 麦角甾醇对BSA荧光光谱的影响(20 ℃)
Fig.3 Effect of ergosterol on fluorescence spectrum of BSA at 20 ℃
c(BSA)=1.0×10 -7mol/L;麦角甾醇的浓度从上到下依次为c(麦角甾醇)=(0、2.5、5.0、7.5、10.0、12.5)×10 -10mol/L。
荧光猝灭分为动态猝灭和静态猝灭,要测定结合常数时必须确定荧光猝灭的类型。Stern-Volmer方程(1)和Perrin方程(2)分别用于描述药物小分子与蛋白质动态和静态荧光猝灭过程 [20]。
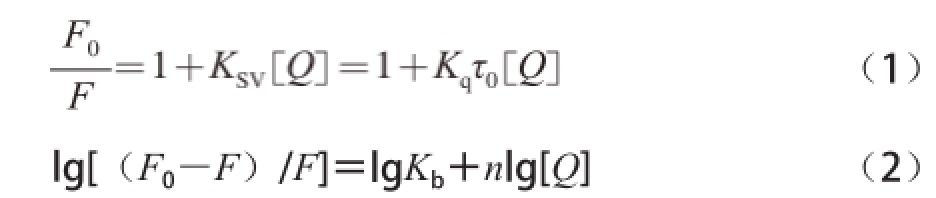
式中:K SV是动态猝灭常数;K q表示扩散碰撞猝灭速率常数;K b为表观静态结合常数;τ 0为猝灭剂不存在时荧光分子的平均寿命,本实验取10 -8s。
将获得的麦角甾醇对BSA的荧光猝灭数据结合浓度[Q]分别作Stern-Volmer拟合和Perrin拟合,得拟合图4和图5,获得K SV和K b,见表1。

图4 4 F
0/F与Q的Stern-Volmer拟合图er
Fig.4 Stern-Volmer plots of ergosterol with BSA at different temperatures

图5 lgg [(F
0-F)//F]与llggQ的Perriinn拟合图
Fig.5 Perrin plots of ergosterol with BSA at different temperatures
分析两 图并计算得出:K q值远大于各类猝灭剂对生物大分子的最大扩散猝灭常数2.0×10 -10L/(mol·s)。由此可以初步证明其过程为静态猝灭。再者,由表1可知,随温度升高猝灭常数减小,而若是动态猝灭,温度升高将增大扩散系数,导致猝灭常数增大,因此进一步断定是静态猝灭,即温度升高可引起复合物的稳定性下降,使猝灭常数减小,由此可知动态碰撞不是引起BSA荧光猝灭的主要原因,麦角甾醇对BSA的猝灭主要是静态猝灭 [21-22],温度对猝灭和结合常数的影响很小,说明化合物与蛋白质相互作用时形成稳定复合物而不是相互碰撞来实现荧光猝灭。
表1 麦角甾醇与BSA分子的结合常数K
b及结合位点数n
Table 1 Binding constants (K
b) and binding sites (n) of ergosterol with BSAA
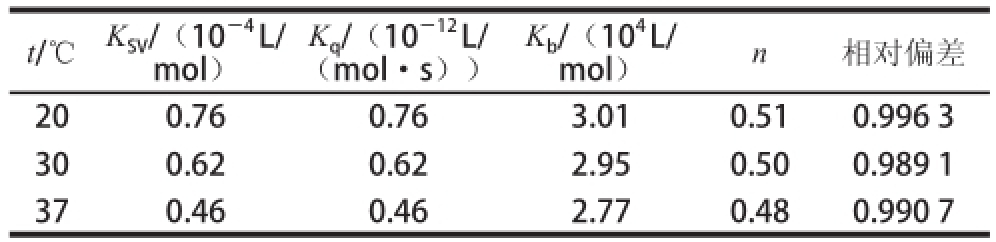
t/℃ K SV/(10 -4L/ mol)K q/(10 -12L/(mol·s))K b/(10 4L/ mol) n 相对偏差20 0.76 0.76 3.01 0.51 0.996 3 30 0.62 0.62 2.95 0.50 0.989 1 37 0.46 0.46 2.77 0.48 0.990 7
麦角甾醇与BSA的相互作用类型为静态猝灭,其表观结合常数K b以及结合位点数n可用静态猝灭公式(2)来计算。处理实验数据,以lg[(F 0-F)/F]对lg[Q]作图可得一直线(图5),由直线斜率和截距求出麦角甾醇与BSA分子的结合常数K b及结合位点数n,结果见表1。在不同温度下结合常数均比较大,说明麦角甾醇可以被蛋白质所贮运和运输。温度对麦角甾醇与BSA的结合常数有轻微影响,随着温度升高结合常数有所降低,但是温度对药物的结合位点数几乎没有影响。
2.1.2 荧光猝灭过程中热力学函数的变化与作用力类型的判断
蛋白质等生物大分子和活性小分子之间常常借助静电作用力、疏水作用力、氢键、范德华力等非共价作用力形成类似超分子的复合物。不同小分子与蛋白质间的主要作用力类型不一样,根据相互作用的热力学参数,Ross等 [23]总结出判断生物大分子与小分子结合性质的热力学规律:若ΔH>0及ΔS>0时,主要表现为疏水作用;若ΔH<0及ΔS>0,主要表现为静电作用;ΔH<0及ΔS<0,主要表现为氢键或范德华力作用。而对于水溶液中的相互作用,ΔS>0就可认为是疏水作用,通常水溶液中有离子间的静电作用使得ΔH<0。小分子与蛋白质之间的热力学参数可通过公式(3)~(5)求算,结果见表2。
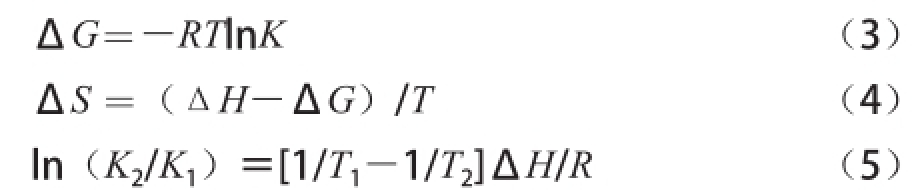
式中:K 1、K 2为不同温度时麦角甾醇与蛋白的结合常数;ΔG为吉布斯自由能/(kJ/mol);ΔH为焓变/(kJ/mol);ΔS为熵变/(kJ/(mol·K))。
根据不同温度下的K值,可求得ΔH、ΔG和ΔS值,结果见表2。
表2 不同温度下麦角甾醇与BSA作用的热力学参数
Table 2 Thermodynamic parameters of the interaction between ergosterol and BSA at different temperatures

T/K ΔH/(kJ/mol) ΔG/(kJ/mol) ΔS/(kJ/(mol·K))293-25.72 64.48 303 -25.93 64.98 310 -26.36 64.90 -6.24
由于BSA结构复杂,所以它和小分子结合时并不是单一的作用力,而是几种作用力共同作用。麦角甾醇与BSA结合过程的ΔH<0,ΔG<0,ΔS>0,表明两者的作用过程是一个熵增加、吉布斯自由能降低的自发过程。麦角甾醇只有一个亲水性的羟基,其余部分均为疏水性,因此麦角甾醇分子自发嵌入到BSA分子的疏水腔内部,该过程ΔS>0。因为ΔH对ΔG的贡献相对较小,所以熵增加是麦角甾醇与BSA自发分子作用过程共同的主要驱动力,即相互作用的主要类型是疏水相互作用。即麦角甾醇与BSA之间以疏水相互作用作用为主,还包括静电相互作用和偶极-偶极相互作用等。
2.2 麦角甾醇与BSA相互作用的分子对接研究
2.2.1 麦角甾醇与BSA的作用位点及结合模式
运用分子对接进行结合位点扫描,发现麦角甾醇可以与BSA相结合,并得到了它们的结合位点,如图2所示,结合位点处麦角甾醇都被疏水性残基包围在一个疏水性的结合口袋中,这一结合口袋正好可以容纳麦角甾醇分子,在结合口袋中麦角甾醇采取最低能量构象与BSA结合。
麦角甾醇分子非极性较强,只有一个极性的羟基在分子的一端,因此结合时以非极性相互作用为主,即主要以疏水相互作用与BSA相结合。通过分子对接操作,得到了麦角甾醇与BSA的结合模式,如图6所示。将结合口袋用网格线表示,麦角甾醇分子用球棍模型展示,BSA中与麦角甾醇有强烈疏水相互作用的氨基酸残基侧链用线型显示。这些相互作用的氨基酸残基包括9 个非极性的氨基酸,即V575、V551、A527、F501、F506、F508、F550、M547 和L531,还包括T578、K524和Y400这3 个极性氨基酸,但这3 个极性氨基酸与麦角甾醇的相互作用也是通过非极性碳链部分的结合实现的。因此麦角甾醇被包裹在一个疏水性的结合口袋中,结合非常稳定。图7展示了麦角甾醇5 .以内氨基酸残基的疏水性表面,为了强调疏水性表面,带状结构表示蛋白质的长链,图中表面颜色从深色到浅色转变表明疏水性逐渐增强亲水性逐渐减弱,可以看出麦角甾醇基本处在一个由浅色组成的结合口袋中,也就是疏水性的结合口袋,其周围氨基酸大部分都是疏水性强的氨基酸残基。图7中仅仅展示了一侧的疏水表面,其实在另一侧也是疏水性的,为便于观察,图中只显示了一半的疏水表面。

图6 麦角甾醇与BSA的相互作用模式及结合口袋
Fig.6 Binding mode and binding pocket of ergosterol on BSA

图7 麦角甾醇周围5 .以内氨基酸残基的疏水表面
Fig.7 Hydrophobic surface of the surrounding residues within 5 .
2.2.2 麦角甾醇与BSA相结合的能量效应
通过分子对接结果的分析,得到麦角甾醇与BSA相结合时体系发生了能量的变化,其中结合自由能ΔG为-38.14 kJ/mol,说明麦角甾醇与BSA的结合非常牢固,即麦角甾醇可以通过与BSA的结合而被输送到身体的各个部位。而荧光光谱中计算得到的结合自由能ΔG为-25.72 kJ/mol (293 K),比用分子对接方法得到的ΔG高一些,这可能是因为分子对接操作中,选取了能量最低的那种结合模式进行分析,这是一种理想的状态;而在实验中,尽管能量最低的结合最稳定,但要每种结合都达到最低能量结合是不可能的,其中会有很多种的结合模式,当然这些结合模式的能量较理想状态高,实验得到这些复杂结合模式所表现的统计结果,因此实验结果较理论计算的结果高。
本实验用荧光光谱法分析了麦角甾醇与BSA的相互作用,得出了两者之间发生荧光静态猝灭;通过对两者结合常数与结合位点数的计算得出麦角甾醇能够被蛋白质贮存和运输;进一步计算不同温度下热力学常数的变化,确定了两者之间的作用力类型以疏水性相互作用为主,ΔH<0,ΔG<0,ΔS>0,而且结合自由能较低(-25.72 kJ/mol,293 K)。
应用分子对接方法考察了麦角甾醇在BSA上的结合位点及结合模式,发现麦角甾醇与BSA主要以疏水相互作用结合在一起,结合位点处为一疏水性口袋,麦角甾醇周围主要以疏水性氨基酸残基为主,该结合模式非常牢固,结合自由能为-38.14 kJ/mol,由于在分子对接中仅仅选择能量最低的那种理想的结合模式,因此较实验得到结果要低。
由以上结果可知:分子荧光光谱的实验结果和分子对接得到的理论结果相一致,证实了麦角甾醇与BSA能够相互结合,结合自由能较低,结合过程可以自发进行,这样有利于麦角甾醇在生物体内的携带和运输,它们之间的相互作用主要为疏水相互作用,结合空腔为疏水性的结合口袋。
参考文献:
[1] YASUKAWA K, AOKI T, TAKIDO M, et al. Inhibitory effects of ergosterol isolated from the edible mushroom Hypsizigus marmoreus on TPA-induced inflammatory ear oedema and tumour promotion in mice[J]. Phytotherapy Research, 1994, 8(1): 10-13.
[2] YAZAWA Y, YOKOTA M, SUGIYAMA K. Antitumor promoting effect of an active component of Polyporus, ergosterol and related compounds on rat urinary bladder carcinogenesis in a short-term test with concanavalin A[J]. Biological and Pharmaceutical Bulletin, 2000,23(11): 1298-1302.
[3] ZHANG Y, MILLS G L, NAIR M G. Cyclooxygenase inhibitory and antioxidant compounds from the mycelia of the edible mushroom Grifola frondosa[J]. Journal of Agricultural and Food Chemistry,2002, 50(26): 7581-7585.
[4] SUBBIAH M T, ABPLANALP W. Ergosterol (major sterol of baker's and brewer's yeast extracts) inhibits the growth of human breast cancer cells in vitro and the potential role of its oxidation products[J]. International Journal for Vitamin and Nutrition Research, 2003, 73(1):19-23.
[5] KOBORI M, YOSHIDA M, OHNISHI-KAMEYAMA M, et al. Ergosterol peroxide from an edible mushroom suppresses inflammatory responses in RAW264.7 macrophages and growth of HT29 colon adenocarcinoma cells[J]. British Journal of Pharmacology, 2007,150(2): 209-219.
[6] HETLAND G, JOHNSON E, LYBERG T, et al. Effects of the medicinal mushroom Agaricus blazei Murill on immunity, infection and cancer[J]. Scandinavian Journal of Immunology, 2008, 68(4):363-370.
[7] 冯娜, 张劲松, 唐庆九, 等. 毛头鬼伞子实体中甾类化合物的结构鉴定及其抑制肿瘤细胞增殖活性的研究[J]. 菌物学报, 2010, 29(2):249-253.
[8] 崔建国, 曾陇梅, 苏镜娱, 等. 多羟基甾醇的合成及其结构与抗肿瘤细胞活性关系研究[J]. 高等学校化学学报, 2000, 21(9): 1399-1404.
[9] 高虹, 史德芳, 杨德, 等. 巴西菇 麦角甾醇抗肿瘤活性及作用机理初探[J]. 中国食用菌, 2011, 30(6): 35-39.
[10] 苏日古格, 包海鹰, 图力古尔, 等. 蒙古口蘑子实体的抗肿瘤活性[J].食品科学, 2012, 33(21): 280-284.
[11] ZAN L, BAO H, BAU T, et al. An antitumor component from Fomitiporia ellipsoidea[J]. Journal of Microbiology and Biotechnology, 2012, 22(11): 1482-1485.
[12] DING Y, BAO H, BAU T, et al. Antitumor components from Naematoloma fasciculare[J]. Journal of Microbiology and Biotechnology, 2009, 19(10): 1135-1138.
[13] GELAMO E, SILVA C, IMASATO H, et al. Interaction of bovine(BSA) and human (HSA) serum albumins with ionic surfactants:spectroscopy and modelling[J]. Biochimica et Biophysica Acta, 2002,1594(1): 84-99.
[14] BUJACZ A. Structures of bovine, equine and leporine serum albumin[J]. Acta Crystallographica Section D, 2012, 68(10): 1278-1289.
[15] CUKUROGLU E, ENGIN H B, GURSOY A, et al. Hot spots in protein-protein interfaces: towards drug discovery[J]. Progress in Biophysics and Molecular Biology, 2014, 116(2): 165-173.
[16] ANGUIZOLA J, JOSEPH K S, BARNABY O S, et al. Development of affinity microcolumns for drug-protein binding studies in personalized medicine: interactions of sulfonylurea drugs with in vivo glycated human serum albumin[J]. Analytical Chemistry, 2013, 85(9):4453-4460.
[17] PETTERSEN E, GODDARD T, HUANG C, et al. UCSF chimera: a visualization system for exploratory research and analysis[J]. Journal of Computational Chemistry, 2004, 25(13): 1605-1612.
[18] LINDAHL E, HESS B, van der SPOEL D. GROMACS 3.0: a package for molecular simulation and trajectory analysis[J]. Journal of Molecular Modeling, 2001, 7(8): 306-317.
[19] MORRIS G, GOODSELL D, HALLIDAY R, et al. Automated docking using a Lamarckian genetic algorithm and an empirical binding free energy function[J]. Journal of Computational Chemistry,1998, 19(14): 1639-1662.
[20] 陈国珍, 黄贤智, 郑朱梓, 等. 荧光分析方法[M]. 北京: 科学出版社,1990: 112-119.
[21] 姚慧芳, 景浩. 笃斯越橘花青素与牛血清白蛋白的相互作用[J]. 食品科学, 2013, 34(23): 6-10. doi: 10.7506/spkx1002-6630-201323002.
[22] XIE Mengxia, LONG Mei, LIU Yuan, et al. Characterization of the interaction between human serum albumin and morin[J]. Biochimica et Biophysica Acta (BBA) - General Subjects, 2006, 1760(8): 1184-1191.
[23] ROSS P D, SUBRAMANIAN S. Thermodynamics of protein association reactions: forces contributing to stability[J]. Biochemistry,1981, 20(11): 3096-3102.
Studies on the Interaction of Ergosterol with Bovine Serum Albumin (BSA) by Fluorescence Spectroscopy and Molecular Docking
ZHANG Rui
1, WU Chaoyi
2, LIU Yu
1, YANG Shude
1, CHENG Xianhao
1
(1. Shandong Key Laboratory of Edible Mushroom Technology, School of Agriculture, Ludong University, Yantai 264025, China;2. College of Chemistry and Chemical Engineering, Hunan University, Changsha 410012, China)
Abstract:The interaction of ergosterol with bovine serum albumin (BSA) was investigated by fluorescence spectroscopy and molecular docking. The fluorescence spectral results showed that BSA fluorescence was quenched regularly with the addition of ergosterol; the quenching mechanism may be a static fluorescence quenching process; the thermodynamic parameters calculated by Van't Hoff equation indicated the major role of hydrophobic interaction in the binding process. Consistent results were obtained from the molecular docking. Hydrophobic interaction was the major interaction, and the binding site of ergosterol on BSA was in a hydrophobic binding pocket, and the binding was a spontaneous process. In addition, the detailed binding mode of ergosterol and the conformation of the surrounding residues were shown in docking results.
Key words:ergosterol; bovine serum albumin (BSA); fluorescence quenching; molecular docking; binding site
中图分类号:Q548.3
文献标志码:A
文章编号:1002-6630(2015)23-0038-05
doi:10.7506/spkx1002-6630-201523008
收稿日期:2015-01-08
基金项目:国家自然科学基金青年科学基金项目(31200048;31300013);山东省优秀中青年科学家奖励基金项目(BS2011SW002)
作者简介:张蕊(1978—),女,副教授,博士,主要从事菌物化学研究。E-mail:zhlrui@163.com