徐兰英 1,赵 辉 2,张 婷 1,吴 伦 1,龙 涛 1,*,李士明 1,*
(1.黄冈师范学院化工学院,催化材料制备及应用湖北省重点实验室,湖北 黄冈 438000;2.天津商业大学生物技术与食品科学学院,天津市食品生物技术 重点实验室,天津 300134)
摘 要:通过分离纯化及改性得到橘皮素和5-去甲氧基橘皮素,并研究其对人体肝星状细胞株LX-2的抑制作用。通过无水乙醇提取、氯仿萃取从陈皮中得到多甲基黄酮混合物,再以不同浓度的乙酸乙酯和石油醚的混合液为洗脱剂,采用硅胶柱层析分离纯化多甲基黄酮混合物,得到橘皮素纯品。将橘皮素置于盐酸乙醇溶液中回流,对所得产物进行纯化即可得5-去甲氧基橘皮素,采用质谱和核磁共振谱进行结构确证。利用人体肝星状细胞株LX-2细胞作为工具细胞,研究其生物活性。结果表明,5-去甲氧基橘皮素在12.5 μmol/L条件下对人肝星状细胞株LX- 2的抑制率即可达到50%,而橘皮素需要在近150 μmol/L条件 下才能达到50%的抑制率,即改性后的橘皮 素对人体肝细胞的抑制有效率增加了10 倍以上。
关键词:橘皮素;5-去甲氧基橘皮素;多甲氧基黄酮;肝星状细胞LX-2
我国是肝病大国,近年来的疾病谱变化表明,随着生活水平的提高,除了肝炎病毒外,酒精和非健康饮食所致的肝纤维化日趋增加,严重威胁到人们的健康 [1]。肝纤维化是包括酒精、肝炎病毒、高脂饮食、自体免疫等多种慢性肝脏炎症性损伤的共同结局,近年来的研究证明,这些慢性炎症刺激之所以会殊途同归,导致肝纤维化,是因为它们具有共同的生物学基础:激活NF-κB信号,导致肝星状细胞(hepatic stellate cells,HSCs)活化和增殖 [2-3]。因此,要解决肝纤维化,必须控制HSCs增殖与活化 [4-5]。
陈皮为芸香科植物橘及其栽培变种的干燥成熟果皮,从中医 理论上来看,陈皮具有 肝升肺降功效,使机体气机条达,血气冲和而运行流畅。例如经典的“陈皮二红饮”和“丹参陈皮 膏”等都是治疗气滞血瘀型脂肪肝的良方。目前研究表明陈皮中主要活性物质有挥发油中的萜 烯类化合物 [6-7]、多羟基黄酮化合物 [8-11]、多甲氧基黄酮以及羟基多甲氧基黄酮 [12-19],其中橘皮素、川陈皮素和3,5,6,7,8,3',4'-七甲氧基黄酮等多甲氧基黄酮是橘皮的特有成分 [20-25]。
本实验以陈皮为原料,首先通过无水乙醇提取、氯仿萃取得到多甲基黄酮混合物,再采用硅胶柱层析法,以乙酸乙酯-石油醚为淋洗液,分离纯化得到橘皮素纯品,并对其进行改性得到5-去甲氧基橘皮素。探讨了橘皮素和5-去甲氧基橘皮素对人肝星状细胞株LX-2的抑制作用,为陈皮膳食防治肝纤维化提供实验基础和理论依据。
1.1 材料、菌株与试剂
陈皮购于黄州百联大药房。
人体肝星状细胞株LX-2由北京友谊医院白志刚教授赠送。
无水乙醇、三氯甲烷、石油醚、乙酸乙酯、浓盐酸(分析纯)、乙腈(色谱纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
CCA-20低温冷却水循环泵、SHZ-DⅢ 循环水真空泵巩义市予 华仪器有限责任公司;RE-52AA旋转蒸发仪上海亚荣生化仪器厂;LC-20型高效液相色谱(high performance liquid chromatograpy,HPLC)仪 日本岛津公司;5975C型气相色谱-质谱(gas chromatograpymass spectrometry,GC-MS)联用仪 美国Agilent公司;Mercury 300型核磁共振波谱(nuclear magnetic resonance,NMR)仪 美国瓦里安公司。
1.3 方法
1.3.1 色谱分离条件
HPLC条件:Spelco RP-Amide液相色谱柱(150 mm×4.6 mm,3 μm);流动相:乙腈-水,梯度:0~15 min,40%~55%乙腈;15~2 0 min,55%~70%乙腈;20~25 min,70%~80%乙腈;25~30 min,80%~40%乙腈;流速:1.0 mL/min; 柱温:35 ℃;检测波长:326 nm;进样量:20 μL。
GC-MS条件:HP-5MS毛细管柱(30 m×0.25 mm,0.25 μm);载气为高纯氦气,柱流速1 mL/min,进样口温度280 ℃,分流比50∶1;起始温度60 ℃,以50 ℃/min速率升温至260 ℃,保持40 min;进样体积1 μL,质谱离子扫描范围为m/z 50~550。
1.3.2 核磁共振波谱条件
核磁共振氢谱频率为300 MHz,以四甲基硅烷为内标,采用氘代二甲基亚砜(dimethyl sulphoxide,DMSO)作为溶剂,室温下对橘皮素和5-去甲氧基橘皮素进行检测。
1.3.3 橘皮素的提取分离
提取:取一定量无水乙醇与陈皮粉末,用乙醇提取陈皮中的物质,再将乙醇溶液过滤,将得到的溶液用旋转蒸发仪蒸为稠状物。
萃取:将稠状物用适量的蒸馏水溶解,再加入等体积萃取剂氯仿,猛烈振荡数分钟,静置24 h,取下层液,蒸干,得多甲基黄酮混合物。
装柱:取0.4 g黄酮类化合物提取物溶于少量二氯甲烷。称取一定量200~300 目的硅胶于烧杯中,加入适量石油醚,搅拌,以湿法装柱,装入4×30 层析柱中,柱高15 cm,再加入适量海沙,硅胶和海沙表面均要保持水平,待到石油醚液面到达海沙表面时,缓慢滴加黄酮粗提取物溶液。
洗脱:待该溶液完全流入石油醚后,首先用2 倍柱体积乙酸乙酯-石油醚(35∶65,V/V)溶液进行洗脱,当洗脱液面接近海砂表面时,改用乙酸乙酯-石油醚(40∶60,V/V)溶液进行洗脱,每12 mL收集,标号,依次为1、2、3、4、5……直至接完3 个柱体积洗脱液。
检测:分别将样品瓶中的溶液旋蒸,将得到的固体物质用无水甲醇定容至10 mL,用HPLC进行检测。
1.3.4 5-去甲氧基橘皮素的制备
取20 mg橘皮素于100 mL圆底烧瓶中,加入20 mL浓盐酸-乙醇(20∶80,V/V)溶液,加热回流24 h后进行旋蒸,得到金黄色固体。
将上述固体用50 mL乙酸乙酯-水(1∶1,V/V)溶液溶解,将溶液转移至分液漏斗,静置,溶液分层。取上层溶液,加入20 mL水,振荡分液漏斗,使溶液充分混合,静置,取上层溶液。
将上述溶液旋蒸得到固体物,用无水乙醇溶解并定容至100 mL。
1.3.5 橘皮素对人体肝星状细胞LX-2的抑制
人体肝星状细胞LX-2的培养条件为DMEM培养基,10%~15%的胎牛血清,青链霉素双抗和1 00 nmol/L的胰岛素。将分离得到的橘皮素及改性得到的5-去甲基橘皮素单体溶于DMEM完全培养基,浓度递增模式(对照、0.5、1、5、10、 25、50 μmol/L)作用于96 孔板和6 孔板培养的LX-2细胞。
1.3.6 噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT)法检测细胞抑制率
对于96 孔板培养的细胞,以MTT法检测LX-2细胞增殖。具体方法为:1)每孔加入10 μL MTT溶液(5 mg/mL),继续培养4 h。若药物与MTT反应,可先离心、弃去培养液,用磷酸缓冲盐溶液(phosphate buffer saline,PBS)小心冲洗2~3 遍后,再加入含MTT的培养液。2)去掉每孔的液体(尽量手法一致,减少结晶的损失),加入150 μL DMSO,置摇床上低速振荡10 min,使结晶物充分溶解;在酶标仪490 nm波长处测量各孔的光密度值,细胞抑制率计算公式如下。
2.1 硅胶柱色谱分离多甲氧基黄酮
实验发现第6、7号样品均可以得到保留时间为13.3 min的物质,并且几乎只有单一的峰,用面积归一化法计算发现含量均大于99%。图1为第7号样品的HPLC图,可以看出第7号样品溶液中几乎只有一种物质峰。取该样品进行GC-MS检测,结果见图2,其分子离子峰为372.0,和橘皮素一致,可以证实分离得到的物质为橘皮素。 1H-NMR 数据: 1H-NMR(DMSO-d 6):δ 8.008(d,J = 9 Hz, 2H, H-2', H-6')、7.145(d, J = 9 Hz, 2H, H-3',H-5')、6.780(s, 1H, H-3)、4.025 (s, 3H, OCH 3)、3.965(s, 3H, OCH 3)、3.859(s, 3H, OCH 3)、3.840(s,3H, OCH 3)、3.780(s, 3H, OCH 3)。
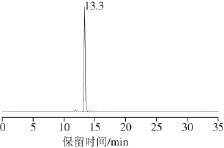
图1 第7号样品HPLC图Fig.1 HPLC of sample 7
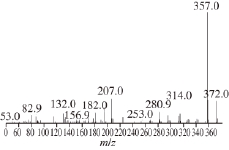
图2 第7号样品GC-MMSS图
Fig.2 GC-MS profile of sample 7
2.2 5-去甲基橘皮素的制备
图3为橘皮素回流反应24 h后的HPLC图,从图中可以看出,保留时间为13.3 min的橘皮素已基本消失,保留时间为20.5 min处出现新的色谱峰,采用面积归一化法得其纯度达99.5%。取该样品同时进行GC-MS和 1H-NMR检测,GC-MS结果如图4所示,其分子离子峰为358.1,和5-去甲基橘皮素一致,证实制备得到的物质为5-去甲基橘皮素。 1H-NMR数据: 1H-NMR(DMSO-d 6):δ 13.028(s, 1H, 5OH)、8.350(d, J = 9 Hz, 2H, H-2', H-6')、7.451(d, J = 9 Hz, 2H, H3', H5')、7.287(s, 1H, H-3)、4.310(s, 3H, OCH 3)、4.205(s, 3H, OCH 3)、4.153(s,3H, OCH 3)、4.105(s, 3H, OCH 3)。

图3 5-去甲氧基橘皮素HPLC图
Fig.3 HPLC of 5-demethyltangeretin

图4 5-去甲氧基橘皮素GC-MMSS图
Fig.4 GC-MS profile of 5-demethyltangeretin
2.3 橘皮素及5-去甲氧基橘皮素对人体肝星状细胞LX-2的抑制
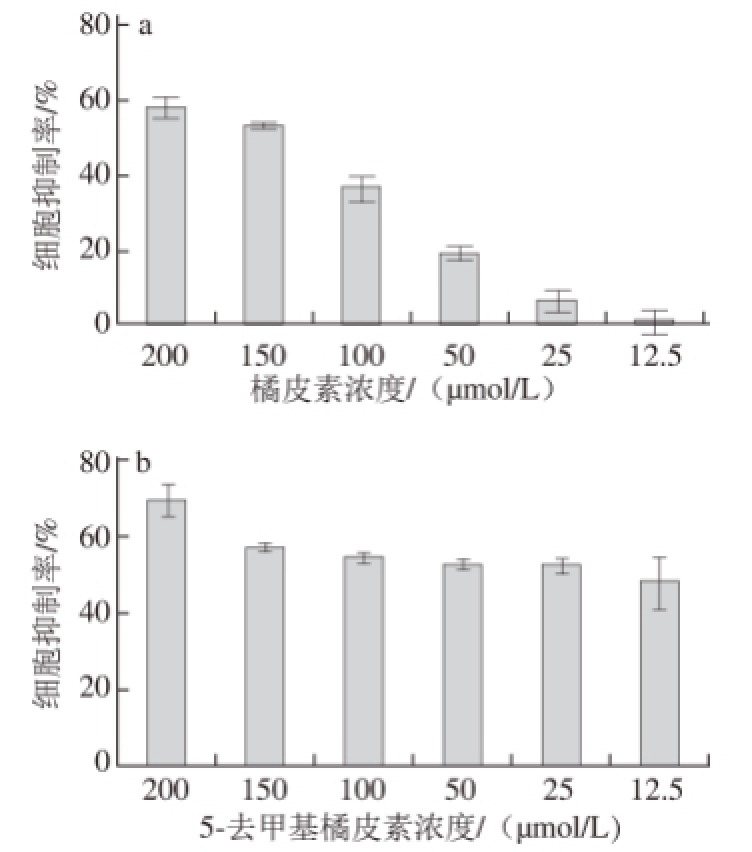
图5 橘皮素及5-去甲氧基橘皮素对人体肝星状细胞LX-2的抑制率
Fig.5 Inhibitory effect of tangeretin a nd 5-demethyltangeretin on human hepatic stellate cell LX-2
由图5可知,橘皮素和5去甲基橘皮素均可以剂量梯度递增性抑制LX-2细胞增殖,但是5-去甲基橘皮素在12.5 μmol/L条件下即可接近达到50%的抑制率,而橘皮素需要在近150 μmol/L条件下才能达到50%的抑制率。改性后的橘皮素对人体肝细胞的抑制有效率增加了10 倍以上。图6是橘皮素和5-去甲基橘皮素在25 μmol/L条件下的细胞生长情况图,显微镜下可见5-去甲基橘皮素显著抑制了LX2细胞生长。

图6 橘皮素(a)及5-去甲氧基橘皮素(b)在2255 μmmooll/L的浓度下对人体肝星状细胞LX-2生长的影响
Fig.6 Growth inhibition of tangeretin (a) and 5-demethyltangeretin (b)on human hepatic stellate cell LX-2
以药食两用中药陈皮为原料,通过无水乙醇粗提,氯仿萃取纯化得到多甲基黄酮混合物,用硅胶柱层析,分别以乙酸乙酯-石油醚(35∶65,V/V)溶液及乙酸乙酯-石油醚(40∶60,V/V)溶液进行梯度洗脱,得到纯度大于99%的橘皮素纯品。将橘皮素在浓盐酸-乙醇(20∶80,V/V)溶液中回流反应,得到纯度大于99%的5-去甲氧基橘皮素。改性得到的5-去甲基橘皮素比橘皮素对人体肝星状细胞株LX-2的抑制作用更强,12.5 μmol/L的5-去甲氧基橘皮素抑制率即可达到50%,而橘皮素却需要150 μmol/L。
参考文献:
[1] FARRELL G C, WONG V W, CHITTURI S. NAFLD in Asiaas common and important as in the West[J]. Natural Reviews. Gastroenterology and Hepatology, 2013, 10(5): 307-318.
[2] MANN D A, SMART D E. Transcriptional regulation of hepatic stellate cell activation[J]. Gut, 2002, 50(6): 891-896.
[3] PRADERE J P, KLUWE J, de MINICIS S, et al. Hepatic macrophages but not dendritic cells contribute to liver fibrosis by promoting the survival of activated hepatic stellate cells in mice[J]. Hepatology,2013, 58(4): 1461-1473.
[4] YIN Chunyue, EVASON K J, ASAHINA K, et al. Hepatic stellate cells in liver development, regeneration, and cancer[J]. The Journal of Clinical Investigation, 2013, 123(5): 1902-1910.
[5] TACKE F, WEISKIRCHEN R. Update on hepatic stellate cells:pathogenic role in liver fibrosis and novel isolation techniques[J]. Expert Review. Gastroenterology and Hepatology, 2012, 6(1): 67-80.
[6] 严寒静, 房志坚, 黄宁, 等. 中药陈皮挥发油的成分分析[J]. 广东药学, 2001,11(1): 17-18.
[7] 张志海, 王彩云, 杨天鸣, 等. 陈皮的化学成分及药理作用研究进展[J].西北药学杂志, 2005, 20(1): 47-48.
[8] 信维平, 孙建华, 祁宏. 陈皮中陈皮甙的提取和应用的研究[J]. 食品研究与开发, 2006, 27(1): 23-24.
[9] PETERSON J J, DWYER J T, BEECHER G R, et al. Flavanones in oranges, tangerines (mandarins), tangors, and tan gelos: a compilation and review of the data from the analytical literature[J]. Journal of Food Composition and Analysis, 2006, 19: S66-S73.
[10] ASSINI J M, MULVIHILL E E, HUFF M W. Citrus flavonoids and lipid metabolism[J]. Current Opinion in Lipidology, 2013, 24(1): 34-40.
[11] LEVAJ B, DRAGOVIC_UZELAC V, KOVACEVIC D B, et al. Determination of Flavonoids in pulp and peel of mandarin fruits[J]. Agriculturae Conspectus Scientificus, 2009, 74(3): 221-225.
[12] LI Shiming, LO C Y, HO C T. Hydroxylated polymethoxyflavones and methylated flavonoids in sweet orange (Citrus sinensis) peel[J]. Journal of Agricultural and Food Chemistry, 200 6, 54(12): 4176-4185.
[13] LI Shiming, YU Haiqing, HO C T. Nobiletin: efficient and large quantity isolation from orange peel extract[J]. Biomedical Chromatography, 2006, 20(1): 133-138.
[14] WANG Zhenyu, LI Shiming, FERGUSON S, et al. Validated reversed phase LC method for quantitative analysis of polymethoxyflavones in citrus peel extracts[J]. Journal of Separation Science, 2008, 31(1): 30-37.
[15] SUN Yinshi, WANG Jianhua, GU Shubo, et al. Simultaneous determination of flavonoids in different parts of Citrus reticulata Chachi fruit by high performance liquid chromatography-photodiode array detection[J]. Molecules. 2010, 15: 5378-5388.
[16] LI Shiming, WANG Yu, WANG Zhengyu, et al. Quantitative analysis of hydroxylated polymethoxyflavones by high-performance liquid chromatography[J]. Biomedical Chromatography, 2010, 24(8): 838-845.
[17] 王华, 任廷远, 安玉红. 超声波辅助乙醇提取柑橘皮渣发酵液总黄酮工艺研究[J]. 食品科学, 2009, 30(24): 206-212.
[18] 麻明友, 刘建本, 吴显明, 等. 超声微波双辅助提取柑橘皮总黄酮的研究[J]. 食品科学, 2010, 31(20): 266-269.
[19] 黄明发, 苏学素, 焦必宁, 等. 柑橘多甲氧基黄酮的检测及分离纯化技术研究进展[J]. 食品科学, 2009, 30(1): 275-281.
[20] 罗世坤, 王家欢, 徐兰英, 等. 陈皮中川陈皮素的提取分离及改性[J]. 食品科学, 2014, 35(24): 20-23. doi: 10.7506/spkx1002-6630-201424004.
[21] 邱培菊. 5-羟基多甲氧基黄酮抗结肠癌活性及其分子机制研究[D].青岛: 中国海洋大学, 2010.
[22] LI Shiming, WANG Hong, GUO Liming, et al. Chemistry and b ioactivity of nobiletin and its metabolites[J]. Journal of Functional Foods, 2014, 6(1): 2-10.
[23] CHOI Y, KIM Y, HAM H, et al. Nobiletin suppresses adipogenesis by regulating the expression of adipogenic transcription factors and the activation of AMP-activated protein kinase (AMPK)[J]. Journal of Agricultural and Food Chemistry, 2011, 59(24): 12843-12849.
[24] MIYATA Y, OSHITARI T, OKUYAMA Y, et al. Polymethoxy flavones as agents that prevent formation of cataract: nobiletin congeners show potent growth inhibitory effects in human lens epithelial cells[J]. Bioorganic & Medicinal Chemistry Letters, 2012,23(1): 183-187.
[25] ONDA K, HORIKE N, SUZUKII T, et al. Polymethoxy flavonoids tangeretin and nobiletin increase glucose uptake in murine adipocytes[J]. Phytotherapy Research, 2013, 27(2): 312-316.
Isolation and 5-Demethylation of Tangertin from Chen-Pi and Their Inhibitory Effect on Hepatic Stellate Cell LX-2
XU Lanying
1, ZHAO Hui
2, ZHANG Ting
1, WU Lun
1, LONG Tao
1,*, LI Shiming
1,*
(1. Hubei Key Laboratory for Processing and Application of Catalytic Materials, College of Chemical Technology, Huanggang Normal University, Huanggang 438000, China; 2. Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Abstract:An efficient and large-scale isolation method for tangeretin from Chen-Pi (aged tangerine peels) has been developed successfully. The transformation of tangeretin to 5-demethyltangeretin was performed in acidified alcohol solution with high conversion efficiency. The structures of both isolated tangeretin and 5-demethyltangeretin were confirmed by MS and 1H NMR. Both compounds exhibited strong inhibitory activity against LX-2 human hepatic stellate cells, with an IC 50of 150 μmol/L for tangeretin and 12.5 μmol/L for 5-demethyltangeretin, indicating the increased potency via the conversion from tangeretin to 5-demethyltangeretin.
Key words:tanger etin; 5-demethyltangeretin; polymethoxyflavones; hepatic stellate cell LX-2
中图分类号:O6.332
文献标志码:A
文章编号:1002-6630(2015)23-0043-04
doi:10.7506/spkx1002-6630-201523009
收稿日期:2015-06-30
基金项目:国家自然科学基金青年科学基金项目(21205046);湖北省科技厅对外合作项目(2014BHE036);经济林木种质改良与资源综合利用湖北省重点实验室开放基金项目(2013001603)
作者简介:徐兰英(1978—),女,副教授,博士,研究方向为分离科学。E-mail:xuly@hgnu.edu.cn
*通信作者:龙涛(1979—),男,副教授,博士,研究方向为天然产物化学。E-mail:longtao@hgnu.edu.cn李士明(1963—),男,教授,博士,研究方向为天然产物化学。E-mail:Shiming3702@gmail.com