肖 枫,朱文学*,康怀彬,刘莉丽,贺家亮,任国艳
(河南科技大学食品与生物工程学院,河南 洛阳 471023)
摘 要:为探索黄河鲤鱼鳞明胶在体内的消化特性,在37 ℃条件下,先采用胃蛋白酶对黄河鲤鱼鳞明胶酶解2 h(pH 2.0),随后调整pH值至7.5,采用胰蛋白酶对其酶解2 h,考察黄河鲤鱼鳞明胶在模拟消化过程中的水解度变化规律。采用体外抗氧化模型考察了黄河鲤鱼鳞明胶在模拟消化过程中的羟自由基清除能力、超氧阴离子自由基清除能力、1,1-二苯基-2-三硝基苯肼自由基的清除能力、总还原力、脂质氧化抑制能力和金属离子螯合能力等抗氧化活性。结果表明,胃蛋白酶对黄河鲤鱼鳞明胶的消化能力较差,对其α链和β链的酶解作用较弱,而胰蛋白酶对黄河鲤鱼鳞明胶肽链有较强的酶解作用,黄河鲤鱼鳞明胶经模拟消化后水解度可达到16.9%,消化产物的抗氧化性能与其消化过程中水解度有较强的相关性。
关键词:黄河鲤鱼鳞;明胶;模拟消化;抗氧化
多种代谢途径都会产生自由基,机体内自由基过多会造成生物大分子的损伤 [1]。食源性抗氧化物质协同内源性抗氧化成分能够有效阻断和消除各种氧化损伤。目前研究者已从多种动植物体中分离出具有抗氧化活性的天然活性物质,包括多糖 [2-3]、多酚类 [4-5]以及蛋白质和多肽 [6-8]类等。现代营养学研究发现,蛋白质消化产物多以小肽而不是游离氨基酸的形式被胃肠道吸收 [9],且肠道对小肽的吸收代谢速率较氨基酸分子更快 [10]。鱼鳞中胶原蛋白含量较为丰富,以鱼鳞提取胶原蛋白或明胶,既能减轻环境污染,又充分利用了鱼鳞资源,达到了淡水鱼的综合利用目的。
采用单酶或复合酶对食物蛋白质进行酶解,可以制备具有各种生物活性的寡肽,研究表明,以多种水产动物蛋白为原料制备的肽类物质具有抗氧化活性,其中,以水产胶原蛋白为原料制备各种生物活性肽已广受关注 [11-14],有关黄河鲤鱼鳞明胶肽的研究尚未见报道。目前,有关胶原或明胶肽的研究主要包括:蛋白质的酶解工艺、生物活性的筛选、目标组分的分离纯化和理化特性等方面,但关于黄河鲤鱼明胶消化性及消化产物的活性方面还未见报道。食源性生物活性肽的活性检测和筛选通常选用体外模型进行实验,但是,目标产物在体内消化系统中可能会发生进一步酶解,从而造成其活性的丧失,使得体外实验的结果与其在体内的活性没有相关性,如果直接采用消化酶模拟消化环境对蛋白质进行酶解,则体外实验检测结果能够反映其在生物体内的作用。本实验以黄河鲤鱼鳞明胶(scale gelatin from the Yellow River carp,YSG)为原料,模拟体内的消化环境,研究消化酶对黄河鲤鱼鳞明胶的消化能力,采用体外抗氧化活性的检测方法研究黄河鲤鱼鳞明胶在模拟消化过 程中消化产物的抗氧化活性,以期为黄河鲤鱼鳞明胶肽的开发提供依据。
1.1 材料、试剂与仪器
黄河鲤鱼鳞明胶 河南科技大学食品学院的专业实验室制备。
胃蛋白酶、胰蛋白酶、1,1-二苯 基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazy,DPPH) 美国Sigma公司;其他试剂均为分析纯。
722N型分光光度计 上海精密科学仪器有限公司;Fs4111型电子分析天平 上海衡平仪器仪表厂;HR152型电热恒温水浴锅 金坛市晶玻实验仪器厂;NS-100B恒温摇床 上海皓庄仪器有限公司。
1.2 方法
1.2.1 黄河鲤鱼鳞明胶的模拟消化
参考You Lijun等 [15]的方法,利用胃蛋白酶和胰蛋白酶模拟胃肠道消化。配制黄河鲤鱼鳞明胶溶液(15 g/L),调pH值至2.0,加入质量浓度4 g/100 mL的胃蛋白酶,37 ℃酶解2 h。然后调节pH 7.5,加入4 g/100 mL的胰蛋白酶,37 ℃酶解2 h。每隔0.5 h取样品测定消化产物的水解度和抗氧化活性。
1.2.2 水解度的测定
采用 茚三酮比色法测定,以被水解的肽键数目占胶原蛋白中总肽键数的百分数来表示明胶的水解度。
式中:h为被裂解的肽键数;H为胶原蛋白的总肽键数。
1.2.3 羟自由基(·OH)清除能力的测定
采用邻二氮菲法测定消化产物的·OH清除能力 [15]。吸取邻二氮菲溶液(5.0 mmol/L)、FeSO 4溶液(5.0 mmol/L)和乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)溶液(15 mmol/L)各600 μL,与400 μL磷酸盐缓冲液(0.2 mol/L,pH 7.4)混合均匀,加入消化液600 μL和0.01%的H 2O 2溶液800 μL,混合液置于37 ℃条件下反应60 min,在536 nm波长处测定混合液的吸光度。按下式计算·OH清除率。
式中:A s为加入样品溶液后的吸光度;A c为对照组(以蒸馏水代替H 2O 2)的吸光度;A 0为空白组(以蒸馏水代替样品液)的吸光度。
1.2.4 超氧阴离子自由基(O 2 -·)清除能力的测定
采用邻苯三酚自氧化法测定消化产物的O 2 -·清除能力 [16]。吸取50 mmol/L的Tris-HCl缓冲液(pH 8.2,含1 mmol/L的EDTA)3 mL,分别加入样品溶液1 mL和浓度为25 mmol/L的邻苯三酚溶液0.5 mL,迅速混合、摇匀,在4 min内,于波长420 nm波长处每隔30 s测定一次反应液的吸光度,计算反应液吸光度的变化率(A s)。以1 mL蒸馏水代替样品,测定空白对照液吸光度的变化率(A c)。按下式计算O 2 -·清除率。
1.2.5 DPPH自由基清除能力的测定
参照文献[15]方法,取一定质量浓度的黄河鲤鱼鳞明胶消化液2 mL,加入0.2 mmol/L DPPH-甲醇溶液2 mL,混合均匀后避光放置30 min,然后测定混合液的吸光度,测定波长为517 nm。同时作空白(相同体积的甲醇和蒸馏水混合)和对照(以蒸馏水代替样品)实验。按下式计算DPPH自由基清除率。
式中:A s为加入样品溶液后的吸光度;A 0为空白液的吸光度。
1.2.6 总还原力的测定
参考You Lijun等 [15]的方法测定黄河鲤鱼鳞明胶消化产物的总还原力,取2.0 mL消化液,添加磷酸盐缓冲溶液(0.2 mol/L,pH 6.6)和铁氰化钾溶液(0.01 g/mL)各2.0 mL,将混合液置于50 ℃温度条件下保持20 min,加入2.0 mL三氯乙酸溶液(0.1 g/mL),混匀后在3 000 r/min的条件下离心10 min。取上清液2 mL,加入0.4 mL FeCl 3溶液(0.01 g/mL)和2 mL蒸馏水,混合均匀,在室温条件下静置10 min,测定该混合液在700 nm波长处的吸光度,以吸光度来反映其总还原力,吸光度越大则表示试样的总还原力越强。
1.2.7 脂质氧化抑制能力的测定
采用硫氰酸铵比色法测定黄河鲤鱼鳞明胶消化产物的脂质氧化抑制率 [15],在50 mL锥形瓶中加入2.0 mL消化液和质量分数2.5%的亚油酸溶液2.0 mL混匀,然后加入4 mL磷酸盐缓冲液(0.05 mol/L,pH 7.0)和2 mL蒸馏水,将反应液置于40 ℃培养箱中保温48 h。亚油酸的氧化测定方法为:将0.1 mL反应液与9.7 mL的75%的乙醇溶液混合,再添加30 g/100 mL的硫氰酸铵和0.02 mol/L FeCl 2溶液各0.1 mL,充分混匀,3 min后测定混合液在500 nm波长处的吸光度。用相同体积蒸馏水代替反应液作为空白。按下式计算脂质氧化抑制率。
式中:A s, 48 h为消化液在反应48 h的吸光度;A s, 0 h为消化液在反应0 h的吸光度;A 0, 48 h为未加样品的空白组在反应48 h的吸光度;A 0, 0 h为未加样品的空白组在反应0 h的吸光度。
1.2.8 金属离子螯合能力的测定
参考You Lijun等 [ 15]的方法测定黄河鲤鱼鳞明胶消化产物的Cu 2+螯合能力,取CuSO 4溶液(2 mmol/L)1 mL与吡啶溶液(pH 7.0)1 mL和邻苯二酚紫(质量浓度0.1 g/100 mL)溶液20 μL混合,加入消化液样品1 mL,反应5 min后,在632 nm波长处测定反应液的吸光度。以相同体积的蒸馏水代替消化液样品作为空白对照,Cu 2+螯合能力用下式进行计算。
式中:A s为加入样品反应液的吸光度;A 0为空白组的吸光度。
2.1 黄河鲤鱼鳞明胶消化过程中水解度的变化
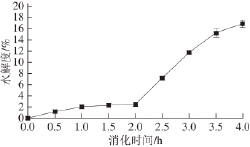
图1 黄河鲤鱼鳞明胶在体外模拟消化过程中水解度的变化
Fig.1 Change in DH during sequential in vitro digestion of YSG
黄河鲤鱼鳞明胶在模拟消化过程中水解度的变化如图1所示,在消化初期(0~2 h内),水解度随消化时间的延长稍有增加(P>0.05)。通常构成胶原蛋白的α链包括N端肽(11~19 个氨基酸残基)、三股螺旋区(1 014~1 029 个氨基酸残基)和C端肽(11~17 个氨基酸残基) [17],胃蛋白酶能够破坏胶原蛋白端肽的交联区,但不会损坏胶原蛋白三螺旋的完整性 [18-19]。胶原蛋白经热处理转变成明胶的过程中会产生α链单链和β链 [20],但在胃蛋白酶作用2 h后,鱼鳞明胶的水解度仅达到(2.6±0.3)%,说明胃蛋白酶对胶原α链和β链不具有水解作用,或水解作用很小。进一步用胰蛋白酶处理的过程中(2~4 h),鱼鳞明胶的水解度从(2.6±0.3)%显著增加到(16.9±0.7)%(P<0.05),说明胰蛋白酶对黄河鲤鱼鳞明胶有较强的酶解作用,能够切断胶原肽链,将其分解为较小分子质量的肽。
2.2 黄河鲤鱼鳞明胶消化过程中的·OH清除能力
在几种氧自由基中,·OH具有最强的氧化能力,能够与生物大分子作用,对·OH的清除可能是机体抵抗疾病的最有效方法 [15]。肽类物质的抗氧化性能与其氨基酸组成、结构和分子疏水性等因素有关,其中Tyr、Trp、Met、Lys、Cys和His等是提供抗氧 化能力的代表性氨基酸 [21]。而具有芳香基团的氨基酸能够作为氢供体,从而提高氨基酸残基的自由基清除能力,适当的氨基酸组成及其在肽链中的位置,以及肽链的构象都是影响肽类物质抗氧化性能的重要因素 [22]。黄河鲤鱼鳞明胶在消化过程中的·OH清除能力如图2所示。胃蛋白酶消化过程中,·OH的清除率缓慢增加到(14.5±1.8)%(P>0.05),然而,进一步采用胰蛋白酶消化后,其·OH清除率显著提高到(45.6±2.3)%(P<0.05)。黄河鲤鱼鳞明胶消化过程中·OH清除能力与其水解度的变化呈相似的趋势,表明其经过胰蛋白酶水解后产生小分子肽,具有氢或电子供体能力,表现出·OH清除活性。蛋白质的水解度、水解酶的种类、水解产物的分子质量等都会影响其抗氧化性能。如谷蛋白水解产物中,分子质量为500~1 500 D的组分具有最强的抗氧化性能,而分子质量低于500 D和高于1 500 D组分的抗氧化性能则较弱 [23]。通常认为肽类物质的总体抗氧化性能归因于 各组分的综合效应,而不是单个成分的个体效应 [24]。
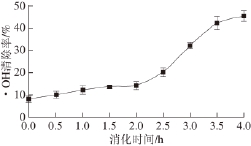
图2 黄河鲤鱼鳞明胶在体外模拟消化过程中·OH清除能力的变化
Fig.2 Change in hydroxyl radical scavenging activity of YSG during sequential in vitro digestion
2.3 黄河鲤鱼鳞明胶消化过程中的O 2 -·清除能力
大量生物反应可产生O 2 -·,从而诱导产生·OH等强氧化性自由基,因此,O 2 -·的清除能力对于抗氧化剂的抗氧化能力非常重要 [21]。黄河鲤鱼鳞明胶在消化过程中的O 2 -·清除能力如图3所示,在胃蛋白酶的消化过程中,消化产物对O 2 -·的清除率缓慢增加到(11.5±1.8)%(P>0.05),进一步采用胰蛋白酶消化后,消化产物的O 2 -·清除率升高到(34.2±2.3)%(P<0.05),表明较小分子的黄河鲤鱼鳞明胶肽具有更强的O 2 -·清除能力。
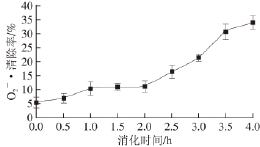
图3 黄河鲤鱼鳞明胶在体外模拟消化过程中的OO
2
-·清除能力
Fig.3 Change in superoxide anion radical scavenging activity of YSG during sequential in vitro digestion
2.4 黄河鲤鱼鳞明胶消化过程中的DPPH自由基清除能力
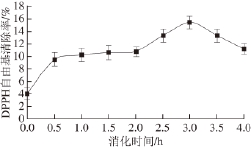
图4 黄河鲤鱼鳞明胶在体外模拟消化过程中DPPH自由基清除能力的变化
Fig.4 Change in DPPH radical scavenging activity of YSG during sequential in vitro digestion
黄河鲤鱼鳞明胶在模拟消化过程中对DPPH自由基清除能力的变化如图4所示,黄河鲤鱼鳞明胶在消化0.5 h后对DPPH自由基的清除率提高到(9.5±1.2)%(P<0.05),胃蛋白酶继续消化后,DPPH自由基清除率缓慢提高到(10.8±0.9)%(P>0.05)。在胰蛋白酶的消化过程中,消化产物在胰蛋白酶消化1 h时达到最大的DPPH自由基清除率(15.5±0.9)%。蛋白质在消化过程中DPPH自由基清除能力提高,是因为蛋白质中肽键的断裂,一些疏水性氨基酸残基暴露出来 [15],更利于肽分子与DPPH自由基的接触,进而使得它们更容易捕捉到DPPH自由基,而过长时间的酶处理过程中,随着蛋白质水解度的增加,水解产物中短链的肽及游离氨基酸的含量增加,使得消化产物的亲水性增强。极性的增加会导致消化产物难以与脂溶性DPPH自由基发生反应 [12]。因此,在胰蛋白酶消化1 h后,消化产物的DPPH自由基清除能力下降。
2.5 黄河鲤鱼鳞明胶消化过程中的总还原力
还原力是预测物质抗氧化能力的一个重要指标,它反映了抗氧化物质提供电子或氢原子的能力。黄河鲤鱼鳞明胶在模拟消化过程中总还原力的变化如图5所示,胃蛋白酶处理1 h后吸光度升高到0.407±0.032,消化液的总还原力显著提高(P<0.05),而在胃蛋白酶继续消化的过程中,其总还原力没有显著变化(P>0.05)。进一步采用胰蛋白酶对其进行消化处理的过程中,消化产物 的总还原力随其消化时间延长而逐渐提高,在胰蛋白酶消化1.5 h后吸光度显著增加到0.657±0.021(P<0.05),随后,消化产物的总还原力随消化时间延长缓慢增加。
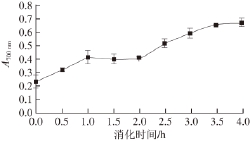
图5 黄河鲤鱼鳞明胶在体外模拟消化过程中总还原力的变化
Fig.5 Change in reducing power of YSG d uring sequential in vitro digestion
2.6 黄河鲤鱼鳞明胶消化过程中的脂质氧化抑制能力
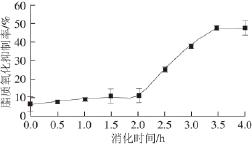
图6 黄河鲤鱼鳞明胶在体外模拟消化过程中脂质氧化抑制能力的变化
Fig.6 Change in lipid peroxidation inhibitory activity of YSG during sequential in vitro digestion
脂质的氧化通常被认为是一种经自由基介导的氧化反应,在此过程中多不饱和脂肪酸分子中亚甲基碳上的氢原子被自由基获取 [25]。黄河鲤鱼鳞明胶在模拟消化过程中脂质氧化抑制能力的变化如图6所示,在胃蛋白酶消化过程中,消化液的脂质氧化抑制能力没有显著变化(P>0.05),其脂质氧化抑制率从(7.2±0.7)%提高到(12.3±0.6)%。在胰蛋白酶消化1.5 h后,消化液的脂质氧化抑制率显著提高到(47.5±1.1)%,然而,继续延长胰蛋白 酶的处理时间对其脂质氧化抑制率没有显著影响(P>0.05)。消化过程中的脂质氧化抑制率与其水解度的变化趋势相似,表明随着水解度的提高,更多具有自由基清除能力的小肽分子被释放出来,与脂质体系中的自由基结合,从而表现出更强的脂质氧化抑制作用。
2.7 黄河鲤鱼鳞明胶消化过程中的金属离子螯合能力
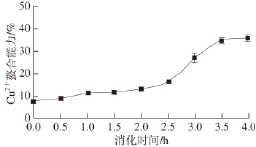
图7 黄河鲤鱼鳞明胶在体外模拟消化过程中金属离子螯合能力的变化
Fig.7 Change in metal chelating activity of YSG during sequential in vitro digestion
如图7所示,随着消化时间的延长,消化液的Cu 2+螯合能力逐渐增强,与水解度的变化趋势相似,表明消化产物中分子质量较小的肽具有更强的Cu 2+螯合能力。一些金属离子如Fe 2+、Cu 2+等在脂类物质的氧化过程中具有催化作用,因此,将脂质反应体系中的Fe 2+、Cu 2+等螯合可以间接地抑制脂类物质的氧化,对金属离子的螯合能力也体现该物质具有一定的抗氧化能力。
胃消化阶段对黄河鲤鱼鳞明胶的α链和β链不具有水解作用,或者水解能力较弱,而肠消化阶段对鱼鳞明胶肽链有较强的酶解作用,鱼鳞明胶经消化后水解度可到达16.9%。
黄河鲤鱼鳞明胶在肠消化阶段能够产生抗氧化活性肽,消化产物的·OH、O 2 -·清除能力和总还原力随其水解程度增加而增强,消化产物的脂质氧化抑制能力和金属离子螯合能力具有相似的变化趋势,一些金属离子在脂类物质的氧化过程中具有催化作用,因此,将脂质反应体系中的Fe 2+、Cu 2+等螯合可以间接地抑制脂类物质的氧化。
参考文献:
[1] 马华威, 杨会成, 付万冬, 等. 鮟鱇鱼皮胶原蛋白肽的抗氧化活性[J]. 食品科学, 2014, 35(9): 80-84. doi: 10.7506/spkx1002-6630-201409017.
[2] WANG Zhanyong, WANG Chenyu, QUAN Yue. Extraction of polysaccharides from Phellinus nigricans mycelia and their antioxidant activities in vitro[J]. Carbohydrate Polymers, 2014, 99(2): 110-115.
[3] LU Xinshan, ZHAO Yan, SUN Yanfei, et al. Characterisation of polysaccharides from green tea of Huangshan maofeng with antioxidant and hepatoprotective effects[J]. Food Chemistry, 2013,141(4): 3415-3423.
[4] DU Hui, WU Jie, LI Hui, et al. Polyphenols and triterpenes from Chaenomeles fruits: chemical analysis and antioxidant activities assessment[J]. Food Chemistry, 2013, 141(4): 4260-4268.
[5] FLORINDA F, FEDERICA C, AUTILIA C, et al. Polyphenol composition and antioxidant activity of different grass pea (Lathyrus sativus), lentils (Lens culinaris), and chickpea (Cicer arietinum) ecotypes of the Campania region (Southern Italy)[J]. Journal of Functional Foods, 2014, 7(2): 551-557.
[6] NAWAPORN L, JIRAWAT Y. Production and purification of antioxidant peptides from a mungbean meal hydrolysate by Virgibacillus sp. SK37 proteinase[J]. Food Chemistry, 2013, 141(2): 992-999.
[7] ZHU Chaozhi, ZHANG Wanguang, KANG Zhuangli, et al. Stability of an antioxidant peptide extracted from Jinhua ham[J]. Meat Science,2014, 96(2): 783-789.
[8] WANG Bin, LI Zhongrui, CHI Changfeng, et al. Preparation and evaluation of antioxidant peptides from ethanol-soluble proteins hydrolysate of Sphyrna lewini muscle[J]. Peptides, 2012, 36(2): 240-250.
[9] CLEMENTE A. Enzymatic protein hydrolysates in human nutrition[J]. Trends in Food Science & Technology, 2000, 11(7): 254-262.
[10] SIEMENSMA A D, WEIJER W J, BAK H J. The importance of peptide lengths in hypoallergenic infant formulae[J]. Trends in Food Science & Technology, 1993, 4(1): 16-21.
[11] ZHANG Yufeng, DUAN Xiu, ZHUANG Yongliang. Purification and characterization of novel antioxidant peptides from enzymatic hydrolysates of tilapia (Oreochromis niloticus) skin gelatin[J]. Peptides, 2012, 38(1): 13-21.
[12] LI Zhongrui, WANG Bin, CHI Changfeng, et al. Influence of average molecular weight on antioxidant and functional properties of cartilage collagen hydrolysates from Sphyrna lewini, Dasyatis akjei and Raja porosa[J]. Food Research International, 2013, 51(1): 283-293.
[13] SUN Liping, ZHANG Yufeng, ZHUANG Yongliang. Antiphotoaging effect and purification of an antioxidant peptide from tilapia(Oreochromis niloticus) gelatin peptides[J]. Journal of Functional Foods, 2013, 5(1): 154-162.
[14] KITTIPHATTANABAWON P, BENJAKUL S, VISESSANGUAN W. Gelatin hydrolysate from blacktip shark skin prepared using papaya latex enzyme: antioxidant activity and its potential in model systems[J]. Food Chemistry, 2012, 135(3): 1118-1126.
[15] YOU Lijun, ZHAO Mouming, REGENSTEIN J M, et al. Changes in the antioxidant activity of loach (Misgurnus anguillicaudatus) protein hydrolysates during a simulated gastrointestinal digestion[J]. Food Chemistry, 2010, 120(3): 810-816.
[16] ZHUANG Hong, TANG Ning, YUAN Yuan. Purification and identification of antioxidant peptides from corn gluten meal[J]. Journal of Functional Foods, 2013, 5(4): 1810-1821.
[17] GELSE K, P.SCHL E, AIGNER T. Collagens-structure, function, and biosynthesis[J]. Advanced Drug Delivery Review, 2003, 55: 1531-1546.
[18] LIU Dasong, LI Liang, REGENSTEIN J M, et al. Extraction and characterisation of pepsin-solubilised collagen from fins, scales,skins, bones and swim bladders of bighead carp (Hypophthalmichthys nobilis)[J]. Food Chemistry, 2012, 133(4): 1441-1448.
[19] HEU M S, LEE J H, KIM H J, et al. Characterization of acid-and pepsin-soluble collagens from flatfish skin[J]. Food Science and Biotechnology, 2010, 19(1): 27-33.
[20] 张丰香. 酶法制备草鱼鱼鳞明胶及ACE抑制肽的研究[D]. 无锡: 江南大学: 2009.
[21] WANG Wenyi, GONZALEZ de MEJIA E. A new frontier in soy bioactive peptides that may prevent age-related chronic diseases[J]. Comprehensive Reviews in Food Science and Food Safety, 2005, 4(4):63-78.
[22] SARMADI B H, ISMAIL A. Antioxidative peptides from food proteins: a review[J]. Peptides, 2010, 31(10): 1949-1956.
[23] LI Xiuxia, HAN Lujia, CHEN Longjian. In vitro antioxidant activity of protein hydrolysates prepared from corn gluten meal[J]. Journal of the Science of Food and Agriculture, 2008, 88(9): 1660-1666.
[24] CHEN Huaming, MURAMOTO K, YAMAUCHI F, et al. Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J]. Journal of Agricultural and Food Chemistry, 1998, 46(1): 49-53.
[25] RAJAPAKSE N, MENDIS E, JUNG W K, et al. Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J]. Food Research International, 2005, 38(2):175-182.
Changes in Antioxidant Activity of Gelatin Hydrolysates from Yellow River Carp (Cyprinus carpio haematopterus Temminck et Schlegel) Scale during Simulated Gastrointestinal Digestion
XIAO Feng, ZHU Wenxue*, KANG Huaibin, LIU Lili, HE Jialiang, REN Guoyan
(School of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471023, China)
Abstract:In order to explore the in vivo digestion properties of scale gelatin from the Yellow River carp Cyprinus carpio haematopterus Temminck et Schlegel , a two-stage in vitro digestion model system (sequential treatment with pepsin for 2 h at pH 2.0 followed by pancreatin for 2 h at pH 7.5) was used to simulate the process of human gastrointestinal (GI)digestion to determine the digestibility of fish scale gelatin at 37 ℃. The change in hydrolysis degree of Yellow River carp scale gelatin (YSG) during simulated GI digestion was studied and its antioxidant activities (hydroxyl, superoxide and DPPH free radical scavenging capacities, reducing power, lipid peroxidation inhibition activity, and metal chelating activity) were investigated through in vitro models. The results showed very low digestive power of pepsin on the α chain and β chain of YSG compared with pancreatin. The final degree of hydrolysis from GI digestion was 16.9%. The antioxidant activity of fish scale gelatin was correlated with the degree of hydrolysis.
Key words:Cyprinus carpio haematopterus scale; gelatin; simulated digestion; antioxidant activity
中图分类号:TS254.9
文献标志码:A
文章编号:1002-6630(2015)23-0116-05
doi:10.7506/spkx1002-6630-201523022
收稿日期:2015-01-15
作者简介:肖枫(1979—),男,讲师,博士,研究方向为水产品综合利用。E-mail:xfeng@haust.edu.cn
*通信作者:朱文学(1967—),男,教授,博士,研究方向为农产品干燥和农产品功能性成分分离、提取及活性。E-mail:zwx@haust.edu.cn