细胞壁组分及酶活性与清见果实囊衣绵韧的相关性
高婧斐,汪志辉*,熊 博,石冬冬,张婷婷,曾海琼,廖 玲,曹淑燕,古咸杰,李清南
(四川农业大学园艺学院,四川 雅安 625014)
摘 要:以清见杂柑为研究材料,进行定点和定期的跟踪测定,探究清见果实囊衣中果胶类物质、纤维素、半纤维素、木质素含量和果胶甲酯酶、多聚半乳糖醛酸酶、纤维素酶活性在花后120~300 d的动态变化情况,及其与清见果实囊衣绵韧程度的相关性。结果表明:囊衣胞壁物质含量在成熟后期均有下降,多聚半乳糖醛酸酶和纤维素酶活性在后期处于上升趋势,果胶甲酯酶则相反;较高水平的水溶性果胶和低水平的木质素、纤维素、半纤维素有利于清见果实良好化渣性的形成;从花后210~300 d,细胞壁中多聚半乳糖醛酸酶、纤维素酶活性高低是决定囊衣质地绵韧程度的关键因子。
关键词:清见;绵韧性;细胞壁物质;细胞壁相关酶活性
清见,日本育成品种,为特洛维它甜橙和宫川温州蜜柑的杂交种,1979年命名推广。20世纪80年代末引入我国,各柑橘产区均有分布,以重庆、四川、广西种植较多
[1]。清见果实果肉橙色、囊壁薄软、果肉柔软多汁、肉质细腻、易化渣、风味较佳
[2]。
遂宁市射洪县为四川省清见柑橘的主要种植区之一,近年来,清见果实出现囊衣变厚、口感绵韧和化渣性下降的现象,严重影响其商品价值,降低了产区经济效益。目前对柑橘果实囊衣质地的研究较少,多数研究集中在囊衣去除技术上。Brownleader等
[3]研究认为果肉硬度、松实、脆性和粗腻影响果实的口感,细胞壁的结构和组成的改变导致果肉组织软化,从而引起果实质地的变化。柑橘果实的化渣性好坏主要与柑橘囊瓣和汁胞膜的成分有关,它们的主要成分是纤维素(cellulose,CEL)、果胶和半纤维素(hemicellulose,HC)物质,以及填充在CEL中间的木质素,当CEL和木质素等含量过多时,食用时会有粗硬多渣的感觉
[4]。高利平等
[5]研究认为成熟期间细胞壁水解酶基因的上调表达及其协同作用会致使苹果果肉由脆变绵。
本研究将从清见果实囊衣细胞壁成分及其相关酶活性变化上探究果胶、CEL、HC、木质素含量及其多聚半乳糖醛酸酶(polygalacturonase,PG)、果胶甲酯酶(pectin methyl esterase,PME)、纤维素酶(cellulose,Cx)活力与囊衣绵韧化渣的关系,阐明清见果实囊衣绵韧发生机理以及囊衣绵韧发生的关键影响因子,为进一步降低清见果实囊衣绵韧发生率,提高产区优果率提供理论与实践基础。
1 材料与方法
1.1 材料与试剂
本研究于2012年3月—2014年4月在四川省遂宁市射洪县清见果园进行。该地区海拔300~674 m,年平均气温17.3 ℃,绝对低温3.9 ℃,年降水量8~993 mm,年日照时数1 307 h,年无霜期238~300 d。土壤以黄壤土和水稻土为主。选择树势基本一致,健壮的清见果树(树高、冠径、坐果率基本一致,12a生,生长状况良好,无病虫害,株行距3 m×4 m)作为实验材料。
咔唑 江苏润江精细化工有限公司;果胶 上海源叶生物科技有限公司;3,5-二硝基水杨酸 (克拉玛尔)上海紫一试剂厂。
1.2 仪器与设备
DW-HL290超低温冷冻冰箱 中科美菱低温科技有限责任公司;3-18K冷冻离心机 美国Sigma公司;FK-A组织粉碎机 广州罡然机电设备有限公司;DHG-9025A电热恒温干燥箱 上海凯朗仪器设备厂。
1.3 方法
1.3.1 果实囊衣绵韧发生率的田间调查
该调查于2012年4月16号、2013年4月22号进行采果,在清见果园中选取10 个具有代表性的小区,每个小区随机选取5 株长势相近的成年果树,在每株树的东南西北中5 个方向随机采摘大小适中的果实2 个,每月采摘一次进行品尝实验。同时调查园区的海拔、树体、树龄、砧木以及果实成熟期(1月3日—4月3日)园区的温度、土壤相对湿度。
由从事柑橘相关研究的15 名研究生(男生7 人,女生8 人)对采摘样品进行品尝实验,每人针对每份样品做3 份关于清见果实囊衣绵韧情况的调查表,即重复3 次。调查表参考魏张奎
[6]、魏清江
[7]等的方法并加以改进,确定感官评价描述、囊衣厚度以及对应的分值(表1)。每次品尝样品为清见囊瓣中间部分,质量为5 g。
表1 感官评价描述、囊衣厚度及相应代表分值
Table 1 Sensory descriptors, albedo thickness and corresponding sensory scores

果肉质地 分数 残渣 分数 易嚼性/次 分数 多汁性 分数 囊衣厚度/mm 分数特别松脆 5 很少 5 ≤6 5 多 5 <0.015 5松脆 4 少 4 7~9 4 较多 4 0.015~0.020 4一般脆 3 一般 3 10~12 3 一般 3 0.020~0.025 3生硬 2 较多 2 13~15 2 少 2 0.025~0.030 2生硬粗糙 1 多 1 >15 1 很少 1 >0.030 1
测试样品所得分数去除最高分和最低分之后统计平均得分,将囊衣绵韧程度分为3 个等级(得分≤2为3级,2<得分≤4为2级,得分>4为1级)。分级记载调查的果实,统计囊衣绵韧发生率。
将调查结果中连续两年囊衣绵韧发生率≥50%的果树归为Ⅰ级,50%>绵韧发生率>25%的果树归为Ⅱ级,绵韧发生率≤25%的果树归为Ⅲ级。
1.3.2 果实生长发育过程中囊衣细胞壁组分及其相关酶活性的测定
在前期供调查的果树中随机选取15 株树,Ⅰ、Ⅱ、Ⅲ级各5 株,2013年9月5日(花后120 d)至2014年3月4日(花后300 d)分别对3 类果树进行采果,每月进行一次。每株采摘大小适中,健康无病害无损伤的果实2 个,每个绵韧等级果树共采摘10 个果实。采收后用冰袋冷却放至绝热泡沫箱中保存并及时运回四川农业大学果树生理生态实验室放于4 ℃的冰箱中冷藏。部分果肉和囊衣用液氮冷冻后贮存于-80 ℃冰箱中用于酶活性的测定;剩余的果皮和囊衣样品漂洗后置于65 ℃烘箱中干燥至恒质量,用组织粉碎机粉碎过60目筛,将过筛后的样品放入干燥箱中室温(25 ℃)保存留作细胞壁成分的测定
[8]。
原果胶(protopectin,HP)、水溶性果胶(water soluble pectin,WSP)及总果胶(total pectin,TP)含量的测定采用咔唑比色法
[9];纤维素和半纤维素含量的测定参照王金主等
[10]的方法;木质素的测定参照鞠志国等
[11]的方法测定;PG酶和Cx酶活性的测定采用3,5-二硝基水杨酸比色法
[12];PME酶活性的测定采用NaOH滴定法
[12]。
1.4 数据处理
采用分析软件Excel 2013进行数据统计,DPS7.05进行数据差异显著性分析,SPSS19.0进行数据相关性分析。
2 结果与分析
2.1 清见果实囊衣绵韧发生率的发生情况
射洪县广兴镇、金华镇的10 个调查小区进行连续两年的果实囊衣绵韧发生情况及田间情况调查结果见表2,采果后果实囊衣绵韧发生率统计结果见表3。
表2 射洪县清见杂柑果实囊衣绵韧发生的主要环境因子
Table 2 Major environmental factors for the formation of albedo fracture toughness in Kiyomi from Shehong county
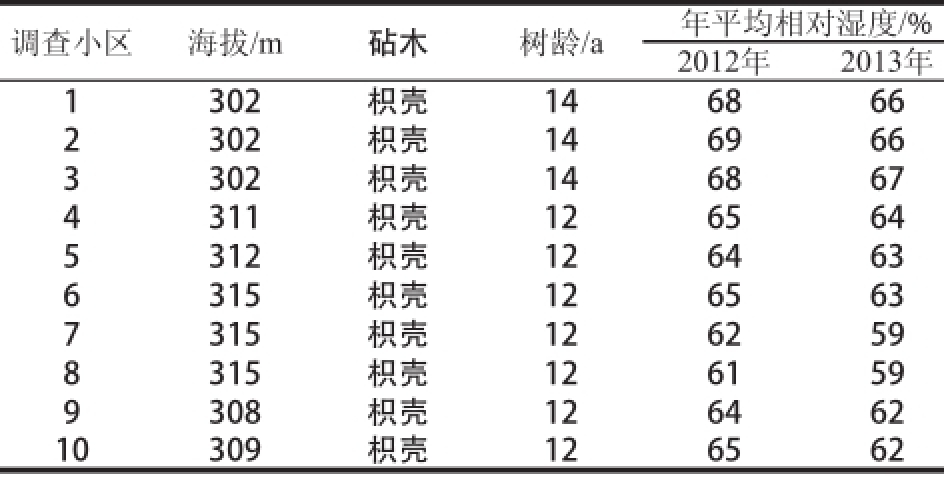
调查小区 海拔/m 砧木 树龄/a 年平均相对湿度/% 2012年 2013年1 302 枳壳 14 68 66 2 302 枳壳 14 69 66 3 302 枳壳 14 68 67 4 311 枳壳 12 65 64 5 312 枳壳 12 64 63 6 315 枳壳 12 65 63 7 315 枳壳 12 62 59 8 315 枳壳 12 61 59 9 308 枳壳 12 64 62 10 309 枳壳 12 65 62
表3 清见果实囊衣绵韧发生率
Table 3 Incidence of albedo toughening in Kiyomi from Shehong county

%
由统计结果可知,2013年相比2012年,清见果实囊衣绵韧发生率均有所上升,2013年果实成熟期气温平均比同期2012年高出2.75 ℃,成熟期气温的升高可能是清见果实囊衣绵韧加剧的因素之一。2小区中果实囊衣绵韧发生率最高,为65%和68%,8小区绵韧发生率最低,为41%和43%。调查小区1、2、3处在涪江河畔,地下水位高,土壤相对湿度偏高,树龄14 a,其囊衣绵韧发生率也较为严重,8小区地势较高,土壤相对湿度偏低,树龄12 a,果实囊衣绵韧发生率较其他小区偏低,说明树体老化、土壤相对湿度高可能会加重果实囊衣绵韧程度。
2.2 三类果实囊衣细胞壁果胶含量差异
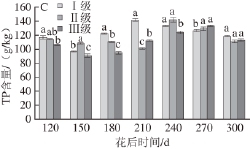
图1 三类清见果实囊衣果胶类物质含量的动态变化
Fig.1 Changes in pectin content of Kiyomi albedo with different incidences of toughening
小写字母不同表示差异显著(P<0.05)。下同。
由图1A可知,清见果实囊衣WSP含量从花后120 d呈下降-逐渐升高-下降的变化趋势,三类果实最大值出现的时间依次为花后210、240和270 d,Ⅲ级果实WSP的增长时期不仅滞后,且增涨幅度也明显高于其他两类果实,其含量在花后270~300 d才略微下降。由图1B可知,三类果实中HP含量从花后120 d起呈下降、上升再下降的趋势,Ⅰ级果实HP在花后210 d处于最高水平,在花后210~300 d的趋势不明显。Ⅱ级果实HP最大值出现在花后240 d,其含量显著高于同期的Ⅲ级果实,从花后120 d开始,Ⅲ级果实的HP含量均显著低于Ⅰ级果实。由图1C可知,三类果实的TP含量变化呈下降、上升、再下降趋势,但最大值出现的时间有所不同,依次为花后210、240和270 d。在花后210 d时,Ⅰ级果实中TP含量比Ⅱ级果实高出40.6%,差异显著。从花后120 d到花后210 d三者之间TP含量差异显著,但到达花后300 d时差异不显著。
2.3 三类果实囊衣细胞壁纤维素和半纤维素含量差异

图2 三类清见果实囊衣纤维素和半纤维素含量的动态变化
Fig.2 Changes in cellulose and hemicellulose contents of Kiyomi albedo with different incidences of toughening
由图2A可知,三类果实从花后120~300 d间CEL含量均呈下降趋势,其中Ⅲ级果实波动性最大,在花后240~300 d期间含量显著低于其他两类果实,且保持较低水平。在花后300 d时三者CEL含量均降至最低值,Ⅲ级果实与Ⅰ、Ⅱ级果实之间差异显著。由图2B可知,三类果实囊衣HC含量在花后120~150 d期间快速上升。Ⅰ级果实在花后210 d时降至9.61%,之后变化平缓,但其含量显著高于其他两类果实;Ⅱ级果实HC含量在花后210 d降至8.12%,花后240~300 d略有下降;Ⅲ级果实HC含量在花后180 d达到最大值9.89%后,花后210~240 d期间持续在6.66%。花后300 d时,三类果实之间HC含量差异显著。
2.4 三类果实囊衣细胞壁木质素含量差异

图3 三类清见果实囊衣木质素含量动态变化
Fig.3 Changes in lignin content of Kiyomi albedo with different incidences of toughening
由图3可知,三类果实木质素含量在4.71%~20.52%之间波动,均在花后210 d时达到最大值,花后270~300 d间变化平缓。其中Ⅰ级果实木质素含量变化波动性最大,Ⅲ级果实次之,Ⅱ级果实趋于直线上升,花后270~300 d略有下降。Ⅲ级果中木质素含量在花后180~300 d期间显著低于Ⅰ、Ⅱ级果实。
2.5 三类果实囊衣细胞壁相关酶活力差异
表4 三类清见果实囊衣PG酶活力变化
Table 4 Changes in PG reactivity of Kiyomi albedo with different incidences of toughening

U/mL果实级别 花后120 d 花后150 d 花后180 d 花后210 d 花后240 d 花后270 d 花后300 dⅠ级 0.010±0.003
a0.014±0.003
b0.025±0.005
b0.015±0.004
b0.023±0.005
b0.034±0.009
b0.036±0.007
bⅡ级 0.012±0.003
a0.016±0.005
a0.022±0.005
b0.016±0.004
b0.026±0.012
a0.034±0.017
b0.037±0.010
bⅢ级 0.009±0.001
b0.013±0.006
b0.026±0.003
a0.027±0.006
a0.030±0.006
a0.038±0.009
a0.045±0.006
a
三类果实PG酶活力的测定结果如表4所示,Ⅰ、Ⅱ级果实PG酶活力水平均呈上升、下降、再上升的趋势,两者在花后210 d时降至最小值,Ⅲ级果实PG酶活力水平在整个时期呈上升趋势,花后180~240 d期间变化较为缓慢但显著高于其他两类果实,在花后300 d时酶活力水平达到最大值,为0.045 U/mL,而同期Ⅰ级果实酶活力水平为0.036 U/mL,Ⅱ级果实酶活力水平为0.37 U/mL。
花后120~300 d期间三类果实PME酶活力变化趋势相似(表5),Ⅲ级果实PME酶活力水平最高,Ⅱ级果实次之,Ⅰ级果实最低。Ⅲ级果实在花后240~300 d酶活力水平均显著高于Ⅰ、Ⅱ级果实,Ⅰ级果实在花后240~300 d酶活力水平下降较为迅速,在花后300 d仅为0.381×10
-3U/mL,显著低于其他两类果实。
表5 三类清见果实囊衣PME酶活力变化
TTaabbllee 55 CChhaannggeess iinn PPMMEE aaccttiivviittyy ooff KKiiyyoommii aallbbeeddoo wwiitthh ddiiffffeerreenntt incidences of tougheniinngg

10
-3U/mL果实级别 花后120 d 花后150 d 花后180 d 花后210 d 花后240 d 花后270 d 花后300 dⅠ级 0.713±0.019
b0.715±0.016
b0.518±0.019
b0.613±0.003
b0.773±0.016
b0.552±0.018
b0.381±0.014
cⅡ级 0.752±0.012
b0.764±0.019
b0.580±0.012
ab0.660±0.021
ab0.822±0.016
b0.463±0.007
c0.432±0.012
bⅢ级 0.833±0.013
a0.891±0.043
a0.625±0.013
a0.684±0.023
a0.878±0.007
a0.625±0.006
a0.520±0.006
a
Cx酶活力水平呈上升、下降、再上升的趋势,其中,Ⅲ级果实Cx酶活力水平在花后120~180 d缓慢上升,在花后180 d之后急剧下降,花后210 d时降至最小值0.313×10
-3U/mL,花后300 d时达到最大值0.564×10
-3U/mL,整个时期酶活力水平均显著高于其他两类果实。Ⅰ、Ⅱ级果实酶活力水平在花后180~210 d时急剧下降后又快速上升,但Ⅱ级果实酶活力水平略高于Ⅰ级果实,从花后240 d开始两者之间酶活力水平差异显著(表6)。
表6 三类清见果实囊衣Cx酶活力变化
Table 6 Changes in Cx activity in Kiyomi albedo with different incidences of toughening

3 讨 论
3.1 清见果实囊衣质地的动态变化
清见果肉细胞汁凝胶化,细胞壁增厚,胞壁中的CEL转化为HC或类木质素会导致柑橘果实粒化、囊衣增厚、硬度增加、果实质地下降
[13-16]。高可溶性膳食纤维和WSP、低CEL含量是脐橙质地优良的物质基础
[17]。
清见果实囊衣中果胶类物质、CEL和HC含量变化与其他研究者
[17-20]的结果一致。本研究发现,细腻化渣的Ⅲ级果实中囊衣木质素含量显著低于Ⅰ、Ⅱ级果实,而WSP含量则相反,此结论与雷莹
[18]研究结果有所差别。Ⅲ级果实囊衣PG酶活性在花后180~300 d均显著高于Ⅰ、Ⅱ级果实,促进HP降解为WSP,说明不同品种间影响果实化渣性的细胞壁物质在含量变化上有所不同,果肉和囊衣中细胞壁物质的含量差异也可能存在。此外还发现口感细腻的Ⅲ级果实囊衣细胞壁中WSP快速上升的时期不仅滞后,而且增长幅度也明显高于其他两类果实,且CEL含量的动态变化幅度最大,HC含量在花后210~300 d显著低于其他两类果实保持较低水平。说明高含量的WSP和低水平的CEL、HC和木质素以及细胞壁物质含量变化波动性大有利于清见果实囊衣良好化渣性的形成。
3.2 清见果实囊衣细胞壁酶的动态变化
细胞壁中PME酶的作用是将高度甲酯化的多聚半乳糖醛酸去甲酯化
[21],形成多聚半乳糖醛酸的聚合体,在转变为Ca
2+联果胶结构后成为PG酶降解的底物
[22],同一柑橘品种在不同生长环境下其细胞壁酶活性也有所差异
[23]。清见果实细胞壁酶降解作用的结果在质地组成上表现为CEL、HC、木质素含量降低而WSP含量不断上升。囊衣质地组分与三类水解酶的相关分析表明,Ⅰ、Ⅱ、Ⅲ级果实囊衣中PG酶活力与WSP含量的相关性分别为r=0.429、r=0.820、r=0.901(P<0.05),囊衣中PME的活性与WSP、HP、TP含量变化的相关性不显著,但PME酶活力高峰的出现在PG酶之前,因此,可以认为清见果实囊衣中PME酶对果胶类物质的降解有启动作用,而PG酶是囊衣化渣性的关键酶,曾秀丽
[17]和董涛
[24]等对脐橙的研究中也得到了类似的结果。
雷莹
[18]研究发现,化渣性差的脐橙中Cx酶的基因表达量低,但Cx酶活性与化渣性好的脐橙无明显差异。化渣性好的塔罗科血橙在果实发育期Cx酶活性显著高于纽荷尔脐橙和红肉脐橙,尤其是在幼果期
[25]。Ⅲ级果实囊衣中Cx酶活性显著高于其他两类果实,与囊衣CEL含量成极显著负相关(r=-0.885),在Ⅰ、Ⅱ级果实囊衣中两者成显著负相关(r=-0.841、r=-0.839)。HC的含量与Cx酶活力水平无明显相关性,Ⅲ级果实中CEL与HC含量均显著低于化渣性差的Ⅰ级果实,表明CEL、HC含量以及Cx酶活力与清见果实囊衣化渣性密切相关。
4 结 论
不同品种的柑橘果实,其细胞壁物质含量变化有所差异,囊衣绵韧程度不同的清见果实,其囊衣细胞壁物质含量和相关酶活力有所差别。高含量的WSP,低含量的CEL、HC、木质素且三者含量的变化幅度较大是形成果实质地化渣性好的物质基础,此外在细胞壁物质变化中PG酶和Cx酶起到了关键的调节作用,但在清见果实中决定PG、PME及Cx酶合成基因的转录和表达还需要进一步研究,与细胞壁物质构成相关的糖苷酶类的活性变化还需深入探讨。
参考文献:
[1] 周开隆, 叶萌民. 中国果树志·柑橘卷[M]. 北京: 中国林业出版社,2009, 420-421.
[2] 王天佑. 清见果实贮藏过程中的介电特性及低温臭氧保鲜技术的研究[D]. 雅安: 四川农业大学, 2008: 8-10.
[3] BROWNLEADER M D, JACKSON P, MOBASHERI A, et al. Molecular aspects of cell wall modifi cations during fruit ripening[J]. Critical Reviews in Food Science and Nutrition, l999, 39(2): 149-164.
[4] van BUGGENHOUT S, SILA D N, DUVETTER T, et al. Pectins in processed fruits and vegetables: part Ⅲ-texture engineering[J]. Comprehensive Reviews in Food Science and Food Safety, 2009, 8(2):105-117.
[5] 高利平, 冀晓昊, 张艳敏, 等. 新疆红肉苹果杂交后代绵/脆肉株系果实质地差异相关酶活性的初步研究[J]. 园艺学报, 2013, 40(6):1153-1161.
[6] 魏张奎. 基于质构特性的夏橙化渣性研究[D]. 武汉: 华中农业大学,2013: 15-17.
[7] 魏清江, 汪妙秋, 曾知富, 等. 南丰蜜橘化渣性评价及不同结果习性果实的品质比较[J]. 中国农业科学, 2014, 47(6): 1162-1170.
[8] 曾秀丽. 不同生境下甜橙果实的质地研究[D]. 雅安: 四川农业大学,2007: 25-30.
[9] 尚雪波, 帅鸣. 柑橘皮中果胶含量的测定[J]. 湖南农业科学, 2010(9):88-90.
[10] 王金主, 王元秀, 李峰, 等. 玉米秸秆中纤维素、半纤维素和木质素的测定[J]. 山东食品发酵, 2010(3): 44-47.
[11] 鞠志国, 刘成连, 原永兵, 等. 莱阳茌梨酚类物质合成的调节及其对果实品质的影响[J]. 中国农业科学, 1993, 26(4): 44-48.
[12] ABU-GOUKH A B, BASHIR H A. Changes in pectic enzymes and cellulase activity during guava fruit ripening[J]. Food Chemistry, 2003,83(2): 213-218.
[13] 郑宴义. 琯溪蜜柚果实汁胞粒化的研究现状与展望[J]. 福建农业学报, 2006, 21(1): 63-65.
[14] 陈昆松, 张上隆, 李方, 等. 胡柚果实采后枯水的研究[J]. 园艺学报,1995, 22(1): 35-39.
[15] 石学根, 徐建国, 张林, 等. 钙剂对防止温州蜜柑果实浮皮的效果[J].中国南方果树, 2007, 36(3): 6-7.
[16] 佘文琴, 赵晓玲, 潘东明, 等. 细胞壁代谢与琯溪蜜柚果实成熟过程汁胞粒化的关系[J]. 热带亚热带植物, 2008, 16(6): 545-550.
[17] 曾秀丽, 张光伦, 闵治平, 等. 脐橙果实发育过程中细胞壁物质及其水解酶活性的变化[J]. 现代农业科学, 2008, 15(8): 6-11.
[18] 雷莹. 柑橘果实化渣性研究[D]. 武汉: 华中农业大学, 2010: 23-27.
[19] 潘腾飞, 朱学亮, 潘东明, 等. “琯溪蜜柚”贮藏期间汁胞粒化与木质素代谢的关系[J]. 果树学报, 2013, 22(2): 294-298.
[20] 张丽芳. 南丰蜜橘果胶代谢与化渣性关系研究[D]. 南昌: 江西农业大学, 2014: 24-30.
[21] 程杰山, 沈火林, 孙秀波, 等. 果实成熟软化过程中主要相关酶作用的研究进展[J]. 北方园艺, 2008(1): 49-52.
[22] GAFFE J, TIZNADO M E, HANDA A K. Characterization and functional expression of a ubiquitously expressed tomato pectin methylesterase[J]. Plant Physiology, 1997, 114(4): 1547-1556.
[23] 曾秀丽, 张光伦, 吕秀兰, 等. 3类生境下脐橙果实细胞壁酶、瓤囊壁超微结构和品质变化的研究[J]. 果树学报, 2006, 23(5): 670-675.
[24] 董涛. 甜橙果实膳食纤维代谢机理研究[D]. 武汉: 华中农业大学,2009: 18-22.
[25] 董涛, 夏仁学, 黄仁华, 等. 甜橙果实膳食纤维与PG、Cx活性的研究[J]. 园艺学报, 2007, 34(5): 1287-1292.
Correlations of Albedo Fracture Toughness with Cell Wall Substances and Enzyme Activities in Kiyomi Fruits
GAO Jingfei, WANG Zhihui*, XIONG Bo, SHI Dongdong, ZHANG Tingting, ZENG Haiqiong, LIAO Ling,
CAO Shuyan, GU Xianjie, LI Qingnan(College of Horticulture, Sichuan Agricultural University, Ya'an 625014, China)
Abstract:The changes in albedo cell wall substances such as water-soluble pectin (WSP), cellulose (CEL), hemicellose (HC)and lignin and related enzyme activities such as pectinesterase (PME), polygalacturonase (PG) and cellulase (Cx) in Kiyomi fruits during 120-300 days after flowering were explored and correlated with albedo fracture toughness. The results showed that the contents of WSP, CEL, HC and lignin decreased during the later stages of maturation; the activities of PG and Cx increased, whereas the opposite trend was observed for PME activity. Low levels of CEL, HC and lignin and high contents of WSP were beneficial to reduce the fracture toughness of albedo in Kiyomi fruits. The key hydrolases affecting albedo fracture toughness in Kiyomi during 210-300 days after flowering were PG and Cx.
Key words:Kiyomi; fracture toughness; cell wall substances; cell wall related enzyme activities
中图分类号:S666.9
文献标志码:A
文章编号:1002-6630(2015)23-0131-05
doi:10.7506/spkx1002-6630-201523025
收稿日期:2015-01-16
基金项目:四川省科技支撑计划项目(2011NZ0034);四川省科技厅基金项目(10ZC1454)
作者简介:高婧斐(1989—),女,硕士研究生,研究方向为果树栽培理论与技术。E-mail:1047730048@qq.com
*通信作者:汪志辉(1968—),男,教授,博士,研究方向为果树栽培理论与技术。E-mail:wangzhihui318@126.com









