反应条件对葡萄糖/苯丙氨酸和葡萄糖/丙氨酸Maillard模型体系挥发性产物的影响
何保江
1,李成刚
2,刘 珊
1,李 鹏
1,曾世通
1,胡 军
1,徐秀娟
1,*, 郝菊芳
3,*
(1.中国烟草总公司郑州烟草研究院,河南 郑州 450001;2.河南中烟工业有限责任公司技术中心,河南 郑州 450000;3.中国烟草总公司职工进修学院,河南 郑州 450008)
摘 要:为研究反应条件对葡萄糖/苯丙氨酸和葡萄糖/丙氨酸Maillard反应体系中挥发性化合物形成的影响,采用气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)法对不同反应物比例和反应时间下Maillard反应产物中挥发性化合物进行了分析。结果表明:1)反应时间对葡萄糖/苯丙氨酸和葡萄糖/丙氨酸体系挥发性产物的影响趋势相似,随着反应时间延长挥发性香味成分总量及脂肪族、芳香族、呋喃类、有机酸、吡啶、吡咯、呋喃酮和碳环类化合物的生成量增加,吡喃酮类化合物生成量先增加后减少。2)反应物比例对葡萄糖/苯丙氨酸和葡萄糖/丙氨酸体系挥发性香味成分生成量的影响不同,随着体系中氨基酸含量增加,葡萄糖/苯丙氨酸体系芳香族化合物生成量增加,脂肪族化合物生成量降低,而在葡萄糖/丙氨酸体系中呈相反的趋势。两个体系中吡嗪类、有机酸、吡喃酮类、吡啶、吡咯、碳环类和呋喃酮类化合物生成量均随体系中氨基酸含量的增加而增加。
关键词:Maillard反应;葡萄糖/苯丙氨酸;葡萄糖/丙氨酸;反应条件;挥发性化合物
Maillard反应是指氨基化合物(如氨基酸、肽、蛋白质等)与羰基化合物(如还原糖等)发生的一类非酶褐变反应。Maillard反应在食品的焙炒、烘烤过程中产生特征香气,一直是食品化学、香料化学等领域的研究热点
[1-13]。Maillard反应产物中的挥发性组分是食品香味的重要来源,文献报道挥发性Maillard反应产物的生成受多种因素影响,包括反应物种类
[14-15]、反应物比例
[16]、反应温度
[1,2,17]、压力
[18-19]、pH值
[20-22]、加热时间
[1-2]等。其中,反应物比例影响挥发性化合物的形成
[16],反应时间主要影响Maillard反应的整体进程
[2],二者最终将对挥发性香味成分的组成和相对含量产生影响。鉴于此,本实验基于葡萄糖/苯丙氨酸(Glc/Phe)和葡萄糖/丙氨酸(Glc/Ala)模型体系,研究反应物比例和反应时间对模型体系形成挥发性香味化合物的影响,以期为Maillard反应香料的开发和品质控制提供参考。
1 材料与方法
1.1 材料与试剂
D-葡萄糖、L-苯丙氨酸、L-丙氨酸 国药集团化学试剂有限公司;氢氧化钠、二氯甲烷 天津市风船化学试剂科技有限公司。以上试剂均为分析纯。
1.2 仪器与设备
101型电热鼓风干燥箱 北京市永光明医疗仪器厂;BP121S电子天平(精度0.000 1 g) 德国Sartorius公司;PHS-3C型pH计 上海精密科学仪器有限公司;TU-1901双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司;智能恒温磁力搅拌器 河南爱博特科技发展有限公司;R201旋转蒸发仪 瑞士Buchi公司;7890型气相色谱/5975型质谱联用仪 美国Agilent公司。
1.3 方法
1.3.1 Maillard反应产物的制备
将一定量的Glc和Phe/Ala溶于一定量的去离子水中,加入NaOH溶液调节pH值至9.0左右,并定容至100 mL,然后将反应溶液倒入250 mL三口烧瓶中,置于105 ℃的油浴锅中磁力搅拌回流反应一定时间后,取出部分反应物,冷水迅速冷却,置于-18 ℃保存,待分析。考察的条件包括:1)反应时间:0.5、1、2、4、6、8 h;2)反应物比例:n(Glc)∶n(Phe)=2∶1(Glc 9.00 g,Phe 4.12 g)、n(Glc)∶n(Phe)=1∶1(Glc 9.00 g,Phe 8.25 g)、n(Glc)∶n(Phe)=1∶2(Glc 9.00 g,Phe 16.50 g),n(Glc)∶n(Ala)=2∶1(Glc 9.00 g,Ala 2.23 g)、n(Glc)∶n(Ala)=1∶1(Glc 9.00 g,Ala 4.45 g)、n(Glc)∶n(Ala)=1∶2(Glc 9.00 g,Ala 8.90 g)。
1.3.2 Maillard反应体系pH值和紫外-可见吸收光谱的测定
pH值:将pH计直接插入反应液,测试其pH值变化。
紫外-可见吸收光谱:将反应液用蒸馏水稀释50 倍,以水为空白分别测定稀释样品液在294 nm和420 nm波长处的吸光度。
1.3.3 Maillard反应产物中挥发性成分的气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)法分析
样品前处理:取10 mL反应液,加入50 μL 1 000 mg/mL乙酸苯乙酯作内标(CH
2Cl
2作溶剂),用30 mL CH
2Cl
2振荡萃取2 次。萃取完成后合并有机相,加入6 g无水硫酸钠干燥,过滤,将滤液减压浓缩至2 mL,过0.22 μm有机相滤膜,待分析。
GC-MS分析条件:色谱柱:HP-FFAP熔融石英毛细管柱(50 m×200 μm,0.32 μm);进样口温度:270 ℃;载气:He,1 mL/min;进样量:1 μL,分流比10∶1;升温程序:60 ℃→240 ℃(3 ℃/min,30 min);传输线温度:250 ℃;电离方式:EI;电离能量:70 eV;离子源温度:230 ℃;四极杆温度:150 ℃;扫描范围:40~380 amu;溶剂延迟:7 min。
采用Nist05和Wiley标准质谱图库检索法定性,以匹配度≥80认为可信。假定相对校正因子为1,回收率为100%,利用m
i= m
sA
i/A
s计算定量。式中:m
i为待测物质的质量;m
s为内标物的质量;A
i为待测物质的峰面积;A
s为内标物的峰面积。
2 结果与分析
2.1 pH值变化
表1 Glc/Phe模型体系pH值变化
Table 1 Changes of pH in Glc/Phe model system
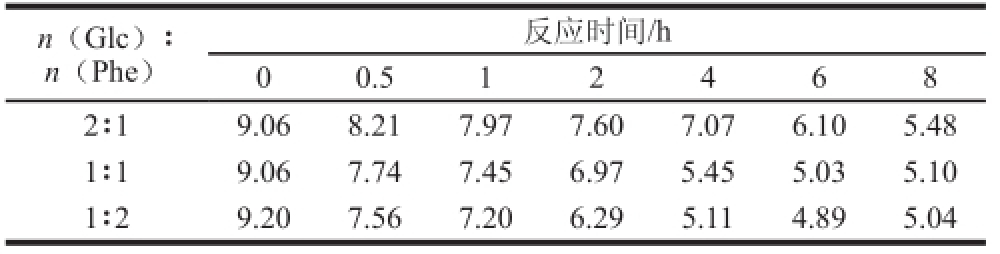
n(Glc)∶n(Phe)反应时间/h 0 0.5 1 2 4 6 8 2∶1 9.06 8.21 7.97 7.60 7.07 6.10 5.48 1∶1 9.06 7.74 7.45 6.97 5.45 5.03 5.10 1∶2 9.20 7.56 7.20 6.29 5.11 4.89 5.04
表2 Glc/Ala模型体系pH值变化
Table 2 Changes of pH in Glc/Ala model system
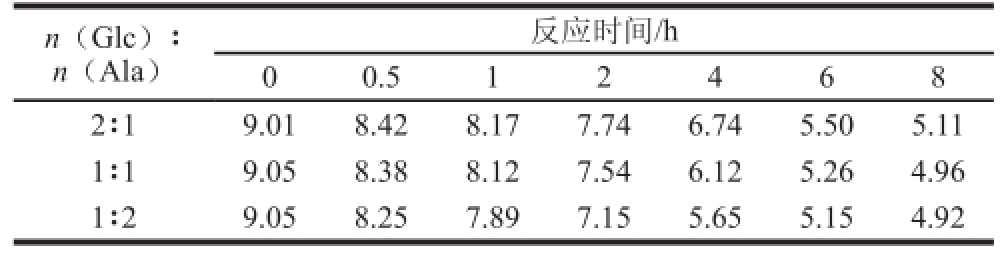
n(Glc)∶n(Ala)反应时间/h 0 0.5 1 2 4 6 8 2∶1 9.01 8.42 8.17 7.74 6.74 5.50 5.11 1∶1 9.05 8.38 8.12 7.54 6.12 5.26 4.96 1∶2 9.05 8.25 7.89 7.15 5.65 5.15 4.92
由表1、2可知,两个体系pH值变化规律相似,即随着体系中氨基酸含量增加,pH值随反应时间延长降低幅度增大;体系的pH值随反应时间延长而逐渐降低,可能是由于反应过程中产生有机酸类化合物导致的
[20,23]。
2.2 紫外-可见吸收光谱变化
在Maillard反应研究中,通常用294 nm波长处的紫外吸收(A
294
nm)光谱来描述Maillard反应中间产物
[24],在420 nm处的可见吸收(A
420
nm)光谱指示反应终产物和棕色化程度
[25]。为研究反应过程中中间产物和反应终产物的变化,重点考察了反应条件对A
294
nm和A
420
nm的影响。
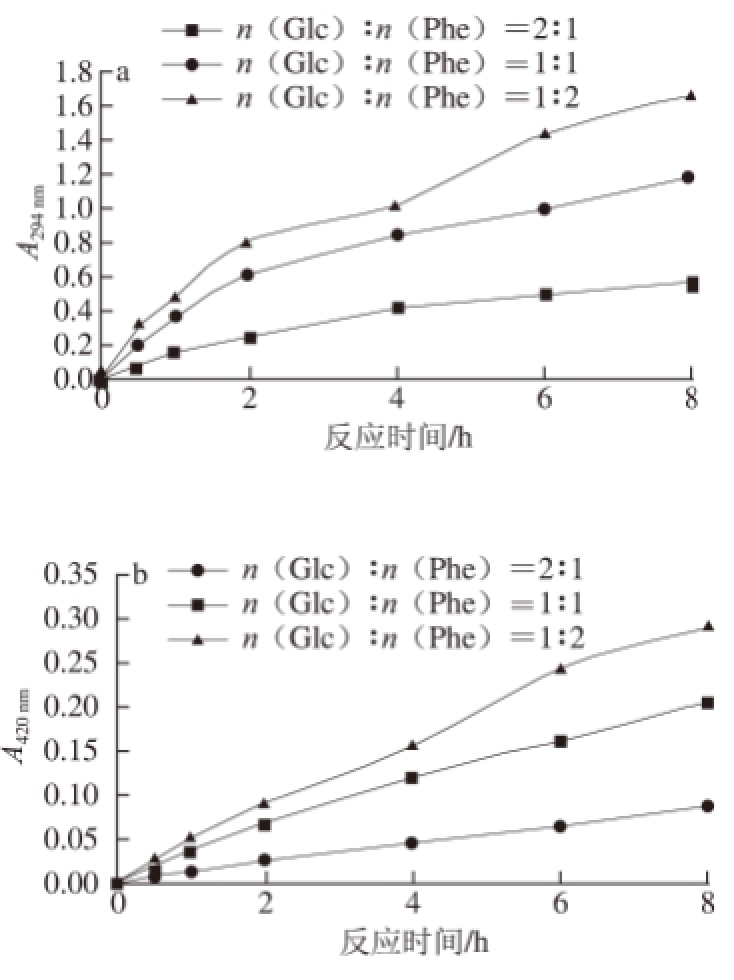
图1 Glc/Phe模型体系紫外-可见吸收光谱变化
Fig.1 Changes of UV-visible absorbance in Glc/Phe model system
由图1可知,随着Phe含量增加,A
294
nm和A
420
nm都明显增大;随着反应时间延长,A
294
nm和A
420
nm均呈增大趋势,其中当n(Glc)∶n(Phe)=1∶1和1∶2时,体系的A
294
nm值从1 h开始增速减缓,3 个反应物比例的A
420
nm值都没有出现增速明显减缓的过程。

图2 Glc/Ala模型体系紫外-可见吸收光谱变化
Fig.2 Changes of UV-visible absorbance in Glc/Ala model system
由图2可知,与Glc/Phe体系变化趋势相似,随着体系中Ala含量增加和反应时间延长,A
294
nm和A
420
nm呈增大趋势,其中当n(Glc)∶n(Ala)=1∶1和1∶2时,体系的A
294
nm值从2 h开始增速减缓。
2.3 反应条件对Maillard反应产物中挥发性成分的影响
2.3.1 反应时间
表3和表4分别为Glc/Phe和Glc/Ala模型体系Maillard反应产生的挥发性香味成分组成,图3为反应时间对挥发性香味成分总生成量的影响。结果显示随着反应时间延长,Glc/Phe和Glc/Ala体系Maillard反应生成的挥发性香味成分总量逐渐增加,当反应时间超过4 h后,增长速率变缓。

图3 反应时间对挥发性化合物总生成量的影响
Fig.3 Effect of reaction time on the total yield of volatile compounds
脂肪族化合物:表3和表4显示1-羟基-2-丙酮是在本实验条件下检测到的主要脂肪族化合物,Weenen
[26]报道在Maillard反应中,脂肪族化合物通过脱氧己酮糖的逆羟醛缩合反应或β-裂解反应生成。随着反应时间延长,Glc/Phe和Glc/Ala体系中脂肪族化合物生成量逐渐增加,反应4 h后增长缓慢。
芳香族化合物:由于Phe含有苯环结构,故Glc/Phe体系芳香族化合物生成量较高,其中苯乙醛、苯乙酸和苯丙酸生成量最高。随着反应时间延长,芳香族化合物的生成量明显增加。
呋喃类化合物:在Glc/Phe和Glc/Ala体系中,呋喃类化合物总生成量均随反应时间的延长而增加。在本实验条件下主要生成的呋喃类化合物为5-羟甲基糠醛,该化合物由3-脱氧己酮糖环化缩合形成。由表3和表4可知,Glc/Phe体系中5-羟甲基糠醛在前2 h时生成量很低,4 h后迅速增加。Glc/Ala体系中前2 h检测不到5-羟甲基糠醛,反应4 h后生成量数倍增长,说明其生成速率较慢,延长时间有利于5-羟甲基糠醛的形成。
吡嗪类化合物:在Glc/Phe和Glc/Ala体系中分别检测到5 种和4 种吡嗪类化合物,均以吡嗪生成量为最高。图4显示Glc/Phe体系反应前2 h吡嗪类化合物总量逐渐增加,2 h后不再增加。由图5可知,Glc/Ala体系反应前4 h吡嗪类化合物生成量大幅增长,4 h后略微下降,这与吡嗪类化合物的形成机理、反应速率有关,其生成速率较快,短时间内就达到较高的产量且随反应时间的延长其产量增加不明显
[1]。
有机酸类化合物:图4和图5显示在两个模型体系中,有机酸类化合物随反应时间延长生成量大幅增长,这与体系的pH值随反应时间的延长而降低相一致。
吡喃酮类化合物:表3和表4数据显示在Glc/Phe和Glc/Ala体系中,2,3-2H-3,5-二羟基-6-甲基-4H-吡喃-4-酮是在本实验条件下检测到的主要吡喃酮化合物。随着反应时间延长,两个体系吡喃酮化合物生成量均呈先增加后减少的趋势,反应4 h时生成量最大。
其他:两个模型体系都产生少量吡啶、吡咯和碳环类化合物,随着反应时间延长其生成量均小幅增加。此外,在两个体系中还检测到2,5-二甲基-4-羟基-3(2H)-呋喃酮,该物质具有很强的焦甜香味,生成量随反应时间的延长逐渐增加。
表3 不同比例Glc/Phe体系Maillard反应产物中挥发性化合物的生成量
Table 3 Yields of volatile compounds generated from Glc/Phe model system

注:各时间的生成量为体系中总量的估算值;ND.未检出。表4同。
10
-2mg时间/min 化合物 反应0.5 h 反应1 h 反应2 h 反应4 h 反应6 h 反应8 h 2∶1 1∶1 1∶2 2∶1 1∶1 1∶2 2∶1 1∶1 1∶2 2∶1 1∶1 1∶2 2∶1 1∶1 1∶2 2∶1 1∶1 1∶2保留10.36 吡啶 1.65 1.94 5.31 2.02 4.79 4.84 4.01 4.66 4.47 4.93 4.86 5.72 5.28 4.94 2.93 4.86 4.68 1.71 10.45 正戊醇 7.32 6.74 6.45 7.31 7.31 6.53 6.85 7.22 6.66 7.39 6.74 6.03 6.87 6.45 3.75 7.23 6.52 2.87 11.15 吡嗪 1.22 2.84 6.24 2.72 8.81 13.38 6.20 16.70 22.03 8.44 16.71 21.89 8.22 16.22 11.75 8.02 15.66 8.52 11.47 2-戊基呋喃 3.72 3.96 3.67 3.84 3.76 3.60 3.68 3.99 3.52 3.84 3.81 3.31 3.87 3.77 2.24 3.67 3.63 1.66 12.69 苯乙烯 5.64 7.53 10.74 2.10 11.98 13.00 9.58 18.19 25.54 11.43 25.82 65.93 17.42 45.51 49.80 19.77 40.46 38.77 13.09 2-甲基吡嗪 1.11 2.80 3.09 2.01 4.31 4.33 3.27 6.46 6.09 4.87 7.30 6.33 5.14 6.83 3.71 5.24 6.93 2.27 13.63 3-羟基-2-丁酮 0.60 0.94 1.35 1.03 1.53 1.64 1.79 3.10 2.91 3.10 3.84 2.54 3.30 4.71 2.13 4.15 5.13 2.42 14.32 1-羟基-2-丙酮 9.40 13.80 20.96 21.20 34.86 43.79 45.11 73.60 73.56 91.07 104.11 50.16 97.42 105.56 37.11 112.05 112.85 38.54 15.25 2,5-二甲基吡嗪 0.22 1.77 3.53 0.44 2.37 4.34 0.74 2.99 5.61 1.01 4.13 6.05 1.02 3.98 3.09 1.02 3.88 2.50 16.05 N,N-二甲基甲酰胺 1.80 1.70 1.96 2.07 1.92 2.27 2.20 2.01 2.01 1.90 2.14 2.56 2.09 2.12 1.66 2.43 1.91 1.18 18.42 2,3,5-三甲基吡嗪 0.09 0.31 0.55 0.13 0.61 0.77 0.20 0.89 1.45 0.38 1.22 1.75 0.50 1.26 1.09 0.53 1.27 0.83 20.00 乙酸 0.75 1.35 3.06 1.57 4.02 7.00 2.53 14.27 30.80 8.87 40.55 83.78 23.24 76.30 52.84 38.07 93.55 60.28 20.74 糠醛 ND ND 0.04 ND ND 0.08 0.11 0.17 0.31 0.34 0.84 0.43 0.71 1.44 0.44 1.74 1.82 0.51 22.42 2-乙酰基呋喃 ND ND ND ND ND 0.05 ND 0.09 0.25 0.10 0.49 1.00 0.24 1.34 1.29 0.47 2.33 1.51 23.24 苯甲醛 2.21 4.02 5.08 3.20 7.43 8.60 5.32 14.06 19.54 9.11 20.43 22.31 13.07 21.34 16.90 14.65 21.35 17.44 23.48 4-羟基-2-丁酮 0.43 1.11 1.37 0.96 2.36 2.11 2.23 3.40 1.68 2.89 2.40 1.23 3.30 1.42 0.37 3.16 1.10 0.29 25.21 5-甲基糠醛 N D 0.03 0.08 ND 0.15 0.25 0.12 0.63 1.05 0.51 2.51 2.55 1.17 5.22 3.82 1.94 8.95 5.03 25.74 2-环戊烯-1,4-二酮 ND 0.20 0.51 0.13 0.54 0.95 0.31 1.18 2.55 0.78 3.09 6.32 1.87 5.18 4.30 2.57 6.28 4.46 27.32 丙烯酸 ND ND ND ND ND 0.17 ND 0.27 0.58 ND 0.73 1.14 0.43 1.15 0.89 0.52 1.19 1.60 27.79 苯乙醛 4.92 8.46 15.01 4.01 17.59 32.49 14.99 53.92 101.16 55.14 177.06 240.07 75.76 249.61 165.94 154.35 283.75 141.03 28.52 苯甲酸乙酯 0.21 0.47 0.85 0.33 0.78 1.26 0.43 1.25 1.97 0.70 1.53 1.91 0.77 1.37 1.00 1.09 1.19 0.93 29.15 3-乙基-2-羟基-2-环戊烯-1-酮 ND ND ND ND ND 0.03 ND 0.13 0.24 0.04 0.42 0.58 0.08 0.69 0.49 0.13 0.81 0.46 30.38 5-甲基糠醇 ND 0.34 0.91 0.25 1.69 3.07 1.11 6.42 8.87 3.82 13.34 10.76 6.52 8.93 3.00 8.09 4.63 1.37 30.85 苯甲基酮 ND ND ND ND ND ND ND 0.32 0.54 ND 0.67 1.48 0.38 1.53 1.37 0.56 2.22 1.81 32.78 苯乙酸乙酯 0.29 0.59 0.64 0.40 0.52 0.74 0.39 0.85 1.89 0.50 1.45 4.25 0.76 2.27 2.68 1.02 2.36 1.66 34.52 3-甲基-1,2-环戊二酮 0.16 0.12 0.12 0.22 0.29 0.31 0.36 0.71 1.31 0.72 1.85 2.97 0.97 3.16 2.75 1.17 4.44 2.52 35.37 3-苯基-呋喃 4.18 4.28 4.08 5.06 4.97 4.08 4.51 4.42 4.18 4.52 4.59 8.61 3.71 5.79 5.18 3.28 6.81 3.84 36.00 苯甲醇 0.70 1.27 1.45 1.15 2.00 2.29 1.78 3.77 4.80 2.68 5.85 7.65 3.21 6.27 5.81 3.76 6.97 4.38 36.33 苯丙酸乙酯 ND ND ND ND ND 0.20 ND 0.25 0.47 ND 0.43 1.28 0.22 0.59 0.75 0.19 0.66 0.57 37.25 苯乙醇 0.91 0.88 0.95 0.82 1.32 1.58 1.15 5.55 4.46 2.62 14.31 25.65 7.79 22.21 20.26 10.04 25.87 17.37 39.49 2-乙酰基吡咯 ND 0.17 0.32 0.13 0.41 0.82 0.24 1.25 3.14 0.61 4.69 9.52 1.40 8.43 9.56 2.15 12.37 10.54 40.08 2,5-醛基-呋喃 ND ND ND ND ND 0.12 ND 0.23 0.43 0.33 2.21 0.95 1.14 5.69 1.07 4.10 8.59 1.74 40.36 苯酚 0.48 0.46 0.66 0.48 0.68 0.75 0.59 0.78 0.99 1.18 1.41 1.88 2.05 1.82 1.47 2.70 2.72 1.68 41.19 2,5-二甲基-4-羟基-3(2H)-呋喃酮 0.11 0.45 0.95 0.38 1.51 2.33 1.18 4.37 6.67 3.11 8.18 10.32 4.63 10.70 6.67 4.67 11.05 5.74 43.85 1-甲基-2-醛基-1H-吡咯 ND ND ND ND ND ND ND ND 0.24 ND 0.59 1.07 0.14 1.47 2.57 0.21 3.20 4.02 47.63 4-苯甲基-吡啶 0.82 0.89 1.37 1.73 1.97 2.46 1.57 3.29 5.03 2.20 6.01 9.24 3.74 8.33 6.90 5.10 9.54 6.25 48.42 3-苯基-吡啶 0.76 1.70 2.40 1.27 2.27 2.90 1.52 2.95 4.69 1.84 4.41 9.16 2.41 6.34 7.30 2.83 7.77 7.11 48.68 2,3-二氢-3,5-二羟基-6-甲基-4H-吡喃-4-酮 4.13 20.61 43.80 14.54 49.51 74.71 35.09 85.21 107.85 56.67 92.04 97.36 67.80 81.42 42.74 63.62 70.18 27.12 49.50 3,5-二羟基-2-甲基-4H-吡喃-4-酮 0.99 2.31 4.13 2.27 5.26 6.01 4.31 8.23 9.26 7.33 8.75 11.73 7.44 9.88 5.28 8.72 10.33 3.83 51.40 2-苯乙基-吡嗪 0.10 0.15 0.20 0.14 0.29 0.29 0.23 0.53 0.49 0.33 0.65 0.82 0.37 0.61 0.44 0.40 0.60 0.83 53.63 苯甲酸 0.50 0.99 1.74 1.06 2.31 3.42 1.44 5.23 9.53 2.96 9.66 15.28 5.13 9.80 9.55 6.52 9.73 8.19 55.05 5-羟甲基-二氢呋喃-2-酮 ND 0.36 0.66 0.38 0.83 1.29 0.72 2.86 3.88 1.59 6.04 9.94 2.84 10.00 8.32 3.61 13.42 8.54 55.44 5-羟甲基-糠醛 ND ND 0.20 ND 0.17 0.34 0.19 0.81 1.82 0.93 11.91 4.86 4.57 32.30 7.11 16.88 49.68 11.56 56.84 苯乙酸 1.14 5.50 17.62 2.05 24.21 68.87 9.49 111.48 189.33 65.75 215.09 220.11 174.28 241.93 163.89 180.29 235.22 216.12 57.87 N-苯乙基-乙酰胺 0.39 0.76 0.67 ND 1.92 1.09 1.27 3.55 2.31 1.69 4.21 4.90 1.94 4.42 3.33 1.95 4.26 2.57 58.47 苯丙酸 1.16 9.26 24.87 3.84 39.79 75.46 17.66 131.67 142.69 68.59 171.49 146.23 99.94 178.98 110.06 108.23 171.23 123.48
表4 不同比例Glc/Ala体系Maillard反应产物中挥发性化合物的生成量
Table 4 Yields of volatile compounds generated from Glc/Ala model system

时间/min 化合物 反应0.5 h 反应1 h 反应2 h 反应4 h 反应6 h 反应8 h 2∶1 1∶1 1∶2 2∶1 1∶1 1∶2 2∶1 1∶1 1∶2 2∶1 1∶1 1∶2 2∶1 1∶1 1∶2 2∶1 1∶1 1∶2保留10.36 吡啶 2.53 2.68 5.03 2.47 2.73 5.48 2.57 2.42 4.60 3.68 2.38 4.41 4.63 3.34 4.07 4.35 5.18 4.62 10.45 正戊醇 6.34 0.32 0.35 6.51 0.37 0.36 6.24 0.28 0.35 5.78 0.27 0.33 6.50 0.28 0.34 6.15 0.30 0.47 11.15 吡嗪 1.64 3.39 10.26 4.84 10.22 28.54 10.47 21.43 41.56 13.56 25.72 42.51 13.86 23.92 42.54 12.31 25.26 39.90 11.47 2-戊基呋喃 3.38 ND 0.47 3.38 ND 1.35 3.34 0.95 1.99 2.87 1.23 2.02 3.14 1.15 2.17 2.60 1.22 1.94 12.69 苯乙烯 1.18 0.52 0.58 1.34 0.47 0.51 1.36 0.52 0.51 1.13 0.45 0.55 1.42 0.58 0.59 1.30 0.59 0.66 13.13 2-甲基吡嗪 0.15 0.31 0.95 0.50 0.88 2.46 0.92 1.89 3.87 1.38 2.56 4.00 1.58 2.53 4.54 1.66 2.95 4.43 13.63 3-羟基-2-丁酮 0.26 ND 0.69 0.46 0.46 2.16 0.95 1.89 4.87 1.48 3.50 7.58 1.89 3.71 9.43 1.99 4.27 9.30 14.32 1-羟基-2-丙酮 4.11 6.24 21.79 16.73 27.15 66.54 40.18 78.21 145.85 77.96 149.59 158.37 103.32 150.84 213.04 98.65 149.80172.39 15.25 2,5-二甲基吡嗪 ND ND 0.63 0.04 0.18 1.38 0.08 0.44 1.82 0.12 0.57 1.60 0.15 0.75 1.46 0.19 0.62 1.63 15.58 2,6-二甲基吡嗪 ND ND 0.12 0.05 0.12 0.20 0.10 0.19 0.33 0.13 0.28 0.34 0.19 0.27 0.32 0.21 0.24 0.34 16.05 N,N-二甲基甲酰胺 1.22 1.03 2.19 1.39 1.17 1.95 1.64 1.07 2.08 1.84 1.21 2.29 2.31 1.58 2.20 1.87 2.31 2.16 20.12 乙酸 0.32 0.42 0.80 0.87 0.67 1.91 0.86 1.75 13.06 4.07 25.19 100.15 31.51 77.47 223.44 40.20 115.92232.62 20.74 糠醛 ND ND ND 0.07 ND 0.05 0.09 0.07 0.08 0.21 0.31 0.35 0.63 0.83 0.69 1.17 1.42 1.08 23.34 丙酸 ND ND ND ND ND 0.13 0.08 0.08 0.33 0.17 0.77 2.48 0.75 2.20 5.22 0.83 2.70 6.34 23.48 4-羟基-2-丁酮 ND ND 0.73 0.25 0.61 2.65 0.65 1.64 4.14 1.23 2.46 3.84 1.59 2.66 2.95 1.66 2.68 2.10 25.21 5-甲基糠醛 ND ND ND ND ND ND ND ND 0.14 0.07 0.20 0.53 0.20 0.62 1.07 0.35 0.89 1.61 28.09 糠醇 ND ND ND 0.04 ND 0.07 0.09 0.16 0.47 0.36 0.74 1.79 0.79 1.50 3.63 0.92 2.19 4.54 30.38 5-甲基糠醇 ND ND 0.07 0.03 0.08 0.70 0.13 0.43 2.79 0.33 1.60 7.44 0.73 3.41 11.53 0.89 3.87 10.94 34.52 3-甲基-1,2-环戊二酮 ND ND 0.11 0.06 0.13 0.44 0.24 0.43 0.99 0.42 0.75 1.64 0.58 1.01 2.31 0.59 1.40 3.09 39.49 2-乙酰基吡咯 ND ND ND ND ND 0.11 0.08 0.15 0.51 0.28 0.94 2.83 0.77 2.30 8.25 1.12 4.19 11.78 40.11 2,5-二醛基-呋喃 ND ND ND ND ND ND ND ND ND 0.14 0.38 0.62 0.67 1.72 1.97 1.46 3.66 3.02 40.36 苯酚 0.33 0.35 0.39 0.32 0.30 0.36 0.32 0.31 0.38 0.34 0.28 0.32 0.43 0.35 0.41 0.37 0.39 0.33 41.19 2,5-二甲基-4-羟基-3(2H)-呋喃酮 ND ND 0.37 0.20 0.40 2.06 0.89 2.08 6.39 1.76 5.24 9.79 2.26 5.85 11.77 2.14 6.71 11.86 48.68 2,3-二氢-3,5-二羟基-6-甲基-4H-吡喃-4-酮 1.98 3.06 19.37 7.36 15.82 59.96 20.75 43.90 105.11 32.10 63.46 100.73 38.03 60.34 99.99 29.90 56.43 87.03 49.51 3,5-二羟基-2-甲基-4H-吡喃-4-酮 ND 0.44 2.47 0.95 2.14 6.97 2.84 5.78 13.65 4.13 9.28 14.87 5.04 9.27 16.54 5.93 10.15 16.19 55.44 5-羟甲基-糠醛 ND ND ND ND ND ND ND ND 0.18 0.43 1.05 2.42 2.29 6.17 8.48 5.15 12.94 14.85 69.61 2,6-二甲基对苯二酚 3.83 ND ND 3.58 ND ND 3.74 ND 0.16 3.60 ND 0.18 4.31 ND 0.18 3.79 ND 0.38
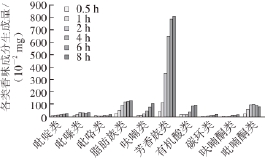
图4 反应时间对Glc/Phe体系挥发性化合物生成量的影响
Fig.4 Effect of reaction time on the yield of volatile compounds generated from Glc/Phe model system

图5 反应时间对Glc/Ala体系挥发性化合物生成量的影响
Fig.5 Effect of reaction time on the yield of volatile compounds generated from Glc/Ala model system
2.3.2 反应物比例
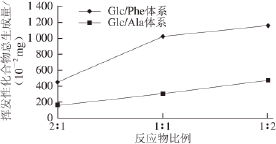
图6 反应物比例对Glc/Phe和Glc/Ala体系挥发性化合物总生成量的影响
Fig.6 Effect of reactant ratio on the total yield of volatile compounds
generated from Glc/Phe and Glc/Ala model system
图6为不同反应物比例对Glc/Phe和Glc/Ala模型体系挥发性香味成分总生成量的影响。结果显示:反应物比例不同,Glc/Phe和Glc/Ala两个体系变化趋势相似。随着体系中氨基酸含量增加,挥发性香味成分总量逐渐升高。其中在Glc/Phe体系中,当Glc与Phe物质的量比从2∶1降至1∶1时,挥发性香味成分生成量增速较快,继续增加Phe含量,挥发性香味成分生成量增速减缓。
脂肪族化合物:图7和图8分别为反应物比例对Glc/Phe和Glc/Ala体系挥发性香味成分生成量的影响。当Glc与氨基酸物质的量比从2∶1降至1∶1时,脂肪族化合物生成量增加,而当物质的量比由1∶1继续降至1∶2时,两个体系变化趋势不一致,Glc/Ala体系中脂肪族化合物产生量继续增加,而Glc/Phe体系显著下降。
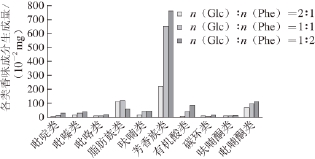
图7 反应物比例对Glc/Phe体系挥发性化合物生成量的影响
Fig.7 Effect of reactant ratio on the yield of volatile compounds generated from Glc/Phe model system
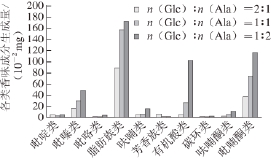
图8 反应物比例对Glc/Ala体系挥发性化合物生成量的影响
Fig.8 Effect of reactant ratio on the yield of volatile compounds generated from Glc/Ala model system
芳香族化合物:图7和图8显示两个体系在不同反应物比例下,芳香族化合物的生成量变化趋势相反,Glc/Ala体系中氨基酸含量增加时,芳香族化合物生成量降低,而Glc/Phe体系中生成量增加。
呋喃类化合物:当Glc与Phe物质的量比从2∶1降至1∶1时,呋喃类化合物生成量显著增加,继续增加Phe含量,呋喃类化合物生成量没有明显变化。而在Glc/Ala体系中,当Glc与Ala物质的量比为2∶1和1∶1时,呋喃类化合物生成量较低,当物质的量比为1∶2时生成量大幅增加。
吡嗪类化合物:两个体系在不同反应物比例下,吡嗪类化合物的生成量变化趋势相似,即随着体系中氨基酸含量增加,吡嗪类化合物生成量逐渐增加。
有机酸类化合物:与挥发性香味成分总生成量变化趋势相似,随着体系中氨基酸含量增加,有机酸类化合物生成量逐渐增加。
吡喃酮类化合物:Glc/Phe体系中随着Phe含量增加,吡喃酮类化合物生成量逐渐增加,其中2,3-2H-3,5-二羟基-6-甲基-4H-吡喃-4-酮的生成量从566.7 μg增至973.6 μg。在Glc与Ala体系中随Ala含量增加,吡喃酮类化合物生成量也明显增加。
其他:图7和图8 显示随着氨基酸含量增加,Glc/Phe和Glc/Ala体系中吡啶、吡咯、碳环类和呋喃酮类化合物生成量均增加。
3 结 论
在Glc/Phe和Glc/Ala模型体系中,随着体系中氨基酸含量增加和反应时间延长,体系的pH值逐渐降低,紫外-可见吸收光谱中A
294
nm和A
420
nm呈增大趋势。
反应时间对Glc/Phe和Glc/Ala体系挥发性香味成分生成量的影响趋势相似,随着反应时间延长挥发性香味成分总量增加,当反应时间超过4 h后,增长速率变缓。脂肪族、芳香族、呋喃类、有机酸、吡啶、吡咯、碳环类和呋喃酮类化合物的生成量均随反应时间延长而增加;在Glc/Phe和Glc/Ala体系中,吡嗪类化合物生成量分别在2 h和4 h达到最大;两个体系中吡喃酮类化合物生成量均呈先增加后减少的趋势,反应4 h时生成量最大。
反应物比例对Glc/Phe和Glc/Ala体系挥发性香味成分生成量的影响不同,随着体系中氨基酸含量增加,Glc/Phe体系芳香族化合物生成量增加,脂肪族化合物生成量降低,而在Glc/Ala体系中呈相反的趋势。两个体系中吡嗪类、有机酸、吡喃酮类、吡啶、吡咯、碳环类和呋喃酮类化合物生成量均随体系中氨基酸含量的增加而增加。
参考文献:
[1] 谭志伟, 余爱农. 反应温度和反应时间对抗坏血酸-赖氨酸Maillard反应体系中挥发性化合物形成的影响[J]. 食品科学, 2012, 33(16):124-129.
[2] 刘应煊, 余爱农. 反应温度和反应时间对抗坏血酸-半胱氨酸模式反应形成香味化合物的影响[J]. 食品科技, 2011, 36(12): 262-267.
[3] 谭志伟, 余爱农, 刘应煊. 水分含量对L-抗坏血酸-L-半胱氨酸Maillard反应体系中挥发性产物的影响[J]. 食品科学, 2014, 35(10):132-138. doi: 10.7506/spkx1002-6630-201410024.
[4] AJANDOUZ E H, IGSERVER A. Nonenzymatic browning reaction of essential amino acids: effect of pH on caramelization and Maillard reaction kinetics[J]. Journal of Agricultural and Food Chemistry, 1999,47(5): 1786-1793.
[5] BAISIER W M, LABUZA T P. Maillard browning kinetics in a liquid model system[J]. Journal of Agricultural and Food Chemistry, 1992,40(5): 707-713.
[6] LAMBERTS L, ROMBOUTS I, DECLOUR J A. Study of nonenzymic browning in a-amino acid and γ-aminobutyric acid/sugar model systems[J]. Food Chemistry, 2008, 111(3): 738-744.
[7] LEE S M, JO Y J, KIM Y S. Investigation of the aroma-active compounds formed in the maillard reaction between glutathione and reducing sugars[J]. Journal of Agricultural and Food Chemistry, 2010,58(5): 3116- 3124.
[8] TRESSL R, WONDRAK G T, GARBE L A, et al. Pentoses and hexoses as sources of new melanoidin-like Maillard polymers[J]. Journal of Agricultural and Food Chemistry, 1998, 46 (5): 1765-1776.
[9] YU A N, TAN Z W, WANG F S. Mechanism of formation of sulphur aroma compounds from L-ascorbic acid and L-cysteine during the Maillard reaction[J]. Food Chemistry, 2012, 132(3): 1316-1323.
[10] ADAMS A, de KIMPE N. Formation of pyrazines from ascorbic acid and amino acids under dry-roasting conditions[J]. Food Chemistry,2009, 115(4): 1417-1423.
[11] 夏炳乐, 刘永军. 生理温度下苯丙氨酸-葡萄糖模式体系Maillard反应的影响因素研究[J]. 中国科学技术大学学报, 2011, 41(5): 422-427.
[12] YU A N, ZHANG A D. Aroma compounds generated from thermal reaction of L-ascorbic acid with L-cysteine[J]. Food Chemistry, 2010,121(4): 1060-1065.
[13] CHEN Y, HO C T. Effects of carnosine on volatile generation from Maillard reaction of ribose and cysteine[J]. Journal of Agricultural and Food Chemistry, 2002, 50(8): 2372-2376.
[14] CHO I H, LEE S, JUN H R, et al. Comparison of volatile Maillard reaction products from tagatose and other reducing sugars with amino acids[J]. Food Science and Biotechnology, 2010, 19(2): 431-438.
[15] LANCKER F V, ADAMS A, KIMPE N D. Formation of pyrazines in Maillard model systems of lysine-containing dipeptides[J]. Journal of Agricultural and Food Chemistry, 2010, 58(4): 2470-2478.
[16] XU Honggao, LIU Xuan, ZHAO Jian, et al. Effects of ribose to cysteine ratios on the formation of volatile compounds from the Maillard reaction in supercritical carbon dioxide[J]. Food Research International, 2008, 41(7): 730-737.
[17] BENZING-PURDIE L M, RIPMEESTER J A, RATCLIFFE C I. Effects of temperature on Maillard reaction products[J]. Journal of Agricultural and Food Chemistry, 1985, 33(1): 31-33.
[18] HILL V M, ISAACS N S, LEDWARD D A, et al. Effect of high hydrostatic pressure on the volatile components of a glucose-lysine model system[J]. Journal of Agricultural and Food Chemistry, 1999,47(9): 3675-3681.
[19] 许洪高, 高彦祥. 不同压力介质对“D-核糖+L-半胱氨酸” Maillard反应产物影响的研究[J]. 食品科学, 2009, 30(17): 15-19.
[20] BLANK I, DEVAUD S, MATTHEY-DORET W, et al. Formation of odorants in Maillard model systems based on L-proline as affected by pH[J]. Journal of Agricultural and Food Chemistry, 2003, 51(12):3643-3650.
[21] YU A N, ZHANG A D. The effect of pH on the formation of aroma compounds produced by heating a model system containing L-ascorbic acid with L-threonine/L-serine[J]. Food Chemistry, 2010, 119(1): 214-219.
[22] 刘应煊, 余爱农. pH值和缓冲剂对抗坏血酸-半胱氨酸模式反应形成香味化合物的影响[J]. 食品科学, 2012, 33(6): 143-149.
[23] LAN X H, LIU P, XIA S Q, et al. Temperature effect on the nonvolatile compounds of Maillard reaction products derived from xylosesoybean peptide system: Further insights into thermal degradation and cross-linking[J]. Food Chemistry, 2010, 120(4): 967-972.
[24] HODGE J E. Dehydrated foods, chemistry of browning reactions in model systems[J]. Journal of Agricultural and Food Chemistry, 1953,15(1): 928-943.
[25] KIM J S, LEE Y S. Study of Maillard reaction products in model aqueous and water/ethanol systems containing glucose and glycine,diglycine, and triglycine[J]. Food Science and Biotechnology, 2010,19(6): 1471-1477.
[26] WEENEN H. Reactive intermediates and carbohydrate fragmentation in Maillard chemistry[J]. Food Chemistry, 1998, 62(4): 393-401.
Effect of Reaction Conditions on Generation of Volatile Compounds from Maillard Reaction of Glucose and Phenylalanine/Alanine
HE Baojiang
1, LI Chenggang
2, LIU Shan
1, LI Peng
1, ZENG Shitong
1, HU Jun
1, XU Xiujuan
1,*, HAO Jufang
3,*
(1. Zhengzhou Tobacco Research Institute of China National Tobacco Corporation, Zhengzhou 450001, China;2. Technical Center of China Tobacco Henan Industrial Co. Ltd., Zhengzhou 450000, China;3. Staff Development Institute of China National Tobacco Corporation, Zhengzhou 450008, China)
Abstract:In order to investigate the effect of reaction conditions on the formation of volatile compounds from Maillard reaction of glucose and phenylalanine/alanine, the generated volatile compounds at different reactant ratios and reaction time were analyzed by gas chromatography-mass spectrometry (GC-MS). The results indicated that: 1) the effect of reaction time on the formation of volatile compounds from glucose/phenylalanine and glucose/alanine model systems were similar. With increasing reaction time, the yields of aliphatic and aromatic compounds, furans, organic acids, pyridines, pyrroles,furanones and carbocyclic compo unds increased, while the yield of pyranones increased at fi rst and decreased afterwards;2) the effects of reactant ratio on the formation of volatile compounds from glucose/phenylalanine and glucose/alanine model systems were diff erent. As the content of amino acid increased in glucose/phenylalanine model system, the yield of aromatic compounds increased and aliphatic compounds decreased, while the opposite trend was observed in glucose/alanine model system. The yields of pyrazines, organic acids, pyranones, pyridines, pyrroles, carbocyclic compounds and furanones increased with increasing amino acid content in both model systems.
Key words:Maillard reaction; glucose/phenylalanine; glucose/alanine; reaction condition; volatile compounds
中图分类号:TS201.7
文献标志码:A
文章编号:1002-6630(2015)23-0143-07
doi:10.7506/spkx1002-6630-201523027
收稿日期:2015-01-16
作者简介:何保江(1980—),男,工程师,硕士,主要从事香精香料及烟草化学研究。E-mail:15937100101@139.com
*通信作者:徐秀娟(1986—),女,工程师,博士,主要从事天然香料提取与分离研究。E-mail:xxjwin@163.com郝菊芳(1982—),女,博士,主要从事烟草化学分析及研究。E-mail:haojufang1982@126.com











